机器人辅助腹腔镜左供体肾切除术用于活体肾脏捐献
Massachusetts General Hospital
Main Text
Table of Contents
肾移植是终末期肾病患者的首选治疗方法,与其他肾脏替代疗法相比,肾移植与更好的生活质量和生存率相关。与已故供体肾脏相比,活体供体肾脏捐献与更短的等待时间、更高的患者和移植物存活率以及抢先移植的可能性有关。在初始学习曲线之后,与开腹肾切除术和腹腔镜肾切除术相比,机器人辅助活体供体肾切除术具有相似的结果,并且在某些情况下总体住院时间缩短。在本文中,我们介绍了一个机器人辅助活体供体肾切除术的病例,包括评估、技术和外科医生术前和术中的注意事项。
肾移植;活体供体;机器人外科手术;热缺血;治疗结果。
肾移植是终末期肾病 (ESRD) 的首选治疗方法,但已故供体器官短缺是一个主要的限制因素。在美国,大约三分之一的肾移植是活体供体移植。1 这与一些发展中国家 40-90% 的活体供体移植形成鲜明对比,由于缺乏已故器官捐献的基础设施以及慢性透析的高成本和低可及性,活体供体移植是最可行的选择。2 微创技术现在是护理标准,与腹腔镜肾切除术相比,机器人辅助活体供体肾切除术已被证明具有相似的术后结果,但总住院时间缩短。3–6
捐献者是一名 38 岁的男性,他向移植中心投递,为他的兄弟捐献了一个肾脏。他没有明显的病史(没有肾结石、尿路感染、糖尿病、高血压或恶性肿瘤的病史)。他过去的手术史包括 13 岁时因阑尾炎破裂而进行的开放性阑尾切除术,但没有麻醉相关问题。他的体重指数 (BMI) 为 31.46 kg/m²。患者的功能状态为 4 代谢当量 (MET),美国麻醉医师协会 (ASA) 1 级。他对青霉素、庆大霉素和万古霉素过敏。他的兄弟有脂肪肝和肾脏疾病家族史(IgA 肾病)。他接受了活体肾脏捐献的全面检查,符合捐献的内科和外科标准。
体格检查无明显异常,无腹部肥胖和右下腹开放性阑尾切除术瘢痕愈合良好。他接受了标准的供体术前检查,包括肾功能检查、感染检测和适龄恶性肿瘤筛查。确定了供体和受体之间的血型 (ABO) 和免疫学 (HLA) 相容性。术前行心电图和胸部 X 线检查,未见异常。鉴于他的 ASA 状态和病史,无需进一步的术前检查。进行横断面成像以评估肾脏大小和脉管系统,以确定供体肾脏偏侧性。
进行腹部 CT 血管造影以评估肾脏的大小以及肾血管系统和集合系统的解剖变化(图1)。在这种情况下,肾脏的估计体积差异小于 10%,这是我们功能测试中心的临界值。供者有双侧单肾动脉和单肾静脉。肾盂或输尿管未见异常。在左肾上极看到一个 2 cm 的简单良性皮质囊肿。肾脏未发现结石或异常肿块。
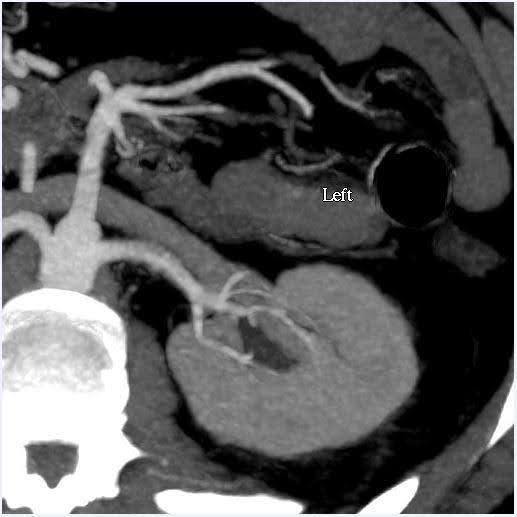
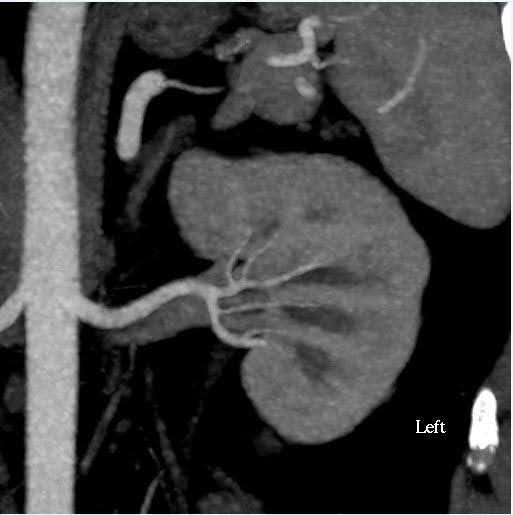
图 1.腹部(肾脏)血管造影 CT。 左:轴向视图显示左侧有单根肾动脉和静脉;右:冠状位 左肾。
活体供体肾切除术可以通过开腹镜、手辅助腹腔镜或机器人辅助方法进行。
与已故供体肾脏相比,活体供体肾脏捐献与更短的等待时间以及更高的患者和移植物存活率相关。虽然在受者开始透析之前先发制人移植是一种选择,但活体捐献可以大大缩短等待时间并提高抢先移植的可能性。
全身麻醉和神经肌肉阻滞在患者仰卧位时进行。麻醉诱导后,放置鼻胃管以保持整个手术过程中的胃减压,并放置 Foley 导管。围手术期给予抗生素。手术室中备有一套剖腹手术器械,以备不时之需。
将患者置于右侧卧位,双臂抱抱枕头。使用机器人时,使用侧臂板会导致来自机械臂的压力,因此最好将机械臂略微向下放置。然后弯曲桌子以帮助将肋骨与髂嵴分开,以便更好地进入。所有压力点都需要填充,并放置腋窝滚动以防止神经压迫损伤。应将患者固定在手术台上。我们使用豆袋来帮助定位患者。在体位结束时确认双侧可触及的桡动脉搏动。序贯加压装置应放置在双下肢。手术区域被剪断,然后以通常的无菌方式准备和覆盖,从剑突延伸到耻骨联合下方,肾切除术侧的腋后线一直延伸到对侧的豆袋。
制作一个 7-8 厘米长的 Pfannenstiel 切口以进入腹腔。腹壁筋膜横向打开,皮瓣上下隆起。腹壁筋膜活动的范围决定了肾脏提取区域的大小。确保有足够的解剖。然后将直肌分开,腹膜在直肌之间垂直打开。小心向上打开腹膜,以避免夹层进入膀胱。将 GelPort 腹腔镜系统放置在切口中,并通过 GelPort 放置一个 12 毫米的腹腔镜端口以建立气腹。在腹腔镜直接观察下放置了三个额外的 8 毫米机器人端口:在上腹区域,位于脐上方,位于左下腹(图2)。端口需要相距约 10 厘米,距离肋骨和髂嵴至少 2 厘米。穿过 GelPort 的 12 mm 端口是整个手术过程中床边辅助的辅助端口。然后将 DaVinci 机器人对接到端口和直接可视化下插入的机器人仪器。
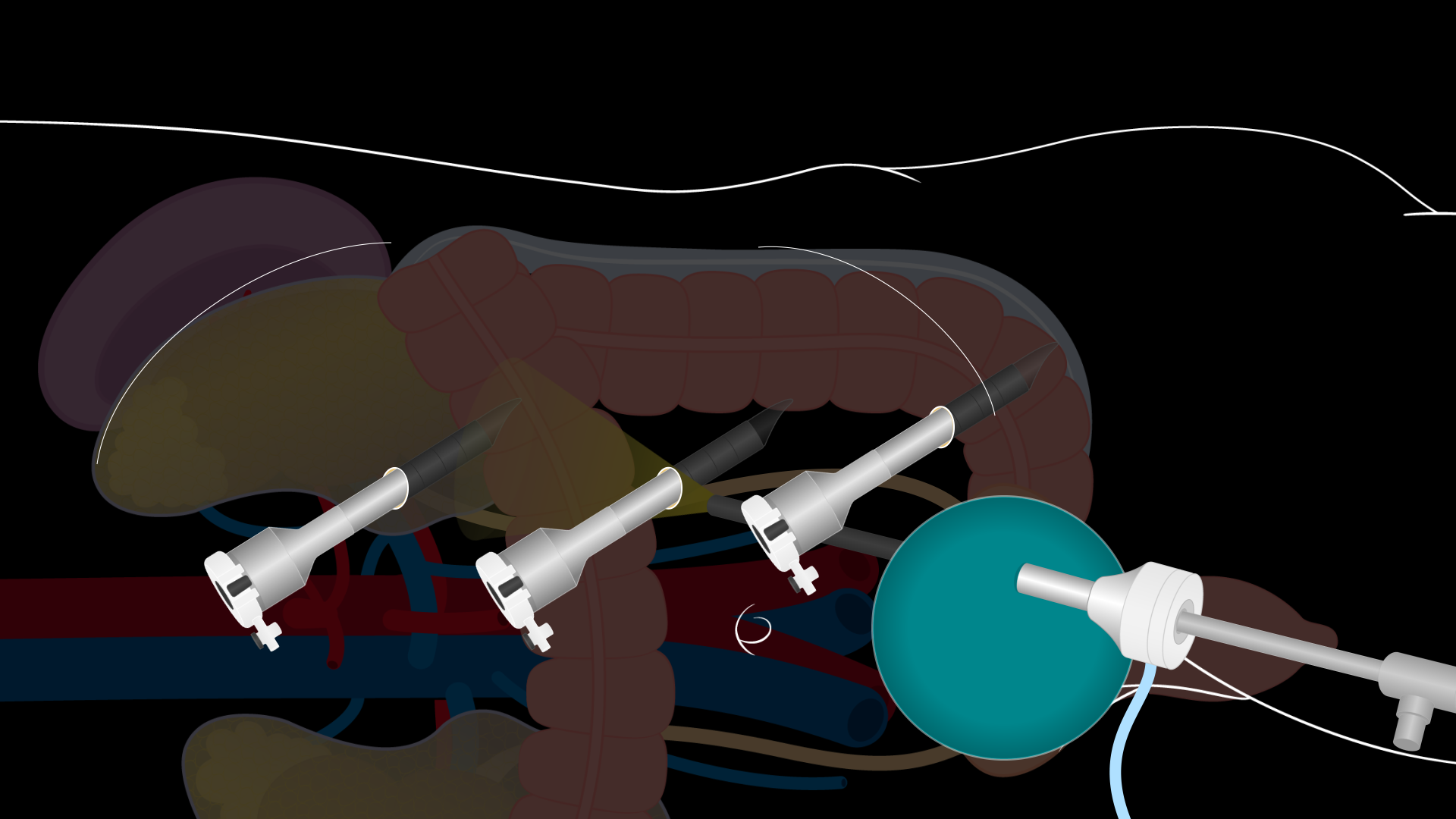
图 2.腹腔镜供体左肾切除术切口部位。 显示腹腔镜供体左肾切除术端口安装位置的图表。制作一个 7-8 厘米长的 Pfannenstiel 切口以进入腹腔。将 GelPort 腹腔镜系统放置在该切口中,并通过 GelPort 放置一个 12 毫米的腹腔镜端口。三个 8 毫米机器人端口放置在上腹部区域,位于脐上方,在直视下位于左下腹。
在控制台上,通过取下腹壁的附件,左结肠向内侧旋转。左肾可见。此时注意不要动员肾脏的后部附着物,使其保持横向缩回,以便于肺门解剖。脾脏及其与横膈膜和肾脏的附着物被释放并向内侧旋转,以帮助解剖血管结构。识别输尿管并解剖至骨盆。重要的是要避免通过留下一定量的输尿管周围脂肪来剥离输尿管外膜,并保留输尿管和肾下极之间的组织,以减少输尿管缺血相关并发症的机会。
注意力转向肺门的解剖,特别是肾静脉、性腺静脉、腰静脉和肾上腺静脉。确保不要在肺门本身解剖,而是在靠近主动脉的地方解剖,因为有损伤肾门中众多血管分支的风险。性腺静脉与血管封闭器分开,先进行 3 次烧伤,然后是肾上腺静脉和腰静脉。一些中心喜欢使用夹子,但存在意外缝合夹在夹子上的风险,因此如果使用夹子,在缝合时必须格外小心。所有分支均在靠近肾静脉的地方横切。在此之后,确定肾动脉并继续向主动脉进行夹层。
然后在肾上腺和肾门之间继续解剖。肾动脉和肾静脉之间的任何结缔组织都要仔细横切。在识别和解剖血管和输尿管后,肾脏从上极完全移动到下极。随后是肾脏后部附件的活动。这部分病例因脂肪围绕和粘附于肾脏的程度而复杂。
清除肾动脉和静脉的所有附着物,为缝合做准备。用两个 Hemo-o-lok 夹夹住输尿管并尽可能远端横切,以保持长度。供体肾切除术中输尿管横断术的可接受位置是输尿管穿过髂动脉的水平。我们使用来自辅助端口的 Hem-o-lok 夹子,但也可以使用机器人夹子并适合使用。使用血管密封器、机器人剪刀的切割功能或使用来自辅助端口的剪刀对输尿管进行横切。
肾血管系统的变化发生在大约 25-50% 的病例中。7、8 肾脏接受动脉末期血液供应,因此识别并仔细保存直径大于 1-2 毫米的任何副动脉非常重要,这些副动脉通常在术前 CT 扫描中可见。术中遇到的任何较小直径的血管都可以横切。建议与受用外科医生进行讨论,最好在术前进行讨论,或者在需要时实时进行讨论。
一旦血管被解剖并准备好缝合,就会静脉注射甘露醇。我们给予 12.5 克甘露醇。我们不给予静脉肝素,但一些捐献中心会在夹夹前给予肝素。准备好冷冲洗,并将机器人取消停靠。最差的 8 毫米端口被放大到 12 毫米端口,以容纳 Endo GIA 吻合器。一些机器人供体肾切除术外科医生可能会选择使用机器人吻合器。如果肾脏很大或有粘附的肾周脂肪,请延长 Pfannenstiel 切口以容纳肾脏,就像这种情况一样。在靠近主动脉的地方用 GIA 30 tan 负荷缝合肾动脉,然后用 GIA 30 tan 负荷缝合肾静脉。通过 Pfannenstiel 切口提取肾脏。然后在后桌上用威斯康星大学的冷保存液(或其他选择的防腐剂溶液)灌注肾脏。冲洗肾动脉,直到来自肾静脉的液体清澈,肾脏实质出现冲洗。然后将肾脏运送到受体室。在这种情况下,由于肾脏的大小和肾周“粘性”脂肪,提取很困难。切口进一步扩大,使用腹腔镜取回袋取出肾脏,然后立即将其置于冰上并冲洗。
在冲洗肾脏时,最直接的第一步是确认手术区域的止血。如有必要,可结合使用夹子、烧灼剂和止血剂。如果担心淋巴引流,可能需要夹子。肾脏的解剖结构在后台上得到确认。腹横肌平面 (TAP) 阻滞可以通过使用肾切除术侧的直接可视化在腹膜浅表注射局部麻醉剂来横向给药。我们在术中进行单侧 TAP 阻滞。另一种选择是在患者仰卧位后,在拔管前麻醉进行 TAP 阻滞。然后在闭合前通过端口部位和 Pfannenstiel 切口注射局部麻醉剂的剩余部分。使用 Carter-Thompson 装置用 0 Vicryl 封闭左下象限 12 mm 端口的筋膜,用 4-0 Monocronyl 封闭端口。确认器械计数后,将 Pfannenstiel 切口分成 4 层闭合:腹膜用 2-0 Vicryl 闭合,直肌前筋膜用 2-0 PDS 闭合,皮肤分两层在 Scarpa 筋膜中使用 3-0 Vicryl,在皮下层使用 4-0 Monocryl。涂上手术胶水并确认重复器械计数。
活体肾脏捐献可以通过活体相关定向捐献、肾脏配对捐献或非定向/利他捐献进行。除了少数例外,自 2005 年以来,美国活体肾脏捐献总体上呈下降趋势。在 COVID-19 大流行期间,活体捐献率进一步下降。9 配对捐献网络可以促进活体供体肾移植的增加。配对捐献接受者更可能是女性、黑人、既往接受过移植、高度敏感并且拥有公共保险,但已被证明他们与其他活体供体肾脏接受者具有相同的结果。10
活体肾脏捐献的筛查可能因中心而异,但通常,潜在捐献者会接受医学、外科和精神病学评估(如图所示)以评估候选资格。检查可能包括心脏和肺功能检查(如有指征)、功能状态评估、恶性肿瘤筛查、感染筛查、根据 BMI 进行营养咨询和 ESRD 风险测试,尤其是对于有肾病家族史的患者。有几种风险评估工具可用于计算供体候选人的捐献前风险。11-13 岁还获得肾脏 CTA 以评估肾脏解剖结构。尽管移植中心对肾脏捐献者的资格标准不同,但如果潜在候选人未满 18 岁、患有糖尿病、患有未控制的高血压、晚期肾病、活动性感染、活动性或未完全治疗的恶性肿瘤、未经治疗的精神疾病、决策能力受损或疑似财务或人际胁迫,则通常禁忌该手术。
解剖学选择取决于外科医生。对于患有小而简单的单侧单肾结石的潜在供者,在筛查供者未来结石形成风险后,可以移植患侧(我们使用 LithoLink 测试)。肾血管系统的变化发生在大约 25-40% 的病例中。双输尿管见于大约 0.7-0.8% 的健康成年人和 2-4% 患有尿路问题的成年人。7、8、1416 在我们的中心,我们不接受马蹄肾供体或纤维肌发育不良供体。在大小差异的情况下评估肾功能分裂测试。肾分裂功能检查的标准取决于中心。在我们的中心,当供体肾脏之间的体积差异在 CT 扫描中超过 10% 时,我们会进行核医学肾脏扫描。如果肾功能分裂差异超过 10%,我们会在捐献后选择功能较低的肾脏,以留下功能较好的肾脏。传统上,左肾是捐献的首选,因为肾静脉较长,这可能有助于更容易接受者的静脉吻合。大约 80% 的活体供体肾移植都使用左肾。17 在左侧没有孤立肾动脉、左肾实质异常或根据大小差异的情况下,可以使用右肾。
活体肾脏供体的围手术期死亡率为 3/10,000,估计 20 年 ESRD 风险约为 30/10,000,无论方法或选择标准的变化如何。11、18 捐献后 6 个月血清肌酐可能与活体肾脏捐献者随后的 ESRD 风险相关。19 另一个潜在的并发症是拔牙或输液港部位有疝气的风险。与使用基于妇科手术文献的腹部中线切口相比,使用 Pfannenstiel 切口发生疝气的风险较低。20 元、21 元患者可能会因性腺静脉分裂而出现睾丸肿胀,但这是一过性的,并且会自行消退。与腹腔镜肾切除术相比,机器人辅助活体供体肾切除术已被证明具有相似的术后结果,并且总体住院时间缩短。3–6 文献中描述了几种修改,包括一个由 7 名患者组成的小型系列,这些患者报告了机器人单端口供体肾切除术的可行性。22
在这种情况下,手术时间为 3.5 小时,估计失血量为 200 毫升。由于过多的粘附肾周脂肪或“粘性脂肪”,我们遇到了额外的困难,这在解剖和肾脏提取过程中引起了问题。然而,供体恢复顺利,并在术后第 3 天出院,口服镇痛药控制疼痛良好。随访时,患者没有问题。
- 达芬奇 习 外科系统。
- 用于手辅助腹腔镜检查的 GelPort 腹腔镜系统。
- 12 mm 一次性腹腔镜端口
没什么可透露的。
本视频文章中提到的患者已同意拍摄,并且知道信息和图像将在网上发布。
References
- 美国卫生与公众服务部。OPTN/SRTR 2020 年年度数据报告:肾脏。网址: https://srtr.transplant.hrsa.gov/annual_reports/2020/Kidney.aspx。2023 年 4 月 30 日访问。
- 全球捐献和移植观察站。总结。网址: https://www.transplant-observatory.org/summary/。2023 年 4 月 30 日访问。
- Bhattu AS、Ganpule A、Sabnis RB、Murali V、Mishra S、Desai M. 机器人辅助腹腔镜供体肾切除术与标准腹腔镜供体肾切除术:一项前瞻性随机比较研究。 J 恩杜罗。2015;29(12):1334-1340. doi:10.1089/end.2015.0213.
- Xiao Q, Fu B, Song K, Chen S, Li J, Xiao J. 活体供体肾切除术手术技术比较:系统评价和贝叶斯网络荟萃分析。安移植。2020;25:e926677.doi:10.12659/AOT.926677.
- Wang H, Chen R, Li T, Peng L. 机器人辅助腹腔镜与腹腔镜供体肾切除术在肾移植中的疗效:荟萃分析。 临床移植。2019;33(1):e13451。 doi:10.1111/ctr.13451.
- Spaggiari M、Garcia-Roca R、Tulla KA 等人。机器人辅助活体供体肾切除术。 安外科。2022;275(3):591-595. doi:10.1097/SLA.00000000000004247.
- Ciçekcibaşi AE, Ziylan T, Salbacak A, Seker M, Büyükmumcu M, Tuncer I.人类胎儿肾动脉的起源、位置和变化及其临床相关性的调查。 安·安纳特。2005;187(4):421-427. doi:10.1016/j.aanat.2005.04.011.
- Aremu A, Igbokwe M, Olatise O, Lawal A, Maduadi K. 肾动脉的解剖学变化:尼日利亚肾移植中心活体肾脏供体的计算机断层血管造影研究。 非洲健康科学。2021;21(3):1155-1162. doi:10.4314/ahs.v21i3.24.
- Al Ammary F、Yu Y、Ferzola A 等人。这是美国 15 年来活体肾脏捐献的首次增长。 Am J 移植。2020;20(12):3590-3598. doi:10.1111/ajt.16136.
- Leeser DB、Thomas AG、Shaffer AA 等人。国家肾脏配对捐赠的患者和肾脏同种异体移植物存活率。 Clin J Am Soc 肾素。2020;15(2):228-237. doi:10.2215/CJN.06660619.
- Massie AB、Muzaale AD、Luo X 等人。量化活体肾脏供体的 ESRD 捐赠后风险。 J Am Soc 肾素。2017;28(9):2749-2755. doi:10.1681/ASN.2016101084.
- Grams ME、Sang Y、Levey AS 等人。活体肾脏供体候选人的肾衰竭风险预测。 N Engl J Med.2016;374(5):411-421. doi:10.1056/NEJMoa1510491.
- 约翰霍普金斯大学。肾脏供体候选人的 ESRD 风险工具。网址: http://www.transplantmodels.com/esrdrisk/。2023 年 5 月 2 日访问。
- Standring S. Philadelphia: 丘吉尔·利文斯通·爱思唯尔。费城:爱思唯尔;2020. 格雷解剖学:临床实践的解剖学基础。
- Schlussel RN, Retik AB. Campbell 泌尿外科。宾夕法尼亚州费城:桑德斯;2002. 异位输尿管、输尿管膨出和输尿管的其他异常;第 2007-2052 页。
- Fernbach SK, Feinstein KA, Spencer K, Lindstrom CA. 输尿管重复及其并发症。 射线照相。1997;17:109-127.
- 王 K, 张 P, 徐 X, 范 M.右侧与左侧腹腔镜活体供体肾切除术:荟萃分析。 Exp 临床移植。2015;13(3):214-226.
- Segev DL、Muzaale AD、Caffo BS 等人。活体肾脏捐献后的围手术期死亡率和长期生存率。 贾马。2010;303(10):959-966. doi:10.1001/jama.2010.237.
- Massie AB、Holscher CM、Henderson ML 等人。活体肾脏供体捐献者捐献后早期肾功能与随后发生终末期肾病风险的关联。 美国医学会外科杂志。2020;155(3):e195472。 doi:10.1001/jamasurg.2019.5472.
- Luijendijk RW、Jeekel J、Storm RK 等人。低位横向 Pfannenstiel 切口以及切口疝和神经卡压的普遍性。 安外科。1997;225(4):365-369. doi:10.1097/00000658-199704000-00004.
- Bewö K, Österberg J, Löfgren M, Sandblom G. 开放妇科手术后的切口疝:一项基于人群的研究。 Arch Gynecol Obstet.2019;299(5):1313-1319. doi:10.1007/s00404-019-05069-0.
- Garden EB、Al-Alao O、Razdan S、Mullen GR、Florman S、Palese MA。使用 da Vinci SP 手术系统进行机器人单端口供体肾切除术。 JSLS的。2021;25(4). doi:10.4293/JSLS.2021.00062.
Cite this article
Atthota S, Grasso J, Dageforde LA.用于活体肾脏捐献的机器人辅助腹腔镜左供体肾切除术。 J Med Insight. 2024;2024(418). doi:10.24296/jomi/418.



