Nefrectomia Laparoscópica Assistida por Robótico de Doador Esquerdo para Doação de Rim Vivo
Massachusetts General Hospital
Main Text
Table of Contents
O transplante renal é o tratamento preferido para pacientes com doença renal terminal e está associado a uma melhor qualidade de vida e sobrevida em comparação com outras terapias renais substitutivas. Em comparação com os rins de doadores falecidos, a doação de rins de doadores vivos está associada a tempos de espera mais curtos, melhor sobrevida do paciente e do enxerto e a possibilidade de transplante preventivo. Após a curva de aprendizado inicial, a nefrectomia de doadores com vida assistida por robótica tem resultados semelhantes em comparação com a nefrectomia aberta e laparoscópica e, em alguns cenários, um tempo geral de internação reduzido. Neste artigo, apresentamos um caso de nefrectomia de doador de vida assistida por robótica, incluindo avaliação, técnica e considerações para o cirurgião no pré e intraoperatório.
Transplante renal; doadores vivos; procedimentos cirúrgicos robóticos; isquemia quente; resultado do tratamento.
O transplante renal é o tratamento de escolha na doença renal terminal (DRT), mas a escassez de órgãos de doadores falecidos é um importante fator limitante. Cerca de um terço dos transplantes de rim nos Estados Unidos são transplantes de doadores vivos. 1 Isso contrasta com 40-90% dos transplantes de doadores vivos em alguns países em desenvolvimento, onde o transplante de doadores vivos é a opção mais viável devido à falta de infraestrutura para doação de órgãos falecidos e alto custo e baixa acessibilidade da diálise crônica. 2 Técnicas minimamente invasivas são agora o padrão de atendimento, e a nefrectomia de doadores de vida assistida por robótica demonstrou ter resultados pós-operatórios semelhantes em comparação com a nefrectomia laparoscópica, com diminuição do tempo total de internação. 3–6
O doador era um homem de 38 anos que se apresentou ao centro de transplante para doar um rim ao irmão. Ele não tinha história médica significativa (sem história de nefrolitíase, infecções do trato urinário, diabetes, hipertensão ou malignidade). Sua história cirúrgica pregressa incluiu uma apendicectomia aberta aos 13 anos de idade devido a apendicite rompida sem problemas relacionados à anestesia. Seu índice de massa corporal (IMC) era de 31,46 kg/m². O estado funcional do paciente era de 4 equivalentes metabólicos (METs) e ele era classe 1 da American Society of Anesthesiologists (ASA). Ele era alérgico à penicilina, gentamicina e vancomicina. Ele tem uma história familiar de fígado gorduroso e doença renal em seu irmão (de nefropatia por IgA). Ele foi submetido a testes abrangentes para doação de rim vivo e atendeu aos critérios médicos e cirúrgicos para doação.
O exame físico não foi digno de nota, exceto por obesidade abdominal e cicatriz de apendicectomia aberta no quadrante inferior direito bem cicatrizada. Ele foi submetido a exames pré-operatórios padrão de doadores, incluindo testes de função renal, testes infecciosos e triagem de malignidade apropriada para a idade. A compatibilidade do tipo sanguíneo (ABO) e imunológico (HLA) entre doador e receptor foi estabelecida. Foram realizados eletrocardiograma e radiografia de tórax pré-operatórios, que não mostraram anormalidades. Dado seu status ASA e histórico médico, nenhuma investigação pré-operatória adicional foi indicada. Exames de imagem transversais foram realizados para avaliar o tamanho e a vasculatura do rim, a fim de determinar a lateralidade do rim do doador.
A angiotomografia computadorizada de abdome foi realizada para avaliar o tamanho dos rins, bem como as variações anatômicas da vasculatura renal e do sistema coletor (Figura 1). Nesse caso, o volume estimado dos rins teve uma discrepância inferior a 10%, que é o ponto de corte para o nosso centro de testes funcionais. O doador apresentava artérias renais únicas bilaterais e veias renais únicas. Não foram observadas anormalidades na pelve ou ureteres renais. Um cisto cortical simples de aparência benigna de 2 cm foi visto no polo superior do rim esquerdo. Não foram observados cálculos ou massas anormais nos rins.
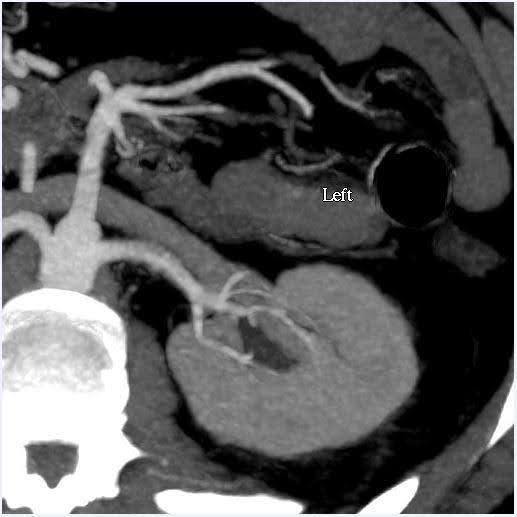
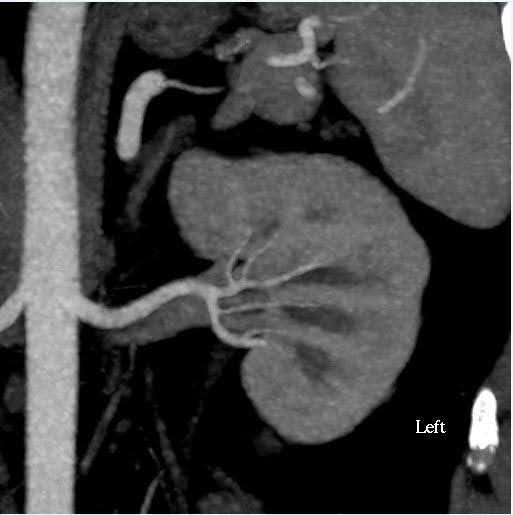
Figura 1. Angiografia por TC do abdômen (rim). Esquerda: incidência axial demonstrando artéria e veia renais únicas do lado esquerdo; Direita: vista coronal Rim esquerdo.
A nefrectomia de doador vivo pode ser realizada por meio de abordagens laparoscópicas abertas, laparoscópicas assistidas manualmente ou assistidas por robótica.
A doação de rim de doador vivo está associada a tempos de espera mais curtos e melhor sobrevida do paciente e do enxerto quando comparada aos rins de doadores falecidos. Embora o transplante preventivo antes que o receptor inicie a diálise seja uma opção com um rim de doação falecida, a doação em vida permite um tempo de espera muito menor e maior probabilidade de transplante preventivo.
A anestesia geral e o bloqueio neuromuscular são administrados com o paciente em decúbito dorsal. Após a indução da anestesia, uma sonda nasogástrica para manter o estômago descomprimido durante toda a operação e o cateter de Foley são colocados. Antibióticos perioperatórios são administrados. Um conjunto de instrumentos de laparotomia é mantido disponível na sala de cirurgia para possível conversão emergente em um procedimento aberto.
O paciente é colocado em decúbito lateral direito com os braços abraçados a um travesseiro. Ao usar o robô, o uso da placa lateral do braço pode levar à pressão do braço robótico, por isso é preferível ter o braço posicionado ligeiramente para baixo. Isso é seguido por flexionar a mesa para ajudar a separar as costelas da crista ilíaca para melhor acesso. Todos os pontos de pressão precisam ser acolchoados e um rolo axilar deve ser colocado para evitar lesões por compressão nervosa. O paciente deve ser preso à mesa de operação. Usamos um saco de feijão para ajudar a posicionar o paciente. Confirme os pulsos radiais palpáveis bilateralmente na conclusão do posicionamento. Dispositivos de compressão sequencial devem ser colocados em ambas as extremidades inferiores. O campo operatório é cortado, depois preparado e coberto da maneira estéril usual, estendendo-se do xifóide até abaixo da sínfise púbica, e a linha axilar posterior no lado da nefrectomia até o pufe no lado contralateral.
Uma incisão de Pfannenstiel de 7 a 8 cm de comprimento é feita para entrar na cavidade abdominal. A fáscia da parede abdominal é aberta transversalmente e os retalhos são elevados superior e inferiormente. A extensão da mobilização da fáscia da parede abdominal determina o tamanho da área para extração renal. Certifique-se de que haja ampla dissecação. Em seguida, os músculos retos são separados e o peritônio é aberto verticalmente entre os músculos retos. Tome cuidado para abrir o peritônio superiormente para evitar dissecção na bexiga. Um sistema laparoscópico GelPort é colocado na incisão e uma porta laparoscópica de 12 mm é colocada através do GelPort para estabelecer o pneumoperitônio. Três portas robóticas adicionais de 8 mm são colocadas sob visualização laparoscópica direta: na área epigástrica, superior ao umbigo, e no quadrante inferior esquerdo (Figura 2). As portas precisam ser colocadas a aproximadamente 10 cm de distância e a pelo menos 2 cm das costelas e crista ilíaca. A porta de 12 mm através do GelPort é uma porta de assistência para a assistência à beira do leito durante toda a operação. O robô DaVinci é então acoplado às portas e instrumentos robóticos inseridos sob visualização direta.
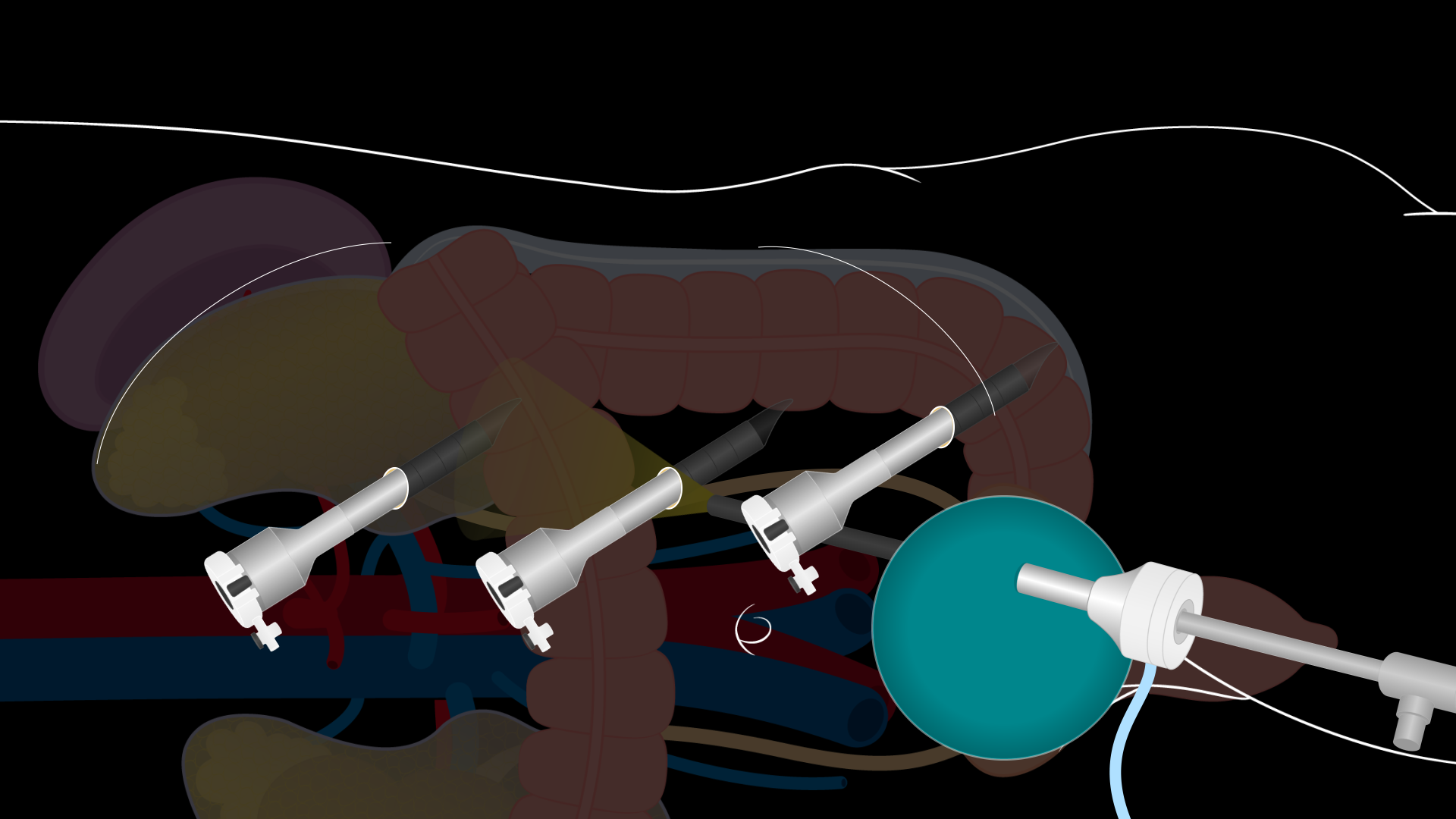
Figura 2. Locais de incisão de nefrectomia renal esquerda do doador laparoscópico. Um diagrama demonstrando a posição das instalações de porta para uma nefrectomia renal esquerda de doador laparoscópico. Uma incisão de Pfannenstiel de 7 a 8 cm de comprimento é feita para entrar na cavidade abdominal. Um sistema laparoscópico GelPort é colocado nesta incisão e uma porta laparoscópica de 12 mm é colocada através do GelPort. Três portas robóticas de 8 mm são colocadas na área epigástrica, superior ao umbigo, e no quadrante inferior esquerdo sob visão direta.
No console, o cólon esquerdo é girado medialmente, retirando as inserções da parede abdominal. O rim esquerdo é visualizado. Toma-se cuidado para não mobilizar as inserções posteriores do rim neste momento, de modo que ele permaneça retraído lateralmente para facilitar a dissecção hilar. O baço e suas ligações ao diafragma e ao rim são liberados e girados medialmente para ajudar na dissecção das estruturas vasculares. O ureter é identificado e dissecado para a pelve. É importante evitar a remoção da adventícia do ureter, deixando alguma quantidade de gordura periureteral, e preservar o tecido entre o ureter e o polo inferior do rim para diminuir a chance de complicações relacionadas à isquemia ureteral.
A atenção é voltada para a dissecção do hilo, especificamente a veia renal, a veia gonadal, a veia lombar e a veia adrenal. Certifique-se de não dissecar no próprio hilo, mas dissecar mais perto da aorta devido ao risco de ferir os numerosos ramos vasculares no hilo renal. A veia gonadal é dividida com o selador de vasos usando três queimaduras, seguidas pela veia adrenal e pelas veias lombares. Alguns centros preferem usar clipes, mas existe o risco de grampear acidentalmente os clipes, portanto, se os clipes forem usados, deve-se tomar cuidado adicional no momento do grampeamento. Todos os ramos são seccionados perto da veia renal. Em seguida, a artéria renal é identificada e a dissecção é continuada em direção à aorta.
A dissecção é então continuada entre a glândula adrenal e o hilo do rim. Qualquer tecido conjuntivo entre a artéria renal e a veia renal é cuidadosamente seccionado. Após identificar e dissecar os vasos e o ureter, o rim é completamente mobilizado do polo superior para o inferior. Isso é seguido pela mobilização das inserções posteriores do rim. Esta parte do caso foi complicada pelo grau de gordura ao redor e aderente ao rim.
A artéria e a veia renais são limpas de todos os anexos em preparação para o grampeamento. O ureter é cortado e seccionado o mais distal possível com dois clipes Hemo-o-lok para preservar o comprimento. O local aceito para transecção do ureter na nefrectomia do doador é no nível em que o ureter passa sobre a artéria ilíaca. Usamos clipes Hem-o-lok da porta de assistência, mas clipes robóticos também estão disponíveis e apropriados para uso. O ureter é seccionado com a função de corte do selador de vasos, tesoura robótica ou usando tesouras da porta de assistência.
Variações na vasculatura renal ocorrem em aproximadamente 25 a 50% dos casos. 7, 8 O rim recebe suprimento sanguíneo arterial final, por isso é importante identificar e preservar cuidadosamente quaisquer artérias acessórias maiores que 1–2 mm de diâmetro, que geralmente são visualizadas na tomografia computadorizada pré-operatória. Quaisquer vasos de menor diâmetro encontrados no intraoperatório podem ser seccionados. É aconselhável ter uma discussão com o cirurgião receptor, idealmente no pré-operatório ou em tempo real, se necessário.
Uma vez que os vasos são dissecados e prontos para grampeamento, o manitol intravenoso é administrado. Damos 12,5 g de manitol. Não administramos heparina intravenosa, mas alguns centros doadores administram heparina antes do clampeamento. A descarga fria é preparada e o robô é desencaixado. A porta de 8 mm mais inferior é aumentada para uma porta de 12 mm para acomodar o grampeador Endo GIA. Alguns cirurgiões de nefrectomia de doadores robóticos podem optar por usar o grampeador robótico. Estenda a incisão de Pfannenstiel para acomodar o rim se o rim for grande ou tiver gordura perinefrica aderente, como neste caso. A artéria renal é grampeada com uma carga de tan GIA 30 próxima à aorta, seguida de grampeamento da veia renal com uma carga tan GIA 30. O rim é extraído através da incisão de Pfannenstiel. O rim é então perfundido com uma solução fria de preservação da Universidade de Wisconsin (ou outra solução conservante de sua escolha) na mesa de trás. A artéria renal é lavada até que o líquido proveniente da veia renal esteja limpo e o parênquima do rim pareça corado. O rim é então transportado para a sala receptora. Nesse caso, a extração foi difícil devido ao tamanho do rim e à gordura "pegajosa" perinefrica. A incisão foi estendida ainda mais e uma bolsa de recuperação laparoscópica foi usada para remover o rim, que foi imediatamente colocado em gelo e lavado.
Enquanto o rim está sendo lavado, o primeiro passo mais imediato é confirmar a hemostasia no campo operatório. Se necessário, use uma combinação de clipes, cauterização e agentes hemostáticos. Clipes podem ser necessários se houver alguma preocupação com a drenagem linfática. A anatomia do rim é confirmada na mesa de trás. Um bloqueio do plano transverso do abdome (TAP) pode ser administrado lateralmente injetando anestésico local superficialmente ao peritônio usando visualização direta do lado da nefrectomia. Realizamos um bloqueio TAP unilateral no intraoperatório. Outra opção é a anestesia realizar um bloqueio TAP assim que o paciente estiver posicionado em decúbito dorsal, antes da extubação. O restante do anestésico local é então injetado pelos locais da porta e pela incisão de Pfannenstiel antes do fechamento. A fáscia na porta de 12 mm no quadrante inferior esquerdo é fechada com um Vicryl 0 usando um dispositivo Carter-Thompson, e as portas são fechadas com Monocryl 4-0. Após a confirmação da contagem de instrumentos, a incisão de Pfannenstiel é fechada em 4 camadas: o peritônio é fechado com Vicryl 2-0, a fáscia anterior do músculo reto com PDS 2-0 e a pele em duas camadas usando Vicryl 3-0 na fáscia de Scarpa e Monocryl 4-0 na camada subcuticular. A cola cirúrgica é aplicada e a contagem de instrumentos repetidos é confirmada.
A doação de rim em vida pode ser realizada por meio de doação dirigida relacionada à vida, doação de rim pareado ou doação não direcionada/altruísta. Com algumas exceções, houve um declínio geral na doação de rins vivos nos Estados Unidos desde 2005. As taxas de doação em vida caíram ainda mais durante a pandemia de COVID-19. 9 As redes de doação pareadas podem facilitar o aumento do transplante renal de doadores vivos. Os receptores de doação pareados eram mais propensos a serem mulheres, negros, ter um transplante anterior, ser altamente sensibilizados e ter seguro público, mas demonstraram ter resultados equivalentes a outros receptores de rim de doadores vivos. 10
A triagem para doação de rim vivo pode variar entre os centros, mas normalmente os doadores em potencial passam por avaliação médica, cirúrgica e psiquiátrica (conforme indicado) para avaliar a candidatura. Os testes podem incluir testes de função cardíaca e pulmonar, se indicado, avaliação do estado funcional, rastreamento de malignidade, rastreamento infeccioso, consulta nutricional dependendo do IMC e teste de risco de DRT, especialmente para aqueles com histórico familiar de doença renal. Várias ferramentas de avaliação de risco estão disponíveis para calcular os riscos de pré-doação para candidatos a doadores. 11–13 Uma angiotomografia computadorizada renal também é obtida para avaliar a anatomia renal. Embora os centros de transplante tenham diferentes critérios de elegibilidade para doadores de rim, o procedimento geralmente é contraindicado se o candidato em potencial tiver menos de 18 anos, diabético, hipertensão não controlada, doença renal avançada, infecção ativa, malignidade ativa ou incompletamente tratada, doença psiquiátrica não tratada, capacidade de tomada de decisão prejudicada ou suspeita de coerção financeira ou interpessoal.
As escolhas anatômicas dependem do cirurgião. Em doadores em potencial com uma pequena pedra renal unilateral não complicada, o lado afetado pode ser transplantado depois que o doador for rastreado quanto a riscos futuros de formação de cálculos (usamos um teste LithoLink). Variações na vasculatura renal ocorrem em aproximadamente 25 a 40% dos casos. Ureteres duplos são observados em aproximadamente 0,7 a 0,8% da população adulta saudável e em 2 a 4% dos adultos com problemas do trato urinário. 7, 8, 1416 Em nosso centro, não aceitamos doadores com rins em ferradura ou doadores com displasia fibromuscular. O teste de função renal dividida é avaliado no caso de discrepância de tamanho. Os critérios para o teste de função renal dividida são centro-dependentes. Em nosso centro, obtemos uma varredura renal de Medicina Nuclear quando a diferença de volume entre os rins do doador excede 10% na tomografia computadorizada. Tomamos o rim de funcionamento inferior se a diferença de função renal dividida exceder 10% para deixar o rim com melhor funcionamento após a doação. Convencionalmente, o rim esquerdo é preferido para doação devido ao maior comprimento das veias renais, o que pode facilitar a anastomose venosa do receptor. O rim esquerdo é usado em cerca de 80% de todos os transplantes de rim de doadores vivos. 17 O rim direito pode ser usado na ausência de uma artéria renal solitária no lado esquerdo, anormalidades parenquimatosas no rim esquerdo ou com base na discrepância de tamanho.
A mortalidade perioperatória em doadores renais vivos é de 3/10.000, e o risco estimado de DRCT em 20 anos é de cerca de 30/10.000, independentemente da abordagem ou variação nos critérios de seleção. 11, 18 A creatinina sérica pós-doação em seis meses pode estar associada ao risco subsequente de DRT em doadores renais vivos. 19 Outra complicação potencial é o risco de hérnia nos locais de extração ou porto. O risco de hérnia é menor usando uma incisão de Pfannenstiel em comparação com o uso de incisões abdominais na linha média com base na literatura de cirurgia ginecológica. 20, 21 Os pacientes podem desenvolver edema testicular devido à divisão da veia gonadal, mas isso é transitório e se resolve automaticamente. A nefrectomia de doadores vivos assistidos por robótica demonstrou ter resultados pós-operatórios semelhantes em comparação com a nefrectomia laparoscópica e diminuir o tempo de internação em geral. 3–6 Várias modificações são descritas na literatura, incluindo uma pequena série de sete pacientes que relataram viabilidade de nefrectomia robótica de doador de portal único. 22
Nesse caso, o tempo de operação foi de 3,5 horas e a perda sanguínea estimada foi de 200 ml. Encontramos dificuldade adicional devido ao excesso de gordura perinefrida aderente ou "gordura pegajosa", que causou problemas durante a dissecção, bem como a extração do rim. No entanto, o doador teve uma recuperação sem intercorrências e recebeu alta no terceiro dia de pós-operatório com bom controle da dor com analgésicos orais. No acompanhamento, o paciente não teve problemas.
- Sistema Cirúrgico Da Vinci Xi.
- Sistema laparoscópico GelPort para laparoscopia manual.
- Porta laparoscópica descartável de 12 mm
Nada a divulgar.
O paciente referido neste artigo em vídeo deu seu consentimento informado para ser filmado e está ciente de que informações e imagens serão publicadas online.
References
- Departamento de Saúde e Serviços Humanos dos EUA. Relatório Anual de Dados OPTN/SRTR 2020: Rim. Disponível em: https://srtr.transplant.hrsa.gov/annual_reports/2020/Kidney.aspx. Acessado em 30 de abril de 2023.
- Observatório Global de Doação e Transplantes. Resumo. Disponível em: https://www.transplant-observatory.org/summary/. Acessado em 30 de abril de 2023.
- Bhattu AS, Ganpule A, Sabnis RB, Murali V, Mishra S, Desai M. Nefrectomia laparoscópica assistida por robô versus nefrectomia laparoscópica padrão do doador: um estudo prospectivo randomizado comparativo. J Endourol. 2015; 29(12):1334-1340. DOI:10.1089/end.2015.0213.
- Xiao Q, Fu B, Song K, Chen S, Li J, Xiao J. Comparação de técnicas cirúrgicas em nefrectomia de doadores vivos: uma revisão sistemática e meta-análise da Rede Bayesiana. Transplante de Ana. 2020; 25:e926677. DOI:10.12659/AOT.926677.
- Wang H, Chen R, Li T, Peng L. Nefrectomia laparoscópica assistida por robô vs nefrectomia laparoscópica de doadores em transplante renal: uma meta-análise. Transplante de Clin. 2019; 33(1):e13451. DOI:10.1111/ctr.13451.
- Spaggiari M, Garcia-Roca R, Tulla KA, et al. Nefrectomias robóticas de doadores de vida assistida. Ann Surg. 2022; 275(3):591-595. DOI:10.1097/SLA.00000000000004247.
- Ciçekcibaşi AE, Ziylan T, Salbacak A, Seker M, Büyükmumcu M, Tuncer I. Uma investigação da origem, localização e variações das artérias renais em fetos humanos e sua relevância clínica. Ann Anat. 2005; 187(4):421-427. DOI:10.1016/j.aanat.2005.04.011.
- Aremu A, Igbokwe M, Olatise O, Lawal A, Maduadi K. Variações anatômicas da artéria renal: um estudo de angiograma tomográfico computadorizado em doadores de rim vivos em um Centro de Transplante de Rim da Nigéria. Afr Health Sci. 2021; 21(3):1155-1162. DOI:10.4314/ahs.v21i3.24.
- Al Ammary F, Yu Y, Ferzola A, et al. O primeiro aumento na doação de rim vivo nos Estados Unidos em 15 anos. Am J Transplante. 2020; 20(12):3590-3598. DOI:10.1111/ajt.16136.
- Leeser DB, Thomas AG, Shaffer AA, et al. Sobrevida do paciente e do aloenxerto renal com doação nacional de rim pareado. Clin J Am Soc Nefril. 2020; 15(2):228-237. DOI:10.2215/CJN.06660619.
- Massie AB, Muzaale AD, Luo X, et al. Quantificando o risco pós-doação de DRT em doadores de rim vivos. J Am Soc Nefrol. 2017; 28(9):2749-2755. DOI:10.1681/ASN.2016101084.
- Gramas ME, Sang Y, Levey AS, et al. Projeção de risco de insuficiência renal para o candidato a doador de rim vivo. N Engl J Med. 2016; 374(5):411-421. DOI:10.1056/NEJMoa1510491.
- Universidade John's Hopkins. Ferramenta de risco de DRT para candidatos a doadores de rim. Disponível em: http://www.transplantmodels.com/esrdrisk/. Acessado em 2 de maio de 2023.
- Standring S. Filadélfia: Churchill Livingstone Elsevier. Filadélfia: Elsevier; 2020. Anatomia de Gray: A Base Anatômica da Prática Clínica.
- Schlussel RN, Retik AB. Urologia de Campbell. Filadélfia, PA: Saunders; 2002. Ureter ectópico, ureterocele e outras anomalias do ureter; págs. 2007–2052.
- Fernbach SK, Feinstein KA, Spencer K, Lindstrom CA. Radiografia. 1997;17:109-127.
- Wang K, Zhang P, Xu X, Ventilador M. Nefrectomia laparoscópica direita versus esquerda de doador vivo: uma meta-análise. Transplante de Exp Clin. 2015; 13(3):214-226.
- Segev DL, Muzaale AD, Caffo BS, et al. Mortalidade perioperatória e sobrevida a longo prazo após doação de rim vivo. JAMA. 2010; 303(10):959-966. DOI:10.1001/JAMA.2010.237.
- Massie AB, Holscher CM, Henderson ML, et al. Associação da função renal pós-doação precoce com o risco subsequente de doença renal terminal em doadores de rim vivos. JAMA Surg. 2020; 155(3):e195472. DOI:10.1001/jamasurg.2019.5472.
- Luijendijk RW, Jeekel J, Tempestade RK, et al. A incisão transversal baixa de Pfannenstiel e a prevalência de hérnia incisional e aprisionamento do nervo. Ann Surg. 1997; 225(4):365-369. DOI:10.1097/00000658-199704000-00004.
- Bewö K, Österberg J, Löfgren M, Sandblom G. Hérnias incisionais após cirurgia ginecológica aberta: um estudo de base populacional. Arco Gynecol Obstet. 2019; 299(5):1313-1319. DOI:10.1007/S00404-019-05069-0.
- Jardim EB, Al-Alao O, Razdan S, Mullen GR, Florman S, Palese MA. Nefrectomia robótica de doador de portal único com o sistema cirúrgico da Vinci SP. JSLS. 2021; 25(4). DOI:10.4293/JSLS.2021.00062.
Cite this article
Atthota S, Grasso J, Dageforde LA. Nefrectomia laparoscópica assistida por robótica de doador esquerdo para doação de rim vivo. J Med Insight. 2024; 2024(418). DOI:10.24296/jomi/418.



