ロボット支援腹腔鏡下の左腎臓切除術による生体腎臓提供
Massachusetts General Hospital
Main Text
Table of Contents
腎移植は末期腎疾患患者にとって推奨される治療法であり、他の腎置換療法と比較してより良い生活の質と生存率と関連しています。死亡したドナー腎臓と比較し、生体ドナー腎臓提供は待ち時間の短縮、患者および移植片の生存率の向上、予防的移植の可能性と関連しています。初期の学習曲線を経て、ロボット支援生活型ドナー腎摘出術は開腹腎や腹腔鏡腎摘出術と同様の結果を得ており、場合によっては全体的な入院期間が短縮されます。本記事では、ロボット支援ドナー腎摘出術の症例を紹介し、評価、技術、術前および術中における外科医の考慮事項を紹介します。
腎移植;生体ドナー;ロボット手術;温性虚血;治療結果。
腎移植は末期腎疾患(ESRD)における選択肢の治療ですが、亡くなったドナー臓器の不足が大きな制約要因となっています。アメリカ合衆国における腎臓移植の約3分の1は生体ドナー移植です。これは 、一部の発展途上国では生体ドナー移植が最も現実的な選択肢となっている場合、40〜90%が生存ドナー移植であり、これは亡くなった臓器提供のためのインフラが不足し、慢性透析の高コストかつアクセスの困難さから最も現実的な選択肢となっています。2 低侵襲技術が現在標準的な治療であり、ロボット支援生活型ドナー腎摘出術は腹腔鏡下腎摘出術と同様の術後転帰を示し、全体の滞在期間が短縮されることが示されています。3–6
ドナーは38歳の男性で、移植センターに来て兄に腎臓を提供しようとしました。彼には特に重要な病歴はありませんでした(腎結石、尿路感染症、糖尿病、高血圧、悪性腫瘍の既往はありません)。過去の手術歴には、麻酔関連の問題なく13歳で虫垂炎破裂による開腹盲垂切除術がありました。彼の体格指数(BMI)は31.46 kg/m²でした。患者の機能的状態は4代謝当量(MET)で、アメリカ麻酔学会(ASA)クラス1に属していました。彼はペニシリン、ゲンタミシン、バンコマイシンにアレルギーがありました。彼の兄弟には脂肪肝と腎臓病の家族歴があります(IgA腎症による)。彼は生体腎臓提供のための包括的な検査を受け、提供のための医療および外科的基準を満たしました。
身体検査は腹部肥満と右下腹部の開放性虫垂切除の瘢痕以外に特に特徴はありませんでした。腎機能検査、感染症検査、年齢に応じた悪性腫瘍スクリーニングなど、標準的なドナー術前検査を受けました。血液型(ABO)および免疫学的(HLA)適合性がドナーとレシピンの適合性を確立しました。術前心電図および胸部X線検査を行い、異常は認められませんでした。ASAのステータスと病歴から、術前検査は追加されませんでした。腎臓の大きさと血管を評価し、ドナー腎臓の側性を判断するために断面画像検査を実施しました。
腹部のCT血管造影は腎臓の大きさおよび腎血管および細胞採取系の解剖学的変異を評価するために実施されました(図1)。今回の場合、腎臓の推定容量の差は10%未満であり、これは機能検査センターの基準値です。ドナーは両側の単一腎動脈と単一の腎静脈を持っていました。腎臓の骨盤や尿管に異常は認められませんでした。左腎の上極に2cmの単純な良性皮質嚢胞が認められました。腎臓に結石や異常腫瘤は認められませんでした。
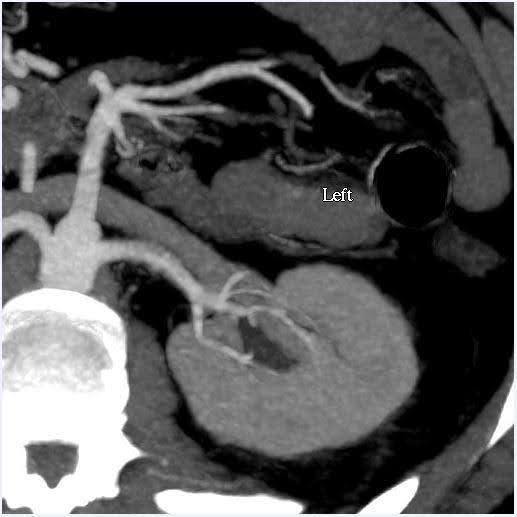
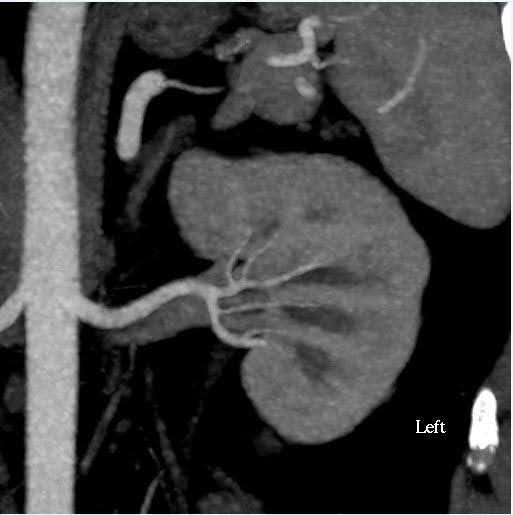
図1。CT血管造影、腹部(腎臓)。 左:左側に単一の腎動脈と静脈を示す軸方向図;右:冠状図 左腎臓。
生体ドナー腎摘出術は、開腹鏡、手補助腹腔鏡、またはロボット補助アプローチで実施可能です。
生体ドナー腎臓提供は、死亡したドナー腎臓と比べて待機時間が短くなり、患者および移植片の生存率が向上することと関連しています。遺体からの腎臓提供では、受血者が透析を始める前の予防的移植も選択肢ですが、生体移植は待ち時間が大幅に短く、予防的移植の可能性が高いです。
全身麻酔と神経筋遮断は、仰臥位で実施されます。麻酔誘導後、手術中に胃を減圧させる鼻胃管とフォーリーカテーテルが挿入されます。術中期間中に抗生物質が投与されます。開腹手術への緊急移行の可能性に備え、手術室には開腹手術器具セットが常備されています。
患者は右側デキュビトゥス姿勢に置かれ、腕は枕に抱きつきます。ロボットを使用する際、横方向のアームボードの使用はロボットアームからの圧力を引き起こす可能性があるため、アームをやや下向きに配置するのが望ましいです。その後、肋骨と腸骨娴を分離しやすくするためにテーブルを曲げます。すべての圧迫点にはパッドを入れ、神経圧迫損傷を防ぐために腋巻きを装着する必要があります。患者は手術台に固定されているべきです。ビーンバッグを使って患者の体勢調整を助けます。位置測定終了時に両側で触知可能な橈骨脈拍を確認します。両下肢に順次圧迫装置を設置する必要があります。手術視野は通常の無菌方法で準備され、歯骨から恥骨結合下まで、腎切除側の後腋線から反対側のビーンバッグまで伸びます。
腹部に入るために長さ7〜8cmのファネンシュティール切開が行われます。腹壁筋膜は横方向に開き、弁は上下に持ち上げられています。腹壁筋膜の動員の程度が腎臓摘出の領域の大きさを決定します。十分な解剖を行ってください。その後、直筋を広げ、腹直筋の間に腹膜を垂直に開きます。膀胱の剥離を防ぐために腹膜を上方に開けるように注意してください。切開部にはGelPort腹腔鏡システムが挿入され、12mmの腹腔鏡ポートがGelPortに挿入されて気腹閉鎖を形成します。さらに3つの8mmロボットポートが直接腹腔鏡下で設置されます。上腹部(へ鼻の上方)と左下腹部に設置されています(図2)。ポートは約10cm間隔、肋骨と腸骨稜から少なくとも2cm離して設置する必要があります。GelPortを通る12mmポートは、手術中のベッドサイドアシストのための補助ポートです。その後、ダヴィンチロボットはポートとロボット機器にドッキングされ、直接可視化されます。
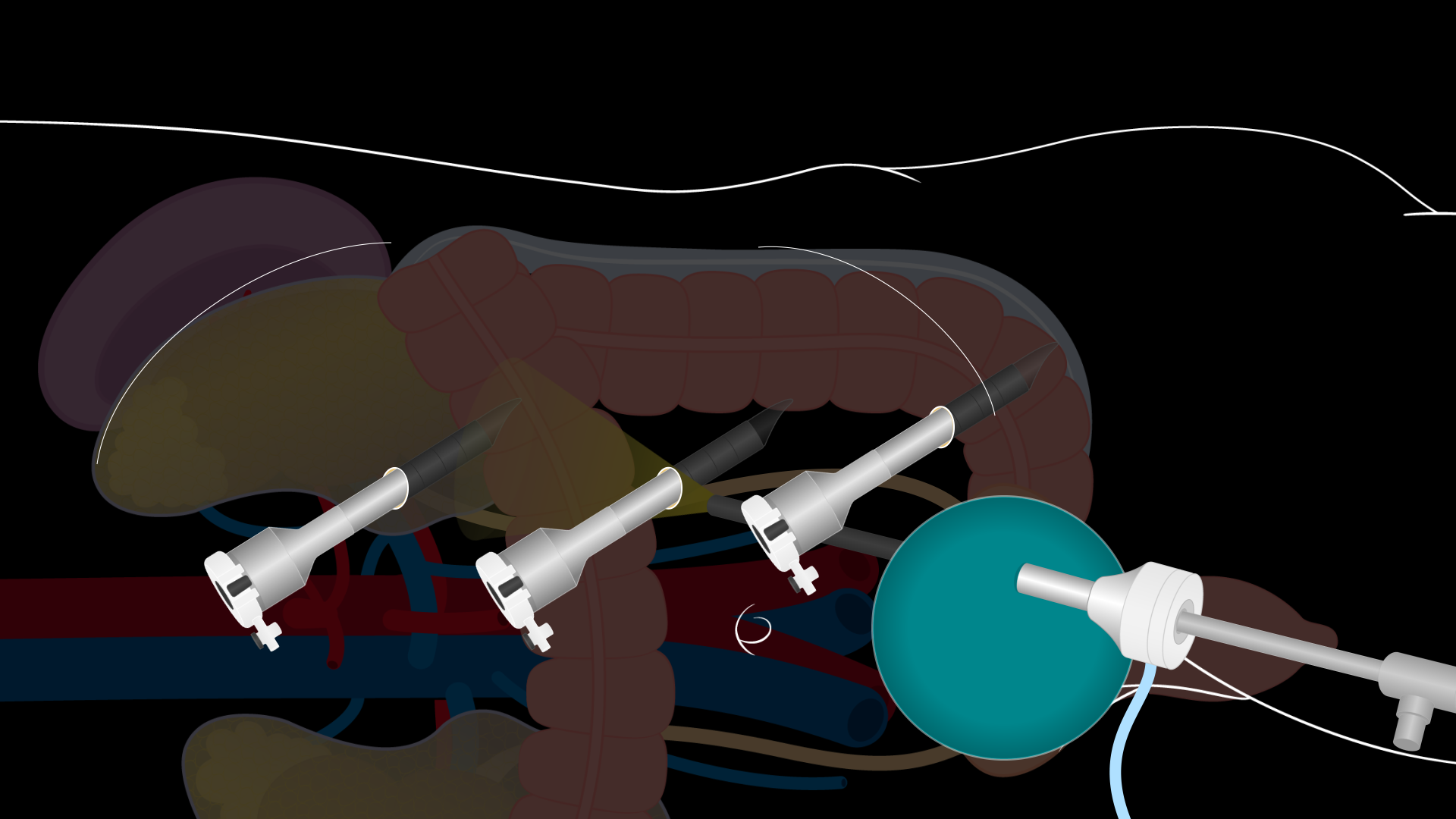
図2。腹腔鏡ドナー左腎腎摘出切開部位。腹腔鏡ドナー左腎腎摘出術のためのポート設置位置を示す図。腹部に7〜8cmのPfannenstiel切開が1つ行われます。この切開部にはGelPort腹腔鏡システムが挿入され、GelPortには12mm腹腔鏡ポートが挿入されます。3つの8mmロボットポートは、臍よりも上位の上腹部、左側下腹部に直接観察できる位置に設置されています。
コンソールでは、左結腸を腹壁への付着部を内側に回旋させます。左腎臓が見える。この時点で腎臓の後部付着部を動かさず、椎間剥離を容易にするために外側に引っ込めたままにするよう注意が必要です。脾臓およびその横隔膜および腎臓への付着部は解放され、血管構造の解離を助けるために内側回旋します。尿管を特定し、骨盤まで剥離します。尿管虚血に関連する合併症のリスクを減らすために、尿道から尿管をある程度残して人工尿管を除去しないようにし、尿管と腎臓の下極の間の組織を保存することが重要です。
特に腎静脈、性腺静脈、腰静脈、副腎静脈の門門の解離に注目します。肺門自体の解離は避け、腎門の多くの血管枝を損傷するリスクがあるため、大動脈に近い位置で解離してください。性腺静脈は、血管シーラーによって3回の焼け傷、続いて副腎静脈と腰静脈を分けます。一部のセンターではクリップの使用を好みますが、クリップの上に誤ってホチキスで留めるリスクがあるため、クリップを使う場合はホチキス留め時に特に注意が必要です。すべての枝は腎静脈の近くで横断されています。その後、腎動脈を特定し、大動脈に向かって解離を続けます。
その後、副腎と腎門の間で解離を続けます。腎動脈と腎静脈の間の結合組織は慎重に切断されます。血管と尿管を特定・解離した後、腎臓は上極から下極へ完全に動員されます。その後、腎臓の後部付着部の動員が行われます。この部分は腎臓を取り囲み、付着する脂肪の度合いによって複雑化しました。
腎動脈と静脈はすべての付着部から除去され、ホチキス留めの準備を行います。尿管は長さを保つために、できるだけ遠位に2本のヘモオロッククリップで切断されます。ドナー腎摘出術における尿管切断の認められた位置は、尿管が腸骨動脈を通過する位置です。アシストポートからHem-o-lokクリップを使用していますが、ロボットクリップも利用可能で、適切なものがあります。尿管は血管シーラーの切断機能、ロボットハサミ、または補助ポートからのハサミを用いて切断されます。
腎血管の変動は約25〜50%の症例で見られます。7、8 腎臓は動脈末端からの血液供給を受けているため、通常術前CTスキャンで確認される直径1〜2mmを超える補助動脈を特定し、慎重に保存することが重要です。術中で遭遇した直径の小さい血管は断切可能です。必要に応じて、受け手の外科医と術前または必要に応じてリアルタイムで話し合うことが望ましいです。
血管を剥離しホチキス固定の準備が整ったら、静脈内マンニトールが投与されます。マンニトールを12.5g投与します。静脈内ヘパリンは投与しませんが、一部のドナーセンターではクロスクランプ前にヘパリンを投与します。コールドフラッシュが準備され、ロボットはドッキングから外れます。最も劣る8mmポートはEndo GIAホチキスに対応するために12mmポートに拡張されています。一部のロボットドナー腎切除外科医はロボットホチキスを使うこともあります。腎臓が大きい場合や、今回のように周り脂肪が付着している場合は、腎臓を受け入れるためにプファネンシュティール切開を延長してください。腎動脈は大動脈近くにGIA 30タンロードでホチキスで固定され、その後GIA 30タンロードで腎静脈をステープスで固定します。腎臓はプファネンシュティール切開から抽出されます。その後、腎臓はウィスコンシン大学の冷たい保存液(または他の保存液)で後方のテーブルに灌流されます。腎動脈は静脈からの液体が澄み、腎の実質が洗い流されるまで洗浄されます。腎臓はその後、受領室へ運ばれます。この場合、腎臓の大きさと腎周の「粘着性」脂肪のため、摘出が困難でした。切開部はさらに延長され、腹腔鏡下での採出バッグで腎臓を取り出し、すぐに氷にかけて洗浄しました。
腎臓を洗浄している間、最も早い段階は手術部位での止血を確認することです。必要に応じてクリップ、焼灼剤、止血剤を組み合わせて使用してください。リンパの排液が心配であればクリップが必要になることがあります。腎臓の解剖学は後ろのテーブルで確認されています。横腹筋面(TAP)ブロックは、腎切除側を直接可視化しながら腹膜の浅い部分に局所麻酔を注入することで外側から投与できます。術中に片側TAPブロックを行います。もう一つの選択肢として、患者が仰臥になった後に麻酔でTAPブロックを行う方法があります。残りの局所麻酔はポート部位とプファネンシュティール切開から注入され、閉鎖されます。左下象限の12mmポートのフェイシアはカーター・トンプソン装置を用いた0 Vicrylで閉じ、ポートは4-0 Monocrylで閉じられます。器具数を確認した後、Pfannenstiel切開部は4層で閉じられます。腹膜は2-0 Vicrylで、直直筋の前筋膜は2-0 PDSで、皮膚は2層に分けてScarpa筋膜の3-0 Vicryl、皮下層に4-0 Monocrylを用いて2層に分けます。外科用接着剤を塗布し、再検査の器具数を確認します。
生体腎臓提供は、生体関連直接提供、腎ペアド、または非指向的/利他的な提供のいずれかで行われます。いくつかの例外を除き、2005年以降、アメリカ合衆国における生体腎臓提供は全体的に減少しています。COVID-19パンデミック中、生体提供率はさらに低下しました。ペア ドナードネーションネットワークは、生体ドナー腎移植の増加を促進します。ペアドナードレシピエントは女性、黒人、過去に移植を受けており、高い感度を持ち、公的保険に加入していることが多いですが、他の生体腎臓ドナー受給者と同等の結果を示すことが示されています。10
生体腎臓提供のスクリーニングはセンターによって異なりますが、通常、潜在的なドナーは医療、外科、精神科の評価を受け、候補者資格を評価します。検査には、必要に応じて心臓および肺機能検査、機能評価、悪性腫瘍スクリーニング、感染症スクリーニング、BMIによる栄養相談、特に腎臓病の家族歴がある方にはESRDリスク検査が含まれます。ドナー候補者の事前献血リスクを計算するためのリスク評価ツールはいくつか用意されています。11–13 腎の解剖学的評価のために腎CTAも取得します。移植センターごとに腎臓ドナーの適格基準は異なりますが、候補者が18歳未満、糖尿病、制御不能な高血圧、進行性腎疾患、活動性感染症、進行性または不完全治療の悪性腫瘍、未治療の精神疾患、意思決定能力の低下、または経済的または対人関係の強要が疑われている場合、一般的にこの手術は禁忌とされます。
解剖学的な選択は外科医によって異なります。小さくて複雑症でない片側の腎結石を持つドナーの候補者では、将来の結石リスクをスクリーニングした後(LithoLink検査を使用)、影響を受けた側を移植することもあります。腎血管の変動は約25〜40%の症例で見られます。二重尿管は、健康な成人人口の約0.7〜0.8%、尿路の問題を持つ成人の2〜4%に見られます。7、8、1416年当センターでは、馬蹄形腎臓や線維筋形成不全のドナーは受け付けていません。サイズの不一致がある場合には分割腎機能検査が評価されます。分割腎機能検査の基準は中心によって異なります。当センターでは、ドナー腎臓の体積差がCTスキャンで10%を超える場合、核医学の腎スキャンを受けます。腎機能の差が10%を超える場合、機能の低い腎臓を移植し、提供後により機能性の高い腎臓を残します。従来、腎静脈の長さが長い左腎臓が提供に好まれ、受血者の静脈吻合が容易になる可能性があります。左腎は、すべての生体ドナー腎移植の約80%で使用されています。17 右腎は、左側に単一腎動脈がない場合、左腎に実質異常がある場合、またはサイズの差に基づいて使用されることがあります。
生存腎臓ドナーの術前死亡率は3/10,000であり、20年後の推定ESRDリスクは約30/10,000で、アプローチや選択基準のばらつきに関わらずです。11、18 6か月時の提供後血清クレアチニンは、生体腎臓ドナーにおけるその後のESRDリスクと関連している可能性があります。19 もう一つの潜在的な合併症は、抜歯部位やポート部位でのヘルニアのリスクです。婦人科手術の文献に基づき、Pfannenstiel切開は腹部正中切開よりもヘルニアのリスクが低いとされています。20、21 患者は性腺静脈の分裂による精巣腫れを発症することがありますが、これは一時的で自然に治ります。ロボット支援ドナー腎摘出術は、腹腔鏡下腎摘出術と同様の術後転帰を示し、全体的な入院期間の短縮が示されています。3–6 文献にはいくつかの修正が記載されており、ロボット単一ポートドナー腎摘出術の実現可能性を報告した7人の患者が報告されました。22
この場合、手術時間は3.5時間、推定出血量は200mlでした。過剰な粘着性腎臓脂肪(「粘着性脂肪」)により、腎臓の解離や摘出時に問題が生じるというさらなる困難に直面しました。しかし、ドナーは特に問題なく回復し、術後3日目に経口鎮痛薬で痛みのコントロールが良好な状態で退院しました。フォローアップでは、患者さんは問題ありませんでした。
- ダ・ヴィンチ・シー手術システム。
- GelPort腹腔鏡検査システム(手助け腹腔鏡検査)。
- 12mm使い捨て腹腔鏡ポート
特に開示することはない。
この動画で言及されている患者は撮影に同意しており、情報や画像がオンラインで公開されることを認識しています。
References
- アメリカ合衆国保健福祉省。OPTN/SRTR 2020年次データ報告書:腎臓。入手可能: https://srtr.transplant.hrsa.gov/annual_reports/2020/Kidney.aspx。2023年4月30日アクセス。
- 世界寄付・移植に関する観測所。概要。購入可能: https://www.transplant-observatory.org/summary/。2023年4月30日アクセス。
- Bhattu AS、Ganpule A、Sabnis RB、Murali V、Mishra S、Desai M. ロボット補助腹腔鏡ドナー腎摘出術と標準的な腹腔鏡ドナー腎摘出術:前向きランダム化比較研究。 J エンドロール。2015;29(12):1334-1340. doi:10.1089/end.2015.0213.
- Xiao Q, Fu B, Song K, Chen S, Li J, Xiao J. 生体ドナー腎摘出術における外科技術の比較:システマティックレビューおよびベイズネットワークメタアナリシス。 アン移植。2020;25:e926677。 doi:10.12659/AOT.926677。
- Wang H, Chen R, Li T, Peng L. 腎移植におけるロボット補助腹腔鏡手術と腹腔鏡ドナー腎摘出術の比較:メタアナリシス。 クリン移植。2019;33巻1号:e13451。 doi:10.1111/ctr.13451。
- スパッギアリ M、ガルシア・ロカ R、トゥラ KA ほか。ロボット支援付き生活ドナー腎摘出術。 アン・サージ。2022;275(3):591-595. doi:10.1097/SLA.0000000000004247.
- Ciçekcibaşi AE, Ziylan T, Salbacak A, Seker M, Büyükmumcu M, Tuncer I.ヒト胎児における腎動脈の起源、位置および変異と臨床的関連性の調査。 アン・アナット。2005;187(4):421-427. DOI:10.1016/J.aanat.2005.04.011.
- アレム A、イグボクウェ M、オラティゼ O、ラワル A、マドゥアディ K. 腎動脈の解剖学的変異:ナイジェリア腎移植センターにおける生体腎臓ドナーを対象としたコンピュータ断層造影血管造影研究。 AFR Health Sci。2021;21(3):1155-1162. DOI:10.4314/AHS.V21i3.24.
- アル・アマリー F、ユー Y、フェルゾラ A ほか。アメリカ合衆国で15年ぶりに生体腎臓提供の増加です。 私はJ Transplantです。2020;20(12):3590-3598. doi:10.1111/ajt.16136。
- リーザーDB、トーマスAG、シャファーAAら。患者および腎臓の同種移植の生存率と全国腎のペアドネーション。 クリニックJ Am Soc ネフロール。2020;15(2):228-237. doi:10.2215/CJN.06660619。
- マッシーAB、ムザーレAD、ルオX他。生体腎臓ドナーにおけるESRDの提供後リスクの定量化。 J Am Soc Nephrol。2017;28(9):2749-2755. doi:10.1681/ASN.2016101084。
- グラムズ、サン・Y、レビーASら。生存腎臓ドナー候補者の腎不全リスク予測。 N Engl J Med.2016;374(5):411-421. doi:10.1056/NEJMoa1510491。
- ジョンズ・ホプキンス大学。腎臓ドナー候補者向けのESRDリスクツール。入手可能: http://www.transplantmodels.com/esrdrisk/。2023年5月2日アクセス。
- スタンドリング 南フィラデルフィア:チャーチル・リビングストン・エルゼビア。フィラデルフィア:エルゼビア;2020年。グレイの解剖学:臨床実践の解剖学的基盤。
- シュルッセル看護師、レティクAB。キャンベル泌尿器科。フィラデルフィア(ペンシルベニア州):ソーンダース;2002年。異所性尿管、尿管膨出、その他の尿管異常;2007–2052年。
- フェルンバックSK、ファインスタインKA、スペンサーK、リンドストロムCA。尿管重複とその合併症。 放射線画像。1997;17:109-127.
- 王K、張P、徐X、ファンM。右腹腔鏡下生体ドナー腎摘出術と左腹腔鏡による肝臓摘出術:メタアナリシス。 経験的なクリン移植。2015;13(3):214-226.
- セゲブDL、ムザーレAD、カッフォBSなど。生体腎臓提供後の周術期死亡率および長期生存率。 JAMA。2010;303(10):959-966. doi:10.1001/jama.2010.237。
- マッシーAB、ホルシャーCM、ヘンダーソンMLほか。生存腎ドナーにおける早期腎機能と末期腎疾患リスクとの関連。 JAMAサージ。2020;155巻3号:e195472。 doi:10.1001/jamasurg.2019.5472。
- ルイエンダイクRW、ジーケルJ、ストームRK他。低位の横切開ファネンシュティール切開と切開ヘルニアおよび神経閉塞の有病率。 アン・サージ。1997;225(4):365-369. DOI:10.1097/00000658-199704000-00004。
- Bewö K, Österberg J, Löfgren M, Sandblom G. 開腹婦人科手術後の切開ヘルニア:集団ベースの研究。 産科婦人科大科。2019;299(5):1313-1319. DOI:10.1007/S00404-019-05069-0。
- ガーデンEB、アルアラオO、ラズダンS、マレンGR、フローマンS、パレーゼMA。ダ・ヴィンチSP手術システムを使ったロボット単一ポートドナー腎摘出術。 JSLSです。2021;25(4). doi:10.4293/JSLS.2021.00062.
Cite this article
アトトータ S、グラッソ J、ダジェフォード LA。生体腎臓提供のためのロボット補助腹腔鏡下左腎臓摘出術。 J Med Insight。 2024;2024(418). DOI:10.24296/jomi/418。



