Néphrectomie laparoscopique du donneur gauche assistée par robot pour le don de rein vivant
Massachusetts General Hospital
Main Text
Table of Contents
La transplantation rénale est le traitement privilégié pour les patients atteints d’insuffisance rénale terminale et est associée à une meilleure qualité de vie et à une meilleure survie par rapport aux autres thérapies de remplacement rénal. Comparé aux reins de donneurs décédés, le don de rein de donneur vivant est associé à des temps d’attente plus courts, à une amélioration de la survie des patients et des greffons, et à la possibilité d’une transplantation préventive. Après la courbe d’apprentissage initiale, la néphrectomie du donneur assistée par robot a des résultats similaires à ceux de la néphrectomie ouverte et laparoscopique et, dans certains contextes, une durée globale de séjour réduite. Dans cet article, nous présentons un cas de néphrectomie de donneur assistée par robot, y compris l’évaluation, la technique et les considérations pour le chirurgien préopératoire et peropératoire.
Transplantation rénale ; les donneurs vivants ; procédures chirurgicales robotiques ; ischémie chaude ; résultat du traitement.
La transplantation rénale est le traitement de choix dans l’insuffisance rénale terminale (IRT), mais la pénurie d’organes de donneurs décédés est un facteur limitatif majeur. Environ un tiers des greffes de rein aux États-Unis sont des greffes de donneurs vivants. 1 Cela contraste avec les 40 à 90 % de greffes de donneurs vivants dans certains pays en développement où la transplantation de donneurs vivants est l’option la plus réalisable en raison du manque d’infrastructures pour le don d’organes de personnes décédées et du coût élevé et de la faible accessibilité de la dialyse chronique. 2 Les techniques mini-invasives sont maintenant la norme de soins, et il a été démontré que la néphrectomie du donneur assistée par robot a des résultats postopératoires similaires à ceux de la néphrectomie laparoscopique, avec une durée globale de séjour réduite. 3 à 6
Le donneur était un homme de 38 ans qui s’est présenté au centre de transplantation pour donner un rein à son frère. Il n’avait pas d’antécédents médicaux importants (aucun antécédent de calculs rénaux, d’infections des voies urinaires, de diabète, d’hypertension ou de tumeur maligne). Ses antécédents chirurgicaux comprenaient une appendicectomie ouverte à l’âge de 13 ans en raison d’une rupture de l’appendicite sans problèmes liés à l’anesthésie. Son indice de masse corporelle (IMC) était de 31,46 kg/m². L’état fonctionnel du patient était de 4 équivalents métaboliques (MET), et il était de classe 1 de l’American Society of Anesthesiologists (ASA). Il était allergique à la pénicilline, à la gentamicine et à la vancomycine. Il a des antécédents familiaux de stéatose hépatique et de maladie rénale chez son frère (néphropathie à IgA). Il a subi des tests complets pour le don de rein vivant et il a satisfait aux critères médicaux et chirurgicaux pour le don.
L’examen physique n’a révélé rien de particulier, à l’exception d’une obésité abdominale et d’une cicatrice d’appendicectomie ouverte dans le quadrant inférieur droit. Il a subi un bilan préopératoire standard chez le donneur, y compris des tests de la fonction rénale, des tests infectieux et un dépistage de la malignité adapté à l’âge. La compatibilité du groupe sanguin (ABO) et de l’immunologie (HLA) entre le donneur et le receveur a été établie. Un électrocardiogramme préopératoire et une radiographie pulmonaire ont été réalisés et n’ont montré aucune anomalie. Compte tenu de son statut d’AAS et de ses antécédents médicaux, aucun autre bilan préopératoire n’a été indiqué. Une imagerie en coupe transversale a été réalisée pour évaluer la taille du rein et la vascularisation afin de déterminer la latéralité rénale du donneur.
Une angiographie par tomodensitométrie de l’abdomen a été réalisée pour évaluer la taille des reins ainsi que les variations anatomiques du système vasculaire et collecteur rénal (Figure 1). Dans ce cas, le volume estimé des reins présentait un écart inférieur à 10 %, ce qui est le seuil pour notre centre de tests fonctionnels. Le donneur avait des artères rénales bilatérales et des veines rénales uniques. Aucune anomalie n’a été notée dans le bassinet du rein ou les uretères. Un simple kyste cortical bénin de 2 cm a été observé dans le pôle supérieur du rein gauche. Aucun calcul ou masse anormale n’a été noté dans les reins.
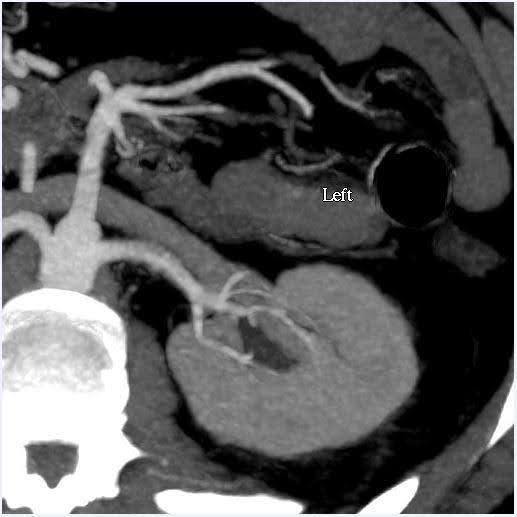
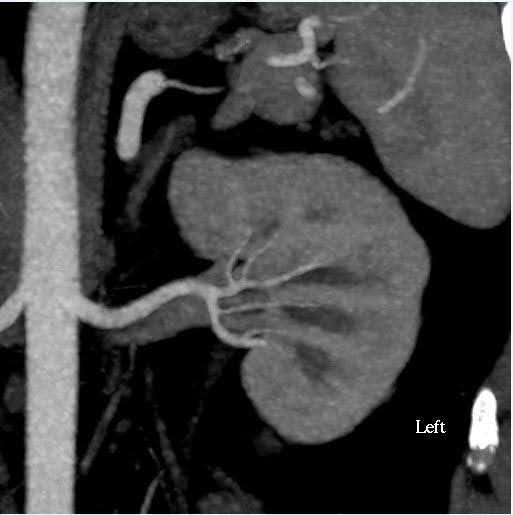
Graphique 1. TDM, angiographie, abdomen (rein). À gauche : vue axiale montrant une artère rénale unique et une veine du côté gauche ; À droite : vue coronale Rein gauche.
La néphrectomie d’un donneur vivant peut être réalisée par laparoscopie ouverte, laparoscopique assistée par la main ou assistée par robot.
Le don de rein de donneur vivant est associé à des temps d’attente plus courts et à une meilleure survie des patients et des greffons par rapport aux reins de donneurs décédés. Bien que la transplantation préventive avant que le receveur ne commence la dialyse soit une option avec un rein provenant d’un don décédé, le don vivant permet un temps d’attente beaucoup plus court et une probabilité plus élevée de transplantation préventive.
L’anesthésie générale et le bloc neuromusculaire sont administrés avec le patient en position couchée. Après l’induction de l’anesthésie, une sonde nasogastrique pour maintenir l’estomac décompressé tout au long de l’opération et un cathéter de Foley sont placés. Des antibiotiques périopératoires sont administrés. Un ensemble d’instruments de laparotomie est disponible dans la salle d’opération pour une conversion émergente potentielle en une procédure ouverte.
Le patient est placé dans la position de décubitus latéral droit, les bras étreignant un oreiller. Lors de l’utilisation du robot, l’utilisation de la planche de bras latéral peut entraîner une pression du bras robotique, il est donc préférable d’avoir le bras positionné légèrement vers le bas. Ensuite, la table est fléchie pour aider à séparer les nervures de la crête iliaque pour un meilleur accès. Tous les points de pression doivent être rembourrés et un rouleau axillaire doit être placé pour éviter les blessures par compression nerveuse. Le patient doit être fixé à la table d’opération. Nous utilisons un pouf pour aider à positionner le patient. Confirmer les impulsions radiales palpables bilatéralement à la fin du positionnement. Des dispositifs de compression séquentielle doivent être placés sur les deux membres inférieurs. Le champ opératoire est coupé, puis préparé et drapé de la manière stérile habituelle, s’étendant de la xiphoïde jusqu’au-dessous de la symphyse pubienne, et de la ligne axillaire postérieure du côté de la néphrectomie jusqu’au pouf du côté controlatéral.
Une incision de Pfannenstiel de 7 à 8 cm de long est pratiquée pour pénétrer dans la cavité abdominale. Le fascia de la paroi abdominale est ouvert transversalement et les rabats sont relevés vers le haut et vers le bas. L’étendue de la mobilisation du fascia de la paroi abdominale détermine la taille de la zone d’extraction rénale. Assurez-vous qu’il y a une dissection suffisante. Ensuite, les muscles droits sont écartés et le péritoine est ouvert verticalement entre les muscles droits. Prenez soin d’ouvrir le péritoine vers le haut pour éviter la dissection dans la vessie. Un système laparoscopique GelPort est placé dans l’incision, et un port laparoscopique de 12 mm est placé à travers le GelPort pour établir le pneumopéritoine. Trois autres ports robotiques de 8 mm sont placés sous visualisation laparoscopique directe : dans la région épigastrique, au-dessus de l’ombilic, et dans le quadrant inférieur gauche (Figure 2). Les orifices doivent être placés à environ 10 cm l’un de l’autre et à au moins 2 cm des côtes et de la crête iliaque. Le port de 12 mm à travers le GelPort est un port d’assistance pour l’assistance au chevet du patient tout au long de l’opération. Le robot DaVinci est ensuite amarré aux ports et aux instruments robotiques insérés sous visualisation directe.
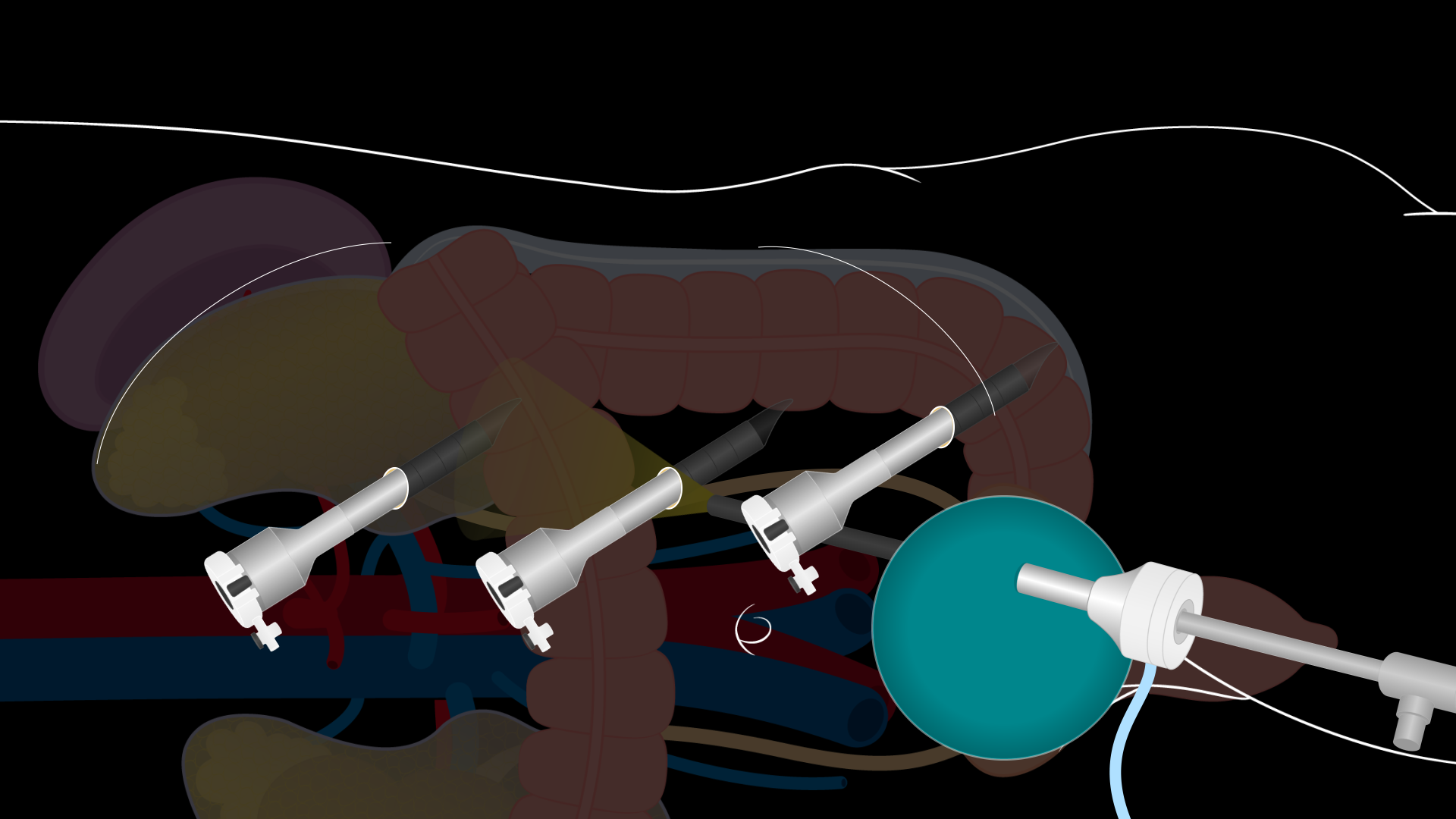
Graphique 2. Sites d’incision de la néphrectomie rénale gauche du donneur laparoscopique. Schéma montrant la position des installations portuaires pour une néphrectomie rénale gauche d’un donneur laparoscopique. Une incision de Pfannenstiel de 7 à 8 cm de long est pratiquée pour pénétrer dans la cavité abdominale. Un système laparoscopique GelPort est placé dans cette incision, et un port laparoscopique de 12 mm est placé à travers le GelPort. Trois ports robotiques de 8 mm sont placés dans la zone épigastrique, au-dessus de l’ombilic, et dans le quadrant inférieur gauche en vision directe.
Au niveau de la console, le côlon gauche est tourné médialement en enlevant les attaches à la paroi abdominale. Le rein gauche est visualisé. On prend soin de ne pas mobiliser les attaches postérieures du rein à ce moment-là afin qu’il reste rétracté latéralement pour faciliter la dissection hilaire. La rate et ses attaches au diaphragme et au rein sont libérées et pivotées médialement pour aider à la dissection des structures vasculaires. L’uretère est identifié et disséqué jusqu’au bassin. Il est important d’éviter d’enlever l’adventice de l’uretère en laissant une certaine quantité de graisse périurétérale, et de préserver le tissu entre l’uretère et le pôle inférieur du rein pour réduire le risque de complications liées à l’ischémie urétérale.
L’attention est portée sur la dissection du hile, en particulier de la veine rénale, de la veine gonadique, de la veine lombaire et de la veine surrénale. Assurez-vous de ne pas disséquer dans le hile lui-même, mais de le faire plus près de l’aorte en raison du risque de blesser les nombreuses branches vasculaires du hile rénal. La veine gonadique est divisée avec le scellant de vaisseaux à l’aide de trois brûlures, suivies de la veine surrénale et des veines lombaires. Certains centres préfèrent utiliser des clips, mais il y a un risque d’agrafage accidentel sur les clips, donc si des clips sont utilisés, des précautions supplémentaires doivent être prises au moment de l’agrafage. Toutes les branches sont transectées près de la veine rénale. Suite à cela, l’artère rénale est identifiée et la dissection se poursuit vers l’aorte.
La dissection se poursuit ensuite entre la glande surrénale et le hile du rein. Tout tissu conjonctif entre l’artère rénale et la veine rénale est soigneusement transecté. Après avoir identifié et disséqué les vaisseaux et l’uretère, le rein est complètement mobilisé du pôle supérieur au pôle inférieur. S’ensuit la mobilisation des attaches postérieures du rein. Cette partie du cas était compliquée par le degré de graisse entourant et adhérant au rein.
L’artère et la veine rénales sont dégagées de toutes les attaches en préparation de l’agrafage. L’uretère est coupé et coupé aussi distal que possible à l’aide de deux clips Hemo-o-lok pour préserver la longueur. L’emplacement accepté pour la section de l’uretère dans la néphrectomie du donneur est au niveau où l’uretère passe au-dessus de l’artère iliaque. Nous utilisons des clips Hem-o-lok à partir du port d’assistance, mais des clips robotiques sont également disponibles et appropriés à l’utilisation. L’uretère est coupé à l’aide de la fonction de coupe de la scelleuse de vaisseaux, de ciseaux robotisés ou à l’aide de ciseaux à partir de l’orifice d’assistance.
Des variations dans le système vasculaire rénal se produisent dans environ 25 à 50 % des cas. 7, 8 Le rein reçoit un apport sanguin en fin d’artère, il est donc important d’identifier et de préserver soigneusement toutes les artères accessoires de plus de 1 à 2 mm de diamètre, qui sont généralement visualisées sur la tomodensitométrie préopératoire. Tous les vaisseaux de plus petit diamètre rencontrés en peropératoire peuvent être transectés. Il est conseillé d’avoir une discussion avec le chirurgien receveur, soit idéalement en préopératoire, soit en temps réel si nécessaire.
Une fois que les vaisseaux sont disséqués et prêts à être agrafés, du mannitol par voie intraveineuse est administré. Nous donnons 12,5 g de mannitol. Nous n’administrons pas d’héparine IV, mais certains centres donneurs administrent de l’héparine avant la clampage croisé. La chasse d’eau froide est préparée et le robot est déconnecté. Le port de 8 mm le plus inférieur est passé à un port de 12 mm pour accueillir l’agrafeuse Endo GIA. Certains chirurgiens spécialisés dans la néphrectomie robotisée du donneur peuvent choisir d’utiliser l’agrafeuse robotisée. Prolongez l’incision de Pfannenstiel pour accueillir le rein si le rein est gros ou a de la graisse périnéphrique adhérente, comme dans ce cas. L’artère rénale est agrafée avec une charge de bronzage GIA 30 près de l’aorte, suivie d’un agrafage de la veine rénale avec une charge de bronzage GIA 30. Le rein est extrait par l’incision de Pfannenstiel. Le rein est ensuite perfusé avec une solution de conservation froide de l’Université du Wisconsin (ou une autre solution de conservation de votre choix) sur la table arrière. L’artère rénale est rincée jusqu’à ce que le liquide provenant de la veine rénale soit clair et que le parenchyme du rein apparaisse rincé. Le rein est ensuite transporté dans la salle du receveur. Dans ce cas, l’extraction a été difficile en raison de la taille du rein et de la graisse « collante » périnéphrique. L’incision a été prolongée davantage et un sac de récupération laparoscopique a été utilisé pour retirer le rein, qui a ensuite été immédiatement placé sur de la glace et rincé.
Pendant que le rein est rincé, la première étape la plus immédiate consiste à confirmer l’hémostase dans le champ opératoire. Si nécessaire, utilisez une combinaison de clips, de cautérisation et d’agents hémostatiques. Des clips peuvent être nécessaires s’il y a un souci de drainage lymphatique. L’anatomie du rein est confirmée sur la table arrière. Un bloc du plan transverse de l’abdomen (TAP) peut être administré latéralement en injectant un anesthésique local juste superficiel au péritoine en utilisant la visualisation directe du côté de la néphrectomie. Nous effectuons un bloc TAP unilatéral en peropératoire. Une autre option consiste pour l’anesthésie à effectuer un bloc TAP une fois que le patient est positionné en décubitus dorsal, avant l’extubation. Le reste de l’anesthésique local est ensuite injecté par les sites portuaires et l’incision de Pfannenstiel avant la fermeture. Le fascia au niveau de l’orifice de 12 mm dans le quadrant inférieur gauche est fermé avec un Vicryl 0 à l’aide d’un dispositif Carter-Thompson, et les orifices sont fermés avec du Monocryl 4-0. Après confirmation du nombre d’instruments, l’incision de Pfannenstiel est fermée en 4 couches : le péritoine est fermé avec du Vicryl 2-0, le fascia antérieur du muscle droit avec du PDS 2-0 et la peau en deux couches avec du Vicryl 3-0 dans le fascia de Scarpa et du Monocryl 4-0 dans la couche sous-cuticulaire. De la colle chirurgicale est appliquée et le nombre répété d’instruments est confirmé.
Le don de rein vivant peut être effectué par le biais d’un don dirigé apparenté vivant, d’un don de rein apparié ou d’un don non dirigé/altruiste. À quelques exceptions près, il y a eu une baisse globale du don de rein vivant aux États-Unis depuis 2005. Les taux de dons vivants ont encore baissé pendant la pandémie de COVID-19. 9 Les réseaux de don jumelés peuvent faciliter une augmentation des greffes de rein de donneurs vivants. Les receveurs de dons appariés étaient plus susceptibles d’être des femmes, des noirs, d’avoir déjà subi une greffe, d’être très sensibilisés et d’avoir une assurance publique, mais il a été démontré qu’ils avaient des résultats équivalents à ceux d’autres receveurs de rein de donneurs vivants. 10
Le dépistage du don de rein vivant peut varier d’un centre à l’autre, mais en général, les donneurs potentiels subissent une évaluation médicale, chirurgicale et psychiatrique (selon les indications) pour évaluer la candidature. Les tests peuvent inclure des tests de la fonction cardiaque et pulmonaire si indiqués, une évaluation de l’état fonctionnel, un dépistage des tumeurs malignes, un dépistage infectieux, une consultation en nutrition en fonction de l’IMC et des tests de risque d’IRT, en particulier pour les personnes ayant des antécédents familiaux de maladie rénale. Plusieurs outils d’évaluation des risques sont disponibles pour calculer les risques préalables au don pour les candidats donneurs. 11 à 13 Une TDM rénale est également obtenue pour évaluer l’anatomie rénale. Bien que les centres de transplantation aient des critères d’éligibilité différents pour les donneurs de rein, la procédure est généralement contre-indiquée si le candidat potentiel a moins de 18 ans, est diabétique, souffre d’hypertension non contrôlée, d’une maladie rénale avancée, d’une infection active, d’une tumeur maligne active ou incomplètement traitée, d’une maladie psychiatrique non traitée, d’une capacité de prise de décision altérée ou d’une coercition financière ou interpersonnelle suspectée.
Les choix anatomiques dépendent du chirurgien. Chez les donneurs potentiels présentant un petit calcul rénal unique unilatéral non compliqué, le côté affecté peut être transplanté après que le donneur ait été dépisté pour les risques futurs de formation de calculs (nous utilisons un test LithoLink). Des variations dans le système vasculaire rénal se produisent dans environ 25 à 40 % des cas. Les uretères doubles sont observés chez environ 0,7 à 0,8 % de la population adulte en bonne santé et chez 2 à 4 % des adultes ayant des problèmes urinaires. 7, 8, 1416 Dans notre centre, nous n’acceptons pas les donneurs avec des reins en fer à cheval ou les donneurs atteints de dysplasie fibromusculaire. Le test de la fonction rénale fractionnée est évalué en cas d’écart de taille. Les critères de test de la fonction rénale fractionnée dépendent du centre. Dans notre centre, nous obtenons une scintigraphie rénale en médecine nucléaire lorsque la différence de volume entre les reins du donneur dépasse 10 % sur la tomodensitométrie. Nous prenons le rein qui fonctionne le moins si la différence de fonction rénale divisée dépasse 10 % pour laisser le rein qui fonctionne mieux après le don. Conventionnellement, le rein gauche est préféré pour le don en raison de la longueur plus longue des veines rénales qui peut faciliter l’anastomose veineuse du receveur. Le rein gauche est utilisé dans environ 80 % de toutes les greffes de rein de donneurs vivants. 17 Le rein droit peut être utilisé en l’absence d’une artère rénale solitaire du côté gauche, d’anomalies parenchymateuses du rein gauche ou en fonction d’une différence de taille.
La mortalité périopératoire chez les donneurs de rein vivants est de 3/10 000, et le risque estimé d’IRT sur 20 ans est d’environ 30/10 000, quelle que soit l’approche ou la variation des critères de sélection. 11, 18 La créatinine sérique post-don à six mois peut être associée à un risque ultérieur d’IRT chez les donneurs de rein vivants. 19 Une autre complication potentielle est le risque de hernie sur les sites d’extraction ou portuaires. Le risque de hernie est plus faible en utilisant une incision de Pfannenstiel par rapport à l’utilisation d’incisions abdominales médianes d’après la littérature de chirurgie gynécologique. 20, 21 Les patients peuvent développer un gonflement testiculaire à cause de la division de la veine gonadique, mais celui-ci est transitoire et se résout de lui-même. Il a été démontré que la néphrectomie avec donneur assistée par robot a des résultats postopératoires similaires à ceux de la néphrectomie laparoscopique et une diminution globale de la durée du séjour. 3 à 6 Plusieurs modifications sont décrites dans la littérature, y compris une petite série de sept patients qui ont signalé la faisabilité d’une néphrectomie robotique à port unique du donneur. 22
Dans ce cas, la durée de l’opération était de 3,5 heures et la perte de sang estimée était de 200 ml. Nous avons rencontré des difficultés supplémentaires en raison d’un excès de graisse périnéphrique adhérente ou « graisse collante », ce qui a causé des problèmes lors de la dissection ainsi que de l’extraction du rein. Cependant, le donneur s’est rétabli sans incident et a reçu son congé le troisième jour postopératoire avec un bon contrôle de la douleur sous analgésiques oraux. Lors du suivi, le patient n’a eu aucun problème.
- Système chirurgical Da Vinci Xi.
- Système laparoscopique GelPort pour la laparoscopie assistée par la main.
- Orifice laparoscopique jetable de 12 mm
Rien à divulguer.
Le patient visé dans cet article vidéo a donné son consentement éclairé pour être filmé et est conscient que des informations et des images seront publiées en ligne.
References
- Département de la Santé et des Services sociaux des États-Unis. Rapport annuel sur les données OPTN/SRTR 2020 : Rein Disponible à l’adresse : https://srtr.transplant.hrsa.gov/annual_reports/2020/Kidney.aspx. Consulté le 30 avril 2023.
- Observatoire mondial du don et de la transplantation. Résumé. Disponible à l’adresse : https://www.transplant-observatory.org/summary/. Consulté le 30 avril 2023.
- Bhattu AS, Ganpule A, Sabnis RB, Murali V, Mishra S, Desai M. Néphrectomie laparoscopique du donneur assistée par robot vs néphrectomie laparoscopique standard du donneur : une étude comparative randomisée prospective. J Endourol. 2015; 29(12):1334-1340. doi :10.1089/end.2015.0213.
- Xiao Q, Fu B, Song K, Chen S, Li J, Xiao J. Comparaison des techniques chirurgicales dans la néphrectomie de donneur vivant : une revue systématique et une méta-analyse du réseau bayésien. Ann Transplant. 2020; 25 :e926677. doi :10.12659/AOT.926677.
- Wang H, Chen R, Li T, Peng L. Néphrectomie laparoscopique assistée par robot vs néphrectomie laparoscopique du donneur laparoscopique dans la transplantation rénale : une méta-analyse. Greffe de clin. 2019; 33(1) :e13451. doi :10.1111/ctr.13451.
- Spaggiari M, Garcia-Roca R, Tulla KA, et al. Néphrectomies robotisées de donneurs assistés. Ann Surg. 2022; 275(3):591-595. doi :10.1097/SLA.000000000004247.
- Ciçekcibaşi AE, Ziylan T, Salbacak A, Seker M, Büyükmumcu M, Tuncer I. Une étude de l’origine, de l’emplacement et des variations des artères rénales chez les fœtus humains et de leur pertinence clinique. Ann Anat. 2005; 187(4):421-427. doi :10.1016/j.aanat.2005.04.011.
- Aremu A, Igbokwe M, Olatise O, Lawal A, Maduadi K. Variations anatomiques de l’artère rénale : une étude d’angiographie tomographique informatisée chez des donneurs de rein vivants dans un centre de transplantation rénale nigérian. Afr Health Sci. 2021; 21(3):1155-1162. doi :10.4314/ahs.v21i3.24.
- Al Ammary F, Yu Y, Ferzola A, et al. La première augmentation du don de rein vivant aux États-Unis en 15 ans. Am J Greffe. 2020; 20(12):3590-3598. doi :10.1111/ajt.16136.
- Leeser DB, Thomas AG, Shaffer AA, et al. Survie du patient et de l’allogreffe rénale avec don apparié national de rein. Clin J Am Soc Nephrol. 2020; 15(2):228-237. doi :10.2215/CJN.06660619.
- Massie AB, Muzaale AD, Luo X, et al. Quantification du risque d’IRT après le don chez les donneurs de rein vivants. J Am Soc Nephrol. 2017; 28(9):2749-2755. doi :10.1681/ASN.2016101084.
- Grams ME, Sang Y, Levey AS, et al. Projection du risque d’insuffisance rénale pour le candidat donneur de rein vivant. N Engl J Med. 2016; 374(5):411-421. doi :10.1056/NEJMoa1510491.
- Université John’s Hopkins. Outil de risque d’IRT pour les candidats au don de rein. Disponible à l’adresse : http://www.transplantmodels.com/esrdrisk/. Consulté le 2 mai 2023.
- Standring S. Philadelphie : Churchill Livingstone Elsevier. Philadelphie : Elsevier ; 2020. L’anatomie de Gray : la base anatomique de la pratique clinique.
- Schlussel RN, Retik AB. Urologie de Campbell. Philadelphie, Pennsylvanie : Saunders ; 2002. Anomalies de l’uretère ectopique, de l’urétérocèle et d’autres anomalies de l’uretère ; p. 2007 à 2052.
- Fernbach SK, Feinstein KA, Spencer K, Lindstrom CA. Duplication urétérale et ses complications. Radiographies. 1997;17:109-127.
- Wang K, Zhang P, Xu X, Fan M. Néphrectomie laparoscopique droite ou gauche : une méta-analyse. Exp Clin Transplantation. 2015; 13(3):214-226.
- Segev DL, Muzaale AD, Caffo BS, et al. Mortalité périopératoire et survie à long terme après un don de rein vivant. JAMA. 2010; 303(10):959-966. doi :10.1001/jama.2010.237.
- Massie AB, Holscher CM, Henderson ML, et al. Association de la fonction rénale post-don précoce avec le risque ultérieur d’insuffisance rénale terminale chez les donneurs de rein vivants. JAMA Surg. 2020; 155(3) :e195472. doi :10.1001/jamasurg.2019.5472.
- Luijendijk RW, Jeekel J, Storm RK, et al. La faible incision transversale de Pfannenstiel et la prévalence de la hernie incisionnelle et du piégeage nerveux. Ann Surg. 1997; 225(4):365-369. doi :10.1097/00000658-199704000-00004.
- Bewö K, Österberg J, Löfgren M, Sandblom G. Hernies incisionnelles après une chirurgie gynécologique ouverte : une étude basée sur la population. Arch Gynecol Obstet. 2019; 299(5):1313-1319. doi :10.1007/s00404-019-05069-0.
- Garden EB, Al-Alao O, Razdan S, Mullen GR, Florman S, Palese MA. Néphrectomie robotisée du donneur à port unique avec le système chirurgical da Vinci SP. JSLS. 2021; 25(4). doi :10.4293/JSLS.2021.00062.
Cite this article
Atthota S, Grasso J, Dageforde LA. Néphrectomie laparoscopique du donneur gauche assistée par robot pour le don de rein vivant. J Med Insight. 2024; 2024(418). doi :10.24296/jomi/418.



