Nefrectomía laparoscópica del donante izquierdo asistida por robot para la donación de riñón en vida
Massachusetts General Hospital
Main Text
Table of Contents
El trasplante de riñón es el tratamiento preferido para los pacientes con enfermedad renal terminal y se asocia con una mejor calidad de vida y supervivencia en comparación con otras terapias de reemplazo renal. En comparación con los riñones de donantes fallecidos, la donación de riñón de donante vivo se asocia con tiempos de espera más cortos, una mejor supervivencia del paciente y del injerto, y la posibilidad de un trasplante preventivo. Después de la curva de aprendizaje inicial, la nefrectomía de donante vivo asistida por robot tiene resultados similares en comparación con la nefrectomía abierta y laparoscópica y, en algunos entornos, una disminución general de la duración de la estadía. En este artículo, presentamos un caso de nefrectomía de donante vivo asistida por robot, incluyendo evaluación, técnica y consideraciones para el cirujano preoperatorio e intraoperatorio.
Trasplante renal; donantes vivos; procedimientos quirúrgicos robóticos; isquemia caliente; resultado del tratamiento.
El trasplante de riñón es el tratamiento de elección en la enfermedad renal terminal (IRT), pero la escasez de órganos de donantes fallecidos es un factor limitante importante. Alrededor de un tercio de los trasplantes de riñón en los Estados Unidos son trasplantes de donantes vivos. 1 Esto contrasta con el 40-90% de los trasplantes de donantes vivos en algunos países en desarrollo, donde el trasplante de donante vivo es la opción más factible debido a la falta de infraestructura para la donación de órganos de fallecidos y al alto costo y la baja accesibilidad de la diálisis crónica. 2 Las técnicas mínimamente invasivas son ahora el estándar de atención, y se ha demostrado que la nefrectomía de donante vivo asistida por robot tiene resultados postoperatorios similares en comparación con la nefrectomía laparoscópica, con una disminución de la duración total de la estancia. De 3 a 6 años
El donante fue un hombre de 38 años que acudió al centro de trasplantes para donar un riñón a su hermano. No tenía antecedentes médicos significativos (no había antecedentes de cálculos renales, infecciones del tracto urinario, diabetes, hipertensión o neoplasias malignas). Sus antecedentes quirúrgicos incluían una apendicectomía abierta a los 13 años de edad debido a una apendicitis rota sin problemas relacionados con la anestesia. Su índice de masa corporal (IMC) fue de 31,46 kg/m². El estado funcional del paciente era de 4 equivalentes metabólicos (METs), y pertenecía a la Sociedad Americana de Anestesiólogos (ASA) clase 1. Era alérgico a la penicilina, a la gentamicina y a la vancomicina. Tiene antecedentes familiares de hígado graso y enfermedad renal en su hermano (por nefropatía por IgA). Se sometió a pruebas exhaustivas para la donación de riñón en vida y cumplió con los criterios médicos y quirúrgicos para la donación.
La exploración física no presentaba presentaciones, excepto por obesidad abdominal y una cicatriz de apendicectomía abierta en el cuadrante inferior derecho bien curada. Se sometió a un estudio preoperatorio estándar del donante, que incluía pruebas de función renal, pruebas infecciosas y pruebas de detección de neoplasias malignas apropiadas para la edad. Se estableció la compatibilidad del grupo sanguíneo (ABO) e inmunológica (HLA) entre donante y receptor. Se realizó electrocardiograma preoperatorio y radiografía de tórax, que no mostraron alteraciones. Dado su estado de AAS y su historial médico, no se indicó ningún otro estudio preoperatorio. Se realizaron imágenes transversales para evaluar el tamaño y la vasculatura del riñón con el fin de determinar la lateralidad del riñón del donante.
Se realizó una angiografía computarizada de abdomen para evaluar el tamaño de los riñones, así como las variaciones anatómicas en la vasculatura renal y el sistema colector (Figura 1). En este caso, el volumen estimado de los riñones tenía una discrepancia de menos del 10%, que es el punto de corte para nuestro centro de pruebas funcionales. El donante tenía arterias renales simples bilaterales y venas renales únicas. No se observaron anomalías en la pelvis renal ni en los uréteres. Se observó un quiste cortical simple de 2 cm de apariencia benigna en el polo superior del riñón izquierdo. No se observaron cálculos ni masas anormales en los riñones.
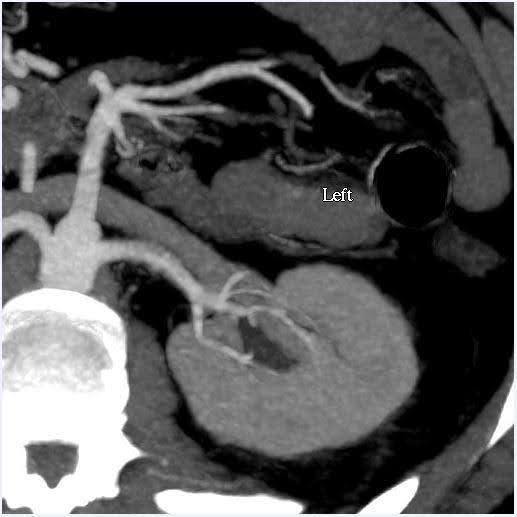
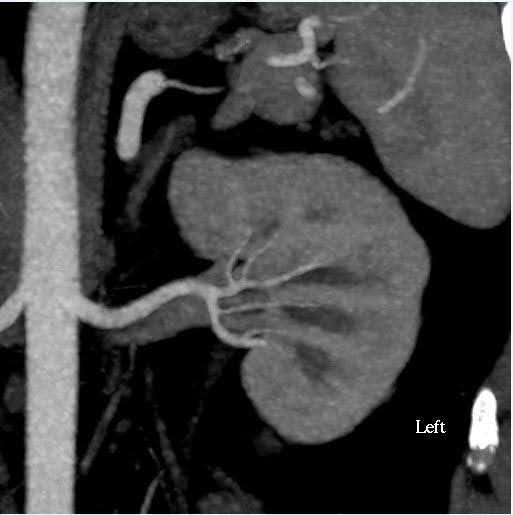
Figura 1. Angiografía por tomografía computarizada de abdomen (riñón). Izquierda: vista axial que muestra una sola arteria renal y vena en el lado izquierdo; Derecha: vista coronal Riñón izquierdo.
La nefrectomía de donante vivo se puede realizar a través de abordajes laparoscópico abierto, laparoscópico asistido por mano o asistido por robot.
La donación de riñón de donante vivo se asocia con tiempos de espera más cortos y una mejor supervivencia del paciente y del injerto en comparación con los riñones de donantes fallecidos. Si bien el trasplante preventivo antes de que el receptor comience la diálisis es una opción con un riñón de una donación fallecida, la donación en vida permite un tiempo de espera mucho más corto y una mayor probabilidad de trasplante preventivo.
La anestesia general y el bloqueo neuromuscular se administran con el paciente en posición supina. Después de la inducción de la anestesia, se coloca una sonda nasogástrica para mantener el estómago descomprimido durante toda la operación, y un catéter de Foley. Se administran antibióticos perioperatorios. Un conjunto de instrumentos de laparotomía se mantiene disponible en el quirófano para una posible conversión emergente a un procedimiento abierto.
El paciente se coloca en la posición de decúbito lateral derecho con los brazos abrazados a una almohada. Al usar el robot, el uso de la placa del brazo lateral puede provocar presión del brazo robótico, por lo que es preferible tener el brazo colocado ligeramente hacia abajo. A continuación, se flexiona la mesa para ayudar a separar las costillas de la cresta ilíaca para un mejor acceso. Todos los puntos de presión deben estar acolchados y se debe colocar un rodillo axilar para evitar lesiones por compresión del nervio. El paciente debe estar asegurado a la mesa de operaciones. Usamos una bolsa de frijoles para ayudar a posicionar al paciente. Confirme los pulsos radiales palpables bilateralmente al final del posicionamiento. Se deben colocar dispositivos de compresión secuencial en ambas extremidades inferiores. El campo operatorio se recorta, luego se prepara y se cubre de la manera estéril habitual, que se extiende desde el xifoides hasta debajo de la sínfisis del pubis, y la línea axilar posterior en el lado de la nefrectomía hasta la bolsa de frijoles en el lado contralateral.
Se realiza una incisión de Pfannenstiel de 7 a 8 cm de largo para entrar en la cavidad abdominal. La fascia de la pared abdominal se abre transversalmente y los colgajos se elevan superior e inferiormente. El grado de movilización de la fascia de la pared abdominal determina el tamaño del área para la extracción del riñón. Asegúrate de que haya una amplia disección. Luego, los músculos rectos se separan y el peritoneo se abre verticalmente entre los músculos rectos. Tenga cuidado de abrir el peritoneo superiormente para evitar la disección en la vejiga. Se coloca un sistema laparoscópico GelPort en la incisión y se coloca un puerto laparoscópico de 12 mm a través del GelPort para establecer el neumoperitoneo. Se colocan tres puertos robóticos adicionales de 8 mm bajo visualización laparoscópica directa: en el área epigástrica, superior al ombligo, y en el cuadrante inferior izquierdo (Figura 2). Los puertos deben colocarse aproximadamente a 10 cm de distancia y al menos 2 cm de las costillas y la cresta ilíaca. El puerto de 12 mm a través del GelPort es un puerto de asistencia para la asistencia a pie de cama durante toda la operación. A continuación, el robot DaVinci se acopla a los puertos y los instrumentos robóticos se insertan en visualización directa.
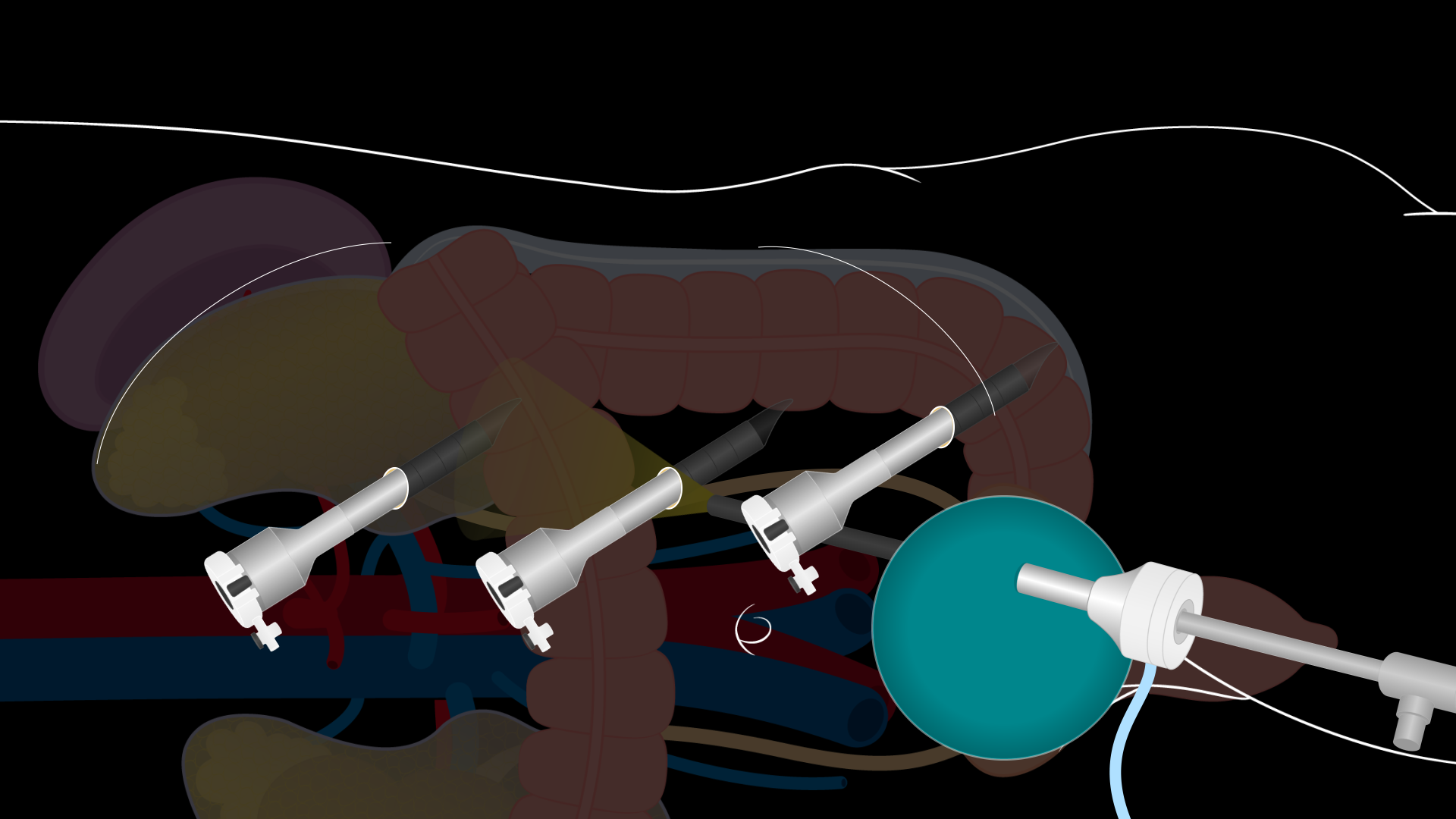
Figura 2. Sitios de incisión de nefrectomía renal izquierda del donante laparoscópico. Diagrama que muestra la posición de las instalaciones de los puertos para una nefrectomía laparoscópica del riñón izquierdo del donante. Se realiza una incisión de Pfannenstiel de 7 a 8 cm de largo para entrar en la cavidad abdominal. Se coloca un sistema laparoscópico GelPort en esta incisión y se coloca un puerto laparoscópico de 12 mm a través del GelPort. Se colocan tres puertos robóticos de 8 mm en la zona epigástrica, superior al ombligo, y en el cuadrante inferior izquierdo bajo visión directa.
En la consola, el colon izquierdo se rota medialmente bajando las inserciones a la pared abdominal. Se visualiza el riñón izquierdo. Se tiene cuidado de no movilizar las inserciones posteriores del riñón en este momento para que permanezca retraído lateralmente para facilitar la disección hiliar. El bazo y sus uniones con el diafragma y el riñón se liberan y rotan medialmente para ayudar en la disección de las estructuras vasculares. Se identifica el uréter y se disecciona hasta la pelvis. Es importante evitar despojar a la adventicia del uréter dejando cierta cantidad de grasa periureteral, y preservar el tejido entre el uréter y el polo inferior del riñón para disminuir la posibilidad de complicaciones relacionadas con la isquemia ureteral.
La atención se centra en la disección del hilio, concretamente de la vena renal, la vena gonadal, la vena lumbar y la vena suprarrenal. Asegúrese de no diseccionar en el hilio en sí, sino más cerca de la aorta debido al riesgo de lesionar las numerosas ramas vasculares en el hilio renal. La vena gonadal se divide con el sellador de vasos mediante tres quemaduras, seguidas de la vena suprarrenal y las venas lumbares. Algunos centros prefieren usar clips, pero existe el riesgo de grapar accidentalmente los clips, por lo que si se usan clips, se debe tener precaución adicional en el momento del grapado. Todas las ramas están seccionadas cerca de la vena renal. A continuación, se identifica la arteria renal y se continúa la disección hacia la aorta.
A continuación, se continúa la disección entre la glándula suprarrenal y el hilio del riñón. Cualquier tejido conectivo entre la arteria renal y la vena renal se secciona cuidadosamente. Después de identificar y diseccionar los vasos y el uréter, el riñón se moviliza completamente desde el polo superior al inferior. A esto le sigue la movilización de las inserciones posteriores del riñón. Esta parte del caso se complicó por el grado de grasa que rodeaba y se adhería al riñón.
La arteria y la vena renal se limpian de todas las uniones en preparación para el grapado. El uréter se recorta y se secciona lo más distal posible con dos clips Hemo-o-lok para preservar la longitud. La ubicación aceptada para la transección del uréter en la nefrectomía del donante es al nivel donde el uréter pasa sobre la arteria ilíaca. Usamos clips Hem-o-lok del puerto de asistencia, pero también hay clips robóticos disponibles y apropiados para su uso. El uréter se secciona con la función de corte del sellador de recipientes, tijeras robóticas o usando tijeras desde el puerto de asistencia.
Las variaciones en la vasculatura renal ocurren en aproximadamente el 25-50% de los casos. 7, 8 El riñón recibe el suministro de sangre al final de la arteria, por lo que es importante identificar y preservar cuidadosamente las arterias accesorias de más de 1-2 mm de diámetro, que generalmente se visualizan en la tomografía computarizada preoperatoria. Cualquier vaso de menor diámetro que se encuentre intraoperatorio puede ser seccionado. Es aconsejable tener una conversación con el cirujano receptor, ya sea idealmente antes de la operación o en tiempo real si es necesario.
Una vez que los vasos están diseccionados y listos para el grapado, se administra manitol intravenoso. Le damos 12,5 g de manitol. No administramos heparina intravenosa, pero algunos centros de donantes administran heparina antes de la pinzación cruzada. Se prepara la descarga de agua fría y se desacopla el robot. El puerto más inferior de 8 mm se amplía a un puerto de 12 mm para acomodar la grapadora Endo GIA. Algunos cirujanos de nefrectomía de donante robótico pueden optar por usar la grapadora robótica. Extienda la incisión de Pfannenstiel para acomodar el riñón si el riñón es grande o tiene grasa perinéfrica adherente, como en este caso. La arteria renal se grapa con una carga de bronceado GIA 30 cerca de la aorta, seguido de un grapado de la vena renal con una carga de bronceado GIA 30. El riñón se extrae a través de la incisión de Pfannenstiel. Luego, el riñón se perfunde con una solución de conservación fría de la Universidad de Wisconsin (u otra solución conservante de elección) en la mesa trasera. La arteria renal se lava hasta que el líquido que sale de la vena renal es transparente y el parénquima del riñón aparece enjuagado. A continuación, el riñón se transporta a la habitación receptora. En este caso, la extracción fue difícil debido al tamaño del riñón y a la grasa perinefrática "pegajosa". La incisión se extendió aún más y se utilizó una bolsa de extracción laparoscópica para extraer el riñón, que luego se colocó inmediatamente en hielo y se enjuagó.
Mientras se lava el riñón, el primer paso más inmediato es confirmar la hemostasia en el campo operatorio. Si es necesario, use una combinación de clips, cauterización y agentes hemostáticos. Los clips pueden ser necesarios si hay alguna preocupación por el drenaje linfático. La anatomía del riñón se confirma en la mesa trasera. Un bloqueo del plano transverso del abdomen (TAP) se puede administrar lateralmente inyectando anestésico local solo superficial al peritoneo mediante visualización directa del lado de la nefrectomía. Realizamos un bloqueo TAP unilateral intraoperatorio. Otra opción es que la anestesia realice un bloqueo TAP una vez que el paciente se coloca en decúbito supino, antes de la extubación. A continuación, el resto del anestésico local se inyecta por los sitios de puerto y la incisión de Pfannenstiel antes del cierre. La fascia en el puerto de 12 mm en el cuadrante inferior izquierdo se cierra con un Vicryl 0 usando un dispositivo Carter-Thompson, y los puertos se cierran con Monocryl 4-0. Después de confirmar el recuento de instrumentos, la incisión de Pfannenstiel se cierra en 4 capas: el peritoneo se cierra con 2-0 Vicryl, la fascia anterior del músculo recto con 2-0 PDS y la piel en dos capas con 3-0 Vicryl en la fascia de Scarpa y 4-0 Monocryl en la capa subcuticular. Se aplica pegamento quirúrgico y se confirma el recuento de instrumentos repetidos.
La donación de riñón en vida se puede realizar a través de la donación dirigida relacionada con vivo, la donación emparejada de riñón o la donación no dirigida/altruista. Con algunas excepciones, ha habido una disminución general en la donación de riñón en vida en los Estados Unidos desde 2005. Las tasas de donación en vida cayeron aún más durante la pandemia de COVID-19. 9 Las redes de donación emparejadas pueden facilitar un aumento en el trasplante de riñón de donante vivo. Los receptores de donaciones emparejados tenían más probabilidades de ser mujeres, negros, tener un trasplante previo, estar muy sensibilizados y tener seguro público, pero se ha demostrado que tienen resultados equivalentes a los de otros receptores de riñón de donantes vivos. 10
La detección de la donación de riñón en vida puede variar de un centro a otro, pero por lo general, los posibles donantes se someten a una evaluación médica, quirúrgica y psiquiátrica (según se indique) para evaluar la candidatura. Las pruebas pueden incluir pruebas de función cardíaca y pulmonar si están indicadas, evaluación del estado funcional, detección de neoplasias malignas, detección de infecciones infecciosas, consulta de nutrición según el IMC y pruebas de riesgo de IRCT, especialmente para aquellos con antecedentes familiares de enfermedad renal. Existen varias herramientas de evaluación de riesgos para calcular los riesgos previos a la donación de los candidatos a donantes. De 11 a 13 años También se obtiene una TAC renal para evaluar la anatomía renal. Aunque los centros de trasplante tienen diferentes criterios de elegibilidad para los donantes de riñón, el procedimiento generalmente está contraindicado si el candidato potencial es menor de 18 años, diabético, tiene hipertensión no controlada, enfermedad renal avanzada, infección activa, neoplasia maligna activa o incompletamente tratada, enfermedad psiquiátrica no tratada, deterioro de la capacidad de toma de decisiones o sospecha de coerción financiera o interpersonal.
Las opciones anatómicas dependen del cirujano. En los donantes potenciales con un solo cálculo renal unilateral pequeño y sin complicaciones, el lado afectado puede trasplantarse después de que el donante se someta a una prueba de detección para detectar futuros riesgos de formación de cálculos (utilizamos una prueba LithoLink). Las variaciones en la vasculatura renal ocurren en aproximadamente el 25-40% de los casos. Los uréteres dobles se observan en aproximadamente el 0,7-0,8% de la población adulta sana y en el 2-4% de los adultos con problemas del tracto urinario. 7, 8, 1416 En nuestro centro, no aceptamos donantes con riñones en herradura ni donantes con displasia fibromuscular. La prueba de función renal dividida se evalúa en caso de discrepancia de tamaño. Los criterios para la prueba de función renal dividida dependen del centro. En nuestro centro, obtenemos una gammagrafía renal de Medicina Nuclear cuando la diferencia de volumen entre los riñones del donante supera el 10% en la TAC. Tomamos el riñón de menor funcionamiento si la diferencia de función renal dividida supera el 10% para dejar el riñón mejor funcional después de la donación. Convencionalmente, se prefiere el riñón izquierdo para la donación debido a la mayor longitud de las venas renales, lo que puede facilitar la anastomosis venosa del receptor. El riñón izquierdo se utiliza en aproximadamente el 80% de todos los trasplantes de riñón de donantes vivos. 17 El riñón derecho se puede usar en ausencia de una arteria renal solitaria en el lado izquierdo, anomalías del parénquima en el riñón izquierdo o en función de la discrepancia de tamaño.
La mortalidad perioperatoria en donantes vivos de riñón es de 3/10.000, y el riesgo estimado de IRT a 20 años es de aproximadamente 30/10.000, independientemente del enfoque o la variación en los criterios de selección. 11 y 18 La creatinina sérica post-donación a los seis meses puede asociarse con el riesgo posterior de IRT en donantes vivos de riñón. 19 Otra posible complicación es el riesgo de hernia en los sitios de extracción o porte. El riesgo de hernia es menor con una incisión de Pfannenstiel en comparación con el uso de incisiones abdominales en la línea media, según la literatura de cirugía ginecológica. 20 y 21 Los pacientes pueden desarrollar hinchazón testicular debido a la división de la vena gonadal, pero esto es transitorio y se resuelve por sí solo. Se ha demostrado que la nefrectomía asistida por robot con donante vivo tiene resultados posoperatorios similares en comparación con la nefrectomía laparoscópica y una disminución general de la duración de la estancia. De 3 a 6 años En la literatura se describen varias modificaciones, incluyendo una pequeña serie de siete pacientes que informaron factibilidad de la nefrectomía robótica de donante de un solo puerto. 22
En este caso, el tiempo quirúrgico fue de 3,5 horas y la pérdida de sangre estimada fue de 200 ml. Nos encontramos con dificultades añadidas debido al exceso de grasa perinéfrica adherente o "grasa pegajosa", que causaba problemas durante la disección y la extracción del riñón. Sin embargo, la donante tuvo una recuperación sin complicaciones y fue dada de alta al tercer día postoperatorio con buen control del dolor con analgésicos orales. En el seguimiento, el paciente no presentó ningún problema.
- Sistema quirúrgico Da Vinci Xi.
- Sistema laparoscópico GelPort para laparoscopia asistida por mano.
- Puerto laparoscópico desechable de 12 mm
Nada que revelar.
El paciente al que se refiere este artículo en vídeo ha dado su consentimiento informado para ser filmado y es consciente de que la información y las imágenes se publicarán en línea.
References
- Departamento de Salud y Servicios Humanos de EE. UU. Informe Anual de Datos 2020 de OPTN/SRTR: Riñón. Disponible en: https://srtr.transplant.hrsa.gov/annual_reports/2020/Kidney.aspx. Consultado el 30 de abril de 2023.
- Observatorio Mundial de Donación y Trasplantes. Resumen. Disponible en: https://www.transplant-observatory.org/summary/. Consultado el 30 de abril de 2023.
- Bhattu AS, Ganpule A, Sabnis RB, Murali V, Mishra S, Desai M. Nefrectomía laparoscópica asistida por robot frente a nefrectomía laparoscópica estándar del donante: un estudio comparativo aleatorizado prospectivo. J Endourol. 2015; 29(12):1334-1340. doi:10.1089/end.2015.0213.
- Xiao Q, Fu B, Song K, Chen S, Li J, Xiao J. Comparación de técnicas quirúrgicas en la nefrectomía de donante vivo: una revisión sistemática y metanálisis de la red bayesiana. Ann Transplant. 2020; 25:E926677. doi:10.12659/AOT.926677.
- Wang H, Chen R, Li T, Peng L. Nefrectomía laparoscópica asistida por robot frente a nefrectomía laparoscópica del donante en el trasplante renal: un metanálisis. Trasplante de Clin. 2019; 33(1):E13451. doi:10.1111/ctr.13451.
- Spaggiari M, García-Roca R, Tulla KA, et al. Nefrectomías robóticas de donantes en vida asistida. Ann Surg. 2022; 275(3):591-595. doi:10.1097/SLA.00000000000004247.
- Ciçekcibaşi AE, Ziylan T, Salbacak A, Seker M, Büyükmumcu M, Tuncer I. Una investigación sobre el origen, la ubicación y las variaciones de las arterias renales en fetos humanos y su relevancia clínica. Ann Anat. 2005; 187(4):421-427. doi:10.1016/j.aanat.2005.04.011.
- Aremu A, Igbokwe M, Olatise O, Lawal A, Maduadi K. Variaciones anatómicas de la arteria renal: un estudio de angiografía tomográfica computarizada en donantes vivos de riñón en un centro nigeriano de trasplante de riñón. Afr Health Sci. 2021; 21(3):1155-1162. doi:10.4314/ahs.v21i3.24.
- Al Ammary F, Yu Y, Ferzola A, et al. El primer aumento en la donación de riñón vivo en los Estados Unidos en 15 años. Am J Trasplante. 2020; 20(12):3590-3598. doi:10.1111/ajt.16136.
- Leeser DB, Thomas AG, Shaffer AA, et al. Supervivencia del paciente y del aloinjerto renal con donación nacional de riñón pareado. Clin J Am Soc Nephrol. 2020; 15(2):228-237. doi:10.2215/CJN.06660619.
- Massie AB, Muzaale AD, Luo X, et al. Cuantificar el riesgo de IRCT después de la donación en donantes vivos de riñón. J Am Soc Nephrol. 2017; 28(9):2749-2755. doi:10.1681/ASN.2016101084.
- Grams ME, Sang Y, Levey AS, et al. Proyección del riesgo de insuficiencia renal para el candidato a donante vivo de riñón. N Engl J Med. 2016; 374(5):411-421. doi:10.1056/NEJMoa1510491.
- Universidad John's Hopkins. Herramienta de riesgo de IRT para candidatos a donantes de riñón. Disponible en: http://www.transplantmodels.com/esrdrisk/. Consultado el 2 de mayo de 2023.
- Standring S. Filadelfia: Churchill Livingstone Elsevier. Filadelfia: Elsevier; 2020. Anatomía de Gray: las bases anatómicas de la práctica clínica.
- Schlussel RN, Retik AB. Urología de Campbell. Filadelfia, Pensilvania: Saunders; 2002. Uréter ectópico, ureterocele y otras anomalías del uréter; págs. 2007-2052.
- Fernbach SK, Feinstein KA, Spencer K, Lindstrom CA. Duplicación ureteral y sus complicaciones. Radiografías. 1997;17:109-127.
- Wang K, Zhang P, Xu X, Fan M. Nefrectomía laparoscópica derecha versus nefrectomía laparoscópica izquierda de donante vivo: metanálisis. Exp Trasplante de Clin. 2015; 13(3):214-226.
- Segev DL, Muzaale AD, Caffo BS, et al. Mortalidad perioperatoria y supervivencia a largo plazo tras la donación renal en vivo. JAMA. 2010; 303(10):959-966. doi:10.1001/jama.2010.237.
- Massie AB, Holscher CM, Henderson ML, et al. Asociación de la función renal precoz posdonación con el riesgo posterior de enfermedad renal terminal en donantes vivos de riñón. JAMA Surg. 2020; 155(3):E195472. doi:10.1001/jamasurg.2019.5472.
- Luijendijk RW, Jeekel J, Storm RK, et al. La incisión transversal baja de Pfannenstiel y la prevalencia de hernia incisional y atrapamiento nervioso. Ann Surg. 1997; 225(4):365-369. doi:10.1097/00000658-199704000-00004.
- Bewö K, Österberg J, Löfgren M, Sandblom G. Hernias incisionales después de la cirugía ginecológica abierta: un estudio poblacional. Arco Gynecol Obstet. 2019; 299(5):1313-1319. doi:10.1007/s00404-019-05069-0.
- Garden EB, Al-Alao O, Razdan S, Mullen GR, Florman S, Palese MA. Nefrectomía robótica de donante de puerto único con el sistema quirúrgico da Vinci SP. JSLS. 2021; 25(4). doi:10.4293/JSLS.2021.00062.
Cite this article
Atthota S, Grasso J, Dageforde LA. Nefrectomía laparoscópica del donante izquierdo asistida por robot para la donación de riñón en vida. J Med Insight. 2024; 2024(418). doi:10.24296/jomi/418.



