Robotergestützte laparoskopische Nephrektomie des linken Spenders zur Lebendnierenspende
Massachusetts General Hospital
Main Text
Table of Contents
Die Nierentransplantation ist die bevorzugte Behandlung für Patienten mit Nierenerkrankungen im Endstadium und ist im Vergleich zu anderen Nierenersatztherapien mit einer besseren Lebensqualität und Überlebensrate verbunden. Im Vergleich zu verstorbenen Spendernieren ist die Lebendspendernierenspende mit kürzeren Wartezeiten, einem verbesserten Überleben von Patienten und Transplantaten und der Möglichkeit einer präventiven Transplantation verbunden. Nach der anfänglichen Lernkurve hat die robotergestützte Nephrektomie mit Lebendspendern ähnliche Ergebnisse wie die offene und laparoskopische Nephrektomie und in einigen Situationen eine insgesamt verkürzte Aufenthaltsdauer. In diesem Artikel stellen wir einen Fall einer robotergestützten Nephrektomie von Lebendspendern vor, einschließlich Bewertung, Technik und Überlegungen für den Chirurgen präoperativ und intraoperativ.
Nierentransplantation; lebende Spender; robotergestützte chirurgische Eingriffe; warme Ischämie; Behandlungsergebnis.
Die Nierentransplantation ist die Behandlung der Wahl bei Nierenerkrankungen im Endstadium (ESRD), aber der Mangel an verstorbenen Spenderorganen ist ein wichtiger limitierender Faktor. Etwa ein Drittel der Nierentransplantationen in den Vereinigten Staaten sind Lebendspendertransplantationen. 1 Dies steht im Gegensatz zu 40-90 % der Lebendspendertransplantationen in einigen Entwicklungsländern, in denen eine Lebendspendertransplantation aufgrund der fehlenden Infrastruktur für die Organspende von Verstorbenen und der hohen Kosten und der geringen Zugänglichkeit der chronischen Dialyse die praktikabelste Option ist. 2 Minimalinvasive Techniken sind heute der Standard der Versorgung, und es hat sich gezeigt, dass die robotergestützte Nephrektomie bei Lebendspendern im Vergleich zur laparoskopischen Nephrektomie ähnliche postoperative Ergebnisse erzielt, mit einer verkürzten Gesamtverweildauer. 3–6
Bei dem Spender handelte es sich um einen 38-jährigen Mann, der sich im Transplantationszentrum vorstellte, um seinem Bruder eine Niere zu spenden. Er hatte keine nennenswerte Krankengeschichte (keine Vorgeschichte von Nierensteinen, Harnwegsinfektionen, Diabetes, Bluthochdruck oder Malignität). Zu seiner chirurgischen Vorgeschichte gehörte eine offene Blinddarmoperation im Alter von 13 Jahren aufgrund einer rupturierten Blinddarmentzündung ohne anästhesiebedingte Probleme. Sein Body-Mass-Index (BMI) lag bei 31,46 kg/m². Der funktionelle Status des Patienten betrug 4 metabolische Äquivalente (METs) und er war American Society of Anesthesiologists (ASA) Klasse 1. Er war allergisch gegen Penicillin, Gentamicin und Vancomycin. Er hat eine familiäre Vorgeschichte von Fettleber- und Nierenerkrankungen bei seinem Bruder (an IgA-Nephropathie). Er unterzog sich umfassenden Tests für eine Lebendnierenspende und erfüllte die medizinischen und chirurgischen Kriterien für eine Spende.
Die körperliche Untersuchung verlief unauffällig, abgesehen von abdominaler Adipositas und einer gut verheilten Narbe im rechten unteren Quadranten einer offenen Appendektomie. Er unterzog sich einer präoperativen Standarduntersuchung von Spendern, einschließlich Nierenfunktionstests, Infektionstests und altersgerechten Malignitätsscreenings. Die Kompatibilität von Blutgruppen (ABO) und Immunologen (HLA) zwischen Spender und Empfänger wurde festgestellt. Es wurden ein präoperatives Elektrokardiogramm und eine Röntgenaufnahme des Brustkorbs durchgeführt, die keine Auffälligkeiten zeigten. Aufgrund seines ASA-Status und seiner Krankengeschichte war keine weitere präoperative Abklärung indiziert. Es wurde eine Schnittbildgebung durchgeführt, um die Größe und das Gefäßsystem der Niere zu beurteilen und die Lateralität der Spenderniere zu bestimmen.
Ein CT-Angiogramm des Abdomens wurde durchgeführt, um die Größe der Nieren sowie anatomische Variationen im Nierengefäßsystem und im Sammelsystem zu beurteilen (Abbildung 1). In diesem Fall wies das geschätzte Volumen der Nieren eine Diskrepanz von weniger als 10 % auf, was der Grenzwert für unser Zentrum für Funktionstests ist. Die Spenderin hatte bilaterale einzelne Nierenarterien und einzelne Nierenvenen. Es wurden keine Anomalien im Nierenbecken oder in den Harnleitern festgestellt. Eine 2 cm große, einfach gutartig erscheinende kortikale Zyste wurde im oberen Pol der linken Niere gesehen. In den Nieren wurden keine Steine oder krankhafte Massen festgestellt.
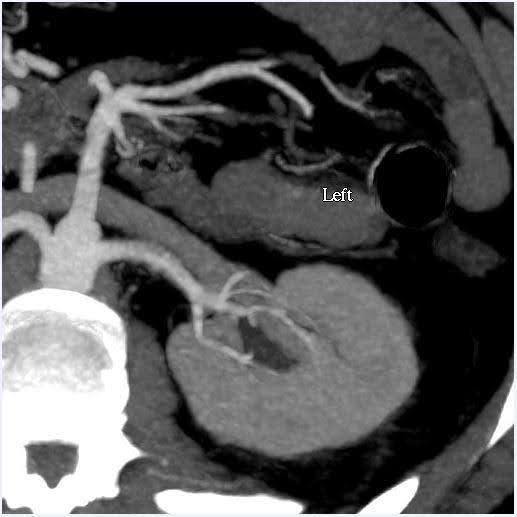
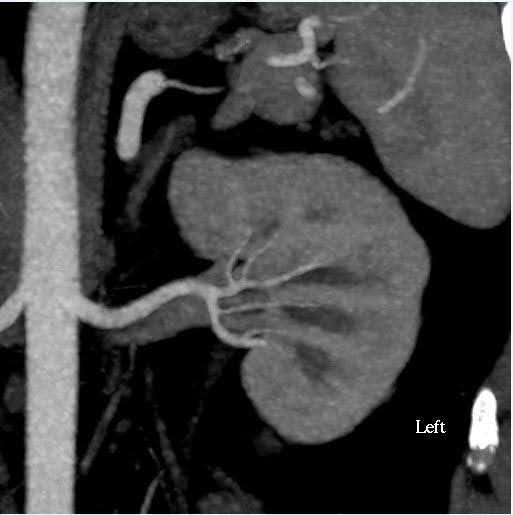
Abbildung 1. CT Angiogramm Abdomen (Niere). Links: Axialansicht, die eine einzelne Nierenarterie und -vene auf der linken Seite zeigt; Rechts: koronale Ansicht Linke Niere.
Die Nephrektomie bei Lebendspendern kann durch offene laparoskopische, handassistierte laparoskopische oder robotergestützte Ansätze durchgeführt werden.
Die Nierenspende von Lebendspendern ist im Vergleich zu verstorbenen Spendernieren mit kürzeren Wartezeiten und einem verbesserten Überleben von Patienten und Transplantaten verbunden. Während bei einer Niere aus einer verstorbenen Spende eine Option ist, bevor der Empfänger mit der Dialyse beginnt, ermöglicht die Lebendspende eine viel kürzere Wartezeit und eine höhere Wahrscheinlichkeit einer präventiven Transplantation.
Die Vollnarkose und die neuromuskuläre Blockade werden in Rückenlage verabreicht. Nach Einleitung der Anästhesie werden eine Magensonde gelegt, um den Magen während der Operation dekomprimiert zu halten, und ein Foley-Katheter. Es werden perioperative Antibiotika verabreicht. Im Operationssaal steht ein Laparotomie-Instrumentarium für eine mögliche Umwandlung in ein offenes Verfahren bereit.
Der Patient wird in die richtige laterale Dekubitusposition gebracht, wobei die Arme ein Kissen umschließen. Bei der Verwendung des Roboters kann die Verwendung des seitlichen Armbretts zu Druck durch den Roboterarm führen, daher ist es vorzuziehen, den Arm leicht nach unten zu positionieren. Anschließend wird der Tisch gebogen, um die Rippen vom Beckenkamm zu trennen und so einen besseren Zugang zu ermöglichen. Alle Druckpunkte müssen gepolstert werden, und eine Achselrolle sollte platziert werden, um Verletzungen der Nervenkompression zu vermeiden. Der Patient sollte an den Operationstisch gefesselt werden. Wir verwenden einen Sitzsack, um den Patienten zu positionieren. Bestätigen Sie die tastbaren radialen Impulse beidseitig am Ende der Positionierung. Sequentielle Kompressionsgeräte sollten an beiden unteren Extremitäten platziert werden. Das Operationsfeld wird gestutzt, dann vorbereitet und in der üblichen sterilen Weise drapiert, wobei es sich vom Xiphoid bis unterhalb der Symphyse pubis und der hinteren Achsellinie auf der Nephrektomieseite bis zum Sitzsack auf der kontralateralen Seite erstreckt.
Ein 7–8 cm langer Pfannenstiel-Schnitt wird gemacht, um in die Bauchhöhle zu gelangen. Die Bauchwandfaszie wird quer geöffnet, die Lappen sind nach oben und unten angehoben. Das Ausmaß der Mobilisation der Bauchwandfaszie bestimmt die Größe des Bereichs für die Nierenextraktion. Stellen Sie sicher, dass es ausreichend Sezieren gibt. Dann werden die Rektusmuskeln gespreizt und das Bauchfell vertikal zwischen den Rektusmuskeln geöffnet. Seien Sie vorsichtig, das Peritoneum von oben zu öffnen, um eine Dissektion in die Blase zu vermeiden. In der Inzision wird ein laparoskopisches GelPort-System platziert, und ein laparoskopischer 12-mm-Port wird durch den GelPort platziert, um ein Pneumoperitoneum zu etablieren. Drei weitere 8-mm-Roboterports werden direkt laparoskopisch sichtbar gemacht: im epigastrischen Bereich, oberhalb des Nabels, und im linken unteren Quadranten (Abbildung 2). Die Ports müssen in einem Abstand von etwa 10 cm und mindestens 2 cm von den Rippen und dem Beckenkamm entfernt platziert werden. Der 12-mm-Anschluss über den GelPort ist ein Hilfsanschluss für die Unterstützung am Krankenbett während der gesamten Operation. Der DaVinci-Roboter wird dann an die Anschlüsse angedockt und die Roboterinstrumente unter direkter Visualisierung eingefügt.
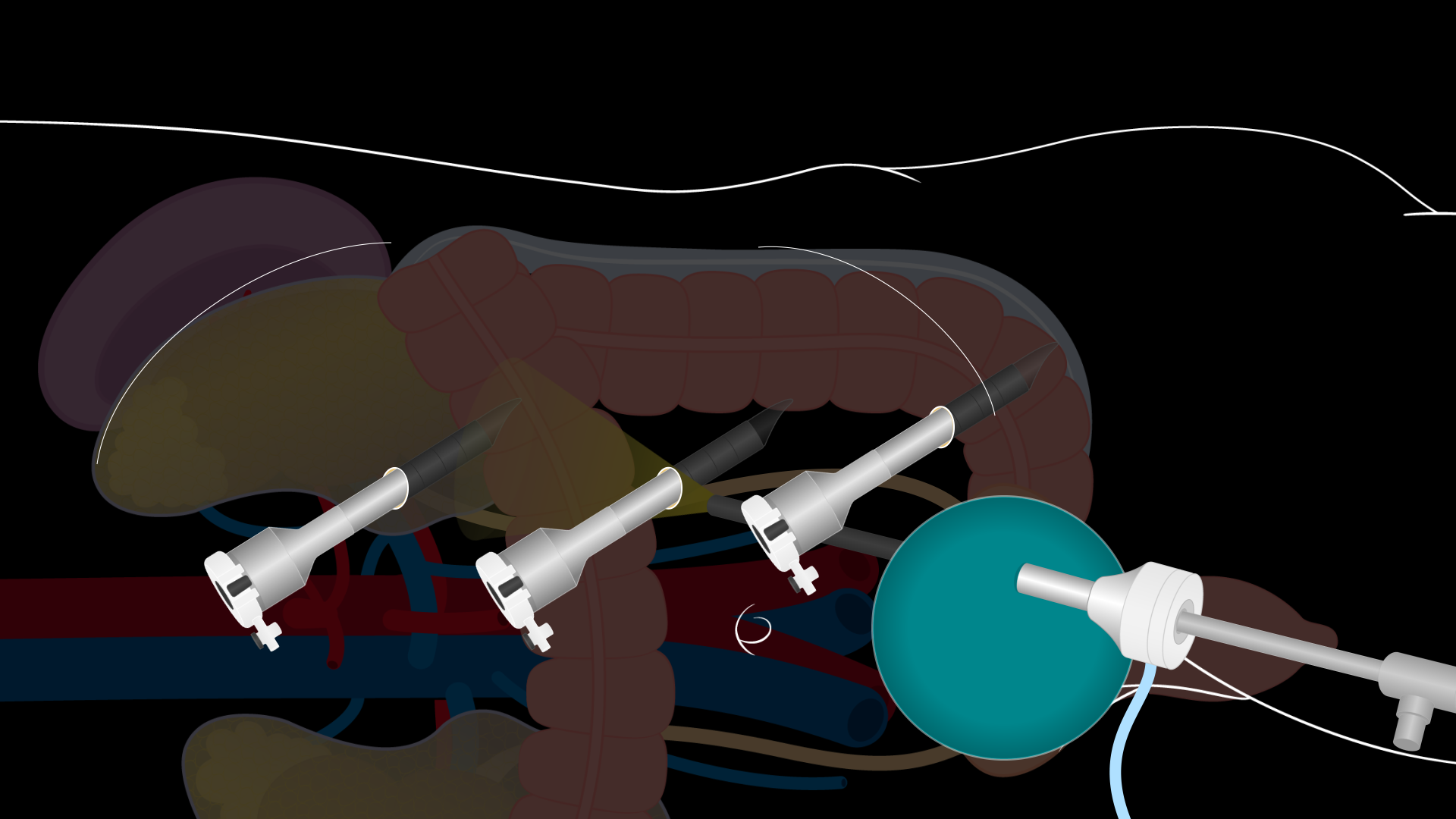
Abbildung 2. laparoskopischer Spender linke Nierennephrektomie-Schnittstelle. Ein Diagramm, das die Position der Portinstallationen für eine Nephrektomie der linken Nieren eines laparoskopischen Spenders zeigt. Ein 7–8 cm langer Pfannenstiel-Schnitt wird gemacht, um in die Bauchhöhle zu gelangen. In diesem Schnitt wird ein laparoskopisches GelPort-System platziert, und ein 12-mm-laparoskopischer Port wird durch den GelPort platziert. Drei 8-mm-Roboterports werden im epigastrischen Bereich, oberhalb des Nabels, und im linken unteren Quadranten unter direkter Sicht platziert.
An der Konsole wird der linke Dickdarm medial gedreht, indem die Ansätze an der Bauchdecke abgenommen werden. Die linke Niere ist sichtbar. Es wird darauf geachtet, die hinteren Ansätze der Niere zu diesem Zeitpunkt nicht zu mobilisieren, so dass sie für eine leichtere hiläre Dissektion seitlich zurückgezogen bleibt. Die Milz und ihre Ansätze am Zwerchfell und an der Niere werden befreit und medial rotiert, um die Dissektion der Gefäßstrukturen zu erleichtern. Der Harnleiter wird identifiziert und zum Becken präpariert. Es ist wichtig, zu vermeiden, dass die Adventitia vom Harnleiter befreit wird, indem eine gewisse Menge periureterales Fett verbleibt, und das Gewebe zwischen dem Harnleiter und dem unteren Pol der Niere zu erhalten, um die Wahrscheinlichkeit von Komplikationen im Zusammenhang mit der Harnleiterischämie zu verringern.
Das Augenmerk liegt auf der Dissektion des Hilus, insbesondere der Nierenvene, der Gonadenvene, der Lendenvene und der Nebennierenvene. Achten Sie darauf, nicht im Hilum selbst, sondern näher an der Aorta zu sezieren, da die Gefahr besteht, dass die zahlreichen Gefäßäste im Hilum der Niere verletzt werden. Die Gonadenvene wird mit dem Gefäßversiegeler durch drei Verbrennungen geteilt, gefolgt von der Nebennierenvene und den Lendenvenen. Einige Center bevorzugen die Verwendung von Clips, aber es besteht die Gefahr, dass die Clips versehentlich überheftet werden, so dass bei Verwendung von Clips zum Zeitpunkt des Heftens zusätzliche Vorsicht geboten ist. Alle Äste werden in der Nähe der Nierenvene durchtrennt. Anschließend wird die Nierenarterie identifiziert und die Dissektion in Richtung Aorta fortgesetzt.
Die Dissektion wird dann zwischen der Nebenniere und dem Hilum der Niere fortgesetzt. Jegliches Bindegewebe zwischen Nierenarterie und Nierenvene wird sorgfältig durchtrennt. Nach der Identifizierung und Präparierung der Gefäße und des Harnleiters wird die Niere vollständig vom oberen zum unteren Pol mobilisiert. Es folgt die Mobilisation der hinteren Ansätze der Niere. Dieser Teil des Falles wurde durch den Grad des Fettes erschwert, das die Niere umgab und an ihr haftete.
Die Nierenarterie und die Vene werden zur Vorbereitung der Heftung von allen Ansätzen befreit. Der Harnleiter wird mit zwei Hemo-o-lok-Clips so distal wie möglich abgeschnitten und durchtrennt, um die Länge zu erhalten. Die akzeptierte Lokalisation für die Harnleiterdurchtrennung bei der Spendernephrektomie befindet sich auf der Höhe, in der der Harnleiter über die Beckenarterie verläuft. Wir verwenden Hem-o-Lok-Clips aus dem Hilfsanschluss, aber es sind auch Roboterclips erhältlich und für den Einsatz geeignet. Der Harnleiter wird mit der Schnittfunktion des Gefäßversiegelungsgeräts, einer Roboterschere oder mit einer Schere aus der Hilfsöffnung durchtrennt.
Schwankungen des Nierengefäßsystems treten in etwa 25–50% der Fälle auf. 7, 8 Die Niere erhält eine endarterielle Blutversorgung, daher ist es wichtig, alle akzessorischen Arterien mit einem Durchmesser von mehr als 1-2 mm, die normalerweise im präoperativen CT-Scan sichtbar sind, zu identifizieren und sorgfältig zu erhalten. Alle Gefäße mit kleinerem Durchmesser, die intraoperativ angetroffen werden, können durchtrennt werden. Es empfiehlt sich, ein Gespräch mit dem Empfängerchirurgen zu führen, idealerweise präoperativ oder bei Bedarf in Echtzeit.
Sobald die Gefäße präpariert und zum Heften bereit sind, wird intravenös Mannitol verabreicht. Wir geben 12,5 g Mannitol. Wir verabreichen kein intravenöses Heparin, aber einige Spenderzentren verabreichen Heparin vor dem Cross-Clamp. Die Kältespülung wird vorbereitet und der Roboter wird abgedockt. Der minderwertigste 8-mm-Anschluss wird auf einen 12-mm-Anschluss vergrößert, um den Endo-GIA-Hefter aufzunehmen. Einige Chirurgen für robotergestützte Spendernephrektomien können sich für den Einsatz des Roboterstaplers entscheiden. Verlängern Sie den Pfannenstiel-Schnitt, um die Niere aufzunehmen, wenn die Niere groß ist oder anhaftendes perinephrisches Fett aufweist, wie in diesem Fall. Die Nierenarterie wird mit einer GIA 30 Tan Load in der Nähe der Aorta getackert, gefolgt von der Heftung der Nierenvene mit einer GIA 30 Tan Load. Die Niere wird durch den Pfannenstiel-Schnitt extrahiert. Die Niere wird dann mit einer kalten Konservierungslösung der University of Wisconsin (oder einer anderen Konservierungslösung Ihrer Wahl) auf dem hinteren Tisch durchblutet. Die Nierenarterie wird gespült, bis die aus der Nierenvene kommende Flüssigkeit klar ist und das Parenchym der Niere gerötet erscheint. Anschließend wird die Niere in den Empfängerraum transportiert. In diesem Fall war die Extraktion aufgrund der Größe der Niere und des perinephrischen "klebrigen" Fettes schwierig. Der Schnitt wurde weiter verlängert und mit einem laparoskopischen Entnahmebeutel die Niere entnommen, die dann sofort auf Eis gelegt und gespült wurde.
Während der Nierenspülung besteht der erste unmittelbare Schritt darin, die Blutstillung im Operationsfeld zu bestätigen. Verwenden Sie bei Bedarf eine Kombination aus Clips, Kauter und Blutstillungsmitteln. Clips können erforderlich sein, wenn Bedenken hinsichtlich der Lymphdrainage bestehen. Die Anatomie der Niere wird auf dem hinteren Tisch bestätigt. Ein transversus abdominis plane (TAP) Block kann lateral verabreicht werden, indem ein Lokalanästhetikum nur oberflächlich in das Peritoneum injiziert wird, wobei die Nephrektomieseite direkt sichtbar gemacht wird. Intraoperativ führen wir einen einseitigen TAP-Block durch. Eine weitere Möglichkeit besteht darin, dass die Anästhesie einen TAP-Block durchführt, sobald der Patient vor der Extubation in Rückenlage liegt. Der Rest des Lokalanästhetikums wird dann durch die Portstellen und den Pfannenstiel-Schnitt vor dem Verschluss injiziert. Die Blende an der 12-mm-Öffnung im linken unteren Quadranten wird mit einem Carter-Thompson-Gerät mit einem 0-Vicryl verschlossen, und die Ports werden mit 4-0 Monocryl verschlossen. Nach Bestätigung der Instrumentenzahl wird der Pfannenstiel-Schnitt in 4 Schichten verschlossen: Das Bauchfell wird mit 2-0 Vicryl verschlossen, die vordere Faszie des Musculus rectus mit 2-0 PDS und die Haut in zwei Schichten mit 3-0 Vicryl in der Scarpa-Faszie und 4-0 Monocryl in der subkutikulären Schicht. Chirurgischer Kleber wird aufgetragen und die Wiederholung der Instrumentenzahl wird bestätigt.
Die Lebendnierenspende kann durch eine gerichtete Lebendspende, eine gepaarte Nierenspende oder eine ungerichtete/altruistische Spende durchgeführt werden. Mit wenigen Ausnahmen ist die Zahl der Lebendnierenspenden in den Vereinigten Staaten seit 2005 insgesamt zurückgegangen. Die Raten der Lebendspenden sind während der COVID-19-Pandemie noch weiter gesunken. 9 Gepaarte Spendernetzwerke können eine Zunahme der Nierentransplantationen von Lebendspendern ermöglichen. Bei den Empfängern von Paarspenden handelte es sich mit größerer Wahrscheinlichkeit um Frauen, Schwarze, die eine frühere Transplantation hatten, hoch sensibilisiert und gesetzlich versichert waren, aber es hat sich gezeigt, dass sie die gleichen Ergebnisse wie andere Empfänger von Lebendspendern von Nieren erzielten. 10
Das Screening auf Lebendnierenspende kann von Zentrum zu Zentrum variieren, aber in der Regel werden potenzielle Spender medizinisch, chirurgisch und psychiatrisch untersucht (je nach Angabe), um die Kandidatur zu beurteilen. Die Tests können Herz- und Lungenfunktionstests umfassen, falls angezeigt, die Beurteilung des Funktionsstatus, Malignitätsscreenings, Infektionsscreenings, Ernährungsberatungen in Abhängigkeit vom BMI und ESRD-Risikotests, insbesondere für Personen mit Nierenerkrankungen in der Familienanamnese. Es stehen mehrere Risikobewertungsinstrumente zur Verfügung, um die Risiken vor der Spende für Spenderkandidaten zu berechnen. 11–13 Uhr Es wird auch eine Nieren-CTA erstellt, um die Nierenanatomie zu beurteilen. Obwohl Transplantationszentren unterschiedliche Zulassungskriterien für Nierenspender haben, ist das Verfahren im Allgemeinen kontraindiziert, wenn der potenzielle Kandidat unter 18 Jahre alt ist, Diabetiker ist, an unkontrolliertem Bluthochdruck, fortgeschrittener Nierenerkrankung, aktiver Infektion, aktiver oder unvollständig behandelter Malignität, unbehandelter psychiatrischer Erkrankung, eingeschränkter Entscheidungsfähigkeit oder Verdacht auf finanziellen oder zwischenmenschlichen Zwang leidet.
Die anatomische Wahl hängt vom Chirurgen ab. Bei potenziellen Spendern mit einem kleinen, unkomplizierten einseitigen Einzelnierenstein kann die betroffene Seite transplantiert werden, nachdem der Spender auf zukünftige steinbildende Risiken untersucht wurde (wir verwenden einen LithoLink-Test). Schwankungen des Nierengefäßsystems treten in etwa 25–40% der Fälle auf. Doppelte Harnleiter treten bei etwa 0,7–0,8 % der gesunden erwachsenen Bevölkerung und bei 2–4 % der Erwachsenen mit Harnwegsproblemen auf. 7, 8, 1416 In unserem Zentrum akzeptieren wir keine Spender mit Hufeisennieren oder Spender mit fibromuskulärer Dysplasie. Die geteilte Nierenfunktionsuntersuchung wird im Falle einer Größendiskrepanz bewertet. Die Kriterien für den Split-Renal Function Test sind zentrumsabhängig. In unserem Zentrum führen wir einen nuklearmedizinischen Nierenscan durch, wenn der Volumenunterschied zwischen den Spendernieren im CT-Scan 10 % übersteigt. Wir nehmen die schlechter funktionierende Niere, wenn der Unterschied in der geteilten Nierenfunktion 10% übersteigt, um nach der Spende die besser funktionierende Niere zu verlassen. Herkömmlicherweise wird die linke Niere für eine Spende bevorzugt, da die Nierenvenen länger sind und eine venöse Anastomose des Empfängers erleichtert werden kann. Die linke Niere wird bei etwa 80% aller Lebendspender-Nierentransplantationen verwendet. 17 Die rechte Niere kann in Abwesenheit einer solitären Nierenarterie auf der linken Seite, bei parenchymalen Anomalien in der linken Niere oder aufgrund von Größenabweichungen verwendet werden.
Die perioperative Mortalität bei Lebendnierenspendern liegt bei 3/10.000 und das geschätzte 20-Jahres-Risiko für ESRD bei etwa 30/10.000, unabhängig vom Ansatz oder der Variation der Auswahlkriterien. 11, 18 Serumkreatinin nach der Spende im Alter von sechs Monaten kann bei lebenden Nierenspendern mit einem späteren ESRD-Risiko verbunden sein. 19 Eine weitere mögliche Komplikation ist das Risiko von Hernien an den Entnahme- oder Portstellen. Das Risiko für Hernien ist bei Verwendung eines Pfannenstiel-Schnitts geringer als bei der Verwendung von Mittellinien-Bauchschnitten, die auf der Literatur aus der gynäkologischen Chirurgie basieren. 20, 21 Die Patienten können durch die Teilung der Gonadenvene eine Hodenschwellung entwickeln, die jedoch vorübergehend ist und sich von selbst auflöst. Es hat sich gezeigt, dass die robotergestützte Nephrektomie von Lebendspendern im Vergleich zur laparoskopischen Nephrektomie ähnliche postoperative Ergebnisse erzielt und die Aufenthaltsdauer insgesamt verkürzt. 3–6 In der Literatur werden mehrere Modifikationen beschrieben, darunter eine kleine Serie von sieben Patienten, die über die Machbarkeit einer robotergestützten Einzelport-Spendernephrektomie berichteten. 22
In diesem Fall betrug die Operationszeit 3,5 Stunden und der geschätzte Blutverlust 200 ml. Wir stießen auf zusätzliche Schwierigkeiten aufgrund von übermäßig anhaftendem perinephrischem Fett oder "klebrigem Fett", das sowohl bei der Dissektion als auch bei der Extraktion der Niere Probleme verursachte. Der Spender erholte sich jedoch ohne Zwischenfälle und wurde am dritten postoperativen Tag mit guter Schmerzkontrolle unter oralen Analgetika entlassen. Bei der Nachuntersuchung hatte der Patient keine Probleme.
- Da Vinci Xi Chirurgisches System.
- GelPort laparoskopisches System für die handassistierte Laparoskopie.
- 12-mm-Einweg-Laparoskopie-Port
Nichts offenzulegen.
Der Patient, auf den sich dieser Videoartikel bezieht, hat seine Einverständniserklärung gegeben, gefilmt zu werden, und ist sich bewusst, dass Informationen und Bilder online veröffentlicht werden.
References
- US-Gesundheitsministerium. OPTN/SRTR 2020 Jahresdatenbericht: Niere. Erhältlich bei: https://srtr.transplant.hrsa.gov/annual_reports/2020/Kidney.aspx. Abgerufen am 30. April 2023.
- Globales Observatorium für Spenden und Transplantationen. Zusammenfassung. Erhältlich unter: https://www.transplant-observatory.org/summary/. Abgerufen am 30. April 2023.
- Bhattu AS, Ganpule A, Sabnis RB, Murali V, Mishra S, Desai M. Roboterassistierte laparoskopische Spendernephrektomie vs. standardmäßige laparoskopische Spendernephrektomie: eine prospektive randomisierte Vergleichsstudie. J Endourol. 2015; 29(12):1334-1340. doi:10.1089/end.2015.0213.
- Xiao Q, Fu B, Song K, Chen S, Li J, Xiao J. Vergleich von Operationstechniken bei der Nephrektomie von Lebendspendern: eine systematische Überprüfung und Metaanalyse des Bayes'schen Netzwerks. Ann Transplantation. 2020; 25:e926677. doi:10.12659/AOT.926677.
- Wang H, Chen R, Li T, Peng L. Robotergestützte laparoskopische vs. laparoskopische Spendernephrektomie bei Nierentransplantation: eine Metaanalyse. Clin Transplantation. 2019; 33(1):e13451. doi:10.1111/ctr.13451.
- Spaggiari M, Garcia-Roca R, Tulla KA, et al. Robotergestützte Nephrektomien von Lebendspendern. Ann Surg. 2022; 275(3):591-595. doi:10.1097/SLA.0000000000004247.
- Ciçekcibaşi AE, Ziylan T, Salbacak A, Seker M, Büyükmumcu M, Tuncer I. Eine Untersuchung der Herkunft, Lokalisation und Variationen der Nierenarterien bei menschlichen Föten und ihrer klinischen Relevanz. Ann Anat. 2005; 187(4):421-427. doi:10.1016/j.aanat.2005.04.011.
- Aremu A, Igbokwe M, Olatise O, Lawal A, Maduadi K. Anatomische Variationen der Nierenarterie: eine computergestützte tomographische Angiogrammstudie an lebenden Nierenspendern in einem nigerianischen Nierentransplantationszentrum. Afr Gesundheit Sci. 2021; 21(3):1155-1162. doi:10.4314/ahs.v21i3.24.
- Al Ammary F, Yu Y, Ferzola A, et al. Der erste Anstieg der Lebendnierenspenden in den Vereinigten Staaten seit 15 Jahren. Am J Transplant. 2020; 20(12):3590-3598. doi:10.1111/ajt.16136.
- Leeser DB, Thomas AG, Shaffer AA, et al. Überleben des Patienten und des Nierentransplantats mit nationaler gepaarter Nierenspende. Clin J Am Soc Nephrol. 2020; 15(2):228-237. doi:10.2215/CJN.06660619.
- Massie AB, Muzaale AD, Luo X und andere. Quantifizierung des Risikos von ESRD nach der Spende bei Lebendnierenspendern. J Am Soc Nephrol. 2017; 28(9):2749-2755. doi:10.1681/ASN.2016101084.
- Grams ME, Sang Y, Levey AS, et al. Projektion des Risikos einer Niereninsuffizienz für den Kandidaten mit lebendem Nierenspender. N Engl J Med. 2016; 374(5):411-421. doi:10.1056/NEJMoa1510491.
- John's Hopkins Universität. ESRD-Risiko-Tool für Nierenspenderkandidaten. Erhältlich bei: http://www.transplantmodels.com/esrdrisk/. Abgerufen am 2. Mai 2023.
- Standring S. Philadelphia: Churchill Livingstone Elsevier. Philadelphia: Elsevier; 2020. Grays Anatomie: Die anatomische Grundlage der klinischen Praxis.
- Schlüssel RN, Retik AB. Campbells Urologie. Philadelphia, PA: Saunders; 2002. Ektopischer Harnleiter, Ureterozele und andere Anomalien des Harnleiters; S. 2007–2052.
- Fernbach SK, Feinstein KA, Spencer K, Lindstrom CA. Harnleiterduplikation und ihre Komplikationen. Radiographie. 1997;17:109-127.
- Wang K, Zhang P, Xu X, Fan M. Rechte versus linke laparoskopische Nephrektomie von Lebendspendern: eine Metaanalyse. Exp Clin Transplantation. 2015; 13(3):214-226.
- Segev DL, Muzaale AD, Caffo BS, et al. Perioperative Mortalität und Langzeitüberleben nach Lebendnierenspende. JAMA. 2010; 303(10):959-966. doi:10.1001/jama.2010.237.
- Massie AB, Holscher CM, Henderson ML et al. Assoziation der frühen Nierenfunktion nach der Spende mit dem anschließenden Risiko einer Nierenerkrankung im Endstadium bei lebenden Nierenspendern. JAMA Surg. 2020; 155(3):e195472. doi:10.1001/jamasurg.2019.5472.
- Luijendijk RW, Jeekel J, Storm RK et al. Der niedrige transversale Pfannenstiel-Schnitt und die Prävalenz von Schnitthernien und Nerveneinklemmungen. Ann Surg. 1997; 225(4):365-369. doi:10.1097/00000658-199704000-00004.
- Bewö K, Österberg J, Löfgren M, Sandblom G. Schnitthernien nach offener gynäkologischer Chirurgie: eine populationsbasierte Studie. Arch Gynecol Obstet. 2019; 299(5):1313-1319. doi:10.1007/s00404-019-05069-0.
- Garten EB, Al-Alao O, Razdan S, Mullen GR, Florman S, Palese MA. Robotergestützte Spendernephrektomie mit einem Port und dem da Vinci SP Operationssystem. JSLS. 2021; 25(4). doi:10.4293/JSLS.2021.00062.
Cite this article
Atthota S, Grasso J, Dageforde LA. Robotergestützte laparoskopische Nephrektomie des linken Spenders zur Lebendnierenspende. J Med Insight. 2024; 2024(418). doi:10.24296/jomi/418.



