CDH1 基因突变的预防性全胃切除术
Main Text
Table of Contents
遗传性弥漫性胃癌 (HDGC) 综合征是由于 CDH1 基因突变引起的,该突变使患者一生中容易患胃癌。因此,通常建议患有这种综合征的患者进行全胃切除术。在这种情况下,患者在被诊断患有早发性直肠癌后获得的基因检测中偶然发现了 CDH1 突变。她接受了预防性全胃切除术和结肠后 Roux-en-Y 食管空肠吻合术。她的术后病程无明显异常,术后第 3 天出院。她的病理显示印戒细胞癌的几个病灶仅限于粘膜。该视频演示了经验丰富的外科医生通过 Roux-en-Y 食管空肠吻合术重建进行预防性全胃切除术的技术。
遗传性弥漫性胃癌 (HDGC) 综合征是一种常染色体显性遗传病,由 CDH1 基因突变引起。这是一种罕见的疾病,仅占所有胃癌的 1-3%。然而,患有这种疾病的患者一生中患胃癌的风险为 56-83%,并且通常在 40 岁之前被诊断出来。1,2 女性患乳腺小叶癌的风险也很高。鉴于一生中患胃癌的重大风险,建议对基因检测发现 CDH1 突变的患者进行预防性全胃切除术。
患者是一名 39 岁的女性,多年前有直肠癌病史,她成功治疗,随后的基因检测显示 CDH1 基因存在种系突变。
她的腹部检查仅对她先前手术(低位前切除术和分流回肠造口术)愈合良好的切口有意义。
患者接受了上消化道内窥镜检查,结果显示胃部外观正常。用冷钳进行活检进行组织学检查,发现壁细胞增生,无恶性肿瘤证据。
HDGC 患者发展为弥漫性(或粘性差型)胃癌,本质上是粘膜下癌,这意味着它们只有在疾病过程的后期侵犯粘膜时才能在粘膜表面可见。因此,建议预防性全胃切除术作为预防 HDGC 患者潜在致命性胃癌的唯一可靠方法。
对于年龄小于 ~20 岁的患者和决定不进行手术治疗的患者,内镜监测和连续上消化道内镜检查是一种替代选择。确切的监测频率尚不清楚,但大多数指南建议每 6-12 个月进行一次内窥镜检查,至少进行 30 次活检,从以下解剖区每个解剖区进行 5 次:幽门前、胃窦、移行区、身体、眼底和贲门。3-5 应该向患者明确,即使经过仔细的内窥镜评估,鉴于癌症浸润小且分布广泛,仍然可能错过早期胃癌。6 然而,研究表明,与接受前期胃切除术的患者相比,推迟胃切除术的患者获得相似的生存结果,因为大多数患者在纵向咨询后最终选择预防性全胃切除术。7
虽然该视频演示了通过传统开放方法进行预防性全胃切除术,但许多外科医生现在以微创方式进行这种手术,无论是腹腔镜还是机器人。尽管严重发病率或死亡率没有差异,但与开放方法相比,微创方法的术后疼痛更少,住院时间相应更短。
预防性全胃切除术的主要目标是切除所有胃粘膜,从而消除患胃癌的风险。因此,术中进行冰冻切片病理评估,以确保胃切除术标本的近端边缘显示 100% 食管鳞状粘膜,并且远端边缘显示仅在十二指肠中可见的 Brunner 腺。
对于接受全胃切除术的患者,我们将他们置于仰卧位,并通过上中线切口进入腹部。仔细检查腹膜表面和肝脏是否有转移性疾病。然后,我们先取下镰状韧带,然后再放置 Thompson 牵开器。
放置牵开器后,我们首先通过胃结肠韧带进入小囊。然后,我们将解剖物向左移动,用血管密封装置 (LigaSure) 将左侧胃肠外血管和所有短胃血管分开。然后,解剖沿着较大的曲率向右移动到胃结肠干。在这里,右胃肠外静脉和动脉被分离并与 LigaSure 结扎。完成此作后,通过 Endo-GIA 60 毫米棕褐色负荷吻合器的一次发射来分割十二指肠的第一部分。
然后将注意力转向较小的曲率。我们打开小网膜,并使用 LigaSure 取右胃静脉和动脉。然后我们分开膈食管韧带,解剖出腹部内食道下部 4-5 厘米,并分开两条迷走神经。这为近端胃和远端食管提供了活动性,与十二指肠的分裂一起,使胃能够在头侧方向移动,从而更容易地解剖左胃静脉和动脉,我们用 Endo-GIA tan 负荷吻合器将其分开(图 1)。

然后在胃食管交界处上方 1-2 cm 处选择食管分裂部位。我们用烧灼术进行此作,在食道分开时将 3-0 根丝牵引缝合线放置在 4 个象限中。一旦食管被分割,胃标本就会被送出现场并送去进行冰冻切片检查,以确保近端和远端边缘没有残留的胃粘膜。
由于 HDGC 的全胃切除术是预防性的,因此不需要 D1+ 或 D2 淋巴结清扫术。然而,直接的胃周围淋巴结(构成 D1 淋巴结清扫术)与胃切除术标本一起整块切除。
食管空肠吻合术使用 25 毫米 Covidien EEA 吻合器以端对侧的吻合方式进行。我们首先在食道的切割边缘放置一根 3-0 PDS 荷包缝合线,以固定 EEA 吻合器的砧座。在此之后,我们通过将空肠分割到 Treitz 韧带远端 ~60 厘米处来创建长约 30 厘米的结肠后 Roux 肢体。进行两层手工缝合的左右空肠空肠吻合术,内层是连续的全层 PDS 缝合线和外排间断的 3-0 丝 Lembert 缝合线。我们用 3-0 丝缝合线闭合肠系膜陷阱。
Roux 支以结肠后的方式通过中绞痛血管左侧横结肠系膜的裂缝通过。小心不要扭曲 Roux 肢体,因为它已经推进到食道。然后,我们通过切断 Roux 肢体的吻合线并将吻合器推进小肠切开术来进行吻合食管空肠吻合术。然后将尖刺从 Roux 支的肠系缘推进出去,然后与食管中的砧座结合。然后发射吻合器,并将食管甜甜圈送去进行最终的切缘评估。然后,我们的麻醉同事将鼻胃管穿过吻合口并进入 Roux 肢体。然后用 Endo-GIA tan 负荷吻合器一次发射切除 Roux 肢上的突出部分(图 2)。最后,我们用一些中断的 2-0 丝缝线重新接近食管裂孔,并用中断的 3-0 丝缝线将 Roux 肢体固定到横膈膜的腹膜上。横结肠系膜处的肠系膜陷阱也用间断的 3-0 丝缝合线闭合。
在经验丰富的转诊中心,可以以最低的发病率和死亡率进行全胃切除术。在最近对我们机构接受全胃切除术的 148 例患者的回顾性研究中,90 天主要发病率和死亡率分别为 14% 和 3%。中位住院时间为 8 天,再入院率为 22%,主要继发于脱水或营养不良。8 本案中的病人的病程并不复杂。她在术后第 2 天接受了上消化道吞咽检查,吻合口瘘呈阴性,术后第 3 天她以全流质饮食出院回家。
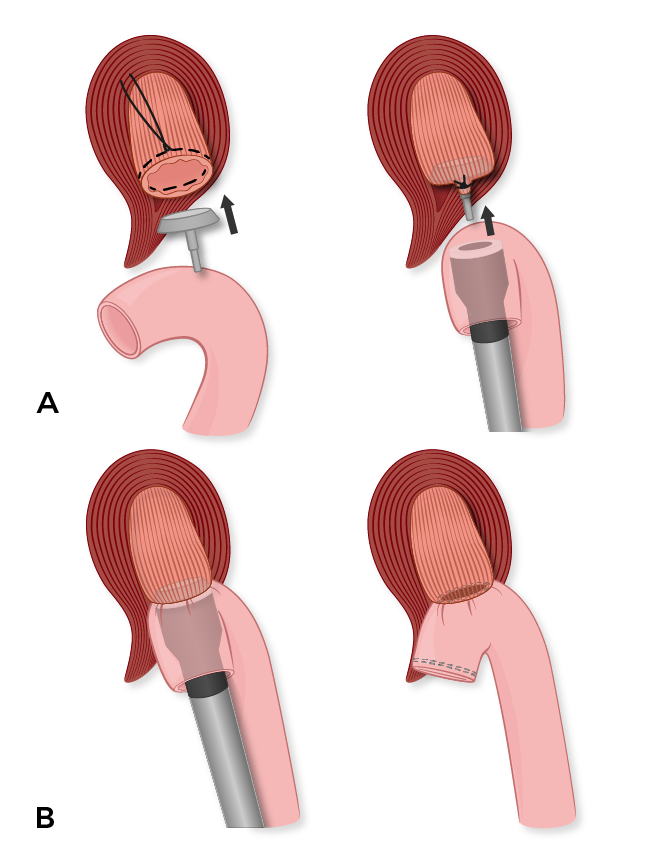
一个。砧座缝在近端,即食管横断面线,作为接收端。EEA 吻合器通过空肠 Roux 支的吻合线开口引入,并在肠系缘上刺出,作为插入端。
B.铁砧和 EEA 吻合器在发射前结合,形成端到端的食管空肠吻合术。然后用 Endo-GIA 吻合器切除空肠 Roux 支的切缘。
全胃切除术:
多灶性腺癌,粘性差型,局限于固有层(见概要报告)。9 个淋巴结没有恶性肿瘤的证据 (0/9)。
最终食管边缘:
未识别诊断异常的食管段。没有恶性肿瘤的证据。
肿瘤分期总结:m p T1a N0。
肿瘤大小(最大尺寸):最大 0.1 厘米(见评论)。
WHO 分类: 黏聚性差癌(包括印戒细胞癌和变异型)。
组织学分级:G3(低分化)。
浸润范围: 肿瘤仅侵入固有层。
原发性肿瘤:pT1a (肿瘤侵入固有层或粘膜肌层)。
小血管(血液/淋巴管)浸润:无。
大血管(静脉)浸润:无。
神经周围浸润:无。
近端食管边缘:鳞状食管,不受浸润性癌累及(B 部分)。
十二指肠远端缘:不受浸润性癌累及。
区域淋巴结: pN0 (无区域淋巴结转移): 检查的淋巴结数量: 9。
Bookwalter、Thompson 或 Omni 手术牵开器等自缩回系统可以极大地方便整个手术过程中的暴露。LigaSure 装置可以促进有效的止血解剖,甚至可以分割主要的血管蒂,例如右胃肠上皮蒂,而无需系带或吻合器。十二指肠和空肠都用采用三钉技术的 Endo-GIA tan 负荷吻合器(0.95-1.12 毫米钉高)进行,食管空肠吻合术使用 25 毫米 Covidien EEA 吻合器(4.8 毫米钉高)进行。
没什么可透露的。
本视频文章中提到的患者已同意拍摄,并且知道信息和图像将在网上发布。
References
- 美国临床肿瘤学会。遗传性弥漫性胃癌。发布时间:2012 年 6 月 25 日。2021 年 12 月 11 日访问。 https://www.cancer.net/cancer-types/hereditary-diffuse-gastric-cancer
- Hansford S、Kaurah P、Li-Chang H 等人。遗传性弥漫性胃癌综合征:CDH1 突变及其他。 美国医学会肿瘤学。2015;1(1):23-32. doi:10.1001/jamaoncol.2014.168.
- Blair VR、McLeod M、Carneiro F 等人。遗传性弥漫性胃癌:更新的临床实践指南。 柳叶刀 Oncol。2020;21(8):e386-e397。 doi:10.1016/S1470-2045(20)30219-9.
- Lim YC、di Pietro M、O'Donovan M 等人。前瞻性队列研究评估了接受内窥镜监测的符合遗传性弥漫性胃癌标准的家庭患者的结局。 胃肠内窥镜。2014;80(1):78-87. doi:10.1016/j.gie.2013.11.040.
- Fitzgerald RC、Hardwick R、Huntsman D 等人。遗传性弥漫性胃癌:更新的临床管理和未来研究方向的共识指南。 J Med Genet.2010;47(7):436-444. doi:10.1136/jmg.2009.074237.
- 思科 RM、福特 JM、诺顿 JA。遗传性弥漫性胃癌:基因检测对筛查和预防性手术的影响。 癌症。2008;113(7 增刊):1850-1856。 doi:10.1002/cncr.23650.
- Friedman M, Adar T, Patel D, Lauwers GY, Yoon SS, Mullen JT, Chung DC.监测内窥镜检查治疗遗传性弥漫性胃癌综合征。 临床胃肠醇肝醇。2021;19(1):189-191. doi:10.1016/j.cgh.2019.10.033.
- 全胃切除术的发病率和死亡率:90 天结果的综合分析。 J 胃肠外科杂志。2019;23(7):1340-1348. doi:10.1007/s11605-019-04228-7.


.jpg&w=3840&q=75&dpl=dpl_Ca7gcJXjbQN6bK8aruk8U4KsAWv7)