Gastrectomie totale prophylactique pour la mutation du gène CDH1
Main Text
Table of Contents
Le syndrome du cancer gastrique diffus héréditaire (HDGC) est dû à une mutation du gène CDH1 qui prédispose les patients à un risque élevé de développer un cancer gastrique au cours de leur vie. En tant que tel, une gastrectomie totale est généralement recommandée pour les patients atteints de ce syndrome. Dans ce cas, la patiente présentait une mutation CDH1 découverte fortuitement sur des tests génétiques obtenus après qu’on lui ait diagnostiqué un cancer du rectum précoce. Elle a subi une gastrectomie totale prophylactique avec une œsophagojéjunostomie rétrocolique de Roux-en-Y. Son évolution postopératoire n’a pas été remarquable et elle a reçu son congé le 3e jour postopératoire. Sa pathologie a mis en évidence plusieurs foyers de carcinome à cellules en anneau limité à la muqueuse. Cette vidéo montre la technique d’un chirurgien expérimenté pour réaliser une gastrectomie totale prophylactique avec une reconstruction d’œsophagojéjunostomie de Roux-en-Y.
Le syndrome du cancer gastrique diffus héréditaire (HDGC) est une maladie génétique autosomique dominante due à une mutation du gène CDH1. Il s’agit d’une maladie rare, responsable de seulement 1 à 3 % de tous les cancers gastriques. Cependant, les patients atteints de cette maladie ont un risque de 56 à 83 % de développer un cancer gastrique et sont souvent diagnostiqués avant l’âge de 40 ans. 1,2 Les femmes courent également un risque élevé de développer un carcinome lobulaire du sein. Compte tenu du risque important de développer un cancer gastrique au cours de leur vie, la gastrectomie totale prophylactique est recommandée pour les patients présentant une mutation CDH1 lors des tests génétiques.
Il s’agit d’une femme de 39 ans ayant des antécédents de cancer du rectum il y a de nombreuses années, pour lequel elle a été traitée avec succès et a subi des tests génétiques ultérieurs qui ont révélé une mutation germinale dans le gène CDH1.
Son examen abdominal n’est significatif que pour les incisions bien cicatrisées de son opération antérieure (résection antérieure basse et iléostomie de dérivation).
Le patient a subi une endoscopie supérieure qui a révélé un estomac d’apparence normale. Des biopsies ont été effectuées à l’aide d’une pince à froid pour un examen histologique, qui a révélé une hyperplasie des cellules pariétales et aucun signe de malignité.
Les patients atteints de HDGC développent le type diffus (ou le type peu cohésif) du cancer gastrique qui est de nature sous-muqueuse, ce qui signifie qu’ils ne sont visibles à la surface de la muqueuse que lorsqu’ils ont violé la muqueuse beaucoup plus tard dans le processus de la maladie. En tant que telle, la gastrectomie totale prophylactique est recommandée comme le seul moyen fiable de prévenir un cancer gastrique potentiellement mortel chez les patients atteints de HDGC.
Pour les patients de moins de ~20 ans et pour ceux qui décident de ne pas pratiquer une prise en charge chirurgicale, la surveillance endoscopique avec des endoscopies supérieures en série est une option alternative. La fréquence exacte de la surveillance n’est pas claire, mais la plupart des directives recommandent que des examens endoscopiques soient effectués tous les 6 à 12 mois, avec un minimum de 30 biopsies prélevées, 5 dans chacune des zones anatomiques suivantes : prépylore, antre, zone transitionnelle, corps, fond d’œil et cardia. 3 à 5 Il faut préciser aux patients que même avec une évaluation endoscopique minutieuse, un cancer gastrique précoce peut toujours passer inaperçu étant donné que les infiltrats du cancer sont petits et largement distribués. 6 Cependant, des études suggèrent que les patients qui reportent la gastrectomie obtiennent des résultats de survie similaires à ceux qui subissent une gastrectomie initiale, sachant que la plupart des patients optent finalement pour une gastrectomie totale prophylactique après un conseil longitudinal. 7
Bien que cette vidéo démontre une gastrectomie totale prophylactique par l’approche ouverte traditionnelle, de nombreux chirurgiens effectuent maintenant cette procédure de manière peu invasive, soit par laparoscopie ou par robot. Bien qu’il n’y ait pas de différence dans les taux de morbidité grave ou de mortalité, l’approche mini-invasive est associée à moins de douleur postopératoire et à une durée de séjour proportionnellement plus courte que l’approche ouverte.
L’objectif principal de la gastrectomie totale prophylactique est d’enlever toute la muqueuse gastrique et d’éliminer ainsi le risque de cancer gastrique. Ainsi, l’évaluation pathologique de la section congelée est effectuée en peropératoire pour s’assurer que le bord proximal de l’échantillon de gastrectomie montre 100 % de la muqueuse squameuse de l’œsophage et que le bord distal montre les glandes de Brunner observées uniquement dans le duodénum.
Pour les patients subissant une gastrectomie totale, nous les plaçons en position couchée et pénétrons dans l’abdomen par une incision médiane supérieure. Les surfaces péritonéales et le foie sont soigneusement inspectés pour détecter une maladie métastatique. Nous enlevons ensuite le ligament falciforme avant de placer l’écarteur de Thompson.
Une fois l’écarteur placé, on commence par entrer dans le petit sac par le ligament gastrocolique. Nous effectuons ensuite la dissection vers la gauche, en divisant les vaisseaux gastro-épiploïques gauches et tous les vaisseaux gastriques courts à l’aide d’un dispositif de scellement des vaisseaux (LigaSure). La dissection est ensuite portée vers la droite le long de la plus grande courbure vers le tronc gastrocolique. Ici, la veine gastroépiploïque droite et l’artère droite sont isolées et ligaturées avec le LigaSure. Une fois cela fait, la première partie du duodénum est divisée avec une seule cuisson de l’agrafeuse à charge beige Endo-GIA de 60 mm.
L’attention est alors dirigée vers la courbure inférieure. Nous ouvrons le petit épiploon et prenons la veine gastrique et l’artère droites avec le LigaSure. Nous divisons ensuite le ligament phréno-œsophagien et disséquons les 4 à 5 cm inférieurs de l’œsophage dans l’abdomen et divisons les deux nerfs vagues. Cela fournit une mobilité à l’estomac proximal et à l’œsophage distal qui, avec la division du duodénum, permet à l’estomac d’être mobilisé dans la direction céphalique pour permettre une dissection plus facile de la veine gastrique et de l’artère gauches, que nous divisons avec des agrafeuses Endo-GIA (Figure 1).

Un site de division de l’œsophage est ensuite choisi à 1 à 2 cm au-dessus de la jonction gastro-œsophagienne. Nous effectuons cela avec une cautérisation, en plaçant des sutures de traction en soie 3-0 dans 4 quadrants lorsque l’œsophage est divisé. Une fois l’œsophage divisé, l’échantillon d’estomac est ensuite évacué du terrain et envoyé pour un examen de coupe congelée afin de s’assurer qu’il n’y a pas de muqueuse gastrique résiduelle aux marges proximale et distale.
Étant donné que la gastrectomie totale réalisée pour la HDGC est prophylactique, une lymphadénectomie D1+ ou D2 n’est pas nécessaire. Cependant, les ganglions lymphatiques périgastriques immédiats (qui constituent une lymphadénectomie D1) sont retirés en bloc avec l’échantillon de gastrectomie.
L’œsophagojéjunostomie est réalisée de bout en bout, agrafée à l’aide d’une agrafeuse Covidien EEA de 25 mm. Nous plaçons d’abord une suture de cordon de bourse PDS 3-0 dans le bord coupé de l’œsophage pour fixer l’enclume de l’agrafeuse EEA. Après cela, nous créons notre membre Roux rétrocolique mesurant environ 60 cm de long en divisant le jéjunum ~30 cm distal au ligament de Treitz. Une jéjunojéjunostomie à deux couches, cousue à la main, est réalisée avec une couche interne de sutures PDS de pleine épaisseur et des rangées extérieures de sutures de Lembert en soie 3-0 interrompues. Nous fermons le piège mésentérique avec des sutures en soie 3-0.
Le membre Roux est passé de manière rétrocolique par une déchirure dans le mésocôlon transverse à gauche des vaisseaux coliques moyens. Attention à ne pas tordre le membre Roux lorsqu’il est avancé vers l’œsophage. Nous effectuons ensuite l’anastomose de l’œsophagojéjunostomie agrafée en coupant la ligne d’agrafe du membre Roux et en faisant avancer l’agrafeuse à travers l’entérotomie. La pointe est ensuite avancée vers le bord antisenérique du membre Roux avant d’être mariée à l’enclume de l’œsophage. L’agrafeuse est ensuite allumée et le beignet œsophagien est envoyé pour l’évaluation finale de la marge. Nos collègues anesthésistes font ensuite passer une sonde nasogastrique à travers l’anastomose et dans le membre Roux. Le porte-à-faux de la branche Roux est ensuite excisé d’une simple mise à feu de l’agrafeuse à charge de bronzage Endo-GIA (figure 2). Enfin, nous rapprochons le hiatus œsophagien avec quelques sutures en soie 2-0 interrompues et fixons le membre Roux au péritoine du diaphragme avec des sutures en soie 3-0 interrompues. Le piège mésentérique au niveau du mésocôlon transverse est également fermé par des sutures de soie 3-0 interrompues.
Dans les centres de référence expérimentés, la gastrectomie totale peut être pratiquée avec une morbidité et une mortalité minimales. Dans une récente revue rétrospective portant sur 148 patients subissant une gastrectomie totale dans notre établissement, les taux de morbidité et de mortalité majeures à 90 jours étaient respectivement de 14 % et 3 %. La durée médiane du séjour était de 8 jours et le taux de réadmission était de 22 %, principalement à la suite d’une déshydratation ou d’une détérioration nutritionnelle. 8 Dans ce cas, le patient a eu une évolution hospitalière sans complications. Elle a subi une étude de déglutition digestive supérieure le jour 2 postopératoire, qui s’est avérée négative pour une fuite anastomotique, et elle a été renvoyée à la maison avec un régime liquide complet le 3e jour postopératoire.
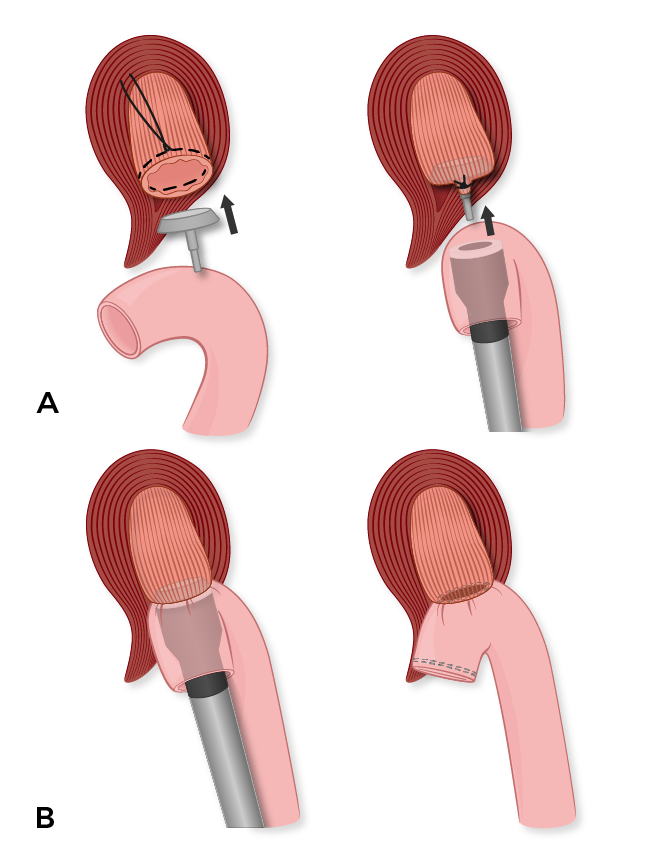
Un. L’enclume est cousue sur l’extrémité proximale, qui est la ligne de transsection de l’œsophage, servant d’extrémité réceptrice. L’agrafeuse EEA est introduite par l’ouverture de la ligne d’agrafe du membre Roux jéjunal, et piquée sur le bord antitimenérique, servant d’extrémité d’insertion.
B. L’enclume et l’agrafeuse EEA sont mariés avant d’être tirés, créant une œsophagojéjunostomie de bout en bout. Le tranchant du membre jéjunal de Roux est ensuite excisé à l’aide d’une agrafeuse Endo-GIA.
GASTRECTOMIE TOTALE :
Adénocarcinome multifocal, de type peu cohésif, confiné à la lamina propria (voir rapport synoptique). Il n’y a aucun signe de malignité dans neuf ganglions lymphatiques (0/9).
MARGE FINALE DE L’ŒSOPHAGE :
Segment de l’œsophage sans anomalie diagnostique reconnue. Il n’y a aucun signe de malignité.
RÉSUMÉ DU STADE DE LA TUMEUR : m p T1a N0.
TAILLE DE LA TUMEUR (plus grande dimension) : jusqu’à 0,1 cm (voir commentaire).
CLASSIFICATION DE L’OMS : Carcinome peu cohésif (y compris le carcinome à cellules en anneau et ses variants).
GRADE HISTOLOGIQUE : G3 (Peu différencié).
ÉTENDUE DE L’INVASION : La tumeur n’envahit que la lamina propria.
TUMEUR PRIMITIVE : pT1a (La tumeur envahit la lamina propria ou la muscularis muqueuse).
INVASION DES PETITS VAISSEAUX (SANGUINS/LYMPHATIQUES) : Absente.
INVASION DE GROS VAISSEAUX (VEINEUX) : Absente.
INVASION PÉRINEURALE : Absente.
MARGE PROXIMALE DE L’ŒSOPHAGE : Œsophage squameux, non touché par un carcinome invasif (partie B).
MARGE DUODÉNALE DISTALE : Non impliquée par le carcinome invasif.
GANGLIONS LYMPHATIQUES RÉGIONAUX : pN0 (pas de métastases ganglionnaires régionales) : Nombre de ganglions lymphatiques examinés : 9.
Un système d’auto-rétraction tel qu’un écarteur chirurgical Bookwalter, Thompson ou Omni peut grandement faciliter l’exposition tout au long de l’opération. Un dispositif LigaSure peut faciliter une dissection hémostatique efficace et permettre de diviser même les principaux pédicules vasculaires, tels que le pédicule gastroépiploïque droit, sans avoir besoin d’attaches ou d’agrafeuses. Le duodénum et le jéjunum sont divisés à l’aide d’une agrafeuse Endo-GIA tan avec technologie tri-agrafe (hauteur d’agrafe de 0,95 à 1,12 mm), et l’œsophagojéjunostomie est réalisée à l’aide d’une agrafeuse Covidien EEA de 25 mm (hauteur d’agrafe de 4,8 mm).
Rien à divulguer.
La patiente dont il est question dans cet article vidéo a donné son consentement éclairé pour être filmée et est consciente que des informations et des images seront publiées en ligne.
References
- Société américaine d’oncologie clinique. Cancer gastrique diffus héréditaire. Publié le 25 juin 2012. Consulté le 11 décembre 2021. https://www.cancer.net/cancer-types/hereditary-diffuse-gastric-cancer
- Hansford S, Kaurah P, Li-Chang H, et al. Syndrome du cancer gastrique diffus héréditaire : mutations CDH1 et au-delà. JAMA Oncol. 2015; 1(1):23-32. doi :10.1001/jamaoncol.2014.168.
- Blair VR, McLeod M, Carneiro F, et al. Cancer gastrique diffus héréditaire : mise à jour des lignes directrices de pratique clinique. Lancet Oncol. 2020; 21(8) :e386 et e397. doi :10.1016/S1470-2045(20)30219-9.
- Lim YC, di Pietro M, O’Donovan M, et al. Étude de cohorte prospective évaluant les résultats de patients issus de familles répondant aux critères du cancer gastrique diffus héréditaire faisant l’objet d’une surveillance endoscopique. Gastrointest Endosc. 2014; 80(1):78-87. doi :10.1016/j.gie.2013.11.040.
- Fitzgerald RC, Hardwick R, Huntsman D, et al. Cancer gastrique diffus héréditaire : lignes directrices consensuelles mises à jour pour la prise en charge clinique et orientations pour les recherches futures. J Med Genet. 2010; 47(7):436-444. doi :10.1136/jmg.2009.074237.
- Cisco RM, Ford JM, Norton JA. Cancer gastrique diffus héréditaire : implications des tests génétiques pour le dépistage et la chirurgie prophylactique. Le cancer. 2008; 113(7 Suppl) :1850-1856. doi :10.1002/cncr.23650.
- Friedman M, Adar T, Patel D, Lauwers GY, Yoon SS, Mullen JT, Chung DC. Endoscopie de surveillance dans la prise en charge du syndrome du cancer gastrique diffus héréditaire. Clin Gastroenterol Hepatol. 2021; 19(1):189-191. doi :10.1016/j.cgh.2019.10.033.
- Li SS, Costantino CL, Mullen JT. Morbidité et mortalité de la gastrectomie totale : une analyse complète des résultats à 90 jours. J Gastrointest Surg. 2019; 23(7):1340-1348. doi :10.1007/s11605-019-04228-7.


.jpg&w=3840&q=75&dpl=dpl_Ca7gcJXjbQN6bK8aruk8U4KsAWv7)