Gastrectomía total profiláctica para la mutación del gen CDH1
Main Text
Table of Contents
El síndrome de cáncer gástrico difuso hereditario (HDGC) se debe a una mutación en el gen CDH1 que predispone a los pacientes a un alto riesgo de por vida de desarrollar cáncer gástrico. Como tal, una gastrectomía total se recomienda típicamente para pacientes con este síndrome. En este caso, la paciente presentó una mutación CDH1 descubierta incidentalmente en las pruebas genéticas obtenidas después de que se le diagnosticó cáncer rectal de inicio temprano. Se sometió a una gastrectomía total profiláctica con una esofagoyeyunostomía retrocólica en Y de Roux. Su curso postoperatorio no fue destacable y fue dada de alta el día 3 del postoperatorio. Su patología demostró varios focos de carcinoma de células en anillo de sello limitado a la mucosa. Este video demuestra la técnica de un cirujano experimentado para realizar una gastrectomía total profiláctica con una reconstrucción de esofagoyeyunostomía en Y de Roux.
El síndrome de cáncer gástrico difuso hereditario (HDGC) es una afección genética autosómica dominante debida a una mutación en el gen CDH1. Es una condición rara, responsable de sólo 1-3% de todos los cánceres gástricos. Sin embargo, los pacientes con esta afección tienen un riesgo de por vida del 56 al 83% de desarrollar cáncer gástrico y, a menudo, se diagnostican antes de los 40 años. 1,2 Las mujeres también tienen un alto riesgo de desarrollar carcinoma lobulillar de mama. Dado el riesgo significativo de desarrollar cáncer gástrico en su vida, se recomienda la gastrectomía total profiláctica para pacientes que tienen una mutación CDH1 en las pruebas genéticas.
La paciente es una mujer de 39 años con antecedentes de cáncer rectal hace muchos años por el que fue tratada con éxito y se sometió a pruebas genéticas posteriores que revelaron una mutación de la línea germinal en el gen CDH1.
Su examen abdominal solo es significativo para incisiones bien curadas de su operación previa (resección anterior baja e ileostomía de desvío).
El paciente se sometió a una endoscopia superior que demostró un estómago de apariencia normal. Las biopsias se tomaron con fórceps fríos para el examen histológico, que reveló hiperplasia de células parietales y ninguna evidencia de malignidad.
Los pacientes con HDGC desarrollan el tipo difuso (o tipo poco cohesivo) de cáncer gástrico que son de naturaleza submucosa, lo que significa que solo son visibles en la superficie de la mucosa cuando han violado la mucosa mucho más tarde en el proceso de la enfermedad. Como tal, la gastrectomía total profiláctica se recomienda como la única forma confiable de prevenir un cáncer gástrico potencialmente mortal en pacientes con HDGC.
Para los pacientes menores de ~ 20 años de edad y para aquellos que deciden no realizar el tratamiento quirúrgico, la vigilancia endoscópica con endoscopias superiores seriadas es una opción alternativa. La frecuencia exacta de la vigilancia no está clara, pero la mayoría de las guías recomiendan que se realicen exámenes endoscópicos cada 6-12 meses, con un mínimo de 30 biopsias tomadas, 5 de cada una de las siguientes zonas anatómicas: prepíloro, antro, zona de transición, cuerpo, fondo de ojo y cardias. 3–5 Debe quedar claro a los pacientes que incluso con una evaluación endoscópica cuidadosa, un cáncer gástrico temprano aún puede pasarse por alto dado que los infiltrados de cáncer son pequeños y están ampliamente distribuidos. 6 Sin embargo, los estudios sugieren que los pacientes que aplazan la gastrectomía logran resultados de supervivencia similares en comparación con aquellos que se someten a gastrectomía inicial, entendiendo que la mayoría de los pacientes finalmente optan por la gastrectomía total profiláctica después del asesoramiento longitudinal. 7
Aunque este video demuestra una gastrectomía total profiláctica a través del enfoque abierto tradicional, muchos cirujanos ahora realizan este procedimiento de una manera mínimamente invasiva, ya sea por vía laparoscópica o robótica. Aunque no hay diferencias en las tasas de morbilidad o mortalidad graves, el enfoque mínimamente invasivo se asocia con menos dolor posoperatorio y, en consecuencia, una duración de la estancia hospitalaria correspondientemente más corta que el enfoque abierto.
El objetivo principal de la gastrectomía total profiláctica es extirpar toda la mucosa gástrica y, por lo tanto, eliminar el riesgo de cáncer gástrico. Como tal, la evaluación patológica de la sección congelada se realiza intraoperatoriamente para garantizar que el margen proximal de la muestra de gastrectomía demuestre 100% de mucosa escamosa esofágica y que el margen distal demuestre las glándulas de Brunner que se ven solo en el duodeno.
Para los pacientes sometidos a gastrectomía total, los colocamos en posición supina y entramos en el abdomen a través de una incisión en la línea media superior. Las superficies peritoneales y el hígado se inspeccionan cuidadosamente para detectar enfermedad metastásica. Luego bajamos el ligamento falciforme antes de colocar el retractor Thompson.
Una vez colocado el retractor, comenzamos por entrar en el saco menor a través del ligamento gastrocólico. Luego llevamos la disección hacia la izquierda, dividiendo los vasos gastroepiploicos izquierdos y todos los vasos gástricos cortos con un dispositivo de sellado de vasos (LigaSure). La disección se lleva hacia la derecha a lo largo de la curvatura mayor hacia el tronco gastrocólico. Aquí, la vena gastroepiploica derecha y la arteria se aíslan y se ligan con el LigaSure. Una vez hecho esto, la primera porción del duodeno se divide con una sola cocción de la grapadora de carga bronceada Endo-GIA de 60 mm.
La atención se dirige entonces hacia la curvatura menor. Abrimos el epiplón menor y tomamos la vena gástrica y la arteria derecha con la LigaSure. Luego dividimos el ligamento frenoesofágico y diseccionamos los 4-5 cm inferiores del esófago dentro del abdomen y dividimos ambos nervios vagos. Esto proporciona movilidad al estómago proximal y al esófago distal que, junto con la división del duodeno, permite movilizar el estómago en dirección cefálica para permitir una disección más fácil de la vena gástrica izquierda y la arteria, que dividimos con grapadoras de carga de bronceado Endo-GIA (Figura 1).

Luego se elige un sitio para la división del esófago a 1-2 cm por encima de la unión gastroesofágica. Realizamos esto con cauterio, colocando 3-0 suturas de tracción de seda en 4 cuadrantes a medida que se divide el esófago. Una vez que el esófago se ha dividido, la muestra del estómago se pasa fuera del campo y se envía para un examen de sección congelada para garantizar que no haya mucosa gástrica residual en los márgenes proximal y distal.
Dado que la gastrectomía total realizada para HDGC es profiláctica, no es necesaria una linfadenectomía D1+ o D2. Sin embargo, los ganglios linfáticos perigástricos inmediatos (que constituyen una linfadenectomía D1) se extirpan en bloque con la muestra de gastrectomía.
La esofagoyeyunostomía se realiza de manera grapada de extremo a lado con una grapadora Covidien EEA de 25 mm. Primero colocamos una sutura de cuerda de bolso PDS 3-0 en el borde cortado del esófago para asegurar el yunque de la grapadora EEA. Después de esto, creamos nuestra extremidad Roux retrocólica que mide unos 60 cm de longitud dividiendo el yeyuno ~ 30 cm distal al ligamento de Treitz. Se realiza una yeyyuyuyunostomía de dos capas, cosida a mano, de lado a lado con una capa interna de suturas PDS de espesor completo y filas externas de suturas de Lembert de seda 3-0 interrumpidas. Cerramos la trampa mesentérica con suturas de seda 3-0.
La extremidad de Roux se pasa de manera retrocólica a través de una ruptura en el mesocolon transverso a la izquierda de los vasos cólicos medios. Tenga cuidado de no torcer la extremidad de Roux a medida que avanza hacia el esófago. Luego realizamos la anastomosis de esofagoyeyunostomía con grapas cortando la línea de grapas de la extremidad de Roux y avanzando la grapadora a través de la enterotomía. La espiga se avanza por el borde antimelérico de la extremidad de Roux antes de que se case con el yunque en el esófago. Luego se dispara la grapadora y se envía la rosquilla esofágica para la evaluación final del margen. Nuestros colegas de anestesia luego avanzan una sonda nasogástrica a través de la anastomosis y hacia la extremidad de Roux. El voladizo de la extremidad de Roux se extirpa con un solo disparo de la grapadora de carga de bronceado Endo-GIA (Figura 2). Finalmente, reaproximamos el hiato esofágico con unas pocas suturas de seda 2-0 interrumpidas y aseguramos la extremidad de Roux al peritoneo del diafragma con suturas de seda 3-0 interrumpidas. La trampa mesentérica en el mesocolon transversal también se cierra con suturas de seda 3-0 interrumpidas.
En centros de referencia experimentados, la gastrectomía total se puede realizar con una morbilidad y mortalidad mínimas. En una reciente revisión retrospectiva de 148 pacientes sometidos a gastrectomía total en nuestra institución, las tasas de morbilidad y mortalidad mayor a 90 días fueron de 14% y 3%, respectivamente. La mediana de estancia fue de 8 días, y la tasa de readmisión fue del 22%, principalmente secundaria a deshidratación o compromiso nutricional. 8 El paciente en este caso tuvo un curso hospitalario sin complicaciones. Se sometió a un estudio de deglución digestiva superior el día 2 postoperatorio, que fue negativo para una fuga anastomótica, y fue dada de alta a casa con una dieta líquida completa el día 3 postoperatorio.
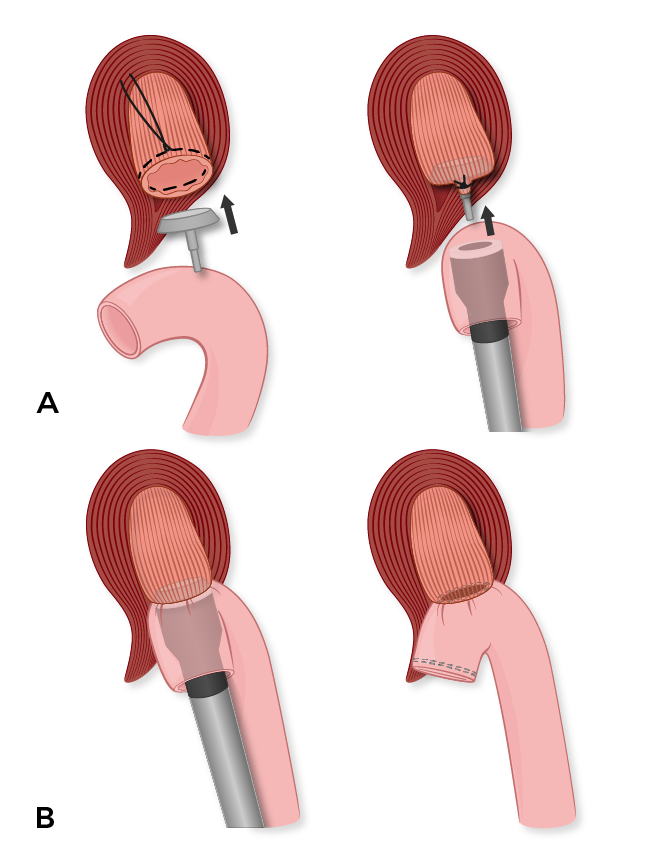
Un. El yunque se cose en el extremo proximal, que es la línea de transección del esófago, que sirve como extremo receptor. La grapadora EEE se introduce a través de la abertura de la línea de grapas de la extremidad yeyunal de Roux, y se clava en el borde antimelérico, sirviendo como extremo de inserción.
B. El yunque y la grapadora EEA se casan antes de ser despedidos, creando una esofagoyeyunostomía de extremo a lado. El borde cortado de la extremidad yeyunal Roux se extirpa con una grapadora Endo-GIA.
GASTRECTOMÍA TOTAL:
Adenocarcinoma multifocal, tipo poco cohesivo, confinado a la lámina propia (ver informe sinóptico). No hay evidencia de neoplasia maligna en nueve ganglios linfáticos (0/9).
MARGEN FINAL DEL ESÓFAGO:
Segmento de esófago sin anomalía diagnóstica reconocida. No hay evidencia de malignidad.
RESUMEN DEL ESTADIO TUMORAL: m p T1a N0.
TAMAÑO DEL TUMOR (mayor dimensión): hasta 0,1 cm (ver comentario).
CLASIFICACIÓN DE LA OMS: Carcinoma poco cohesivo (incluye carcinoma de células en anillo de sello y variantes).
GRADO HISTOLÓGICO: G3 (Pobremente diferenciado).
EXTENSIÓN DE LA INVASIÓN: El tumor invade la lámina propia solamente.
TUMOR PRIMARIO: pT1a (tumor que invade la lámina propia o muscularis mucosae).
INVASIÓN DE VASOS PEQUEÑOS (SANGRE/LINFÁTICOS): Ausente.
INVASIÓN DE GRANDES BUQUES (VENOSOS): Ausente.
INVASIÓN PERINEURAL: Ausente.
MARGEN ESOFÁGICO PROXIMAL: Esófago revestido de escamoso, no afectado por carcinoma invasivo (parte B).
MARGEN DUODENAL DISTAL: No afectado por carcinoma invasivo.
GANGLIOS LINFÁTICOS REGIONALES: pN0 (Sin metástasis en los ganglios linfáticos regionales): Número de ganglios linfáticos examinados: 9.
Un sistema de autorretracción como un retractor quirúrgico Bookwalter, Thompson u Omni puede facilitar enormemente la exposición durante toda la operación. Un dispositivo LigaSure puede facilitar una disección hemostática eficiente y permitir la división incluso de los principales pedículos vasculares, como el pedículo gastroepiploico derecho, sin necesidad de ataduras o grapadoras. Tanto el duodeno como el yeyuno se dividen con una grapadora de carga de bronceado Endo-GIA con tecnología de triple grapas (0,95-1,12 mm de altura de grapa), y la esofagoyeyunostomía se realiza con una grapadora Covidien EEA de 25 mm (altura de grapa de 4,8 mm).
Nada que revelar.
La paciente a la que se hace referencia en este artículo de video ha dado su consentimiento informado para ser filmada y es consciente de que la información y las imágenes se publicarán en línea.
References
- Sociedad Americana de Oncología Clínica. Cáncer gástrico difuso hereditario. Publicado el 25 de junio de 2012. Último acceso: 11 de diciembre de 2021. https://www.cancer.net/cancer-types/hereditary-diffuse-gastric-cancer
- Hansford S, Kaurah P, Li-Chang H, et al. Síndrome de cáncer gástrico difuso hereditario: mutaciones CDH1 y más allá. JAMA Oncol. 2015;1(1):23-32. doi:10.1001/jamaoncol.2014.168.
- Blair VR, McLeod M, Carneiro F, et al. Cáncer gástrico difuso hereditario: guías actualizadas de práctica clínica. Lanceta Oncol. 2020;21(8):E386-E397. doi:10.1016/S1470-2045(20)30219-9.
- Lim YC, di Pietro M, O'Donovan M, et al. Estudio de cohorte prospectivo que evalúa los resultados de pacientes de familias que cumplen los criterios de cáncer gástrico difuso hereditario sometidos a vigilancia endoscópica. Gastrointest Endosc. 2014;80(1):78-87. doi:10.1016/j.gie.2013.11.040.
- Fitzgerald RC, Hardwick R, Huntsman D, et al. Cáncer gástrico difuso hereditario: guías de consenso actualizadas para el tratamiento clínico y direcciones para futuras investigaciones. J Med Genet. 2010;47(7):436-444. doi:10.1136/jmg.2009.074237.
- Cisco RM, Ford JM, Norton JA. Cáncer gástrico difuso hereditario: implicaciones de las pruebas genéticas para la detección y la cirugía profiláctica. Cáncer. 2008;113(7 Suppl):1850-1856. DOI:10.1002/CNCR.23650.
- Friedman M, Adar T, Patel D, Lauwers GY, Yoon SS, Mullen JT, Chung DC. Endoscopia de vigilancia en el manejo del síndrome de cáncer gástrico difuso hereditario. Clin Gastroenterol Hepatol. 2021;19(1):189-191. doi:10.1016/j.cgh.2019.10.033.
- Li SS, Costantino CL, Mullen JT. Morbilidad y mortalidad de la gastrectomía total: un análisis exhaustivo de los resultados de 90 días. J Gastrointest Surg. 2019;23(7):1340-1348. doi:10.1007/s11605-019-04228-7.


.jpg&w=3840&q=75&dpl=dpl_HJYYCySDPY2KETmGE5V29rKLg7oJ)