Prophylaktische totale Gastrektomie bei CDH1-Genmutation
Main Text
Table of Contents
Das hereditäre diffuse Magenkrebssyndrom (HDGC) ist auf eine Mutation im CDH1-Gen zurückzuführen, die Patienten für ein hohes lebenslanges Risiko prädisponiert, an Magenkrebs zu erkranken. Daher wird eine totale Gastrektomie typischerweise für Patienten mit diesem Syndrom empfohlen. In diesem Fall präsentierte sich die Patientin mit einer zufällig entdeckten CDH1-Mutation bei Gentests, die nach der Diagnose eines früh einsetzenden Rektumkarzinoms erhalten wurde. Sie unterzog sich einer prophylaktischen totalen Gastrektomie mit einer retrokolischen Roux-en-Y-Ösophagojejunostomie. Ihr postoperativer Verlauf war unauffällig und sie wurde am postoperativen Tag 3 entlassen. Ihre Pathologie zeigte mehrere Herde von Siegelringzellkarzinomen, die auf die Schleimhaut beschränkt waren. Dieses Video zeigt die Technik eines erfahrenen Chirurgen zur Durchführung einer prophylaktischen totalen Gastrektomie mit einer Roux-en-Y-Ösophagojejunostomierekonstruktion.
Das hereditäre diffuse Magenkrebssyndrom (HDGC) ist eine autosomal-dominante genetische Erkrankung aufgrund einer Mutation im CDH1-Gen. Es ist eine seltene Erkrankung, die nur für 1-3% aller Magenkrebserkrankungen verantwortlich ist. Patienten mit dieser Erkrankung haben jedoch ein Lebenszeitrisiko von 56-83%, an Magenkrebs zu erkranken, und werden oft vor dem 40. Lebensjahr diagnostiziert. 1,2 Frauen haben auch ein hohes Risiko, ein lobuläres Mammakarzinom zu entwickeln. Angesichts des signifikanten Risikos, im Laufe ihres Lebens an Magenkrebs zu erkranken, wird eine prophylaktische totale Gastrektomie für Patienten empfohlen, bei denen bei Gentests eine CDH1-Mutation festgestellt wurde.
Die Patientin ist eine 39-jährige Frau mit einer Vorgeschichte von Rektumkrebs vor vielen Jahren, für die sie erfolgreich behandelt wurde und anschließende Gentests hatte, die eine Keimbahnmutation im CDH1-Gen ergaben.
Ihre Bauchuntersuchung ist nur für gut verheilte Schnitte aus ihrer vorherigen Operation (niedrige vordere Resektion und ablenkende Ileostomie) von Bedeutung.
Der Patient unterzog sich einer oberen Endoskopie, die einen normal aussehenden Magen zeigte. Biopsien wurden mit einer kalten Pinzette zur histologischen Untersuchung entnommen, die eine parietale Zellhyperplasie und keine Anzeichen von Malignität ergab.
Patienten mit HDGC entwickeln den diffusen Typ (oder schlecht kohäsiven Typ) von Magenkrebs, der submuköser Natur ist, was bedeutet, dass sie nur auf der Schleimhautoberfläche sichtbar sind, wenn sie die Schleimhaut viel später im Krankheitsprozess verletzt haben. Daher wird eine prophylaktische totale Gastrektomie als einzige zuverlässige Methode zur Vorbeugung eines potenziell tödlichen Magenkrebses bei Patienten mit HDGC empfohlen.
Für Patienten, die jünger als ~20 Jahre sind und für diejenigen, die sich gegen eine operative Behandlung entscheiden, ist die endoskopische Überwachung mit seriellen oberen Endoskopien eine alternative Option. Die genaue Häufigkeit der Überwachung ist unklar, aber die meisten Richtlinien empfehlen, endoskopische Untersuchungen alle 6-12 Monate durchzuführen, wobei mindestens 30 Biopsien entnommen werden, 5 aus jeder der folgenden anatomischen Zonen: Prepylorus, Antrum, Übergangszone, Körper, Fundus und Kardia. 3–5 Den Patienten sollte klar gemacht werden, dass selbst bei sorgfältiger endoskopischer Abklärung ein früher Magenkrebs noch übersehen werden kann, da die Krebsinfiltrate klein und weit verbreitet sind. 6 Studien deuten jedoch darauf hin, dass Patienten, die die Gastrektomie aufschieben, ähnliche Überlebensergebnisse erzielen wie diejenigen, die sich einer Vor-Gastrektomie unterziehen, wobei sie verstehen, dass sich die meisten Patienten nach longitudinaler Beratung schließlich für eine prophylaktische Totalgastrektomie entscheiden. 7
Obwohl dieses Video eine prophylaktische totale Gastrektomie über den traditionellen offenen Ansatz zeigt, führen viele Chirurgen diesen Eingriff jetzt minimalinvasiv durch, entweder laparoskopisch oder robotisch. Obwohl es keine Unterschiede in den Raten schwerer Morbidität oder Mortalität gibt, ist der minimalinvasive Ansatz mit weniger postoperativen Schmerzen und einer entsprechend kürzeren Verweildauer verbunden als der offene Ansatz.
Das primäre Ziel der prophylaktischen Totalmagenmage ist es, die gesamte Magenschleimhaut zu entfernen und dadurch das Risiko von Magenkrebs zu beseitigen. Daher wird intraoperativ eine pathologische Untersuchung des gefrorenen Abschnitts durchgeführt, um sicherzustellen, dass der proximale Rand der Gastrektomieprobe 100% Plattenepithelschleimhaut der Speiseröhre aufweist und dass der distale Rand die Brunner-Drüsen nur im Zwölffingerdarm zeigt.
Bei Patienten, die sich einer totalen Gastrektomie unterziehen, bringen wir sie in Rückenlage und gelangen über einen oberen Mittellinienschnitt in den Bauch. Die Peritonealoberflächen und die Leber werden sorgfältig auf metastasierende Erkrankungen untersucht. Wir entfernen dann das falciforme Band, bevor wir den Thompson-Retraktor einsetzen.
Sobald der Retraktor platziert wurde, beginnen wir mit dem Eintritt in den kleinen Sack durch das gastrokolische Band. Wir tragen dann die Dissektion nach links und trennen die linken gastroepiploischen Gefäße und alle kurzen Magengefäße mit einer Gefäßversiegelungsvorrichtung (LigaSure). Die Dissektion wird dann entlang der größeren Krümmung nach rechts in Richtung des gastrokolischen Stammes geführt. Hier werden die rechte gastroepiploische Vene und Arterie isoliert und mit dem LigaSure ligiert. Sobald dies geschehen ist, wird der erste Teil des Zwölffingerdarms mit einem einzigen Zünden des Endo-GIA 60-mm-Hefters geteilt.
Die Aufmerksamkeit richtet sich dann auf die geringere Krümmung. Wir öffnen das kleinere Omentum und nehmen mit dem LigaSure die richtige Magenvene und Arterie. Wir teilen dann das Ligamentum phrenoösophagealis und sezieren die unteren 4-5 cm der Speiseröhre im Bauchraum und teilen beide Vagusnerven. Dies ermöglicht die Beweglichkeit des proximalen Magens und der distalen Speiseröhre, die zusammen mit der Teilung des Zwölffingerdarms die Mobilisierung des Magens in Richtung des Kopfhaldes ermöglicht, um eine leichtere Dissektion der linken Magenvene und Arterie zu ermöglichen, die wir mit Endo-GIA tan load staplern teilen (Abbildung 1).

Ein Ort für die Teilung der Speiseröhre wird dann 1–2 cm über dem gastroösophagealen Übergang gewählt. Wir führen dies mit Kauterisation durch und platzieren 3-0 Seidenzugnähte in 4 Quadranten, während die Speiseröhre geteilt wird. Sobald die Speiseröhre geteilt wurde, wird die Magenprobe vom Feld geleitet und zur gefrorenen Schnittuntersuchung geschickt, um sicherzustellen, dass an den proximalen und distalen Rändern keine Magenschleimhaut vorhanden ist.
Da die gesamte bei HDGC durchgeführte Gastrektomie prophylaktisch ist, ist eine D1+- oder D2-Lymphadenektomie nicht notwendig. Die unmittelbaren perigastrischen Lymphknoten (die eine D1-Lymphadenektomie darstellen) werden jedoch en bloc mit der Gastrektomieprobe entfernt.
Die Ösophagojejunostomie wird in einer End-to-Side-Heftung mit einem 25-mm-Covidien-EEA-Hefter durchgeführt. Wir platzieren zunächst eine 3-0 PDS Geldbörse Schnurnaht in der Schnittkante der Speiseröhre, um den Amboss des EWR-Hefters zu sichern. Danach erstellen wir unser retrokolisches Roux-Glied mit einer Länge von etwa 60 cm, indem wir das Jejunum ~ 30 cm distal zum Band von Treitz teilen. Eine zweilagige, handgenähte, seitliche Jejunojejunostomie wird mit einer inneren Schicht aus laufenden, volldicken PDS-Nähten und äußeren Reihen unterbrochener 3-0-Seiden-Lembert-Nähte durchgeführt. Wir schließen die Mesenterialfalle mit 3-0 Seidennähten.
Das Roux-Glied wird retrokolisch durch einen Riss im transversalen Mesokolon links von den mittleren Kolikgefäßen geführt. Achten Sie darauf, das Roux-Glied nicht zu verdrehen, wenn es zur Speiseröhre vorgeschoben wird. Wir führen dann die geklammerte Ösophagojejunostomie-Anastomose durch, indem wir die Klammerlinie von der Roux-Extremität abschneiden und den Hefter durch die Enterotomie vorantreiben. Der Dorn wird dann aus dem antimesenterischen Rand des Roux-Gliedes herausgeschoben, bevor er mit dem Amboss in der Speiseröhre verheiratet wird. Der Hefter wird dann abgefeuert und der Ösophagusdonut wird zur endgültigen Randbewertung geschickt. Unsere Anästhesiekollegen führen dann eine Nasensonde durch die Anastomose in die Roux-Extremität. Der Überhang am Roux-Glied wird dann mit einem einzigen Zünden des Endo-GIA tan Lasthefters herausgeschnitten (Abbildung 2). Schließlich nähern wir uns dem Ösophagushiatus mit einigen unterbrochenen 2-0-Seidennähten an und sichern das Roux-Glied mit unterbrochenen 3-0-Seidennähten am Peritoneum des Zwerchfells. Die mesenteriale Falle am transversalen Mesokolon wird ebenfalls mit unterbrochenen 3-0-Seidennähten geschlossen.
In erfahrenen Überweisungszentren kann die totale Gastrektomie mit minimaler Morbidität und Mortalität durchgeführt werden. In einer kürzlich durchgeführten retrospektiven Überprüfung von 148 Patienten, die sich einer totalen Gastrektomie in unserer Einrichtung unterzogen, betrugen die 90-Tage-Hauptmorbiditäts- und Mortalitätsraten 14% bzw. 3%. Die mediane Aufenthaltsdauer betrug 8 Tage und die Rückübernahmerate betrug 22%, hauptsächlich sekundär zu Dehydrierung oder Ernährungskompromissen. 8 Der Patient hatte in diesem Fall einen unkomplizierten Krankenhausverlauf. Sie unterzog sich am postoperativen Tag 2 einer Studie zum oberen GI-Schlucken, die negativ für ein anastomotisches Leck war, und sie wurde am postoperativen Tag 3 mit einer vollständigen flüssigen Diät nach Hause entlassen.
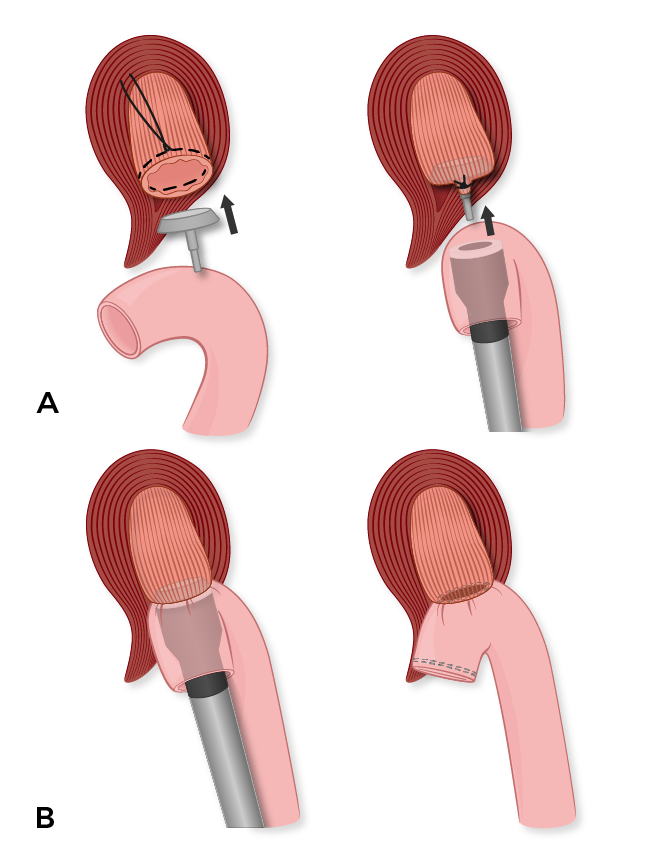
Ein. Der Amboss ist auf das proximale Ende genäht, das ist die Ösophagus-Transektionslinie, die als Empfangsende dient. Der EEA-Hefter wird durch die Klammerlinienöffnung des jejunalen Roux-Gliedes eingeführt und an der antimesenterischen Grenze ausgestochen und dient als einführendes Ende.
B. Der Amboss und der EEA-Hefter werden geheiratet, bevor sie gefeuert werden, wodurch eine End-to-Side-Ösophagojejunostomie entsteht. Die Schnittkante des jejunalen Roux-Gliedes wird dann mit einem Endo-GIA-Hefter herausgeschnitten.
TOTALE GASTREKTOMIE:
Multifokales Adenokarzinom, schlecht kohäsiver Typ, beschränkt auf die Lamina propria (siehe synoptischer Bericht). Es gibt keine Hinweise auf Malignität in neun Lymphknoten (0/9).
LETZTER ÖSOPHAGUSRAND:
Segment der Speiseröhre ohne erkannte diagnostische Anomalie. Es gibt keine Hinweise auf Malignität.
TUMORSTADIUM ZUSAMMENFASSUNG: m p T1a N0.
TUMORGRÖSSE (größte Dimension): bis zu 0,1 cm (siehe Kommentar).
WHO-KLASSIFIKATION: Schlecht kohäsives Karzinom (einschließlich Siegelringzellkarzinom und Varianten).
HISTOLOGISCHER GRAD: G3 (schlecht differenziert).
AUSMASS DER INVASION: Tumor dringt nur in Lamina propria ein.
PRIMÄRTUMOR: pT1a (Tumor dringt in Lamina propria oder Muscularis mucosae ein).
INVASION KLEINER GEFÄSSE (BLUT/LYMPHATISCH): Fehlt.
GROSSE (VENÖSE) INVASION: Abwesend.
PERINEURALE INVASION: Abwesend.
PROXIMALER ÖSOPHAGUSRAND: Plattenepithelausgekleidete Speiseröhre, nicht durch invasives Karzinom beteiligt (Teil B).
DISTALER ZWÖLFFINGERDARMRAND: Nicht am invasiven Karzinom beteiligt.
REGIONALE LYMPHKNOTEN: pN0 (keine regionale Lymphknotenmetastasierung): Anzahl der untersuchten Lymphknoten: 9.
Ein Selbstrückzugssystem wie ein Bookwalter-, Thompson- oder Omni-chirurgischer Retraktor kann die Exposition während der gesamten Operation erheblich erleichtern. Ein LigaSure-Gerät kann eine effiziente, hämostatische Dissektion ermöglichen und die Teilung selbst wichtiger Gefäßstiele wie des rechten gastroepiploischen Stiels ermöglichen, ohne dass Krawatten oder Hefter erforderlich sind. Sowohl der Zwölffingerdarm als auch das Jejunum werden mit einem Endo-GIA-Hefter mit Tri-Stapel-Technologie (0,95-1,12 mm Klammerhöhe) geteilt, und die Ösophagojejunostomie wird mit einem 25-mm-Covidien-EEA-Hefter (4,8 mm Klammerhöhe) durchgeführt.
Nichts zu enthüllen.
Die in diesem Videoartikel erwähnte Patientin hat ihre informierte Einwilligung zum Filmen gegeben und ist sich bewusst, dass Informationen und Bilder online veröffentlicht werden.
References
- Amerikanische Gesellschaft für klinische Onkologie. Hereditärer diffuser Magenkrebs. Veröffentlicht am 25. Juni 2012. Abgerufen am 11. Dezember 2021. https://www.cancer.net/cancer-types/hereditary-diffuse-gastric-cancer
- Hansford S, Kaurah P, Li-Chang H, et al. Hereditäres diffuses Magenkrebssyndrom: CDH1-Mutationen und darüber hinaus. JAMA Oncol. 2015;1(1):23-32. doi:10.1001/jamaoncol.2014.168.
- Blair VR, McLeod M, Carneiro F, et al. Hereditärer diffuser Magenkrebs: aktualisierte Leitlinien für die klinische Praxis. Lancet Oncol. 2020;21(8):e386-e397. doi:10.1016/S1470-2045(20)30219-9.
- Lim YC, di Pietro M, O'Donovan M, et al. Prospektive Kohortenstudie zur Beurteilung der Ergebnisse von Patienten aus Familien, die die Kriterien für erblichen diffusen Magenkrebs erfüllen und einer endoskopischen Überwachung unterzogen werden. Gastrointest Endosc. 2014;80(1):78-87. doi:10.1016/j.gie.2013.11.040.
- Fitzgerald RC, Hardwick R, Huntsman D, et al. Hereditärer diffuser Magenkrebs: aktualisierte Konsensusrichtlinien für das klinische Management und Richtungen für zukünftige Forschung. J Med Genet. 2010;47(7):436-444. doi:10.1136/jmg.2009.074237.
- Cisco RM, Ford JM, Norton JA. Hereditärer diffuser Magenkrebs: Implikationen von Gentests für Screening und prophylaktische Chirurgie. Krebs. 2008;113(7 Suppl):1850-1856. doi:10.1002/cncr.23650.
- Friedman M, Adar T, Patel D, Lauwers GY, Yoon SS, Mullen JT, Chung DC. Surveillancoskopie bei der Behandlung des hereditären diffusen Magenkrebssyndroms. Clin Gastroenterol Hepatol. 2021;19(1):189-191. doi:10.1016/j.cgh.2019.10.033.
- Li SS, Costantino CL, Mullen JT. Morbidität und Mortalität der totalen Gastrektomie: eine umfassende Analyse der 90-Tage-Ergebnisse. J Gastrointest Surg. 2019;23(7):1340-1348. doi:10.1007/s11605-019-04228-7.


.jpg&w=3840&q=75&dpl=dpl_Ca7gcJXjbQN6bK8aruk8U4KsAWv7)