预防性腹腔镜双侧性腺切除术治疗完全性雄激素不敏感综合征
1; 2; 3; 3; 2; 4
1Department of Urology, University of Arkansas for Medical Sciences
2Department of Pathology, University of Arkansas for Medical Sciences / Arkansas Children’s Hospital
3Department of Obstetrics and Gynecology, University of Arkansas for Medical Sciences
4Department of Pediatric Urology, Arkansas Children’s Hospital
Main Text
雄激素不敏感综合征 (AIS) 是一种由雄激素受体 X 连锁突变引起的罕见疾病,估计发病率为每 100,000 人 1-5 人。完全性、部分性或轻度存在不同程度的表现,具体取决于雄激素抵抗的严重程度。完全性 AIS (CAIS) 患者出生时表型为女性,但具有男性 XY 染色体和睾丸,而不是卵巢。它们表现出正常的第二性征,例如乳房发育和女性外生殖器,但由于睾丸产生苗勒管抑制因子 (MIF),它们缺乏子宫和其他苗勒管结构。由于雄激素耐药,雄激素依赖性 Wolffian 导管产物无法发育,例如附睾、输精管和精囊。这些患者通常在婴儿期出现腹股沟疝或唇下肿块,或在青春期出现原发性闭经。体格检查时,他们的乳房发育通常正常,没有或腋毛,并且会有一个阴道长度不同的盲端阴道袋。诊断性病情检查通常使用超声或 MRI、血清激素水平和核型分析进行。
对于 CAIS 患者,他们的睾丸可以位于腹股沟管内、唇下或腹腔内。青春期后,腹腔内睾丸患者患生殖细胞瘤 (GCT) 的风险增加 15%(范围 0-22%)。治疗包括预防性性腺切除术和随后的激素替代疗法 (HRT),以维持正常的青春期发育并促进足够的骨骼健康。关于预防性性腺切除术时间的争论仍在进行中,一些患者支持团体反对性腺切除术,理由是担心长期激素治疗和保持生育能力的愿望。目前的惯例提倡将性腺切除术推迟到生理青春期实现之后,因为发生青春期前 GCT 的风险相对较低 (0.8-2%)。我们概述了通过双侧腹腔镜性腺切除术治疗 CAIS 的表现、诊断、术中技术和术后注意事项。
由于性腺恶性肿瘤的风险增加,性发育差异 (DSD) 携带 Y 染色体性腺的儿童可能需要进行性腺切除术。1 其中一种 DSD 是雄激素不敏感综合征 (AIS),它是由雄激素受体 (AR) 的 X 连锁突变引起的。2 AIS 是一种罕见的诊断,估计发病率为每 100,000 人 1-5 人。3 AIS 根据雄激素耐药的严重程度,可有不同程度的表现,范围从完全 (CAIS)、部分 (PAIS) 和轻度 (MAIS)。4 患有 CAIS 的儿童在外观上是女性,女性外生殖器正常,但有睾丸而不是卵巢,并且具有男性核型 (46, XY)。在这些患者中,他们的睾丸能够产生睾酮,但由于 AR 功能的缺陷,无法产生 Wolffian 导管产物,例如附睾、输精管和精囊。由于这种睾酮外周芳构化为雌激素,这些患者具有正常的第二性女性性别特征,例如乳房发育。然而,睾丸的支持细胞继续产生苗勒管抑制因子 (MIF),从而抑制苗勒管衍生物的发育。这导致患者出现盲端阴道袋,没有其他女性性器官,如子宫、宫颈和输卵管。5 在这些患者中,睾丸可以位于腹股沟管内、唇下或腹腔内。6 雄激素不敏感的婴儿可能表现为单侧或双侧腹股沟疝或唇肿块。据估计,女孩中 1-2% 的双侧腹股沟疝可能代表 CAIS 诊断,在评估过程中保持强烈的临床怀疑很重要。7 通常,CAIS 在青春期表现为乳房发育正常但检查时几乎没有或腋毛的女孩的原发性闭经。CAIS 与睾丸发育异常以及青春期后生殖细胞恶性肿瘤风险增加有关。8
该患者是一名 15 岁的亚裔女性,既往有病态肥胖(BMI 为 45)、CPAP 阻塞性睡眠呼吸暂停和糖尿病前期(HbA1c 为 5.5)的病史,目前正在服用二甲双胍。她小时候有双侧腹股沟疝修补术的既往手术史。她没有以前的怀孕史,没有性生活,并被转诊到我们的诊所进一步评估原发性闭经。她报告说,她在 11 岁时患上了睑板,但腋毛和稀疏,没有痤疮的迹象。此外,她否认任何疼痛、阴道分泌物、多毛症或溢乳。在室外诊所,我们的患者否认在孕激素激发后出血,并且在之前的盆腔检查中没有触及宫颈。
根据患者的家族史,她有三个姐姐,年龄分别为 19 岁、21 岁和 26 岁。她的母亲从 14 岁开始月经。她 26 岁和 19 岁的姐妹也报告说,月经规律从 11 岁左右开始,最大的姐姐有四个健康的孩子。有趣的是,她 21 岁的姐姐也被一位外州医生看过,以评估病因不明的原发性闭经。她被告知她的阴道裂孔不足以分娩,并被转介给专家进行进一步评估,但失访。
体格检查发现,患者肥胖,乳房发育为 Tanner 5 期,腋毛稀疏,无痤疮迹象。泌尿生殖系统检查显示,患者女性外生殖器正常,稀疏。阴道外观正常,无异常分泌物,阴道袋呈盲端。我们无法在检查中看到或触及子宫颈或子宫。对于潜在的先天性异常,检查结果一致。然后订购了适当的实验室和影像学检查。
实验室结果:
| 测试 | 结果 | 参考 |
| 乙型人绒毛膜促性腺激素 | 阴性 | 阴性 |
| 促卵泡激素 | 13.20 毫米单位/毫升 | 5–20 mIU/mL |
| LH 系列 | 22.20 毫 IU/毫升 | 5–20 mIU/mL |
| 泌乳刺激素 | 8.1 纳克/毫升 | 3.0–18.6 纳克/毫升 |
| 雌二醇 | 38.33 pg/mL |
34–170 pg/mL (女性 Tanner Stage 5) |
| 睾酮 | 269 纳克/分升 |
20–38 纳克/分升 (女性 Tanner Stage 5) |
| 促甲状腺激素 | 1.94 毫国际单位/升 | 0.47–4.68 mIU/L |
| 染色体分析 | 46、XY |
女性:46 岁,XX 岁 男:46 岁,XY |
最初的实验室被抽取来评估与下丘脑-垂体-卵巢 (HPO) 轴相关的问题,例如促卵泡激素 (FSH)、黄体生成素 (LH)、催乳素和睾酮。此外,进行了尿液 β-hCG 以排除妊娠。我们患者的实验室显示,与正常女性患者相比,她的睾丸激素水平升高。此外,我们患者的核型分析得出 46 条 XY 染色体。总之,这些发现与 CAIS 的诊断一致,其中睾酮水平升高 (女性范围异常,但男性范围正常) 和高血清 LH 水平是由于垂体前叶雄激素负反馈受损。
命令通过盆腔超声进行成像,以评估子宫和其他女性性器官的存在与否。在一家外部医院进行的超声成像显示没有子宫、输卵管和子宫颈。此外,影像学检查显示没有卵巢,无法准确评估潜在腹腔内睾丸的位置。超声可能依赖于作者,MRI 被广泛认为是腹腔镜性腺切除术和性腺监测手术计划中诊断和定位性腺的金标准。5
Wisniewski 等人 的一项研究检查了 14 名在性腺切除术后接受长期激素替代疗法 (HRT) 的 CAIS 女性的长期结局。9 他们发现,总体而言,这些女性可以预期具有正常的积极寿命。这些女性中的大多数超过了正常成年女性的身高第 90 个百分位,9 使她们比普通女性高,但仍比正常男性矮。10 这些女性中最常见的疾病是骨质疏松症。大多数女性认为自己具有异性恋女性性别认同,但没有人希望进行性别逆转手术。大多数人报告说对他们的性功能感到满意。该队列的平均阴道长度为 8.8 厘米,这与正常阴道长度在 7-11 厘米之间一致。
目前,没有疗法可以逆转 CAIS 患者 AR 的潜在基因突变。因此,治疗的重点是预防性腺切除术,以防止潜在的性腺恶性肿瘤并随后进行 HRT,如果需要,治疗泌尿生殖道,以及心理支持。性腺切除术通常推迟到青春期性成熟完成,以允许正常的自发青春期发育。3 如果在婴儿期或儿童期早期诊断出,如果儿童出现疼痛或不舒服的腹股沟或唇肿块,可以考虑早期性腺切除术,但需要随后的 HRT 才能在大约 11-12 岁时诱导青春期。3 性腺切除术的时机已引起争议,一些患者和 AIS 支持团体倡导保留睾丸。这些支持团体引用了保留睾丸的各种原因,例如心理因素、与手术相关的风险、可能保留生育能力的愿望以及不愿意坚持长期 HRT。然而,腹腔镜性腺切除术的报道风险非常低,估计每 1000 例手术中有 0.1 例死亡,据报道肠道损伤或出血的风险为 2.4%。11 此外,Hannema 等人的一项研究检查了 44 名 CAIS 患者的睾丸,发现生殖细胞数量在出生后第一年后迅速下降,并且没有发现任何睾丸发生精子的证据,这使得 CAIS 患者极不可能生育。12 对于决定保留睾丸的 CAIS 患者,据报道,患生殖细胞瘤 (GCT) 的风险随着年龄的增长而增加。11 重要的是通过利用定期成像(超声和/或 MRI)和血清血液标志物来筛查这些患者 GCT 的潜在发展,通过主动监测来保持密切随访。13 虽然 MRI 可以检测到良性变化,例如睾丸旁囊肿和腺瘤,但它们无法检测到癌前病变,例如原位生殖细胞瘤变 (GCNIS),这需要对性腺进行活检。14 此外,超声筛查的质量通常取决于作者。Wunsch 等人 为希望保留睾丸的患者提出的一种方法是进行腹腔镜性腺活检,并通过手术固定腹壁附近的腹腔内性腺,以便通过超声更好地观察。15
在 CAIS 的情况下进行性腺切除术的主要目标是降低未来恶性肿瘤的风险。与其他形式的隐睾症一样,患 GCT 的风险增加。在 CAIS 中,这些患者患青春期前 GCT 的风险被认为非常低,范围为 0.8-2.0%。16 青春期后,这种风险随着年龄的增长而增加,估计约为 15%(范围为 0-22%)。11 人们提倡预防性性腺切除术发生在青春期后,此时女性化部分由睾丸雌激素完成,睾丸雌激素部分来自雄激素向雌激素的转化。3、8 将性腺切除术推迟到青春期后期也允许护理提供者直接从患者那里获得知情同意。
在评估 HPO 轴仍未成熟的儿童时,需要进行 hCG 刺激试验以正确评估 Leydig 细胞睾酮分泌。17 性腺切除术后,这些患者将需要长期激素补充疗法和雌激素替代治疗,直到自然绝经年龄(约 50-52 岁),以维持正常的乳房和骨骼发育、社会心理健康和性功能。18 因为这些患者没有子宫,所以不需要孕激素来补充雌激素治疗。17 这些患者将继续保持正常的第二性征,并且可以获得正常的性功能,但可能需要阴道扩张疗法或阴道成形术,具体取决于其阴道管的充足性。17 不孕症和性别认同的问题会对这些患者产生严重的社会心理影响,强烈建议提供咨询或支持团体治疗作为多学科方法的一部分。9
CAIS(以前称为 Morris 综合征)是 46 XY DSD 最常见的可定义原因之一。它是由 AR 的一种罕见的 X 连锁突变引起的,导致外周雄激素耐药。这些患者出生时为表型女性,女性外生殖器正常。通常,这些患者在青春期出现原发性闭经,随后的检查会发现这些患者有一个盲端阴道袋,影像学上没有女性内部性器官。这些患者的睾丸可能位于腹部、腹股沟管或阴唇,而不是卵巢。在儿童或婴儿中,CAIS 可能表现为腹股沟疝或肿块,其中大约 1-2% 的腹股沟疝女婴被发现患有 46,XY 核型隐睾症。7 在这个特定案例中,我们的患者在幼儿时期有双侧腹股沟疝修补术的既往手术史。这表明漏诊或延迟诊断,并强调了对表现为双侧腹股沟疝的儿科女性患者保持对 CAIS 的强烈临床怀疑的重要性,这需要进一步检查以排除隐睾症。
AIS 患者发生 GCT 的估计风险与雄激素耐药程度成反比。CAIS 患者的 AR 突变更严重,提示功能完全丧失。如果没有雄激素刺激,精子发生就会受损,并且在出生后第一年后生殖细胞数量会迅速下降,理论上可以降低以后患 GCT 的风险。14 这与 PAIS 患者形成鲜明对比,PAIS 患者仍然保留一定程度的 AR 功能,因此更有可能拥有存活的生殖细胞,这随后使他们在成年后患 GCT 的风险增加。19 从历史上看,Manuel 等人 报告了 25 岁以下含 Y 的 DSD 患者发生 GCT 的累积风险为 3.6%,到 50 岁时增加到 33%。20 最近,Deans 等人 在他们的评论中发现,CAIS 患者在成年后患性腺恶性肿瘤的风险增加了 15%(范围 0-22%)。11 Cools 等人 发现,CAIS 患者在青春期前患 GCT 的估计风险要低得多,为 0.8-2%。16
由于 CAIS 患者成年后患性腺恶性肿瘤的风险增加,目前的建议是在性成熟完成后进行性腺切除术,通常在 15-16 岁左右,因为青春期前患肿瘤的风险被认为相对较低。21 由于睾丸产生生理激素,随后外周雄激素转化为雌激素,这种方法允许在青春期自发地发育乳房和更好的骨矿化。3、8从历史上看,剖腹手术和双侧性腺切除术对含有 DSD 的 Y 染色体患者进行。随着时间的推移,腹腔镜手术在 DSD 患者中被广泛采用,因为腹腔镜手术具有放大和通过微创方法易于进入盆腔的相关优势,从而缩短了术后恢复和住院时间,并改善了美观性。22 元、23 元
腹腔镜性腺切除术是在患者接受全身麻醉时通过气管插管进行的。视频监视器、吹气器和光源位于患者脚部。在这种情况下,使用开腹腔镜技术进行腹部吹入,其中在脐下部做一个半月切口,并使用止血器抬高筋膜。然后将 Veress 针头放入腹部,并使用盐水滴剂试验确认其正确位置。然后经脐部插入 10 mm Step 套管针,并使用 CO2 获得气腹。然后将 0o 腹腔镜引入腹部。在左右两侧的脐部水平放置了两个额外的 5 毫米工作器械套管针。然后将患者置于特伦德伦伯卧位,这样可以更轻松地进行腹腔镜骨盆检查,以确定性腺的位置并检查盆腔器官。当性腺不明显时,识别并跟踪性腺血管可以帮助定位它们。1
在腹腔镜检查期间,我们患者的性腺在双侧闭合的内环上方被发现。在双侧睾丸上明显可见囊肿。输精管穿过尿道,骨盆内没有任何苗勒管结构的证据。通过性腺周围的后腹膜解剖一个平面,远离其他腹膜后结构。重要的是要确定腹膜后结构(如输尿管和髂血管)的位置和路线,以避免医源性损伤。然后识别横穿性腺的精索内管,并在横切前使用 Ligasure 装置分四个连续切片进行电裂,以减少出血的可能性。然后从腹膜中动员睾丸,输精管也以类似的方式进行电灼和分裂。腹腔镜通过其中一个工作端口插入,以便可以通过中央 10 毫米脐带端口取出性腺。然后反转腹部 CO2 气腹,并使用 2-0 薇乔线缝合脐筋膜。使用 5-0 Monocryl 闭合所有端口部位的皮肤,并用 Dermabond 覆盖。
两个性腺均被切除,无并发症,并送病理学评估。腹腔镜性腺切除术从切口到闭合的手术时间约为 80 分钟。估计失血量不到 5 mL。由于社会因素,患者被收治入院过夜观察。她对手术的耐受性很好,使用多模式疼痛管理很好地控制了她的疼痛,第二天早上她出院回家了。她被安排在两周后与她的妇科医生进行随访,以开始雌激素替代疗法。
值得注意的是,在腹腔镜下,我们能够看到可追溯到尿道的双侧输精管。Hannema 等人 对 44 名 CAIS 患者的病例系列研究发现,36% 的患者存在附睾或输精管。12 Hannema 等人 假设残留的旁分泌雄激素活性可能能够诱导 Wolffian 管产物的发育,即使在完全型 AIS 患者中也是如此。12
我们患者的手术病理学证实,她的两个性腺实际上是萎缩的睾丸。有趣的是,两个睾丸都表现出 GCNIS 和明显的 Leydig 细胞增生(图 1-2)。肿瘤细胞用 OCT3/4 和 PLAP 染色(图 3-4)。该患者所见的 Leydig 细胞增生是 CAIS 患者的常见发现。24 有人提出,由于垂体前叶缺乏雄激素负反馈,高水平的 LH 是导致 Leydig 细胞增加的原因。25 个 GCNIS 被认为是癌前肿瘤,高达 50% 的 GCNIS 将在 5 年内进展为 GCT。26 在 CAIS 患者中,GCNIS 进展为侵袭性 GCT 的风险不太确定。Kaprova-Pleskacova 等人提出的“缺乏雄激素理论”表明,由于雄激素反应不足,无法促进异常生殖细胞的存活,CAIS 患者比 PAIS 患者更不可能进展为 GCT。27 相反,Kaprova-Pleskacova 等人 也认为,Hannema 等人12 提到的可能负责诱导 Wolffian 管发育的相同旁分泌雄激素活性也可能促进 GCNIS 发展为侵袭性 GCT。27 我们患者存在输精管和 GCNIS 的组织学证据表明潜在的残余旁分泌雄激素反应。因此,我们认为该病例有助于支持 CAIS 患者预防性性腺切除术潜在益处的论点。
我们患者的手术病理对双侧睾丸旁平滑肌瘤也很重要(图 5),这是一种很少发生在泌尿生殖道内的平滑肌肿瘤。它们的位置可能是睾丸内或睾丸旁,据信来源于间质基质的平滑肌细胞、白膜血管的肌肉层、生精小管以及睾丸旁结构,如精索、附睾、退化残余物和阴道外膜。28 平滑肌瘤在 AIS 患者中很少描述。事实上,文献中只有四例病例报告描述了 AIS 患者性腺切除术后活检时出现平滑肌瘤。28-31 据我们所知,这是 CAIS 患者双侧睾丸旁平滑肌瘤与 GCNIS 同时发展的第一例记录病例。
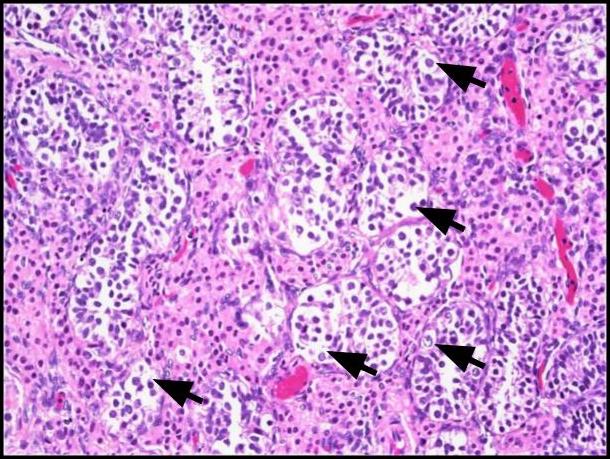
图 1. 原位生殖细胞瘤 (GCNIS)。可见大的非典型细胞(黑色箭头),具有大量透明至微弱的嗜酸性粒细胞质、具有突出核仁的中央细胞核和均匀分布的染色质。H&E,200 倍。
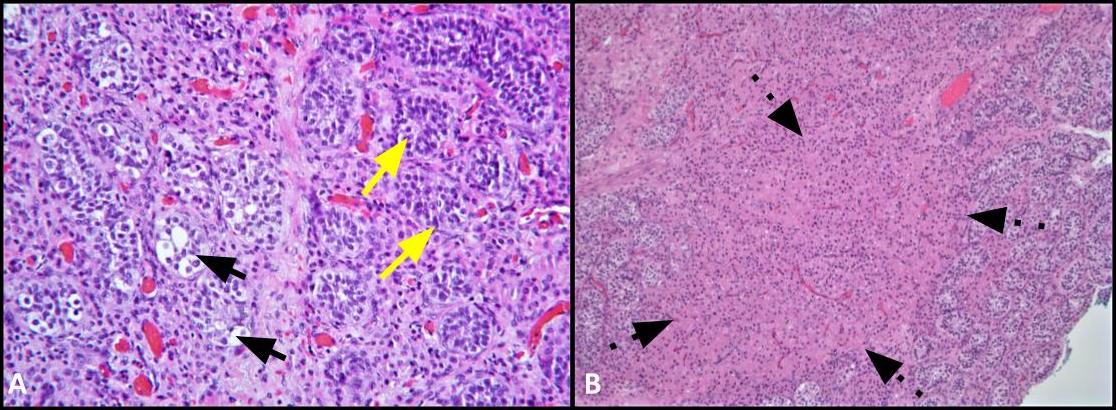
图 2. A) 该图像显示了 GCNIS 涉及的小管(黑色箭头)与精子发生正常的相邻生精小管(黄色箭头)的比较;H&E,200x。B) 低倍图像显示间质内的 Leydig 细胞簇(虚线箭头);H&E,100 倍。
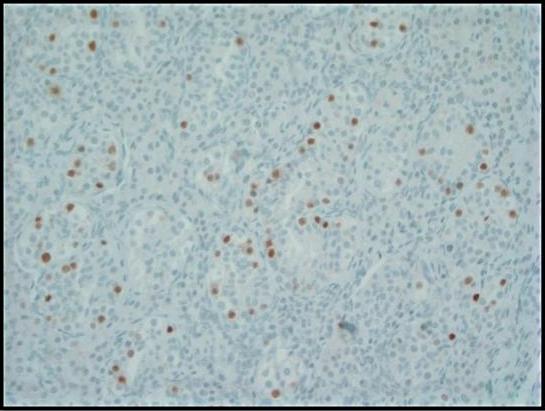
图 3. 八聚体结合转录因子 (OCT) 3/4 的免疫组织化学染色显示生精小管内的 GCNIS 细胞具有很强的核免疫反应性。正常生殖细胞为阴性;200 倍。
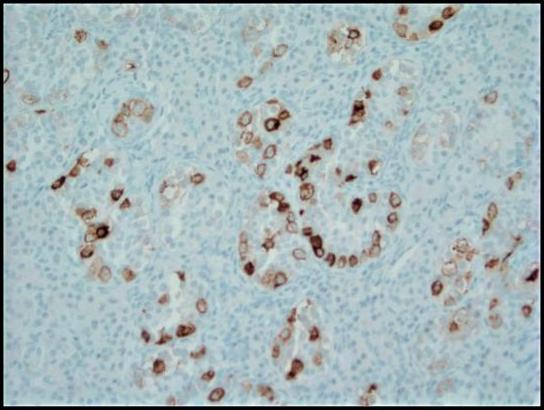
图 4. 胎盘碱性磷酸酶 (PLAP) 免疫组织化学染色以细胞质膜模式突出显示 GCNIS 的肿瘤细胞;200 倍。
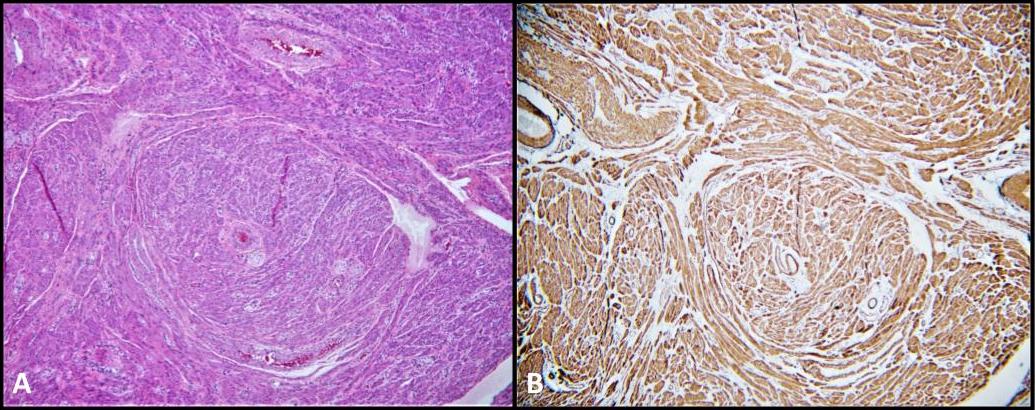
图 5. A) 平滑肌瘤;H&E,100 倍。纺锤形平滑肌细胞的束。B) 平滑肌肌动蛋白 (SMA) 细胞质染色是弥漫而强的。
未使用特定设备。
没什么可透露的。
本视频文章中提到的患者已同意拍摄,并且知道信息和图像将在网上发布。
References
- Calvo A, Escolino M, Settimi A, Roberti A, Caprio MG, Esposito C. 腹腔镜方法用于双性人疾病儿科患者的性腺切除术。 翻译儿科。2016;5(4):295-304. https://doi.org/10.21037/tp.2016.09.06
- Kusumi M、Mitsunami M、Onoue H 等人。腹腔镜性腺切除术前后完全雄激素不敏感综合征和抗苗勒管激素水平。 Gynecol Minim invasive ther.2017;6(3):126-128. https://doi.org/10.1016/j.gmit.2016.11.001
- Cheikhelard A、Thibaud E、Morel Y 等人。完全性雄激素不敏感综合征:诊断和管理。 专家 Rev Endocrinol Metab。2009;4(6):565-573. https://doi.org/10.1586/eem.09.31
- Lanciotti L, Cofini M, Leonardi A, Bertozzi M, Penta L, Esposito S. 完全雄激素不敏感综合征 (CAIS) 的不同临床表现和管理。 国际环境研究公共卫生杂志。2019;16(7):1268. https://doi.org/10.3390/ijerph16071268
- Grasso D, Borreggine C, Campanale C, Longo A, Grilli G, Macarini L. 磁共振成像在完全雄激素不敏感综合征病例中的有用性和作用。 Radiol 案例代表2015;10(2):1119. https://doi.org/10.2484/rcr.v10i2.1119
- Nezzo M, De Visschere P, T'Sjoen G, Weyers S, Villeirs G. 影像学在成人完全雄激素不敏感综合征诊断和管理中的作用。 案例代表 Radiol。2013;2013:158484. https://doi.org/10.1155/2013/158484
- Viner RM、Teoh Y、Williams DM、Patterson MN、Hughes IA。雄激素不敏感综合征:英国诊断程序和管理调查。 Arch Dis Child.1997;77(4):305-309. https://doi.org/10.1136/adc.77.4.305
- Galani A, Kitsiou-Tzeli S, Sofokleous C, Kanavakis E, Kalpini-Mavrou A. 雄激素不敏感综合征:临床特征和分子缺陷。 激素(雅典)。2008;7(3):217-229. https://doi.org/10.14310/horm.2002.1201
- Wisniewski AB、Migeon CJ、Meyer-Bahlburg HF 等人。完全性雄激素不敏感综合征:长期躯体、手术和性心理结局。 J Clin 内分泌代谢物。2000;85(8):2664-2669. https://doi.org/10.1210/jcem.85.8.6742
- Hughes IA、Davies JD、Bunch TI、Pasterski V、Mastroyannopoulou K、MacDougall J. 雄激素不敏感综合征。 柳叶刀。2012;380(9851):1419-1428. https://doi.org/10.1016/S0140-6736(12)60071-3
- Deans R、Creighton SM、Liao LM、Conway GS。患有完全雄激素不敏感综合征 (CAIS) 的成年女性进行性腺切除术的时间:患者偏好和临床证据。 临床内分泌 (Oxf)。2012;76(6):894-898. https://doi.org/10.1111/j.1365-2265.2012.04330.x
- Hannema SE, Scott IS, Rajpert-De Meyts E, Skakkebaek NE, Coleman N, Hughes IA.完全雄激素不敏感综合征的睾丸发育。 J Pathol.2006;208(4):518-527. https://doi.org/10.1002/path.1890
- Döhnert U, Wünsch L, Hiort O. 完全雄激素不敏感综合征的性腺切除术:为什么和何时? 性开发2017;11(4):171-174. https://doi.org/10.1159/000478082
- 乔杜里 S、Tadokoro-Cuccaro R、Hannema SE、Acerini CL、休斯 IA。完全性雄激素不敏感综合征 (CAIS) 中性腺肿瘤的频率: 回顾性病例系列分析。 J 儿科 Urol.2017;13(5):498.e491-498.e496。 https://doi.org/10.1016/j.jpurol.2017.02.013
- Wünsch L, Holterhus PM, Wessel L, Hiort O. 有性腺肿瘤发展风险的性发育障碍 (DSD) 患者:基于腹腔镜活检和分子诊断的管理。 BJU 国际2012;110(11 点 C):E958-965。 https://doi.org/10.1111/j.1464-410X.2012.11181.x
- Cools M, Drop SL, Wolffenbuttel KP, Oosterhuis JW, Looijenga LH.双性性腺中的生殖细胞肿瘤:旧路径、新方向、移动的前沿。 内分泌修订版2006;27(5):468-484. https://doi.org/10.1210/er.2006-0005
- Batista RL、Costa EMF、Rodrigues AdS 等人。雄激素不敏感综合征: 综述。内分泌学和代谢档案。2018;62:227-235. https://doi.org/10.20945/2359-3997000000031
- Bertelloni S, Meriggiola MC, Dati E, Balsamo A, Baroncelli GI.患有完全雄激素不敏感综合征且睾丸完整或性腺切除的女性的骨矿物质密度。 性开发2017;11(4):182-189. https://doi.org/10.1159/000477599
- 派尔 LC,内桑森 KL。评估性发育差异中性腺生殖细胞肿瘤易感性的实用指南。 Am J med Genet C Semin med Genet.2017;175(2):304-314. https://doi.org/10.1002/ajmg.c.31562
- Manuel M, 片山 PK, 琼斯 HW, Jr.具有 Y 染色体的双性人患者性腺肿瘤的发生年龄。 Am J Obstet Gynecol.1976;124(3):293-300.
https://doi.org/10.1016/0002-9378(76)90160-5 - 切尔廷 B、库利科夫 D、阿尔伯顿 J、哈达斯-哈尔彭 I、赖斯曼 P、法卡斯 A。腹腔镜检查在双性人患者中的使用。 儿科外科 Int.2006;22(5):405-408. https://doi.org/10.1007/s00383-006-1662-3
- Esegbona G, Cutner A, Cuckow P, Creighton S. 患有双性人障碍的儿科和青少年女孩的腹腔镜性腺切除术。 BJOG:国际妇产科杂志。2003;110(2):210-212.PMID:12618168。
- Cools M, Looijenga L. 完全雄激素不敏感综合征中恶性睾丸生殖细胞肿瘤发展的病理生理学和危险因素的最新进展。 性开发2017;11(4):175-181. https://doi.org/10.1159/000477921
- Jockenhövel、罗格斯 JK、梅森 JS、格里芬 JE、斯沃德洛夫 RS。Reifenstein 综合征患者的 Leydig 细胞瘤。 Exp 临床内分泌。1993;101(6):365-370.
- Akyüz M, Topaktaş R, Ürkmez A, Koca O, Öztürk M. 睾丸肿瘤原位生殖细胞瘤的评估。 Turk J Urol.2019;45(6):418-422. https://doi.org/10.5152/tud.2018.48855
- Kaprova-Pleskacova J、Stoop H、Brüggenwirth H 等人。完全性雄激素不敏感综合征:影响性腺组织学的因素,包括生殖细胞病理学。 现代病理学。2014;27(5):721-730. https://doi.org/10.1038/modpathol.2013.193
- 与双侧支持细胞腺瘤和睾丸旁平滑肌瘤相关的完全雄激素不敏感综合征:病例报告和文献回顾。 J 儿科 Urol.2013;9(1):e31-34。 https://doi.org/10.1016/j.jpurol.2012.06.013
- Goulis DG、Iliadou PK、Papanicolaou A 等人。患有完全雄激素不敏感综合征和双侧睾丸错构瘤的青少年雄激素受体基因的 R831X 突变。 激素(雅典)。2006;5(3):200-204. https://doi.org/10.14310/horm.2002.11185
- Krichen Makni S、Mnif Hachicha L、Ellouze S 等人。伴有多发性错构瘤和双侧睾丸旁平滑肌瘤的女性化睾丸综合征。 Rev Med Interne.2005;26(12):980-983. https://doi.org/10.1016/j.revmed.2005.08.003
- Savaş-Erdeve Ş、Aycan Z、Keskin M 等人。与双侧支持细胞腺瘤和单侧睾丸旁平滑肌瘤相关的完全雄激素不敏感综合征:病例报告。 土耳其儿科杂志。2016;58(6):654-657. https://doi.org/10.24953/turkjped.2016.06.012
Cite this article
诺顿 JC、辛格 A、霍伦巴赫 LL、甘布尔 G、冈萨雷斯-克雷尔维茨洛杉矶、佳能 SJ。预防性腹腔镜双侧性腺切除术治疗完全性雄激素不敏感综合征。 J Med Insight. 2021;2021(313). doi:10.24296/jomi/313.
