Komple Androjen Duyarsızlığı Sendromu için Profilaktik Laparoskopik Bilateral Gonadektomi
1; 2; 3; 3; 2; 4
1Department of Urology, University of Arkansas for Medical Sciences
2Department of Pathology, University of Arkansas for Medical Sciences / Arkansas Children’s Hospital
3Department of Obstetrics and Gynecology, University of Arkansas for Medical Sciences
4Department of Pediatric Urology, Arkansas Children’s Hospital
Main Text
Table of Contents
Androjen duyarsızlık sendromu (AIS), androjen reseptörünün X'e bağlı bir mutasyonunun neden olduğu nadir bir durumdur ve tahmini insidansı 100.000 kişide 1-5'tir. Androjen direncinin ciddiyetine bağlı olarak tam, kısmi veya hafif için değişen derecelerde sunum mevcuttur. Tam AIS'li (CAIS) hastalar fenotipik olarak dişi doğarlar, ancak yumurtalıklar yerine erkek XY kromozomları ve testisleri vardır. Meme gelişimi ve dış kadın genital organları gibi normal ikincil kadın cinsiyet özellikleri sergilerler, ancak testis Müllerian inhibe edici faktör (MIF) üretimi nedeniyle uterus ve diğer Müllerian kanal yapılarından yoksundurlar. Androjen direnci nedeniyle, epididim, vas deferens ve seminal veziküller gibi androjene bağımlı Wolffian kanal ürünleri gelişemez. Bu hastalar sıklıkla bebeklik döneminde kasık fıtıkları veya sublabial kitleler ile veya primer amenore ile ergenlik döneminde başvururlar. Fizik muayenede, tipik olarak normal meme gelişimine sahip olacaklar, kasık veya koltuk altı kıllarından yoksun olacaklar ve değişen vajinal uzunluklarda kör uçlu bir vajinal keseye sahip olacaklar. Tanısal çalışma genellikle ultrason veya MRI, serum hormon seviyeleri ve karyotip analizi kullanılarak yapılır.
CAIS'li hastalar için testisleri kasık kanalı içinde, sublabikal veya intraabdominal olarak yerleştirilebilir. Ergenliği takiben, karın içi testisleri olan hastalar, germ hücreli tümörler (GCT) geliştirme riski% 15 (dağılım % 0-22) altındadır. Yönetim, normal pubertal gelişimi sürdürmek ve yeterli kemik sağlığını geliştirmek için profilaktik gonadektomi ve ardından hormon replasman tedavisinden (HRT) oluşur. Profilaktik gonadektominin zamanlaması ile ilgili tartışmalar, uzun süreli hormon tedavisi ve doğurganlığı koruma arzusu ile ilgili endişeleri öne sürerek gonadektomiye karşı çıkan bazı hasta destek grupları ile devam etmektedir. Mevcut konvansiyon, prepubertal GCT gelişme riski nispeten düşük olduğu için (%0.8-2) fizyolojik ergenlik elde edilene kadar gonadektominin ertelenmesini önermektedir. Bilateral laparoskopik gonadektomi ile KAIS tedavisinde prezentasyon, tanı, intraoperatif teknikler ve postoperatif hususları özetledik.
Gonadektomi, gonadal malignite riskinin artması nedeniyle Y kromozomu gonadlarını barındıran Cinsel Gelişim Farklılıkları (DSD) olan çocuklarda endike olabilir. 1 Böyle bir DSD, androjen reseptörünün (AR) X'e bağlı bir mutasyonunun neden olduğu androjen duyarsızlık sendromudur (AIS). 2 AIS, 100.000 kişide tahmini insidansı 1-5 arasında olan nadir bir tanıdır. 3 AIS, androjen direncinin ciddiyetine bağlı olarak, tam (CAIS), kısmi (PAIS) ve hafif (MAIS) arasında değişen derecelerde sunuma sahip olabilir. 4 KAIS'li çocuklar fenotipik olarak dişi görünümdedir ve normal kadın dış genital organlarına sahiptirler, ancak yumurtalıklar yerine testisleri vardır ve erkek karyotipine sahiptirler (46, XY). Bu hastalarda testisleri testosteron üretebilir, ancak AR fonksiyonundaki kusur nedeniyle epididim, vas deferens ve seminal veziküller gibi Wolffian kanal ürünlerini üretemez. Bu testosteronun östrojene periferik aromatizasyonu nedeniyle, bu hastalar meme gelişimi gibi normal ikincil kadın cinsiyet özelliklerine sahiptir. Bununla birlikte, testislerin Sertoli hücreleri, Müllerian kanal türevlerinin gelişimini engelleyen Müllerian inhibe edici faktör (MIF) üretmeye devam eder. Bu, rahim, serviks ve fallop tüpleri gibi diğer kadın cinsiyet organlarının yokluğu ile kör uçlu vajinal kese olan hastalarla sonuçlanır. 5 Bu hastalarda testisler kasık kanalı içinde yer alabilir, sublabial veya intraabdominal olabilir. 6 Androjen duyarsızlığı olan bebeklerde tek taraflı veya iki taraflı kasık fıtıkları veya labial kitleler ortaya çıkabilir. Kızlar arasında bilateral kasık fıtıklarının %1-2'sinin CAIS tanısını temsil edebileceği tahmin edilmektedir ve değerlendirmeniz sırasında güçlü bir klinik şüphe sürdürmeniz önemlidir. 7 Klasik olarak, CAIS ergenlik döneminde normal meme gelişimi olan ancak muayenede kasık veya koltuk altı kıllarının çok az olduğu veya hiç olmadığı kızlarda primer amenore olarak ortaya çıkar. CAIS, anormal testis gelişiminin yanı sıra ergenliği takiben germ hücre malignitesi riskinin artması ile ilişkilidir. 8
Bu hasta, geçmişte morbid obezite (VKİ) (VKİ) (VKİ), CPAP'de obstrüktif uyku apnesi ve prediyabet (HbA1c, 5.5) öyküsü olan 15 yaşında Asya kökenli bir kadındır. Küçük bir çocukken bilateral kasık fıtığı onarımı ile ilgili geçmiş bir cerrahi öyküsü var. Hastanın daha önce gebelik öyküsü yoktu, cinsel olarak aktif değildi ve primer amenore açısından daha ileri değerlendirme için kliniğimize yönlendirildi. 11 yaşında telarche geliştirdiğini, ancak seyrek koltuk altı ve kasık kıllarına sahip olduğunu ve akne belirtisi olmadığını bildirdi. Ek olarak, herhangi bir ağrı, vajinal akıntı, hirsutizm veya galaktore reddeder. Dışarıdan bir klinikte, hastamız bir progestin tehdidinin ardından kanamayı reddetti ve önceki bir pelvik muayene sırasında hiçbir serviks palpe edilmedi.
Hastanın aile öyküsüne göre, 19, 21 ve 26 yaşlarında üç ablası var. Annesi 14 yaşında adet görmeye başladı. 26 yaşındaki ve 19 yaşındaki kız kardeşleri de 11 yaş civarında başlayan düzenli adet kanamaları olduğunu ve en büyük kız kardeşinin dört sağlıklı çocuğu olduğunu bildiriyor. İlginç bir şekilde, 21 yaşındaki kız kardeşi de etiyolojisi bilinmeyen primer amenore'nin değerlendirilmesi için eyalet dışından bir doktor tarafından görüldü. Vajinal boşluğunun doğum için yetersiz olduğu söylendi ve daha ileri değerlendirme için bir uzmana sevk edildi, ancak takip için kaybedildi.
Fizik muayenede hasta obezdi, seyrek aksiller kıllı Tanner evre 5 meme gelişimi vardı ve akne belirtisi yoktu. Genitoüriner muayenede, hastanın seyrek kasık kılları ile normal dış kadın genital organı vardı. Vajina görünüşte normaldi, anormal akıntı yoktu ve kör uçlu bir vajinal kese vardı. Muayenede rahim ağzını veya uterusu görüntüleyemedik veya palpe edemedik. Muayene bulguları potansiyel bir konjenital anormallik açısından tutarlıydı. Daha sonra uygun laboratuvar ve görüntüleme testleri istendi.
Laboratuvar Sonuçları:
| Test | Sonuç | Referans |
| B-hCG (B-hCG) | Negatif | Negatif |
| FSH | 13,20 mIU/mL | 5–20 mIU/mL |
| LH | 22.20 mIU/mL | 5–20 mIU/mL |
| Prolaktin | 8.1 ng/mL | 3,0–18,6 ng/mL |
| Estradiol | 38,33 sayfa/mL |
34–170 sayfa/mL (Kadın Bronzlaştırıcı Aşama 5) |
| Testosteron | 269 ng/dL |
20–38 ng/dL (Kadın Bronzlaştırıcı Aşama 5) |
| TSH | 1,94 mIU/L | 0,47–4,68 mIU/L |
| Kromozom Analizi | 46, XY |
Kadın: 46, XX Erkek: 46, XY |
Folikül uyarıcı hormon (FSH), luteinize edici hormon (LH), prolaktin ve testosteron gibi hipotalamik-hipofiz-yumurtalık (HPO) ekseni ile ilişkili sorunları değerlendirmek için ilk laboratuvarlar çizildi. Ek olarak, gebeliği ekarte etmek için bir idrar beta-hCG yapıldı. Hastamız için yapılan laboratuarlarda testosteron düzeyinin normal kadın hastalara göre daha yüksek olduğu ortaya çıktı. Ek olarak, hastamız için yapılan bir karyotip analizi sonucunda 46, XY kromozomu elde edildi. Birlikte, bu bulgular, yüksek testosteron seviyelerinin (anormal kadın aralığı, ancak normal erkek aralığı) ve yüksek serum LH seviyelerinin ön hipofiz üzerindeki androjen negatif geri bildiriminin bozulmasına bağlı olarak ortaya çıktığı CAIS tanısı ile tutarlıdır.
Uterus ve diğer kadın cinsiyet organlarının varlığını veya yokluğunu değerlendirmek için pelvik ultrason ile görüntüleme istendi. Dışarıdaki bir hastanede yapılan ultrason görüntülemesi rahim, fallop tüpleri ve rahim ağzının olmadığını gösterdi. Ek olarak, görüntüleme yumurtalıkların yokluğunu ortaya çıkardı ve potansiyel karın içi testislerin yerini doğru bir şekilde değerlendiremedi. Ultrasonlar operatöre bağımlı olabilir ve MRG, laparoskopik gonadektomi ve gonadal sürveyans için cerrahi planlamada gonadları teşhis etmek ve konumlandırmak için altın standart olarak kabul edilir. 5
Wisniewski ve arkadaşları tarafından yapılan bir çalışmada, gonadektomi sonrası uzun süreli hormon replasman tedavisi (HRT) alan CAIS'li 14 kadın arasında uzun vadeli sonuçlar incelenmiştir. 9 Genel olarak bu kadınların normal ve aktif bir yaşam süresine sahip olmayı bekleyebileceklerini buldular. Bu kadınların çoğunluğu normal yetişkin kadınlar için 90. yüzdelik dilimi aştı,9 bu da onları normal erkek nüfusundan daha kısa iken ortalama bir kadından daha uzun yaptı. 10 Bu kadınlar arasında teşhis edilen en yaygın tıbbi durum osteoporozdu. Kadınların çoğunluğu heteroseksüel bir kadın cinsiyet kimliğine sahip olarak tanımlandı ve hiçbiri cinsiyet değiştirme ameliyatı istemedi. Çoğunluk cinsel işlevlerinden memnun olduklarını bildirdi. Bu kohort arasındaki ortalama vajinal uzunluk 8,8 cm idi ve bu, 7-11 cm arasında değişen normal vajinal uzunlukla tutarlıdır.9
Şu anda, CAIS'li hastalarda AR'nin altta yatan genetik mutasyonunu tersine çevirmek için herhangi bir tedavi mevcut değildir. Bu nedenle, tedavi, müteakip HRT ile potansiyel gonadal maligniteyi önlemek için profilaktik gonadektomiye, belirtilirse ürogenital sistemin tedavisine ve psikolojik desteğe odaklanır. Gonadektomi genellikle normal spontan pubertal gelişime izin vermek için ergenlik döneminde cinsel olgunlaşma tamamlanana kadar ertelenir. 3 Bebeklik veya çocuklukta erken teşhis edilirse, çocuk ağrılı veya rahatsız edici kasık veya labial kitlelerle ortaya çıkıyorsa, ancak yaklaşık 11-12 yaşlarında ergenliği indüklemek için müteakip HRT gerektirecekse erken gonadektomi düşünülebilir. 3 Gonadektominin zamanlaması, testislerini korumayı savunan bazı hastalar ve AIS destek grupları ile tartışmalı hale gelmiştir. Bu destek grupları tarafından testisleri tutmak için psikolojik faktörler, ameliyatla ilişkili riskler, potansiyel olarak doğurganlığı koruma arzusu ve uzun süreli HRT'ye uyma konusunda isteksizlik gibi çeşitli nedenler belirtilmiştir. Bununla birlikte, laparoskopik gonadektomi için bildirilen riskler çok düşüktür, 1000 prosedür başına tahmini ölüm riski 0.1'dir ve bağırsak yaralanması veya kanama riski %2.4 olarak bildirilmiştir. 11 Ayrıca, Hannema ve arkadaşları tarafından yapılan bir çalışmada, CAIS'li 44 hastanın testisleri incelenmiş ve germ hücrelerinin yaşamın ilk yılından sonra sayıca hızla azaldığı ve testislerin hiçbirinde spermatogenez kanıtı bulunmadığı, bu da CAIS hastaları için doğurganlığı oldukça düşük bir oran haline getirdiği bulunmuştur. 12 Testislerini korumaya karar veren CAIS hastaları için, germ hücreli tümör (GCT) gelişme riskinin yaşla birlikte arttığı bildirilmiştir. 11 Bu hastalarda potansiyel GCT gelişimini taramak için düzenli görüntüleme (ultrason ve/veya MRG) ve serum kan belirteçleri kullanarak aktif gözetim yoluyla yakın takibin sürdürülmesi önemlidir. 13 MRG, paratestiküler kistler ve adenomlar gibi iyi huylu değişiklikleri tespit edebilirken, gonadların biyopsisini gerektirecek germ hücreli neoplazi in situ (GCNIS) gibi premalign değişiklikleri tespit edemez.14 Ek olarak, ultrason taramasının kalitesi genellikle operatöre bağlıdır. Wunsch ve ark. tarafından testislerini korumak isteyen hastalar için önerilen bir yaklaşım, laparoskopik gonadal biyopsi yapmak ve ultrason ile daha iyi görselleştirme sağlamak için karın içi gonadları karın duvarına yakın cerrahi olarak sabitlemek olacaktır. 15
KAIS ortamında gonadektomi yapılmasının birincil amacı gelecekteki malignite riskini azaltmaktır. Diğer kriptorşidizm formlarında olduğu gibi, GCT geliştirme riski artmıştır. CAIS'de, bu hastalar arasında prepubertal GCT gelişme riskinin %0.8-2.0 arasında çok düşük olduğu düşünülmektedir. 16 Ergenliği takiben, bu risk yaşla birlikte artar ve kabaca %15 (%0-22 arasında değişir) olduğu tahmin edilmektedir. 11 Profilaktik gonadektominin, feminizasyonun kısmen androjenlerin östrojene dönüştürülmesinden türetilen testis östrojeni ile tamamlandığı postpubertal dönemde meydana geldiği iddia edilmektedir. 3, 8 Gonadektomiyi ergenlik döneminin ilerleyen dönemlerine kadar ertelemek, bakım sağlayıcıların doğrudan hastalarından bilgilendirilmiş onam almalarını da sağlar.
HPO ekseni hala olgunlaşmamış olan çocukları değerlendirirken, Leydig hücresi testosteron sekresyonunu uygun şekilde değerlendirmek için bir hCG stimülasyon testi gereklidir. 17 Gonadektomiyi takiben, bu hastaların normal meme ve kemik gelişimini, psikososyal iyilik halini ve cinsel işlevi sürdürmek için doğal menopoz yaşına kadar (yaklaşık 50-52 yaş) östrojen replasmanı ile uzun süreli hormonal takviye tedavisine ihtiyacı olacaktır. 18 Bu hastaların uterusu olmadığından, östrojen tedavisini tamamlamak için progestinlere gerek yoktur. 17 Bu hastalar normal ikincil kadın cinsiyet özelliklerini korumaya devam edecek ve normal cinsel fonksiyona ulaşabilirler, ancak vajinal kanallarının yeterliliğine bağlı olarak vajinal dilatasyon tedavisi veya vajinoplasti gerektirebilirler. 17 Kısırlık ve cinsiyet kimliği ile ilgili sorular bu hastalar için ağır bir psikososyal etki taşıyabilir ve multidisipliner bir yaklaşımın parçası olarak danışmanlık veya destek grup terapisi sunulması şiddetle teşvik edilir. 9
CAIS (eski adıyla Morris sendromu), 46, XY DSD'nin en yaygın tanımlanabilir nedenlerinden birini temsil eder. Periferik androjen direncine neden olan AR'nin nadir bir X'e bağlı mutasyonundan kaynaklanır. Bu hastalar normal kadın dış genital organları ile fenotipik olarak kadın olarak doğarlar. Genellikle, bu hastalar ergenlik döneminde primer amenore ile başvururlar ve sonraki muayenede bu hastaların kör uçlu bir vajinal poş olduğu ve görüntülemede iç kadın cinsel organlarının olmadığı ortaya çıkar. Yumurtalıklar yerine, bu hastaların karın, kasık kanalı veya labiada bulunabilen testisleri vardır. Çocuklarda veya bebeklerde KAIS kasık fıtığı veya kitle şeklinde ortaya çıkabilir ve kasık fıtığı olan kız bebeklerin yaklaşık %1-2'sinde 46,XY karyotipli kriptorşidizm bulunur. 7 Bu özel olguda, hastamızın küçük bir çocukken bilateral kasık fıtığı onarımı geçirdiği bir cerrahi öyküsü vardı. Bu, kaçırılmış veya gecikmiş bir tanıyı düşündürür ve bilateral kasık fıtıkları ile başvuran pediatrik kadın hastalarda güçlü bir klinik CAIS şüphesinin sürdürülmesinin önemini vurgular, bu da kriptorşidizmi ekarte etmek için daha fazla incelemeyi garanti eder.
AIS'li hastaların GCT geliştirme riski, androjen direncinin derecesi ile ters orantılıdır. CAIS'li hastalar, AR'lerinde tam bir fonksiyon kaybı anlamına gelen daha ciddi mutasyonlara sahiptir. Androjen stimülasyonu olmadan, spermatogenez bozulur ve yaşamın ilk yılından sonra germ hücre sayılarında hızlı bir düşüş olur ve bu da teorik olarak yaşamın ilerleyen dönemlerinde GCT geliştirme riskini azaltır. 14 Bu, hala bir dereceye kadar AR fonksiyonunu koruyan ve bu nedenle hayatta kalan germ hücrelerine sahip olma olasılığı daha yüksek olan ve daha sonra onları yetişkinlikte GCT geliştirme riskine sokan PAIS'li hastaların aksine. 19 Tarihsel olarak, Manuel ve ark. 25 yaşına kadar Y içeren DSD'leri olan hastalarda% 3.6'lık bir kümülatif GCT riski bildirmiştir ve bu oran 50 yaşına kadar% 33'e yükselmiştir. 20 Daha yakın zamanlarda, Deans ve ark. incelemelerinde, CAIS hastalarının yetişkinlikte gonadal malignite geliştirme riskinin %15 arttığını (dağılım %0-22) bulmuşlardır. 11 Cools ve ark. ergenlikten önce CAIS hastalarında GCT gelişme riskinin tahmini riskinin %0.8-2 ile çok daha düşük olduğunu bulmuşlardır. 16
Yetişkinlikte CAIS hastaları arasında gonadal malignite riskinin artması nedeniyle, ergenlikten önce tümör geliştirme riskinin nispeten düşük olduğu düşünüldüğünden, mevcut öneri, cinsel olgunlaşma tamamlandıktan sonra, tipik olarak 15-16 yaş civarında gonadektomi yapılmasıdır. 21 Bu yaklaşım, testisler tarafından fizyolojik hormon üretimi ve ardından periferik androjenlerin östrojenlere dönüşümü nedeniyle ergenlik döneminde spontan meme gelişimine ve daha iyi kemik mineralizasyonuna izin verir. 3, 8 Tarihsel olarak, DSD içeren Y kromozomu olan hastalara laparotomi ve bilateral gonadektomi uygulanmıştır. Zamanla, laparoskopik prosedürler, büyütmenin ilişkili avantajları ve minimal invaziv bir yaklaşımla pelvik boşluğa kolay erişimin ilişkili avantajları nedeniyle yaygın olarak benimsendi, bu da daha kısa postoperatif iyileşme ve hastanede kalış süresi ve daha iyi kozmetik sağlar. 22, 23
Laparoskopik gonadektomi, hasta genel anestezi altındayken endotrakeal entübasyon yoluyla yapılır. Video monitörü, insüflatör ve ışık kaynağı hastanın ayağına yerleştirilir. Bu durumda, karın insüflasyonu açık laparoskopi tekniği kullanılarak yapıldı, burada göbek alt tarafında yarım ay insizyonu yapıldı ve fasya hemostatlar kullanılarak yükseltildi. Daha sonra karın içine bir Veress iğnesi yerleştirildi ve doğru pozisyonu bir salin damla testi kullanılarak doğrulandı. Daha sonra göbekten 10 mm'lik bir Step trokar yerleştirildi ve pnömoperitoneum elde etmek için CO2 kullanıldı. Daha sonra karın içine 0o laparoskop sokuldu. Sağ ve sol taraflarda göbek hizasına çalışma aletleri için iki adet 5 mm'lik trokar daha yerleştirildi. Hasta daha sonra gonadların yerini belirlemek ve pelvik organları incelemek için pelvisin daha kolay laparoskopik muayenesine izin veren Trendelenburg pozisyonuna yerleştirildi. Gonadlar kolayca belirgin olmadığında, gonadal damarları tanımlamak ve takip etmek onların yerini belirlemeye yardımcı olabilir. 1
Laparoskopi sırasında hastamızın gonadları bilateral olarak kapalı iç halkaların üzerinde görüldü. Grossen, kistler bilateral testislerde görüntülendi. Vas deferens üretraya geçti ve pelvis içinde herhangi bir Müllerian yapıya dair bir kanıt yoktu. Diğer retroperitoneal yapılardan uzakta, gonadların etrafındaki posterior peritondan bir düzlem diseke edildi. İyatrojenik yaralanmayı önlemek için üreterler ve iliak damarlar gibi retroperitoneal yapıların yerini ve seyrini belirlemek önemlidir. İç spermatik damarlar daha sonra gonada enine olarak tanımlandı ve kanama olasılığını azaltmak için transekte etmeden önce dört ardışık bölümde Ligasure cihazı kullanılarak yerine getirildi. Testisler daha sonra peritondan mobilize edildi ve vas deferens de benzer şekilde yerine getirildi ve bölündü. Laparoskop, gonadların merkezi 10 mm'lik göbek portundan çıkarılabilmesi için çalışma portlarından birinden yerleştirildi. Abdominal CO2 pnömoperitoneum daha sonra ters çevrildi ve umbilikal fasya 2-0 Vicryl sütür kullanılarak kapatıldı. Tüm port bölgelerindeki cilt 5-0 Monocryl ile kapatıldı ve Dermabond ile kaplandı.
Her iki gonad da komplikasyonsuz eksize edildi ve değerlendirilmek üzere patolojiye gönderildi. Laparoskopik gonadektomi ameliyat süresi, insizyondan kapanışa kadar yaklaşık 80 dakikaydı. 5 mL'den az tahmini kan kaybı vardı. Hasta sosyal faktörler nedeniyle bir gece gözlem için yatırıldı. Prosedürü iyi tolere etti, ağrısı multimodal ağrı yönetimi kullanılarak iyi kontrol edildi ve ertesi sabah eve taburcu edildi. Östrojen replasman tedavisine başlamak için jinekoloğu ile iki hafta içinde takip edilmesi planlandı.
Laparoskopi altında, üretraya kadar uzanan bilateral vas deferensleri görüntüleyebildiğimizi belirtmek önemlidir. Hannema ve ark. tarafından 44 CAIS hastasından oluşan bir vaka serisi, %36'sında epididim veya vas deferens bulunduğunu buldu. 12 Hannema ve ark. rezidüel parakrin androjen aktivitesinin, tam AIS formlarına sahip hastalarda bile Wolffian kanal ürünlerinin gelişimini indükleyebileceğini varsaymıştır. 12
Hastamızın cerrahi patolojisi, her iki gonadının da aslında atrofik testis olduğunu doğruladı. İlginç bir şekilde, her iki testis de GCNIS gösterdi ve Leydig hücre hiperplazisini işaretledi (Şekil 1-2). Neoplastik hücreler OCT3/4 ve PLAP ile boyanır (Şekil 3-4). Leydig hücre hiperplazisi, bu hastada görüldüğü gibi, KAIS'li hastalarda sık görülen bir bulgudur. 24 Ön hipofiz üzerinde androjen negatif geri bildirim eksikliğine bağlı olarak yüksek LH seviyelerinin, Leydig hücreselliğinin artmasından sorumlu olduğu öne sürülmüştür. 25 GCNIS, premalign bir tümör olarak kabul edilir ve 50% 50'ye kadarı 5 yıl içinde GCT'ye ilerleyecektir. 26 GCNIS'in invaziv GCT'ye ilerleme riski, CAIS'li hastalarda daha az belirgindir. Kaprova-Pleskacova ve arkadaşları tarafından önerilen "androjen eksikliği teorisi", anormal germ hücrelerinin hayatta kalmasını teşvik etmek için yetersiz androjen yanıtı nedeniyle CAIS'li hastaların GCT'ye ilerleme olasılığının PAIS'li hastalara göre daha düşük olduğunu göstermektedir. 27 Tersine, Kaprova-Pleskacova ve ark. ayrıca, Hannema ve ark.12 tarafından belirtildiği gibi Wolffian kanalı gelişimini indüklemekten potansiyel olarak sorumlu olan aynı parakrin androjen aktivitesinin, GCNIS'in invaziv GCT'ye dönüşmesini de teşvik edebileceğini öne sürmüştür. 27 Hastamızda vas deferens varlığı ve GCNIS'in histolojik kanıtları potansiyel rezidüel parakrin androjen yanıtını düşündürmektedir. Bu nedenle, bu vakanın CAIS hastaları arasında profilaktik gonadektominin potansiyel yararı konusundaki argümanı desteklemeye yardımcı olduğuna inanıyoruz.
Ürogenital sistem içinde çok nadir görülen düz kas tümörü olan bilateral paratestiküler leiomyomlar için de hastamızın cerrahi patolojisi anlamlıydı (Şekil 5). Yerleşimleri intratestiküler veya paratestiküler olabilir ve interstisyel stroma'nın düz kas hücreleri, tunika albuginea damarlarının kas tabakası, seminifer tübüller ve ayrıca spermatik kord, epididim, körelmiş kalıntılar ve tunika vajinalis gibi paratestiküler yapılardan türetildiğine inanılmaktadır. 28 Leiomyomlar, AIS'li hastalarda çok nadiren tanımlanır. Aslında, literatürde AIS hastalarında gonadektomi sonrası biyopside leiomyomların bulunduğunu tanımlayan sadece dört olgu sunumu bulunmaktadır. 28-31 Bildiğimiz kadarıyla, bu KAIS'li bir hastada GCNIS ile eş zamanlı gelişen bilateral paratestiküler leiomyomların belgelenmiş ilk olgusudur.
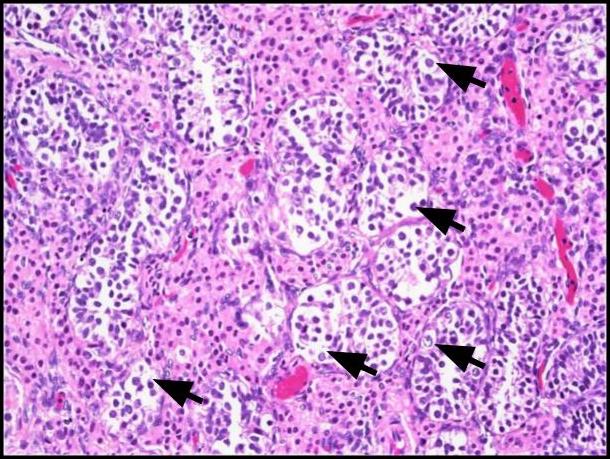
Şekil 1. Germ hücreli neoplazi in situ (GCNIS). Bol miktarda berrak ila hafif eozinofilik sitoplazmaya sahip büyük atipik hücreler (siyah oklar), belirgin nükleolus ile merkezi bir çekirdek ve eşit olarak dağılmış kromatin görülür. H ve E, 200x.
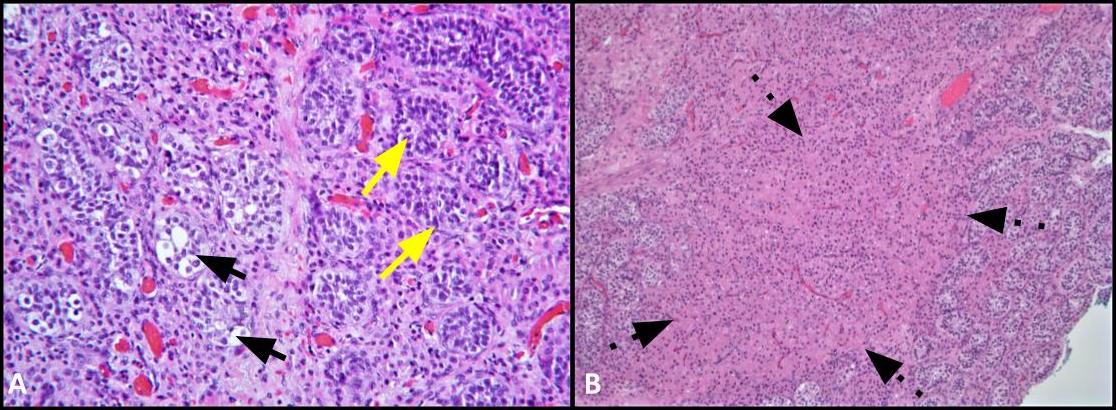
Şekil 2. A) Bu görüntü, GCNIS tarafından tutulan tübüllerin (siyah oklar) normal spermatogenez (sarı oklar) ile bitişik seminifer tübüllerle karşılaştırmasını göstermektedir; H&E, 200x. B) Düşük güç görüntüsü, interstisyum içindeki Leydig hücre kümelerini gösterir (kesikli oklar); H & E, 100x.
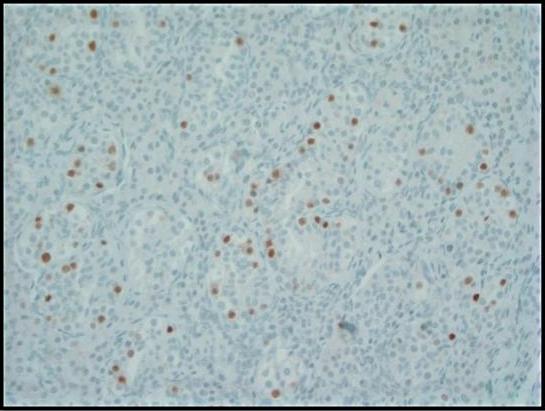
Şekil 3. Oktamer bağlayıcı transkripsiyon faktörü (OCT) 3/4 için immünohistokimyasal boyama, seminifer tübüller içindeki GCNIS hücrelerinde güçlü nükleer immünoreaktivite gösterir. Normal germ hücreleri negatiftir; 200x'tir.
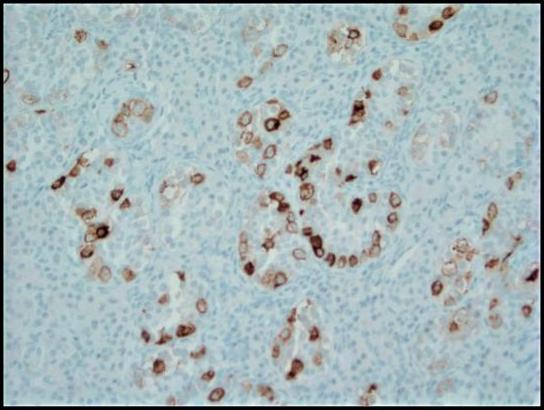
Şekil 4. Plasental alkalen fosfataz (PLAP) ile immünohistokimyasal boyama, GCNIS'in tümör hücrelerini sitoplazmik membranöz bir paternde vurgular; 200x.
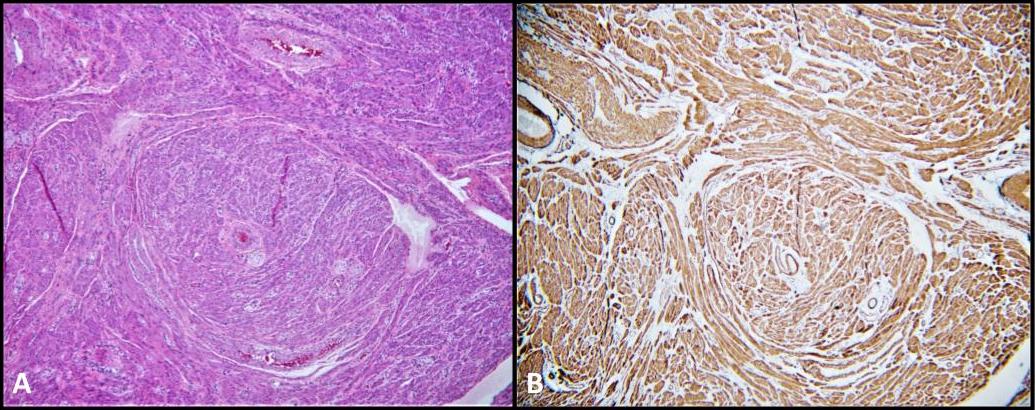
Şekil 5. a) Leiomyom; H & E, 100x. İğilmiş düz kas hücrelerinin fasikülleri. B) Düz kas aktin (SMA) sitoplazmik boyanması yaygın ve güçlüdür.
Özel bir ekipman kullanılmaz.
Açıklanacak bir şey yok.
Bu video makalesinde atıfta bulunulan hasta, filme alınması için bilgilendirilmiş onamını vermiştir ve bilgi ve görüntülerin çevrimiçi olarak yayınlanacağının farkındadır.
References
- Calvo A, Escolino M, Settimi A, Roberti A, Caprio MG, Esposito C. İnterseks bozukluğu olan pediatrik hastalarda gonadektomi için laparoskopik yaklaşım. Çev. Pediatr. 2016; 5(4):295-304. https://doi.org/10.21037/tp.2016.09.06
- Kusumi M, Mitsunami M, Onoue H, et al. Laparoskopik gonadektomi öncesi ve sonrası tam androjen duyarsızlığı sendromu ve anti-Müllerian hormon düzeyleri. Jinekolü Minim İnvaziv Ther. 2017; 6(3):126-128. https://doi.org/10.1016/j.gmit.2016.11.001
- Cheikhelard A, Thibaud E, Morel Y, et al. Tam androjen duyarsızlığı sendromu: tanı ve yönetim. Uzman Rev Endocrinol Metab. 2009; 4(6):565-573. https://doi.org/10.1586/eem.09.31
- Lanciotti L, Cofini M, Leonardi A, Bertozzi M, Penta L, Esposito S. Tam Androjen Duyarsızlık Sendromunda (CAIS) Farklı Klinik Sunumlar ve Yönetim. Int J Environ Res Halk Sağlığı. 2019; 16(7):1268. https://doi.org/10.3390/ijerph16071268
- Grasso D, Borreggine C, Campanale C, Longo A, Grilli G, Macarini L. Tam androjen duyarsızlığı sendromu durumunda manyetik rezonans görüntülemenin kullanışlılığı ve rolü. Radyol Vaka Temsilcisi 2015; 10(2):1119. https://doi.org/10.2484/rcr.v10i2.1119
- Nezzo M, De Visschere P, T'Sjoen G, Weyers S, Villeirs G. Yetişkinlerde tam androjen duyarsızlığı sendromunun tanı ve tedavisinde görüntülemenin rolü. Vaka Temsilcisi Radiol. 2013;2013:158484. https://doi.org/10.1155/2013/158484
- Viner RM, Teoh Y, Williams DM, Patterson MN, Hughes IA. Androjen duyarsızlığı sendromu: İngiltere'de tanısal prosedürler ve yönetim üzerine bir anket. Arch Dis Çocuk. 1997; 77(4):305-309. https://doi.org/10.1136/adc.77.4.305
- Galani A, Kitsiou-Tzeli S, Sofokleous C, Kanavakis E, Kalpini-Mavrou A. Androjen duyarsızlık sendromu: klinik özellikler ve moleküler kusurlar. Hormonlar (Atina). 2008; 7(3):217-229. https://doi.org/10.14310/horm.2002.1201
- Wisniewski AB, Migeon CJ, Meyer-Bahlburg HF ve diğerleri. Tam androjen duyarsızlığı sendromu: uzun süreli tıbbi, cerrahi ve psikoseksüel sonuç. J Clin Endokrinol Metab. 2000; 85(8):2664-2669. https://doi.org/10.1210/jcem.85.8.6742
- Hughes IA, Davies JD, Bunch TI, Pasterski V, Mastroyannopoulou K, MacDougall J. Androjen duyarsızlık sendromu. Neşter. 2012; 380(9851):1419-1428. https://doi.org/10.1016/S0140-6736(12)60071-3
- Dekanlar R, Creighton SM, Liao LM, Conway GS. Tam androjen duyarsızlığı sendromu (CAIS) olan yetişkin kadınlarda gonadektomi zamanlaması: hasta tercihleri ve klinik kanıtlar. Klinik Endokrinol (Oxf). 2012; 76(6):894-898. https://doi.org/10.1111/j.1365-2265.2012.04330.x
- Hannema SE, Scott IS, Rajpert-De Meyts E, Skakkebaek NE, Coleman N, Hughes IA. Tam androjen duyarsızlığı sendromunda testis gelişimi. J Pathol. 2006; 208(4):518-527. https://doi.org/10.1002/path.1890
- Döhnert U, Wünsch L, Hiort O. Tam Androjen Duyarsızlığı Sendromunda Gonadektomi: Neden ve Ne Zaman? Seks Dev. 2017; 11(4):171-174. https://doi.org/10.1159/000478082
- Chaudhry S, Tadokoro-Cuccaro R, Hannema SE, Acerini CL, Hughes IA. Tam androjen duyarsızlığı sendromunda (CAIS) gonadal tümörlerin sıklığı: Retrospektif bir vaka serisi analizi. J Pediatr Urol. 2017; 13(5):498.e491-498.e496. https://doi.org/10.1016/j.jpurol.2017.02.013
- Wünsch L, Holterhus PM, Wessel L, Hiort O. Gonadal tümör gelişimi riski taşıyan cinsiyet gelişimi bozukluğu (DSD) olan hastalar: laparoskopik biyopsi ve moleküler tanıya dayalı yönetim. BJU Int. 2012; 110(11 pt C):E958-965. https://doi.org/10.1111/j.1464-410X.2012.11181.x
- M, Damla SL, Wolffenbuttel KP, Oosterhuis JW, Looijenga LH'yi soğutur. İnterseks gonaddaki germ hücreli tümörler: eski yollar, yeni yönler, hareketli sınırlar. Endokrin Rev. 2006; 27(5):468-484. https://doi.org/10.1210/er.2006-0005
- Batista RL, Costa EMF, Rodrigues AdS, et al. Androjen duyarsızlık sendromu: bir inceleme. Endokrinoloji ve Metabolizma Arşivleri. 2018;62:227-235. https://doi.org/10.20945/2359-3997000000031
- Bertelloni S, Meriggiola MC, Dati E, Balsamo A, Baroncelli GI. Tam Androjen Duyarsızlığı Sendromu ile Yaşayan Kadınlarda ve Sağlam Testislerde veya Çıkarılmış Gonadlarda Kemik Mineral Yoğunluğu. Seks Dev. 2017; 11(4):182-189. https://doi.org/10.1159/000477599
- Pyle LC, Nathanson KL. Cinsiyet gelişimi farklılıklarında gonadal germ hücreli tümör yatkınlığını değerlendirmek için pratik bir rehber. J med genet c semin med genet. 2017; 175(2):304-314. https://doi.org/10.1002/ajmg.c.31562
- Manuel M, Katayama PK, Jones HW, Jr. Y kromozomlu interseks hastalarda gonadal tümörlerin görülme yaşı. Ben J Obstet Jinekolü. 1976; 124(3):293-300.
https://doi.org/10.1016/0002-9378(76)90160-5 - Chertin B, Koulikov D, Alberton J, Hadas-Halpern I, Reissman P, Farkas A. İnterseks hastalarda laparoskopi kullanımı. Pediatr Cerrahi Int. 2006; 22(5):405-408. https://doi.org/10.1007/s00383-006-1662-3
- Esegbona G, Cutner A, Cuckow P, Creighton S. İnterseks bozukluğu olan pediatrik ve ergen kızlarda laparoskopik gonadektomi. BJOG: Uluslararası Obstetrik ve Jinekoloji Dergisi. 2003; 110(2):210-212. PMID: 12618168.
- Cools M, Looijenga L. Tam Androjen Duyarsızlığı Sendromunda Malign Testis Germ Hücreli Tümörlerin Gelişimi için Patofizyoloji ve Risk Faktörleri Hakkında Güncelleme. Seks Dev. 2017; 11(4):175-181. https://doi.org/10.1159/000477921
- Jockenhövel, Rutgers JK, Mason JS, Griffin JE, Swerdloff RS. Reifenstein sendromlu bir hastada Leydig hücreli neoplazi. Exp Klinik Endokrinol. 1993; 101(6):365-370.
- Akyüz M, Topaktaş R, Ürkmez A, Koca Ö, Öztürk M. Testis tümörlerinde germ hücreli neoplazi in situ antitenin değerlendirilmesi. Türk J Urol. 2019; 45(6):418-422. https://doi.org/10.5152/tud.2018.48855
- Kaprova-Pleskacova J, Stoop H, Brüggenwirth H, et al. Tam androjen duyarsızlığı sendromu: germ hücre patolojisi dahil gonadal histolojiyi etkileyen faktörler. Modern Patoloji. 2014; 27(5):721-730. https://doi.org/10.1038/modpathol.2013.193
- Siminas S, Kokai G, Kenny SE. Bilateral Sertoli hücreli adenomlar ve paratestiküler leiomyomlar ile ilişkili tam androjen duyarsızlık sendromu: olgu sunumu ve literatürün gözden geçirilmesi. J Pediatr Urol. 2013; 9(1):E31-34. https://doi.org/10.1016/j.jpurol.2012.06.013
- Goulis DG, Iliadou PK, Papanicolaou A, et al. Tam androjen duyarsızlığı sendromu ve bilateral testis hamartomları olan bir ergende androjen reseptör geninin R831X mutasyonu. Hormonlar (Atina). 2006; 5(3):200-204. https://doi.org/10.14310/horm.2002.11185
- Krichen Makni S, Mnif Hachicha L, Ellouze S, et al. Multipl hamartomlar ve bilateral paratestiküler leiomyomlar ile dişileştirici testis sendromu. Rev Med Interne. 2005; 26(12):980-983. https://doi.org/10.1016/j.revmed.2005.08.003
- Savaş-Erdeve Ş, Aycan Z, Keskin M, et al. Bilateral sertoli hücreli adenomlar ve tek taraflı paratestiküler leiomyom ile ilişkili komplet androjen duyarsızlık sendromu: Olgu sunumu. Türk Pediatri Dergisi. 2016; 58(6):654-657. https://doi.org/10.24953/turkjped.2016.06.012
Cite this article
Norton JC, Singh A, Hollenbach LL, Kumar G, Gonzalez-Krellwitz LA, Canon SJ. Tam androjen duyarsızlığı sendromu için profilaktik laparoskopik bilateral gonadektomi. J Med İçgörü. 2021; 2021(313). doi:10.24296/jomi/313.
