Gonadectomia bilateral laparoscópica profilática para síndrome de insensibilidade androgênica completa
1; 2; 3; 3; 2; 4
1Department of Urology, University of Arkansas for Medical Sciences
2Department of Pathology, University of Arkansas for Medical Sciences / Arkansas Children’s Hospital
3Department of Obstetrics and Gynecology, University of Arkansas for Medical Sciences
4Department of Pediatric Urology, Arkansas Children’s Hospital
Main Text
Table of Contents
A síndrome de insensibilidade androgênica (AIS) é uma condição rara causada por uma mutação ligada ao X do receptor de andrógeno com uma incidência estimada de 1 a 5 por 100.000 indivíduos. Existem vários graus de apresentação para completa, parcial ou leve, dependendo da gravidade da resistência androgênica. Os pacientes com EIA completa (CAIS) nascem fenotipicamente do sexo feminino, mas têm cromossomos XY e testículos masculinos em vez de ovários. Eles exibem características sexuais femininas secundárias normais, como desenvolvimento mamário e genitália feminina externa, mas não possuem útero e outras estruturas do ducto mülleriano devido à produção testicular do fator inibidor de Müller (MIF). Devido à resistência aos andrógenos, os produtos do ducto de Wolff dependentes de andrógenos não se desenvolvem, como o epidídimo, o ducto deferente e as vesículas seminais. Esses pacientes geralmente se apresentam durante a infância com hérnias inguinais ou massas sublabiais, ou durante a adolescência com amenorreia primária. No exame físico, elas geralmente têm desenvolvimento normal da mama, não têm pelos pubianos ou axilares e têm uma bolsa vaginal cega de comprimentos vaginais variados. A investigação diagnóstica é frequentemente realizada por meio de ultrassonografia ou ressonância magnética, níveis séricos de hormônios e análise de cariótipo.
Para pacientes com CAIS, seus testículos podem estar localizados dentro do canal inguinal, sublabialmente ou intra-abdominalmente. Após a puberdade, os pacientes com testículos intra-abdominais têm um risco 15% maior (variação de 0 a 22%) de desenvolver tumores de células germinativas (TCG). O tratamento consiste em gonadectomia profilática com terapia de reposição hormonal (TRH) subsequente para manter o desenvolvimento puberal normal e promover a saúde óssea adequada. O debate sobre o momento da gonadectomia profilática está em andamento, com alguns grupos de apoio ao paciente argumentando contra a gonadectomia, citando preocupações com a terapia hormonal de longo prazo e o desejo de preservar a fertilidade. A convenção atual promove o adiamento da gonadectomia até que a puberdade fisiológica tenha sido alcançada, pois o risco de desenvolver TCG pré-púbere é relativamente baixo (0,8–2%). Descrevemos a apresentação, o diagnóstico, as técnicas intraoperatórias e as considerações pós-operatórias para o tratamento da CAIS por meio de gonadectomia laparoscópica bilateral.
A gonadectomia pode ser indicada em crianças com Diferenças de Desenvolvimento Sexual (DDS) que abrigam gônadas do cromossomo Y devido ao aumento do risco de malignidade gonadal. 1 Um desses DDS é a síndrome de insensibilidade a andrógenos (AIS), que é causada por uma mutação ligada ao X do receptor de andrógeno (AR). 2 AIS é um diagnóstico raro com uma incidência estimada entre 1-5 por 100.000 indivíduos. 3 A EIA pode ter vários graus de apresentação, dependendo da gravidade da resistência androgênica, variando de completa (CAIS), parcial (PAIS) e leve (MAIS). 4 Crianças com CAIS são fenotipicamente femininas na aparência com genitália externa feminina normal, mas têm testículos em vez de ovários e têm cariótipo masculino (46, XY). Nesses pacientes, seus testículos são capazes de produzir testosterona, mas, devido ao defeito na função AR, não conseguem produzir produtos do ducto de Wolff, como o epidídimo, o ducto deferente e as vesículas seminais. Devido à aromatização periférica dessa testosterona em estrogênio, esses pacientes têm características sexuais femininas secundárias normais, como o desenvolvimento dos seios. No entanto, as células de Sertoli dos testículos continuam a produzir o fator inibidor de Müller (MIF), que inibe o desenvolvimento dos derivados do ducto mülleriano. Isso resulta em pacientes com uma bolsa vaginal cega com ausência de outros órgãos sexuais femininos, como útero, colo do útero e trompas de falópio. 5 Nesses pacientes, os testículos podem estar localizados dentro do canal inguinal, ser sublabiais ou intra-abdominais. 6 Bebês com insensibilidade a andrógenos podem apresentar hérnias inguinais uni ou bilaterais ou massas labiais. Estima-se que 1–2% das hérnias inguinais bilaterais entre meninas possam representar um diagnóstico de CAIS, e é importante manter uma forte suspeita clínica durante sua avaliação. 7 Classicamente, o CAIS se apresenta durante a adolescência como amenorreia primária em meninas com desenvolvimento mamário normal, mas com pouco ou nenhum pelo pubiano ou axilar no exame. A CAIS está associada ao desenvolvimento testicular anormal, bem como a um aumento do risco de malignidade de células germinativas após a puberdade. 8
Esta paciente é uma mulher de 15 anos de ascendência asiática com história médica pregressa de obesidade mórbida (IMC de 45), apneia obstrutiva do sono em CPAP e pré-diabetes (HbA1c de 5.5) atualmente em uso de metformina. Ela tem uma história cirúrgica pregressa de correção de hérnia inguinal bilateral quando criança. Ela não tem história de gestações anteriores, não é sexualmente ativa e foi encaminhada ao nosso ambulatório para avaliação adicional da amenorreia primária. Ela relata que desenvolveu telarca aos 11 anos, mas tem pelos axilares e pubianos esparsos e nenhum sinal de acne. Além disso, ela nega qualquer dor, corrimento vaginal, hirsutismo ou galactorreia. Em uma clínica externa, nossa paciente negou sangramento após um teste de provocação com progesterona, e nenhum colo uterino foi palpado durante um exame pélvico anterior.
De acordo com o histórico familiar da paciente, ela tem três irmãs mais velhas de 19, 21 e 26 anos de idade. Sua mãe começou a menstruar aos 14 anos. Suas irmãs de 26 e 19 anos também relatam ter menstruações regulares que começaram por volta dos 11 anos, e a irmã mais velha teve quatro filhos saudáveis. Curiosamente, sua irmã de 21 anos também foi examinada por um médico de fora do estado para avaliação de amenorreia primária de etiologia desconhecida. Ela foi informada de que seu hiato vaginal era insuficiente para o parto e foi encaminhada a um especialista para avaliação adicional, mas perdeu o acompanhamento.
Ao exame físico, a paciente era obesa, apresentava desenvolvimento mamário estágio 5 de Tanner com pêlos axilares esparsos e sem sinais de acne presentes. No exame geniturinário, a paciente apresentava genitália feminina externa normal com pelos pubianos esparsos. A vagina tinha aparência normal, sem corrimento anormal e uma bolsa vaginal cega. Não foi possível visualizar ou palpar o colo do útero ou o útero no exame. Os achados do exame foram consistentes para uma possível anormalidade congênita. Exames laboratoriais e de imagem apropriados foram então solicitados.
Resultados do laboratório:
| Teste | Resultado | Referência |
| B-hCG | Negativo | Negativo |
| FSH | 13,20 mUI/mL | 5-20 mUI/mL |
| LH | 22,20 mUI/mL | 5-20 mUI/mL |
| Prolactina | 8,1 ng/mL | 3,0–18,6 ng/mL |
| Estradiol | 38,33 pg/mL |
34-170 pg/mL (Fêmea Tanner Estágio 5) |
| Testosterona | 269 ng/dL |
20–38 ng/dL (Fêmea Tanner Estágio 5) |
| TSH | 1,94 mIU/L | 0,47–4,68 mUI/L |
| Análise cromossômica | 46, XY |
Feminino: 46, XX Macho: 46, XY |
Os laboratórios iniciais foram elaborados para avaliar problemas associados ao eixo hipotálamo-hipófise-ovário (HPO), como hormônio folículo-estimulante (FSH), hormônio luteinizante (LH), prolactina e testosterona. Além disso, um beta-hCG na urina foi realizado para descartar a gravidez. Os laboratórios de nossa paciente revelaram que ela tinha um nível elevado de testosterona quando comparada a pacientes normais do sexo feminino. Além disso, uma análise de cariótipo para nosso paciente resultou em 46 cromossomos XY. Juntos, esses achados são consistentes com um diagnóstico de CAIS, em que níveis elevados de testosterona (faixa feminina anormal, mas faixa masculina normal) e altos níveis séricos de LH resultam devido ao comprometimento do feedback negativo de andrógenos na hipófise anterior.
Exames de imagem por ultrassonografia pélvica foram solicitados para avaliar a presença ou ausência do útero e de outros órgãos sexuais femininos. Imagens de ultrassom realizadas em um hospital externo mostraram ausência de útero, trompas de falópio e colo do útero. Além disso, a imagem revelou ausência de ovários e não foi capaz de avaliar com precisão a localização de possíveis testículos intra-abdominais. Os ultrassons podem ser dependentes do operador, e a ressonância magnética é amplamente considerada o padrão-ouro para diagnosticar e localizar as gônadas no planejamento cirúrgico para gonadectomia laparoscópica e vigilância gonadal. 5
Um estudo de Wisniewski et al. examinou os resultados em longo prazo entre 14 mulheres com CAIS que estavam em terapia de reposição hormonal (TRH) de longo prazo após gonadectomia. 9 Eles descobriram que, em geral, essas mulheres podem esperar ter uma expectativa de vida ativa normal. A maioria dessas mulheres excedeu o percentil 90 de altura para mulheres adultas normais,9 tornando-as mais altas do que a média das mulheres, mas ainda sendo mais baixas do que a população masculina normal. 10 A condição médica mais comum diagnosticada entre essas mulheres foi a osteoporose. A maioria das mulheres se identificou como tendo uma identidade de gênero feminina heterossexual e nenhuma delas desejou a cirurgia de reversão de gênero. A maioria relatou estar satisfeita com seu funcionamento sexual. O comprimento vaginal médio entre esta coorte foi de 8,8 cm, o que é consistente com o comprimento vaginal normal variando de 7 a 11 cm.9
Atualmente, não há terapia disponível para reverter a mutação genética subjacente do RA em pacientes com CAIS. Portanto, o tratamento é focado na gonadectomia profilática para prevenir uma possível malignidade gonadal com TRH subsequente, tratamento do trato urogenital, se indicado, bem como apoio psicológico. A gonadectomia geralmente é adiada até que a maturação sexual esteja completa durante a adolescência para permitir o desenvolvimento puberal espontâneo normal. 3 Se diagnosticada no início da infância, a gonadectomia precoce pode ser considerada se a criança apresentar massas inguinais ou labiais dolorosas ou desconfortáveis, mas exigirá TRH subsequente para induzir a puberdade aproximadamente aos 11 a 12 anos de idade. 3 O momento da gonadectomia tornou-se controverso, com alguns pacientes e grupos de apoio à AIS defendendo a retenção de seus testículos. Uma variedade de razões foi citada por esses grupos de apoio para manter os testículos, como fatores psicológicos, riscos associados à cirurgia, desejo de preservar potencialmente a fertilidade e relutância em aderir à TRH de longo prazo. No entanto, os riscos relatados para gonadectomia laparoscópica são muito baixos, com um risco estimado de morte de 0,1 por 1000 procedimentos, e o risco de lesão intestinal ou sangramento é relatado em 2,4%. 11 Além disso, um estudo de Hannema et al. examinou os testículos de 44 pacientes com CAIS e descobriu que as células germinativas diminuíram rapidamente em número após o primeiro ano de vida e não encontraram evidências de espermatogênese em nenhum dos testículos, tornando a fertilidade altamente improvável para pacientes com CAIS. 12 Para pacientes com CAIS que decidem manter seus testículos, foi relatado que o risco de desenvolver tumores de células germinativas (TCG) aumenta com a idade. 11 É importante manter um acompanhamento rigoroso por meio de vigilância ativa, utilizando imagens regulares (ultrassom e/ou ressonância magnética) e marcadores sanguíneos séricos para rastrear o potencial desenvolvimento de TCG nesses pacientes. 13 Embora a ressonância magnética possa detectar alterações benignas, como cistos paratesticulares e adenomas, ela não pode detectar alterações pré-malignas, como neoplasia de células germinativas in situ (GCNIS), o que exigiria uma biópsia das gônadas.14 Além disso, a qualidade da triagem ultrassonográfica geralmente depende do operador. Uma abordagem proposta por Wunsch et al. para pacientes que desejam reter seus testículos, seria realizar biópsia gonadal laparoscópica e fixar cirurgicamente as gônadas intra-abdominais próximas à parede abdominal para permitir melhor visualização via ultrassom. 15
O objetivo principal da realização da gonadectomia no contexto da CAIS é diminuir o risco de malignidade futura. Como em outras formas de criptorquidia, há um risco aumentado de desenvolver TCG. No CAIS, o risco de desenvolver TCG pré-púbere entre esses pacientes é considerado muito baixo, variando de 0.8 a 2.0%. 16 Após a puberdade, esse risco aumenta com a idade e é estimado em cerca de 15% (varia de 0 a 22%). 11 Defende-se que a gonadectomia profilática ocorra no período pós-puberal, quando a feminização é completada em parte pelo estrogênio testicular que é parcialmente derivado da conversão de andrógenos em estrogênio. 3, 8 Adiar a gonadectomia até mais tarde na adolescência também permite que os profissionais de saúde obtenham o consentimento informado diretamente de seus pacientes.
Ao avaliar crianças, cujo eixo HPO ainda é imaturo, um teste de estimulação de hCG é necessário para avaliar adequadamente a secreção de testosterona das células de Leydig. 17 Após a gonadectomia, esses pacientes precisarão de terapia de suplemento hormonal de longo prazo com reposição de estrogênio até a idade da menopausa natural (cerca de 50 a 52 anos de idade) para manter o desenvolvimento normal das mamas e dos ossos, o bem-estar psicossocial e a função sexual. 18 Como essas pacientes não têm útero, as progestinas não são necessárias para complementar a terapia com estrogênio. 17 Essas pacientes continuarão a manter as características sexuais femininas secundárias normais e podem atingir a função sexual normal, mas podem necessitar de terapia de dilatação vaginal ou vaginoplastia, dependendo da adequação do canal vaginal. 17 Questões de infertilidade e identidade de gênero podem ter um forte impacto psicossocial para esses pacientes, e é fortemente encorajado oferecer aconselhamento ou terapia de grupo de apoio como parte de uma abordagem multidisciplinar. 9
CAIS (anteriormente conhecida como síndrome de Morris) representa uma das causas definíveis mais comuns de DDS 46, XY. Resulta de uma rara mutação ligada ao cromossomo X do RA que causa resistência periférica a andrógenos. Esses pacientes nascem fenotipicamente femininos com genitália externa feminina normal. Comumente, essas pacientes se apresentam na adolescência com amenorreia primária, onde o exame subsequente revelará que essas pacientes têm uma bolsa vaginal cega e ausência de órgãos sexuais femininos internos nos exames de imagem. Em vez de ovários, esses pacientes têm testículos que podem ser encontrados no abdômen, canal inguinal ou lábios. Em crianças ou bebês, a CAIS pode se apresentar como uma hérnia ou massa inguinal, em que aproximadamente 1–2% das crianças do sexo feminino com hérnias inguinais apresentam criptorquidia com cariótipo 46,XY. 7 Neste caso específico, nosso paciente tinha história cirúrgica pregressa de herniorrafia inguinal bilateral quando criança. Isso sugere um diagnóstico perdido ou tardio e destaca a importância de manter uma forte suspeita clínica de CAIS em pacientes pediátricas do sexo feminino que apresentam hérnias inguinais bilaterais, o que justifica um exame mais aprofundado para descartar criptorquidia.
O risco estimado para pacientes com EIA que desenvolvem TCG está inversamente relacionado ao grau de resistência androgênica. Pacientes com CAIS têm mutações mais graves de seu AR que inferem uma perda completa da função. Sem estimulação androgênica, a espermatogênese é prejudicada e há um rápido declínio associado no número de células germinativas após o primeiro ano de vida que, teoricamente, confere um risco reduzido de desenvolver TCG mais tarde na vida. 14 Isso contrasta com os pacientes com PAIS, que ainda mantêm algum grau de função AR e, portanto, são mais propensos a ter células germinativas sobreviventes, o que subsequentemente os coloca em maior risco de desenvolver TCG na idade adulta. 19 Historicamente, Manuel et al. relataram um risco cumulativo de 3,6% de TCG em pacientes com DDS contendo Y até a idade de 25 anos, que aumentou para 33% aos 50 anos de idade. 20 Mais recentemente, Deans et al. descobriram em sua revisão que os pacientes com CAIS tinham um risco 15% maior de desenvolver uma malignidade gonadal na idade adulta (variação de 0 a 22%). 11 Cools et al. descobriram que o risco estimado de desenvolver TCG em pacientes com CAIS antes da puberdade era muito menor, de 0,8 a 2%. 16
Devido ao aumento do risco de malignidade gonadal entre pacientes com CAIS na idade adulta, a recomendação atual é realizar gonadectomia após a maturação sexual completa, geralmente por volta dos 15 a 16 anos de idade, pois o risco de desenvolver tumores antes da puberdade é considerado relativamente baixo. 21 Essa abordagem permite o desenvolvimento espontâneo da mama e uma melhor mineralização óssea durante a puberdade devido à produção fisiológica de hormônios pelos testículos e subsequente conversão de andrógenos periféricos em estrogênios. 3, 8 Historicamente, laparotomia e gonadectomia bilateral foram realizadas em pacientes com cromossomo Y contendo DDS. Com o tempo, os procedimentos laparoscópicos tornaram-se amplamente adotados para pacientes com DDS devido às vantagens associadas de ampliação e fácil acesso à cavidade pélvica por meio de uma abordagem minimamente invasiva, que proporciona menor recuperação pós-operatória e tempo de internação, além de melhora da estética. 22, 23
A gonadectomia laparoscópica é realizada enquanto o paciente está sob anestesia geral por meio de intubação endotraqueal. O monitor de vídeo, o insuflador e a fonte de luz são posicionados ao pé do paciente. Neste caso, a insuflação do abdome foi realizada por meio de uma técnica de laparoscopia aberta, onde foi feita uma incisão semilunar na face inferior do umbigo e a fáscia foi elevada com hemostáticos. Uma agulha de Veress foi então colocada no abdome, e sua posição correta foi confirmada por meio de um teste de queda salina. Um trocarte Step de 10 mm foi então inserido através do umbigo e CO2 foi usado para obter pneumoperitônio. Umlaparoscópio 0o foi então introduzido no abdome. Dois trocartes adicionais de 5 mm para instrumentos de trabalho foram colocados ao nível do umbigo nos lados direito e esquerdo. O paciente foi então colocado em posição de Trendelenburg, o que permite uma inspeção laparoscópica mais fácil da pelve para determinar a localização das gônadas e inspecionar os órgãos pélvicos. Quando as gônadas não são prontamente aparentes, identificar e seguir os vasos gonadais pode ajudar a localizá-los. 1
Durante a laparoscopia, as gônadas de nosso paciente foram anotadas acima dos anéis internos fechados bilateralmente. Macroscopicamente, os cistos foram visualizados nos testículos bilaterais. O ducto deferente atravessava a uretra e não havia evidência de nenhuma estrutura mülleriana dentro da pelve. Um plano foi dissecado através do peritônio posterior ao redor das gônadas, afastando-se das outras estruturas retroperitoneais. É importante determinar a localização e o curso das estruturas retroperitoneais, como os ureteres e os vasos ilíacos, para evitar lesão iatrogênica. Os vasos espermáticos internos foram então identificados à medida que se transpõem à gônada e fulgurados usando o dispositivo Ligasure em quatro seções sucessivas antes de se cruzarem para reduzir a probabilidade de sangramento. Os testículos foram então mobilizados a partir do peritônio, e os ductos deferentes também foram fulgurados e divididos de maneira semelhante. O laparoscópio foi inserido através de uma das portas de trabalho para que as gônadas pudessem ser removidas através da porta umbilical central de 10 mm. O pneumoperitônio CO2 abdominal foi então revertido e a fáscia umbilical foi fechada com sutura Vicryl 2-0. A pele em todos os locais do porto foi fechada com Monocryl 5-0 e coberta com Dermabond.
Ambas as gônadas foram excisadas sem complicações e enviadas para avaliação anatomopatológica. O tempo operatório da gonadectomia laparoscópica, desde a incisão até o fechamento, foi de aproximadamente 80 minutos. Houve menos de 5 mL de perda sanguínea estimada. O paciente foi internado durante a noite para observação devido a fatores sociais. Ela tolerou bem o procedimento, sua dor foi bem controlada usando o controle multimodal da dor e ela recebeu alta para casa na manhã seguinte. Ela estava programada para acompanhamento em duas semanas com seu ginecologista para iniciar a terapia de reposição de estrogênio.
É significativo notar que, sob laparoscopia, fomos capazes de visualizar o ducto deferente bilateral que se estendia até a uretra. Uma série de casos de 44 pacientes com CAIS por Hannema et al. descobriu que 36% tinham epidídimo ou ducto deferente presentes. 12 Hannema et al. levantaram a hipótese de que a atividade androgênica parácrina residual pode ser capaz de induzir o desenvolvimento de produtos do ducto de Wolff, mesmo em pacientes com formas completas de EIA. 12
A patologia cirúrgica de nossa paciente confirmou que ambas as gônadas eram de fato testículos atróficos. Curiosamente, ambos os testículos demonstraram GCNIS e hiperplasia acentuada de células de Leydig (Figuras 1-2). As células neoplásicas coram com OCT3/4 e PLAP (Figuras 3–4). A hiperplasia de células de Leydig, como observada neste paciente, é um achado comum em pacientes com CAIS. 24 Foi proposto que altos níveis de LH, devido à falta de feedback negativo de andrógenos na hipófise anterior, são responsáveis pelo aumento da celularidade de Leydig. 25 O GCNIS é considerado um tumor pré-maligno, onde até 50% progredirá para GCT dentro de 5 anos. 26 O risco de progressão do GCNIS para GCT invasivo é menos certo em pacientes com CAIS. A "teoria da falta de andrógenos" proposta por Kaprova-Pleskacova et al., sugere que os pacientes com CAIS têm menos probabilidade de progredir para TCG do que os pacientes com PAIS devido à resposta androgênica insuficiente para promover a sobrevivência de células germinativas anormais. 27 Por outro lado, Kaprova-Pleskacova et al. também sugeriram que a mesma atividade andrógena parácrina potencialmente responsável pela indução do desenvolvimento do ducto de Wolff, conforme mencionado por Hannema et al.,12 também poderia promover o GCNIS a se transformar em GCT invasivo. 27 A presença de ducto deferente e evidência histológica de GCNIS em nosso paciente sugere potencial resposta andrógena parácrina residual. Como tal, acreditamos que este caso ajuda a apoiar o argumento para o benefício potencial da gonadectomia profilática entre pacientes com CAIS.
A patologia cirúrgica de nosso paciente também foi significativa para leiomiomas paratesticulares bilaterais (Figura 5), um tumor de músculo liso que muito raramente ocorre no trato urogenital. Sua localização pode ser intratesticular ou paratesticular e acredita-se que seja derivada das células musculares lisas do estroma intersticial, da camada muscular dos vasos da túnica albugínea, dos túbulos seminíferos, bem como das estruturas paratesticulares, como o cordão espermático, epidídimo, remanescentes vestigiais e a túnica vaginal. 28 Leiomiomas são muito raramente descritos em pacientes com EIA. De fato, houve apenas quatro relatos de casos na literatura descrevendo a presença de leiomiomas na biópsia após gonadectomia em pacientes com AIS. 28-31 Até onde sabemos, este é o primeiro caso documentado de leiomiomas paratesticulares bilaterais que se desenvolvem concomitantemente com GCNIS em um paciente com CAIS.
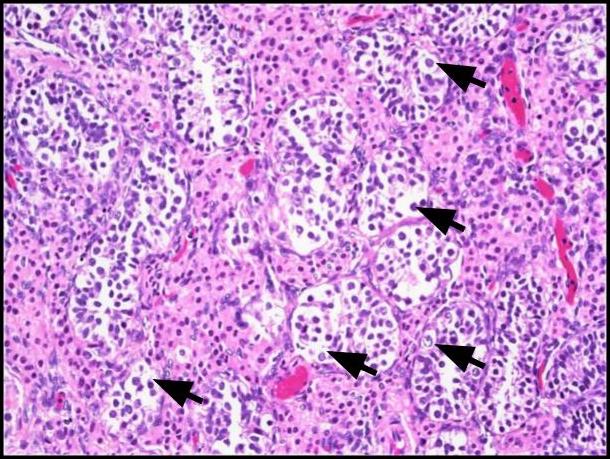
Figura 1. Neoplasia de células germinativas in situ (GCNIS). Grandes células atípicas (setas pretas) com citoplasma abundante claro a fracamente eosinofílico, um núcleo central com o nucléolo proeminente e cromatina uniformemente distribuída são vistas. H&E, 200x.
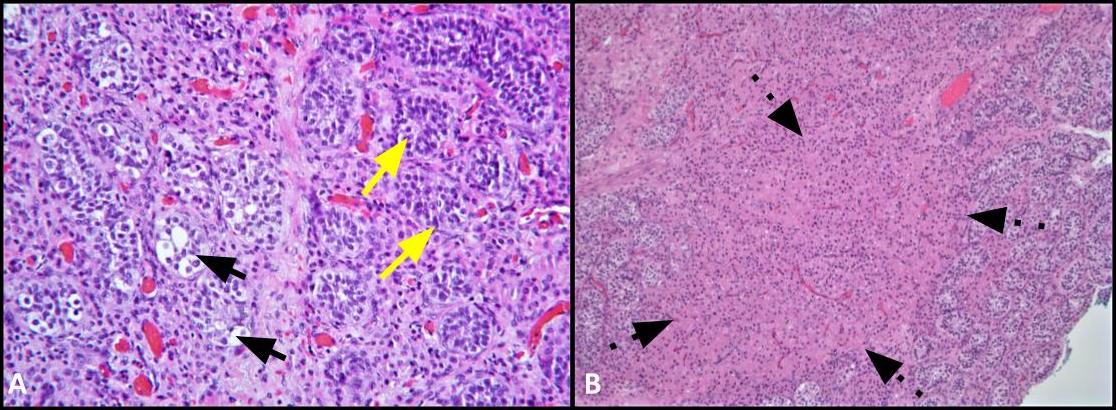
Figura 2. A) Esta imagem mostra a comparação dos túbulos envolvidos pelo GCNIS (setas pretas) com os túbulos seminíferos adjacentes com espermatogênese normal (setas amarelas); H&E, 200x. B) Imagem de baixa potência mostra aglomerados de células de Leydig dentro do interstício (setas tracejadas); H&E, 100x.
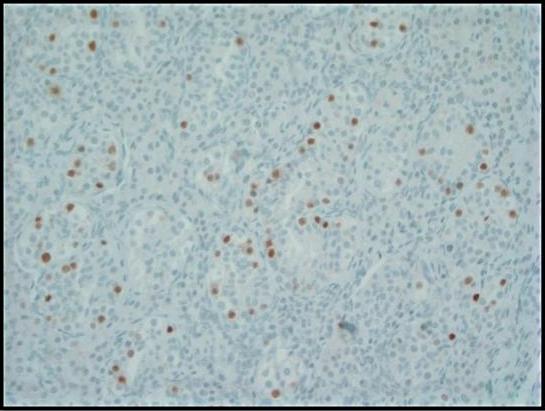
Figura 3. A coloração imuno-histoquímica para o fator de transcrição de ligação ao octâmero (OCT) 3/4 mostra forte imunorreatividade nuclear nas células GCNIS dentro dos túbulos seminíferos. As células germinativas normais são negativas; 200x.
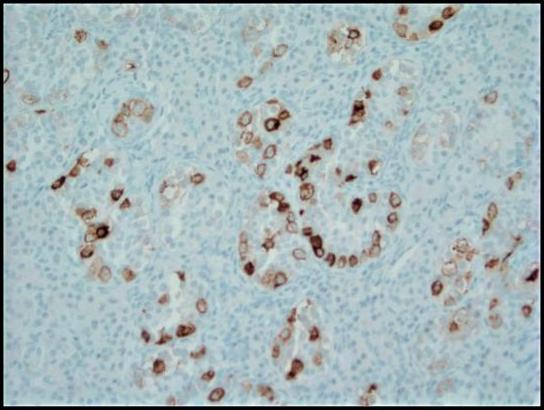
Figura 4. A coloração imuno-histoquímica com fosfatase alcalina placentária (PLAP) destaca as células tumorais do GCNIS em um padrão membranoso citoplasmático; 200x.
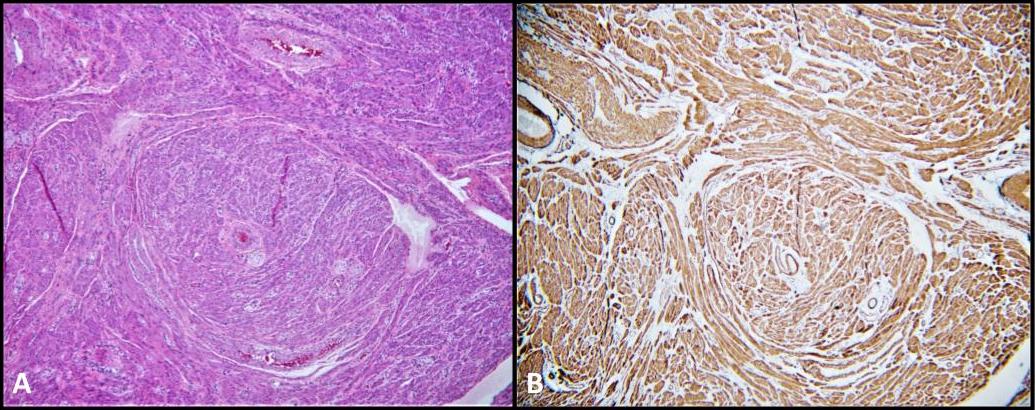
Figura 5. A) Leiomioma; H&E, 100x. Fascículos de células musculares lisas espigadas. B) A coloração citoplasmática da actina de músculo liso (SMA) é difusa e forte.
Nenhum equipamento específico usado.
Nada a divulgar.
O paciente referido neste artigo em vídeo deu seu consentimento informado para ser filmado e está ciente de que informações e imagens serão publicadas online.
References
- Calvo A, Escolino M, Settimi A, Roberti A, Caprio MG, Esposito C. Abordagem laparoscópica para gonadectomia em pacientes pediátricos com distúrbios intersexuais. Transl Pediatr. 2016; 5(4):295-304. https://doi.org/10.21037/tp.2016.09.06
- Kusumi M, Mitsunami M, Onoue H, et al. Síndrome de insensibilidade androgênica completa e níveis hormonais anti-müllerianos antes e depois da gonadectomia laparoscópica. Gynecol Minim Invasivo Ther. 2017; 6(3):126-128. https://doi.org/10.1016/j.gmit.2016.11.001
- Cheikhelard A, Thibaud E, Morel Y, et al. Síndrome de insensibilidade androgênica completa: diagnóstico e tratamento. Especialista Rev Endocrinol Metab. 2009; 4(6):565-573. https://doi.org/10.1586/eem.09.31
- Lanciotti L, Cofini M, Leonardi A, Bertozzi M, Penta L, Esposito S. Diferentes apresentações clínicas e tratamento na síndrome de insensibilidade androgênica completa (CAIS). Int J Environ Res Saúde Pública. 2019; 16(7):1268. https://doi.org/10.3390/ijerph16071268
- Grasso D, Borreggine C, Campanale C, Longo A, Grilli G, Macarini L. Utilidade e papel da ressonância magnética em um caso de síndrome de insensibilidade androgênica completa. Representante do Caso Radiol. 2015; 10(2):1119. https://doi.org/10.2484/rcr.v10i2.1119
- Nezzo M, De Visschere P, T'Sjoen G, Weyers S, Villeirs G. Papel da imagem no diagnóstico e tratamento da síndrome de insensibilidade androgênica completa em adultos. Representante do Caso Radiol. 2013;2013:158484. https://doi.org/10.1155/2013/158484
- Viner RM, Teoh Y, Williams DM, Patterson MN, Hughes IA. Síndrome de insensibilidade androgênica: uma pesquisa sobre procedimentos diagnósticos e tratamento no Reino Unido. Arch Dis Criança. 1997; 77(4):305-309. https://doi.org/10.1136/adc.77.4.305
- Galani A, Kitsiou-Tzeli S, Sofokleous C, Kanavakis E, Kalpini-Mavrou A. Síndrome de insensibilidade a andrógenos: características clínicas e defeitos moleculares. Hormônios (Atenas). 2008; 7(3):217-229. https://doi.org/10.14310/horm.2002.1201
- Wisniewski AB, Migeon CJ, Meyer-Bahlburg HF, et al. Síndrome de insensibilidade androgênica completa: resultado médico, cirúrgico e psicossexual a longo prazo. J Clin Endocrinol Metab. 2000; 85(8):2664-2669. https://doi.org/10.1210/jcem.85.8.6742
- Hughes IA, Davies JD, Bunch TI, Pasterski V, Mastroyannopoulou K, MacDougall J. Síndrome de insensibilidade a andrógenos. Lanceta. 2012; 380(9851):1419-1428. https://doi.org/10.1016/S0140-6736(12)60071-3
- Reitores R, Creighton SM, Liao LM, Conway GS. Momento da gonadectomia em mulheres adultas com síndrome de insensibilidade androgênica completa (CAIS): preferências do paciente e evidências clínicas. Clin Endocrinol (Oxf). 2012; 76(6):894-898. https://doi.org/10.1111/j.1365-2265.2012.04330.x
- Hannema SE, Scott IS, Rajpert-De Meyts E, Skakkebaek NE, Coleman N, Hughes IA. Desenvolvimento testicular na síndrome de insensibilidade androgênica completa. J Pathol. 2006; 208(4):518-527. https://doi.org/10.1002/path.1890
- Döhnert U, Wünsch L, Hiort O. Gonadectomia na síndrome de insensibilidade androgênica completa: por que e quando? Desenvolvimento Sexual. 2017; 11(4):171-174. https://doi.org/10.1159/000478082
- Chaudhry S, Tadokoro-Cuccaro R, Hannema SE, Acerini CL, Hughes IA. Frequência de tumores gonadais na síndrome de insensibilidade androgênica completa (CAIS): uma análise retrospectiva de séries de casos. J Pediatr Urol. 2017; 13(5):498.e491-498.e496. https://doi.org/10.1016/j.jpurol.2017.02.013
- Wünsch L, Holterhus PM, Wessel L, Hiort O. Pacientes com distúrbios do desenvolvimento sexual (DDS) em risco de desenvolvimento de tumor gonadal: manejo baseado em biópsia laparoscópica e diagnóstico molecular. BJU Int. 2012; 110(11 Pt C):E958-965. https://doi.org/10.1111/j.1464-410X.2012.11181.x
- Esfria M, Drop SL, Wolffenbuttel KP, Oosterhuis JW, Looijenga LH. Tumores de células germinativas na gônada intersexo: velhos caminhos, novas direções, fronteiras móveis. Endocr Rev. 2006; 27(5):468-484. https://doi.org/10.1210/er.2006-0005
- Batista RL, Costa EMF, Rodrigues AdS, et al. Síndrome de insensibilidade androgênica: uma revisão. Arquivos de Endocrinologia e Metabolismo. 2018;62:227-235. https://doi.org/10.20945/2359-3997000000031
- Bertelloni S, Meriggiola MC, Dati E, Balsamo A, Baroncelli GI. Densidade mineral óssea em mulheres que vivem com síndrome de insensibilidade androgênica completa e testículos intactos ou gônadas removidas. Desenvolvimento Sexual. 2017; 11(4):182-189. https://doi.org/10.1159/000477599
- Pyle LC, Nathanson KL. Um guia prático para avaliar a predisposição do tumor de células germinativas gonadais nas diferenças de desenvolvimento sexual. Am J med genet c semin med genet. 2017; 175(2):304-314. https://doi.org/10.1002/ajmg.c.31562
- Manuel M, Katayama PK, Jones HW, Jr. A idade de ocorrência de tumores gonadais em pacientes intersexuais com cromossomo Y. Am J Obstet Gynecol. 1976; 124(3):293-300.
https://doi.org/10.1016/0002-9378(76)90160-5 - Chertin B, Koulikov D, Alberton J, Hadas-Halpern I, Reissman P, Farkas A. O uso da laparoscopia em pacientes intersexuais. Pediatr Surg Int. 2006; 22(5):405-408. https://doi.org/10.1007/s00383-006-1662-3
- Esegbona G, Cutner A, Cuckow P, Creighton S. Gonadectomia laparoscópica em meninas pediátricas e adolescentes com distúrbios intersexuais. BJOG: Um Jornal Internacional de Obstetrícia e Ginecologia. 2003; 110(2):210-212. PMID: 12618168.
- Cools M, Looijenga L. Atualização sobre a fisiopatologia e fatores de risco para o desenvolvimento de tumores malignos de células germinativas testiculares na síndrome de insensibilidade androgênica completa. Desenvolvimento Sexual. 2017; 11(4):175-181. https://doi.org/10.1159/000477921
- Jockenhövel, Rutgers JK, Mason JS, Griffin JE, Swerdloff RS. Neoplasia de células de Leydig em paciente com síndrome de Reifenstein. Exp Clin Endocrinol. 1993; 101(6):365-370.
- Akyüz M, Topaktaş R, Ürkmez A, Koca O, Öztürk M. Avaliação da neoplasia de células germinativas in situ em tumores testiculares. Turk J Urol. 2019; 45(6):418-422. https://doi.org/10.5152/tud.2018.48855
- Kaprova-Pleskacova J, Stoop H, Brüggenwirth H, et al. Síndrome de insensibilidade androgênica completa: fatores que influenciam a histologia gonadal, incluindo patologia de células germinativas. Patologia Moderna. 2014; 27(5):721-730. https://doi.org/10.1038/modpathol.2013.193
- Síndrome de insensibilidade androgênica completa associada a adenomas bilaterais de células de Sertoli e leiomiomas paratesticulares: relato de caso e revisão da literatura. J Pediatr Urol. 2013; 9(1):e31-34. https://doi.org/10.1016/j.jpurol.2012.06.013
- Goulis DG, Iliadou PK, Papanicolaou A, et al. Mutação R831X do gene do receptor de andrógeno em um adolescente com síndrome de insensibilidade androgênica completa e hamartomas testiculares bilaterais. Hormônios (Atenas). 2006; 5(3):200-204. https://doi.org/10.14310/horm.2002.11185
- Krichen Makni S, Mnif Hachicha L, Ellouze S, et al. Síndrome testicular feminizante com múltiplos hamartomas e leiomiomas paratesticulares bilaterais. Rev Med Interne. 2005; 26(12):980-983. https://doi.org/10.1016/j.revmed.2005.08.003
- Savaş-Erdeve Ş, Aycan Z, Keskin M, et al. Síndrome de insensibilidade androgênica completa associada a adenomas bilaterais de células de Sertoli e leiomioma paratesticular unilateral: relato de caso. O Jornal Turco de Pediatria. 2016; 58(6):654-657. https://doi.org/10.24953/turkjped.2016.06.012
Cite this article
Norton JC, Singh A, Hollenbach LL, Gamble G, Gonzalez-Krellwitz LA, Canon SJ. Gonadectomia bilateral laparoscópica profilática para síndrome de insensibilidade androgênica completa. J Med Insight. 2021; 2021(313). DOI:10.24296/jomi/313.
