완전한 안드로겐 무감각 증후군에 대한 예방 복강경 양측 임질 절제술
1; 2; 3; 3; 2; 4
1Department of Urology, University of Arkansas for Medical Sciences
2Department of Pathology, University of Arkansas for Medical Sciences / Arkansas Children’s Hospital
3Department of Obstetrics and Gynecology, University of Arkansas for Medical Sciences
4Department of Pediatric Urology, Arkansas Children’s Hospital
Main Text
안드로겐 무감각 증후군 (AIS)은 안드로겐 수용체의 X- 연관 돌연변이로 인해 발생하는 드문 질환으로 100,000 명당 1-5 명의 발병률로 추정됩니다. 안드로겐 내성의 중증도에 따라 완전, 부분 또는 경증에 대해 다양한 정도의 표현이 존재합니다. 완전한 AIS(CAIS) 환자는 표현형 여성으로 태어났지만 난소 대신 남성 XY 염색체와 고환을 가지고 있습니다. 그들은 유방 발달 및 외부 여성 생식기와 같은 정상적인 2차 여성 성징을 나타내지만 Müllerian 억제 인자(MIF)의 고환 생성으로 인해 자궁 및 기타 Müllerian 덕트 구조가 부족합니다. 안드로겐 저항성으로 인해 안드로겐 의존성 Wolffian 덕트 생성물은 부고환, 정관 및 정낭과 같이 발달하지 못합니다. 이 환자들은 종종 사타구니 탈장 또는 음순 하 종괴가있는 유아기 또는 원발성 무월경이있는 청소년기에 나타납니다. 신체 검사에서 그들은 일반적으로 정상적인 유방 발달을 가지며 음모 또는 겨드랑이 털이 없으며 다양한 질 길이의 맹인 질 주머니를 갖게 됩니다. 진단 정밀 검사는 종종 초음파 또는 MRI, 혈청 호르몬 수치 및 핵형 분석을 사용하여 수행됩니다.
CAIS 환자의 경우, 고환은 사타구니 운하 내, 음순 하 또는 복부 내에있을 수 있습니다. 사춘기 이후 복강 내 고환 환자는 생식 세포 종양 (GCT) 발병 위험이 15 % 증가합니다 (범위 0-22 %). 관리는 정상적인 사춘기 발달을 유지하고 적절한 뼈 건강을 촉진하기 위해 후속 호르몬 대체 요법(HRT)과 함께 예방적 생식선 절제술로 구성됩니다. 예방적 생식선 절제술의 시기에 대한 논쟁은 장기 호르몬 요법에 대한 우려와 생식력 보존에 대한 열망을 이유로 생식선 절제술에 반대하는 일부 환자 지원 그룹과 함께 진행 중입니다. 현재의 관례는 사춘기 전 GCT 발병 위험이 상대적으로 낮기 때문에 생리적 사춘기가 달성 될 때까지 생식선 절제술을 연기하는 것을 촉진합니다 (0.8-2 %). 양측 복강경 생식선 절제술을 통한 CAIS 관리를 위한 프레젠테이션, 진단, 수술 중 기술 및 수술 후 고려 사항을 간략하게 설명합니다.
생식선 절제술은 생식선 악성 종양의 위험 증가로 인해 Y 염색체 생식선을 보유한 성적 발달 차이 (DSD)가있는 어린이에게 표시 될 수 있습니다. 1 그러한 DSD 중 하나는 안드로겐 수용체 (AR)의 X- 연관 돌연변이에 의해 유발되는 안드로겐 무감각 증후군 (AIS)입니다. 2 AIS는 100,000명당 1-5명의 발병률로 추정되는 드문 진단이다. 3 AIS는 안드로겐 내성의 중증도에 따라 완전(CAIS), 부분적(PAIS) 및 경증(MAIS)에 이르기까지 다양한 정도의 표현을 가질 수 있습니다. 4 CAIS를 가진 아이들은 정상적인 여성 외부 생식기를 가진 표현형 여성이지만 난소 대신 고환을 가지고 있으며 남성 핵형을 가지고 있습니다 (46, XY). 이 환자들에서 고환은 테스토스테론을 생산할 수 있지만 AR 기능의 결함으로 인해 부고환, 정관 및 정낭과 같은 Wolffian 덕트 제품을 생성하지 못합니다. 이 테스토스테론이 에스트로겐으로 말초 방향화되기 때문에이 환자들은 유방 발달과 같은 정상적인 2 차 여성 성징을 가지고 있습니다. 그럼에도 불구하고, 고환의 Sertoli 세포는 Müllerian 덕트 유도체의 발달을 억제하는 Müllerian 억제 인자 (MIF)를 계속 생성합니다. 그 결과 자궁, 자궁 경부 및 나팔관과 같은 다른 여성 성기가없는 맹인 질 주머니가있는 환자가 발생합니다. 5 이 환자들에서 고환은 사타구니 운하 내에 위치하거나, 음순 하 있거나, 복부 내에있을 수 있습니다. 6 안드로겐 둔감증이 있는 영아는 편측성 또는 양측 사타구니 탈장 또는 음순 종괴를 나타낼 수 있다. 여아의 양측 사타구니 탈장의 1-2%가 CAIS 진단을 나타낼 수 있는 것으로 추정되며 평가 중에 강력한 임상적 의심을 유지하는 것이 중요합니다. 7 고전적으로, CAIS는 청소년기에 정상적인 유방 발달을 가진 소녀의 일차 무월경으로 나타나지만 검사에서 음모 또는 겨드랑이 털이 거의 또는 전혀 없습니다. CAIS는 비정상적인 고환 발달뿐만 아니라 사춘기 이후 생식 세포 악성 종양의 위험 증가와 관련이 있습니다. 8
이 환자는 병적 비만 (BMI 45), CPAP의 폐쇄성 수면 무호흡증, 현재 메트포르민을 복용중인 당뇨병 전 증상 (HbA1c 5.5)의 과거 병력이있는 아시아 출신의 15 세 여성입니다. 그녀는 어린 시절 양측 사타구니 탈장 수리의 과거 수술 이력이 있습니다. 그녀는 이전 임신 병력이없고 성적으로 활동적이지 않으며 원발성 무월경에 대한 추가 평가를 위해 우리 클리닉에 의뢰되었습니다. 그녀는 11세에 테라슈가 생겼지만 겨드랑이와 음모가 드물고 여드름의 징후가 없다고 보고합니다. 또한 그녀는 통증, 질 분비물, 다모증 또는 유즙 분비를 부인합니다. 외부 클리닉에서 우리 환자는 프로게스틴 챌린지 후 출혈을 거부했으며 이전 골반 검사에서 자궁 경부가 촉진되지 않았습니다.
환자의 가족력에 따르면 그녀에게는 19세, 21세, 26세의 세 명의 누나가 있습니다. 그녀의 어머니는 14 세에 월경을 시작했습니다. 그녀의 26 세와 19 세 자매도 11 세 경에 시작된 정기적 인 월경을 가지고 있다고보고했으며, 가장 오래된 자매는 4 명의 건강한 자녀를 낳았습니다. 흥미롭게도, 그녀의 21 세 여동생은 원인을 알 수없는 원발성 무월경 평가를 위해 타주 의사에게 진찰을 받았습니다. 그녀는 질 틈새가 출산하기에 불충분하다는 말을 듣고 추가 평가를 위해 전문가에게 의뢰되었지만 후속 조치를 취하지 못했습니다.
신체 검사에서 환자는 비만이었고 겨드랑이 털이 희박하고 여드름의 징후가없는 태너 5 단계 유방 발달이있었습니다. 비뇨 생식기 검사에서 환자는 음모가 드문 정상적인 외부 여성 생식기를 가졌습니다. 질은 외관상 정상이었고 비정상적인 분비물이 없었으며 눈이 먼 질 주머니였습니다. 우리는 시험에서 자궁 경부 나 자궁을 시각화하거나 촉지 할 수 없었다. 검사 결과는 잠재적인 선천성 기형에 대해 일관되었습니다. 그런 다음 적절한 실험실 및 영상 검사가 주문되었습니다.
실험실 결과:
| 테스트 | 결과 | 참조 |
| B-hCG | 마이너스 | 마이너스 |
| 증권 시세 표시기 | 13.20 밀리칼로리 / 밀리리터 | 5–20 밀리엘유/밀리리터 |
| 증권 시세 표시기 | 22.20 밀리칼로리 / 밀리리터 | 5–20 밀리엘유/밀리리터 |
| 프로락틴 | 8.1 응 / 밀리람베르트 | 3.0–18.6 응/밀리람베르트 |
| 에스트라 디올 | 38.33 페이지 / 밀리리터 |
34–170 PG / mL (여성 태너 스테이지 5) |
| 남성 호르몬 | 269 초당 일드 |
20–38 응/일 (여성 태너 스테이지 5) |
| 증권 시세 표시기 | 1.94 밀리 IU / L | 0.47–4.68 밀리유 / L |
| 염색체 분석 | 46, XY |
여성 : 46, XX 남성 : 46, XY |
초기 실험실은 난포 자극 호르몬(FSH), 황체 형성 호르몬(LH), 프로락틴 및 테스토스테론과 같은 시상하부-뇌하수체-난소(HPO) 축과 관련된 문제를 평가하기 위해 그려졌습니다. 또한 임신을 배제하기 위해 소변 베타 -hCG를 실시했습니다. 우리 환자를위한 실험실은 정상적인 여성 환자와 비교할 때 테스토스테론 수치가 높다는 것을 보여주었습니다. 또한, 우리 환자에 대한 핵형 분석 결과 46, XY 염색체가 나왔습니다. 함께, 이러한 발견은 뇌하수체 전엽에 대한 안드로겐 음성 피드백의 손상으로 인해 테스토스테론 수치 상승 (비정상적인 여성 범위이지만 정상 남성 범위)과 높은 혈청 LH 수치가 발생하는 CAIS 진단과 일치합니다.
골반 초음파를 통한 영상은 자궁 및 기타 여성 성기의 유무를 평가하도록 지시되었습니다. 외부 병원에서 실시한 초음파 영상은 자궁, 나팔관 및 자궁 경부가 없음을 보여주었습니다. 또한 영상에서 난소가 없는 것으로 나타났고 잠재적인 복강 내 고환의 위치를 정확하게 평가할 수 없었습니다. 초음파는 작업자에 따라 다를 수 있으며 MRI는 복강경 생식선 절제술 및 생식선 감시를 위한 수술 계획에서 생식선을 진단하고 찾는 황금 표준으로 널리 간주됩니다. 5
Wisniewski et al .의 한 연구는 생식선 절제술 후 장기 호르몬 대체 요법 (HRT)을받은 CAIS 여성 14 명을 대상으로 장기적인 결과를 조사했습니다. 9 그들은 전반적으로 이 여성들이 정상적인 활동적인 수명을 기대할 수 있음을 발견했습니다. 이 여성의 대다수는 정상 성인 여성의 키에 대한 90번째 백분위수를 초과했으며,9 평균 여성보다 키가 크지만 여전히 정상 남성 인구보다 키가 작습니다. 10 이 여성들 사이에서 진단된 가장 흔한 의학적 상태는 골다공증이었습니다. 대다수의 여성은 이성애 여성의 성 정체성을 가진 것으로 확인되었으며 그들 중 누구도 성 반전 수술을 원하지 않았습니다. 대다수는 성적 기능에 만족한다고보고했습니다. 이 코호트의 평균 질 길이는 8.8cm였으며 이는 7-11cm 범위의 정상적인 질 길이와 일치합니다.9
현재 CAIS 환자에서 AR의 근본적인 유전 적 돌연변이를 되돌릴 수있는 치료법은 없습니다. 따라서 치료는 후속 HRT로 인한 잠재적 인 생식선 악성 종양을 예방하기위한 예방 적 생식선 절제술, 지시가있는 경우 비뇨 생식기 치료 및 심리적 지원에 중점을 둡니다. Gonadectomy는 일반적으로 정상적인 자발적인 사춘기 발달을 허용하기 위해 청소년기에 성적 성숙이 완료 될 때까지 지연됩니다. 3 유아기 또는 아동기 초기에 진단된 경우, 아동이 고통스럽거나 불편한 사타구니 또는 음순 종괴를 보이는 경우 조기 생식선 절제술을 고려할 수 있지만 대략 11-12세에 사춘기를 유도하기 위해 후속 HRT가 필요합니다. 3 생식선 절제술의 시기는 일부 환자와 AIS 지원 그룹이 고환 유지를 옹호하면서 논란이 되고 있다. 이러한 지원 그룹은 심리적 요인, 수술과 관련된 위험, 잠재적으로 생식력을 보존하려는 욕구, 장기 HRT 준수를 꺼리는 것과 같은 고환을 유지하는 다양한 이유를 인용했습니다. 그럼에도 불구하고 복강경 생식선 절제술에 대한보고 된 위험은 매우 낮으며 사망 위험은 1000 건당 0.1 건이며 장 손상 또는 출혈 위험은 2.4 %로보고됩니다. 11 또한, Hannema et al.의 연구에 따르면 CAIS 환자 44명의 고환을 조사한 결과 생후 1년 이후 생식 세포의 수가 급격히 감소했으며 고환에서 정자 형성의 증거가 발견되지 않아 CAIS 환자의 생식력이 거의 없음을 발견했습니다. 12 고환을 유지하기로 결정한 CAIS 환자의 경우 생식 세포 종양(GCT) 발병 위험이 나이가 들면서 증가하는 것으로 보고되었습니다. 11 이러한 환자에서 GCT의 잠재적 발달을 선별하기 위해 정기적인 영상(초음파 및/또는 MRI) 및 혈청 혈액 마커를 활용하여 적극적인 감시를 통해 면밀한 추적 관찰을 유지하는 것이 중요합니다. 13 MRI는 고환 주위 낭종 및 선종과 같은 양성 변화를 감지할 수 있지만 생식선 생검이 필요한 생식 세포 종양(GCNIS)과 같은 전악성 변화는 감지할 수 없습니다.14 또한 초음파 검사의 품질은 일반적으로 작업자에 따라 다릅니다. Wunsch et al .이 제안한 한 가지 접근법은 고환을 유지하려는 환자를 위해 복강경 생검을 수행하고 복벽 근처의 복강 내 생식선을 외과 적으로 고정하여 초음파를 통해 더 나은 시각화를 허용하는 것입니다. 15
CAIS 환경에서 생식선 절제술을 시행하는 주요 목표는 향후 악성 종양의 위험을 줄이는 것입니다. 다른 형태의 cryptorchidism에서와 마찬가지로 GCT 발병 위험이 증가합니다. CAIS에서 이러한 환자들 사이에서 사춘기 전 GCT가 발생할 위험은 0.8-2.0% 범위로 매우 낮은 것으로 간주됩니다. 16 사춘기 이후에는 이 위험이 나이가 들면서 증가하며 대략 15%(0-22% 범위)로 추정됩니다. 11 예방 적 생식선 절제술은 부분적으로 안드로겐의 에스트로겐으로의 전환에서 부분적으로 파생 된 고환 에스트로겐에 의해 여성화가 완료되는 사춘기 이후에 발생한다고 주장됩니다. 3, 8 청소년기 후반까지 생식선 절제술을 연기하면 의료 제공자가 환자로부터 직접 정보에 입각 한 동의를 얻을 수 있습니다.
HPO 축이 아직 미성숙 한 어린이를 평가할 때 Leydig 세포 테스토스테론 분비를 적절하게 평가하기 위해서는 hCG 자극 검사가 필요합니다. 17 생식선 절제술 후,이 환자들은 정상적인 유방과 뼈 발달, 심리 사회적 웰빙 및 성기능을 유지하기 위해 자연 폐경 (약 50-52 세)까지 에스트로겐 대체와 함께 장기 호르몬 보충 요법이 필요합니다. 18 이 환자들은 자궁이 없기 때문에 프로게스틴은 에스트로겐 요법을 보완할 필요가 없습니다. 17 이 환자들은 정상적인 2차 여성의 성징을 계속 유지하고 정상적인 성기능을 얻을 수 있지만 질관의 적절성에 따라 질 확장 요법이나 질 성형술이 필요할 수 있습니다. 17 불임과 성 정체성에 대한 질문은 이러한 환자에게 큰 심리사회적 영향을 미칠 수 있으며, 다학문적 접근의 일환으로 상담을 제공하거나 그룹 치료를 지원하는 것이 강력히 권장됩니다. 9
CAIS (이전에는 모리스 증후군으로 알려짐)는 46, XY DSD의 가장 일반적인 정의 가능한 원인 중 하나입니다. 이는 말초 안드로겐 내성을 유발하는 AR의 희귀 한 X- 연관 돌연변이로 인해 발생합니다. 이 환자들은 정상적인 여성 외부 생식기를 가진 표현형 여성으로 태어납니다. 일반적으로이 환자들은 청소년기에 원발성 무월경으로 나타나며, 후속 검사에서이 환자들은 눈이 먼 질 주머니가 있고 영상에 내부 여성 성기가 없다는 것을 알 수 있습니다. 난소 대신에이 환자들은 복부, 사타구니 운하 또는 음순에서 발견 될 수있는 고환을 가지고 있습니다. 어린이 또는 유아에서 CAIS는 사타구니 탈장 또는 종괴로 나타날 수 있으며, 사타구니 탈장이 있는 여성 영아의 약 1-2%가 46,XY 핵형을 가진 크립토키드증이 있는 것으로 밝혀졌습니다. 7 이 특정한 경우에, 우리 환자는 어린 시절 양측 사타구니 탈장 복구의 과거 수술 이력이 있었습니다. 이것은 진단을 놓치거나 지연시켰음을 시사하며, 양측 사타구니 탈장을 앓고 있는 소아 여성 환자에서 CAIS에 대한 강력한 임상적 의심을 유지하는 것의 중요성을 강조하며, 이는 cryptorchidism을 배제하기 위한 추가 검사가 필요합니다.
GCT가 발생하는 AIS 환자의 예상 위험은 안드로겐 내성 정도와 반비례합니다. CAIS 환자는 기능의 완전한 상실을 추론하는 AR의 더 심각한 돌연변이를 가지고 있습니다. 안드로겐 자극이 없으면 정자 형성이 손상되고 생후 첫해 이후 생식 세포 수가 급격히 감소하여 이론적으로 나중에 GCT 발병 위험이 감소합니다. 14 이것은 여전히 어느 정도의 AR 기능을 유지하고 있으므로 생존 한 생식 세포를 가질 가능성이 더 높은 PAIS 환자와 대조적이며, 이로 인해 성인기에 GCT 발병 위험이 증가합니다. 19 역사적으로 Manuel et al . 25세까지의 Y 함유 DSD 환자에서 GCT의 누적 위험은 3.6%였으며 50세까지 33%로 증가했습니다. 20 보다 최근에 Deans et al . 그들의 리뷰에서 CAIS 환자는 성인기에 생식선 악성 종양이 발생할 위험이 15% 증가한다는 것을 발견했습니다(범위 0–22%). 11 Cools et al . 사춘기 이전에 CAIS 환자에서 GCT가 발생할 것으로 예상되는 위험은 0.8-2 %로 훨씬 낮았습니다. 16
성인기의 CAIS 환자들 사이에서 생식선 악성 종양의 위험이 증가하기 때문에 현재 권장되는 것은 사춘기 이전에 종양이 발생할 위험이 상대적으로 낮은 것으로 간주되기 때문에 성적 성숙이 완료된 후, 일반적으로 15-16 세 정도에 생식선 절제술을 시행하는 것입니다. 21 이 접근법은 고환에 의한 생리적 호르몬 생산과 에스트로겐으로의 말초 안드로겐 전환으로 인해 사춘기 동안 자발적인 유방 발달과 더 나은 뼈 광물화를 허용합니다. 3, 8 역사적으로 개복술과 양측 생식선 절제술은 DSD를 포함하는 Y 염색체 환자에 대해 수행되었습니다. 시간이 지남에 따라 복강경 절차는 수술 후 회복 및 입원 기간을 단축하고 미용을 개선하는 최소 침습적 접근 방식을 통해 확대 및 골반강에 쉽게 접근할 수 있는 관련 이점으로 인해 DSD 환자에게 널리 채택되었습니다. 22, 23
복강경 생식선 절제술은 환자가 기관 내 삽관을 통해 전신 마취를받는 동안 수행됩니다. 비디오 모니터, 인퓨틀레이터 및 광원은 환자의 발에 위치합니다. 이 경우, 복부의 흡입은 배꼽의 하부에서 반월 절개를하고 지혈제를 사용하여 근막을 상승시키는 개방 복강경 기술을 사용하여 수행되었습니다. 그런 다음 Veress 바늘을 복부에 넣고 식염수 방울 테스트를 사용하여 올바른 위치를 확인했습니다. 이어서, 10-mm 스텝 투관침을 배꼽을 통해 삽입하고,CO2 를 사용하여 기복막을 수득하였다. 그런 다음 0o 복강경을 복부에 도입했습니다. 작동 도구를위한 2 개의 추가 5mm 투관침이 오른쪽과 왼쪽의 배꼽 높이에 배치되었습니다. 그런 다음 환자를 Trendelenburg 위치에 배치하여 골반의 복강경 검사를 더 쉽게 수행하여 생식선의 위치를 결정하고 골반 장기를 검사할 수 있습니다. 생식선이 쉽게 드러나지 않는 경우 생식선을 식별하고 추적하면 생식선을 찾는 데 도움이 될 수 있습니다. 1
복강경 검사 동안, 우리 환자의 생식선은 닫힌 내부 고리 위에 양측으로 나타났습니다. 총체적으로, 낭종은 양측 고환에서 시각화되었습니다. 정관은 요도로 횡단했으며 골반 내에 뮐러 구조의 증거는 없었습니다. 평면은 다른 후 복막 구조에서 멀리 떨어진 생식선 주위의 후 복막을 통해 해부되었습니다. 의원 성 손상을 피하기 위해 요관 및 장골 혈관과 같은 후 복막 구조의 위치와 과정을 결정하는 것이 중요합니다. 그런 다음 내부 정자 혈관이 생식선으로 횡단할 때 식별되고 출혈 가능성을 줄이기 위해 횡단하기 전에 Ligasure 장치를 사용하여 4개의 연속 섹션으로 수행되었습니다. 그런 다음 고환은 복막에서 동원되었고, 정관도 비슷한 방식으로 성취되고 분할되었습니다. 복강경은 중앙 10mm 배꼽 포트를 통해 생식선을 제거 할 수 있도록 작업 포트 중 하나를 통해 삽입되었습니다. 이어서, 복부CO2 기복막을 역전시키고, 2-0 Vicryl 봉합사를 사용하여 배꼽 근막을 폐쇄하였다. 모든 항구 사이트의 피부를 5-0 Monocryl을 사용하여 닫고 Dermabond로 덮었습니다.
두 생식선 모두 합병증없이 절제되어 평가를 위해 병리학으로 보내졌습니다. 복강경 생식선 절제술 수술 시간은 절개에서 폐쇄까지 약 80 분이었습니다. 추정 출혈량은 5mL 미만이었다. 환자는 사회적 요인으로 인해 관찰을 위해 밤새 입원했습니다. 그녀는 시술을 잘 견뎌냈고 다중 모드 통증 관리를 사용하여 통증을 잘 조절했으며 다음날 아침 집으로 퇴원했습니다. 그녀는 산부인과 의사와 함께 에스트로겐 대체 요법을 시작하기 위해 2 주 후에 후속 조치를 취할 예정이었습니다.
복강경 검사에서 우리는 요도까지 추적되는 양측 정관을 시각화 할 수 있었다는 점에 유의하는 것이 중요합니다. Hannema et al .의 44 CAIS 환자 시리즈에 따르면 36 %가 부고환 또는 정관이 존재하는 것으로 나타났습니다. 12 Hannema et al .은 잔류 파라크린 안드로겐 활성이 완전한 형태의 AIS를 가진 환자에서도 Wolffian 덕트 생성물의 발달을 유도할 수 있다는 가설을 세웠습니다. 12
우리 환자의 외과 적 병리학은 그녀의 생식선이 실제로 위축성 고환임을 확인했습니다. 흥미롭게도 두 고환 모두 GCNIS를 나타내고 Leydig 세포 증식을 표시했습니다 (그림 1-2). 신생물 세포는 OCT3/4 및 PLAP로 염색됩니다(그림 3–4). 이 환자에서 볼 수 있듯이 Leydig 세포 증식은 CAIS 환자에서 흔히 발견됩니다. 24 뇌하수체 전엽에 대한 안드로겐 부정적인 피드백이 부족하기 때문에 높은 수준의 LH가 Leydig 세포 성 증가의 원인이된다고 제안되었습니다. 25 GCNIS는 전악성 종양으로 간주되며, 최대 50 %가 5 년 이내에 GCT로 진행됩니다. 26 GCNIS가 침습성 GCT로 진행될 위험은 CAIS 환자에서 덜 확실합니다. Kaprova-Pleskacova 등이 제안한 "안드로겐 결핍 이론"은 CAIS 환자가 비정상적인 생식 세포의 생존을 촉진하기위한 안드로겐 반응이 불충분하기 때문에 PAIS 환자보다 GCT로 진행될 가능성이 적다는 것을 시사합니다. 27 반대로, Kaprova-Pleskacova 등은 또한 Hannema et al.12에서 언급한 바와 같이 Wolffian 덕트 발달을 유도하는 데 잠재적으로 책임이 있는 동일한 파라크린 안드로겐 활성이 GCNIS가 침습성 GCT로 발전하도록 촉진할 수 있다고 제안했습니다. 27 우리 환자에서 GCNIS의 정관 및 조직 학적 증거의 존재는 잠재적 인 잔류 파라 크린 안드로겐 반응을 시사합니다. 따라서 우리는이 사례가 CAIS 환자들 사이에서 예방 적 생식선 절제술의 잠재적 이점에 대한 주장을 뒷받침하는 데 도움이된다고 믿습니다.
우리 환자의 외과 적 병리학은 비뇨 생식기 내에서 거의 발생하지 않는 평활근 종양 인 양측 고환 평활근 종 (그림 5)에도 중요했습니다. 그들의 위치는 고환 내 또는 고환 주위일 수 있으며 간질 기질의 평활근 세포, 튜니카 알부기니아 혈관의 근육층, 정세뇨관 및 정자, 부고환, 흔적 잔여 및 튜니카 질리스와 같은 고환 주위 구조에서 파생된 것으로 믿어집니다. 28 평활근종은 AIS 환자에서 매우 드물게 설명됩니다. 사실, AIS 환자의 생식선 절제술 후 생검에서 평활근종이 존재한다는 문헌 내에서 단 4건의 사례 보고가 있었습니다. 28-31 우리가 아는 한, 이것은 CAIS 환자에서 GCNIS와 동시에 발생하는 양측 고환 평활근종의 첫 번째 문서화 된 사례입니다.
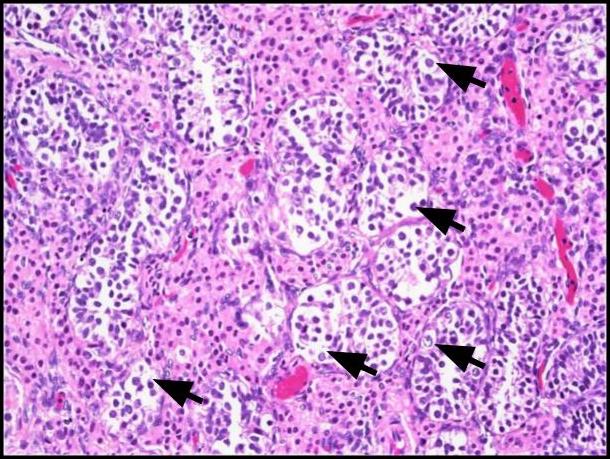
그림 1. 생식 세포 종양 제자리 (GCNIS). 투명하거나 희미하게 호산 구성 세포질이 풍부한 큰 비정형 세포 (검은 색 화살표), 두드러진 핵소체를 가진 중심 핵 및 고르게 분포 된 염색질이 보입니다. H & E, 200x.
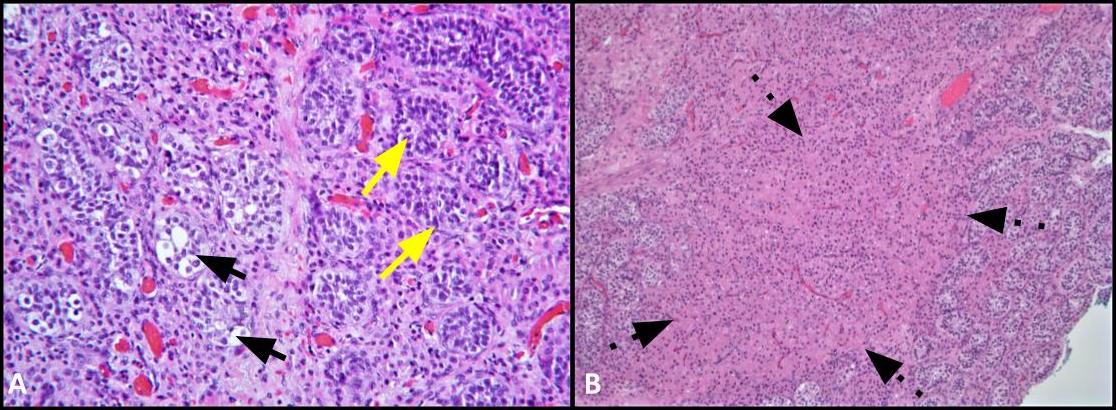
그림 2. A)이 이미지는 GCNIS와 관련된 세뇨관 (검은 색 화살표)과 정상적인 정자 형성 (노란색 화살표)이있는 인접한 정관 세뇨관의 비교를 보여줍니다. H&E, 200x. B) 저전력 이미지는 간질 내의 Leydig 세포 클러스터를 보여줍니다(점선 화살표). H & E, 100x.
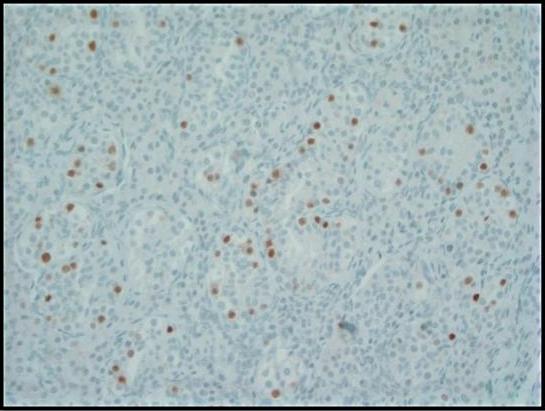
그림 3. 옥타머 결합 전사 인자 (OCT) 3/4에 대한 면역 조직 화학적 염색은 정세관 내의 GCNIS 세포에서 강한 핵 면역 반응성을 보여줍니다. 정상적인 생식 세포는 음성입니다. 200배.
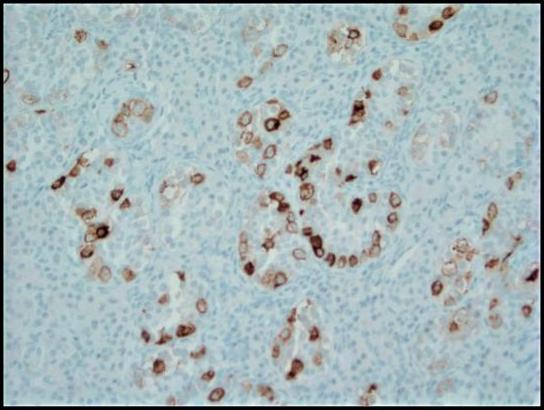
그림 4. 태반 알칼리성 인산 가수 분해 효소 (PLAP)를 사용한 면역 조직 화학 염색은 세포질 막 패턴에서 GCNIS의 종양 세포를 강조합니다. 200x.
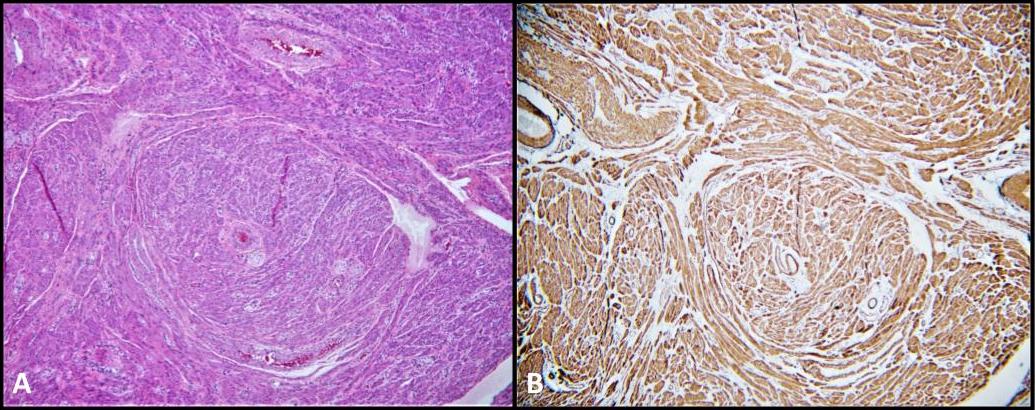
그림 5. A) 평활근종; H & E, 100x. 스핀들 평활근 세포의 근막. B) 평활근 액틴 (SMA) 세포질 염색은 확산되고 강하다.
특정 장비가 사용되지 않았습니다.
공개 할 것이 없습니다.
이 비디오 기사에 언급된 환자는 정보에 입각한 동의로 촬영에 동의했으며 정보와 이미지가 온라인에 게시될 것임을 알고 있습니다.
References
- Calvo A, Escolino M, Settimi A, Roberti A, Caprio MG, Esposito C. 간성 장애가있는 소아 환자의 생식선 절제술에 대한 복강경 접근법. 트랜스 페디아 트르. 2016;5(4):295-304. https://doi.org/10.21037/tp.2016.09.06
- 쿠스미 M, 미츠나미 M, 오노우에 H 외 완전한 안드로겐 무감각 증후군 및 복강경 생식선 절제술 전후의 항 뮐러 호르몬 수치. Gynecol minim Invasive Ther. 2017;6(3):126-128. https://doi.org/10.1016/j.gmit.2016.11.001
- Cheikhelard A, Thibaud E, Morel Y, et al. 완전한 안드로겐 무감각 증후군 : 진단 및 관리. 전문가 목사 엔도크리놀 메타브. 2009;4(6):565-573. https://doi.org/10.1586/eem.09.31
- Lanciotti L, Cofini M, Leonardi A, Bertozzi M, Penta L, Esposito S. 완전한 안드로겐 무감각 증후군 (CAIS)의 다양한 임상 발표 및 관리. Int J Environ Res 공중 보건. 2019;16(7):1268. https://doi.org/10.3390/ijerph16071268
- Grasso D, Borreggine C, Campanale C, Longo A, Grilli G, Macarini L. 완전한 안드로겐 무감각 증후군의 경우 자기 공명 영상의 유용성과 역할. 라디오 사건 담당자 2015;10(2):1119. https://doi.org/10.2484/rcr.v10i2.1119
- Nezzo M, De Visschere P, T'Sjoen G, Weyers S, Villeirs G. 성인의 완전한 안드로겐 무감각 증후군의 진단 및 관리에서 영상의 역할. 케이스 담당자 라디올. 2013;2013:158484. https://doi.org/10.1155/2013/158484
- 비너 RM, 테오 Y, 윌리엄스 DM, 패터슨 미네소타, 휴즈 IA. 안드로겐 무감각 증후군 : 영국의 진단 절차 및 관리에 대한 조사. 아치 디스 차일드. 1997;77(4):305-309. https://doi.org/10.1136/adc.77.4.305
- Galani A, Kitsiou-Tzeli S, Sofokleous C, Kanavakis E, Kalpini-Mavrou A. 안드로겐 무감각 증후군 : 임상 적 특징 및 분자 결함. 호르몬 (아테네). 2008;7(3):217-229. https://doi.org/10.14310/horm.2002.1201
- Wisniewski AB, Migeon CJ, Meyer-Bahlburg HF, et al. 완전한 안드로겐 무감각 증후군: 장기적인 의학적, 외과적 및 정신성적 결과. J 클린 엔도크리놀 메타브. 2000;85(8):2664-2669. https://doi.org/10.1210/jcem.85.8.6742
- 휴즈 IA, 데이비스 JD, 번치 TI, 파스테르스키 V, 마스트로야노풀루 K, 맥두걸 J. 안드로겐 무감각 증후군. 랜싯. 2012;380(9851):1419-1428. https://doi.org/10.1016/S0140-6736(12)60071-3
- 딘스 R, 크레이튼 SM, 리아오 LM, 콘웨이 GS. 완전한 안드로겐 무감각 증후군 (CAIS)이있는 성인 여성의 생식선 절제술시기 : 환자 선호도 및 임상 증거. 클린 엔도크리놀(옥스프). 2012;76(6):894-898. https://doi.org/10.1111/j.1365-2265.2012.04330.x
- 하네마 SE, 스콧 IS, 라즈퍼트 드 메이츠 E, 스카케백 NE, 콜먼 N, 휴즈 IA. 완전한 안드로겐 무감각 증후군의 고환 발달. J 패톨. 2006;208(4):518-527. https://doi.org/10.1002/path.1890
- Döhnert U, Wünsch L, Hiort O. 완전한 안드로겐 무감각 증후군의 임질 절제술 : 왜 그리고 언제? 섹스 데브. 2017;11(4):171-174. https://doi.org/10.1159/000478082
- Chaudhry S, Tadokoro-Cuccaro R, Hannema SE, Acerini CL, Hughes IA. 완전한 안드로겐 무감각 증후군(CAIS)에서 생식선 종양의 빈도: 후향적 사례 시리즈 분석. J 페디아 유롤. 2017;13(5):498.e491-498.e496. https://doi.org/10.1016/j.jpurol.2017.02.013
- Wünsch L, Holterhus PM, Wessel L, Hiort O. 생식선 종양 발병 위험이있는 성 발달 장애 (DSD) 환자 : 복강경 생검 및 분자 진단을 기반으로 한 관리. BJU 국제 2012;110(11점 C):E958-965. https://doi.org/10.1111/j.1464-410X.2012.11181.x
- 쿨스 M, 드롭 SL, 볼펜부텔 KP, 우스터하위스 JW, 루이젠가 LH. 간성 생식선의 생식 세포 종양 : 오래된 길, 새로운 방향, 움직이는 국경. 내분비 목사 2006;27(5):468-484. https://doi.org/10.1210/er.2006-0005
- 바티스타 RL, 코스타 EMF, 로드리게스 광고 외 안드로겐 무감각 증후군 : 리뷰. 내분비학 및 신진 대사의 기록 보관소. 2018;62:227-235. https://doi.org/10.20945/2359-3997000000031
- 베르텔로니 S, 메리기올라 MC, 다티 E, 발사모 A, 바론첼리 GI. 완전한 안드로겐 무감각 증후군과 온전한 고환 또는 제거 된 생식선을 가진 여성의 골밀도. 섹스 데브. 2017;11(4):182-189. https://doi.org/10.1159/000477599
- 파일 LC, 네이선슨 KL. 성 발달의 차이에서 생식선 생식 세포 종양 소인을 평가하기위한 실용적인 가이드. Am J Med Genet C Semin Med Genet. 2017;175(2):304-314. https://doi.org/10.1002/ajmg.c.31562
- 마누엘 M, 카타야마 PK, 존스 HW, 주니어 Y 염색체를 가진 간성 환자에서 생식선 종양의 발생 연령. Am J Obstet Gynecol. 1976;124(3):293-300.
https://doi.org/10.1016/0002-9378(76)90160-5 - Chertin B, Koulikov D, Alberton J, Hadas-Halpern I, Reissman P, Farkas A. 간성 환자에서 복강경 검사의 사용. Pediatr Surg Int. 2006;22(5):405-408. https://doi.org/10.1007/s00383-006-1662-3
- Esegbona G, Cutner A, Cuckow P, Creighton S. 간성 장애가있는 소아 및 청소년 소녀의 복강경 생식선 절제술. BJOG : 산부인과의 국제 저널. 2003;110(2):210-212. PMID: 12618168.
- 완전한 안드로겐 무감각 증후군에서 악성 고환 생식 세포 종양의 발병에 대한 병태 생리학 및 위험 인자에 대한 M, Looijenga L. 업데이트를 냉각시킵니다. 섹스 데브. 2017;11(4):175-181. https://doi.org/10.1159/000477921
- 요켄회벨, 럿거스 JK, 메이슨 JS, 그리핀 JE, 스베르들로프 RS. 라이펜슈타인 증후군 환자의 라이디히 세포 신생물. 특급 클린 엔도크리놀. 1993;101(6):365-370.
- Akyüz M, Topaktaş R, Ürkmez A, Koca O, Öztürk M. 고환 종양에서 생식 세포 신 생물 평가. 터크 J 우롤. 2019;45(6):418-422. https://doi.org/10.5152/tud.2018.48855
- Kaprova-Pleskacova J, Stoop H, Brüggenwirth H, et al. 완전한 안드로겐 무감각 증후군: 생식 세포 병리를 포함한 생식선 조직학에 영향을 미치는 요인. 현대 병리학. 2014;27(5):721-730. https://doi.org/10.1038/modpathol.2013.193
- Siminas S, Kokai G, Kenny SE. 양측 Sertoli 세포 선종 및 고환 주위 평활근종과 관련된 완전한 안드로겐 무감각 증후군 : 사례보고 및 문헌 검토. J 페디아 유롤. 2013;9(1):e31-34. https://doi.org/10.1016/j.jpurol.2012.06.013
- 굴리스 DG, 일리아두 PK, 파파니콜라우 A, 외. 완전한 안드로겐 무감각 증후군 및 양측 고환 과오종이있는 청소년의 안드로겐 수용체 유전자의 R831X 돌연변이. 호르몬 (아테네). 2006;5(3):200-204. https://doi.org/10.14310/horm.2002.11185
- Krichen Makni S, Mnif Hachicha L, Ellouze S, et al. 다발성 과오종 및 양측 성 고환 평활근종을 동반 한 여성화 고환 증후군. 레브 메드 인턴. 2005;26(12):980-983. https://doi.org/10.1016/j.revmed.2005.08.003
- Savaş-Erdeve Ş, Aycan Z, Keskin M, et al. 양측 성 sertoli 세포 선종 및 편측성 고환 평활근종과 관련된 완전한 안드로겐 무감각 증후군 : 사례 보고서. 터키 소아과 저널. 2016;58(6):654-657. https://doi.org/10.24953/turkjped.2016.06.012
Cite this article
Norton JC, Singh A, Hollenbach LL, Gamble G, Gonzalez-Krellwitz LA, Canon SJ. 완전한 안드로겐 무감각 증후군에 대한 예방 적 복강경 양측 생식선 절제술. J 메드 인사이트. 2021;2021(313). 도이 : 10.24296 / 조미 / 313.
