完全アンドロゲン不感受症に対する予防的腹腔鏡下両側ゴナデクトミー
1; 2; 3; 3; 2; 4
1Department of Urology, University of Arkansas for Medical Sciences
2Department of Pathology, University of Arkansas for Medical Sciences / Arkansas Children’s Hospital
3Department of Obstetrics and Gynecology, University of Arkansas for Medical Sciences
4Department of Pediatric Urology, Arkansas Children’s Hospital
Main Text
アンドロゲン不感受症(AIS)は、アンドロゲン受容体のX連鎖変異によって引き起こされるまれな疾患で、推定発症率は10万人あたり1〜5人と推定されています。アンドロゲン耐性の重症度に応じて、完全、部分、軽度の症状の程度が異なります。完全AIS(CAIS)患者は表現型は女性ですが、卵巣の代わりに男性のXY染色体と精巣を持っています。乳房の発達や外陰器などの正常な二次性徴を示しますが、精巣によるミュラー抑制因子(MIF)の産生により子宮やその他のミュラー管構造がありません。アンドロゲン耐性のため、副上体、精管、精嚢などのアンドロゲン依存性ウォルフ管産物の発達が困難です。これらの患者は乳児期に鼠径部ヘルニアや唇下腫瘤、または思春期に原発性無月経を発症することが多いです。身体検査では、通常乳房の発達は正常で、陰毛や腋毛はなく、膣の長さが異なる盲目の膣袋を持っています。診断検査はしばしば超音波やMRI、血清ホルモンレベル、核型解析を用いて行われます。
CAIS患者の精巣は鼠径管内、唇下、または腹内にあることがあります。思春期後、腹腔精巣を持つ患者は生殖細胞腫瘍(GCT)を発症するリスクが15%増加します(範囲0〜22%)。管理は、予防的なゴナデクトミーとその後のホルモン補充療法(HRT)によるもので、正常な思春期の発達を維持し、適切な骨の健康を促進します。予防的ゴナデクトミーの時期をめぐる議論は続いており、一部の患者支援団体は長期ホルモン療法の懸念や妊娠能力維持の望みからゴナデクトミーに反対しています。現在の慣習では、思春期前のGCT発症リスクが比較的低い(0.8–2%)ため、生理的な思春期が達成されるまでゴナデクトミーを遅らせることが推奨されています。両側腹腔鏡下性腺切除術によるCAIS管理における症状、診断、術中の技術、術後の考慮事項を概説します。
性器官悪性のリスク増加により、Y染色体生殖腺を持つ性発達障害(DSD)を持つ子どもにゴナデクトミーが適応されることがあります。1 その一例がアンドロゲン不感受症(AIS)で、これはアンドロゲン受容体(AR)のX連鎖変異によって引き起こされます。2 AISは稀な診断で、推定発生率は10万人あたり1〜5人と推定されています。3 AISはアンドロゲン抵抗の重症度に応じて、完全(CAIS)、部分的(PAIS)、軽度(MAIS)など、さまざまな症状の出現を示します。4 CAISの子どもは、外見は女性で、外性器は正常ですが、卵巣ではなく精巣を持ち、男性の核型(46、XY)を持っています。これらの患者では、精巣はテストステロンを産生できますが、AR機能の欠陥により、精巣上体、精管、精嚢などのウルフ管産物を産生できません。このテストステロンが末梢でエストロゲンに芳香化されるため、これらの患者は乳房の発達など正常な二次性徴を持ちます。それでも、精巣のセルトリ細胞はミュラー誘導体の発生を阻害するミュラー阻害因子(MIF)を産生し続けています。その結果、子宮、子宮頸部、卵管など他の女性の性器が欠如した盲末型膣袋を持つ患者が現れます。5 これらの患者では、精巣が鼠径管内に位置する場合、唇下にある場合、または腹内にある場合もあります。6 アンドロゲン不敏感症の乳児は、片側または両側の鼠径ヘルニアや陰唇腫瘤を呈することがあります。女子の両側鼠径ヘルニアの1〜2%がCAISの診断を示す可能性があると推定されており、評価時には強い臨床的疑いを持つことが重要です。7 古典的には、CAISは思春期に、乳房の正常な発達を持つが陰毛や腋毛がほとんどない女性に原発性無月経として現れます。CAISは、思春期後の異常な精巣発生や生殖細胞悪性腫瘍のリスク増加と関連しています。8
この患者はアジア系の15歳女性で、過去に病的肥満(BMI45)、閉塞性睡眠時無呼吸症候群(CPAP使用)、前糖尿病(HbA1c5.5)の既往歴があり、現在メトホルミンを服用中です。幼い頃に両側鼠径ヘルニア修復術の既往歴があります。彼女は過去の妊娠歴がなく、性的活動もありません。原発性無月経のさらなる評価のために当院に紹介されました。彼女は11歳でセラーシュを発症したと報告していますが、腋毛と陰毛はまばらでニキビの兆候はありません。さらに、痛み、膣分泌物、多毛症、乳漏などは否定しています。外部クリニックでは、患者はプロゲスチン挑戦後に出血を否定し、以前の骨盤検査では子宮頸部の触診はありませんでした。
患者の家族歴によると、19歳、21歳、26歳の3人の姉がいます。母親は14歳で生理を始めました。彼女の26歳と19歳の姉妹も11歳頃から定期的に月経が来ていると報告しており、長女は4人の健康な子どもをもうけています。興味深いことに、彼女の21歳の妹も原因不明の原発性無月経の評価のために州外の医師の診察を受けています。膣の休止期間は出産には不十分だと告げられ、専門医に紹介されましたが、フォローアップはできませんでした。
身体検査の結果、患者は肥満で、タナー期5の乳房発達、腋毛がまばらでニキビの兆候はありませんでした。泌尿生殖器検査では、患者は正常な女性器で、陰毛はまばらでした。膣は見た目は正常で、異常な分泌物もなく、盲目が終わる膣袋がありました。検査では子宮頸部や子宮を視覚化したり触診したりすることができませんでした。検査結果は先天異常の可能性を一貫させた。適切な検査および画像検査が指示されました。
検査結果:
| テスト | 結果 | 参考文献 |
| B-hCG | - | - |
| FSH | 13.20 mIU/mL | 5〜20 mIU/mL |
| LH | 22.20 mIU/mL | 5〜20 mIU/mL |
| プロラクチン | 8.1 ng/mL | 3.0–18.6 ng/mL |
| エストラジオール | 38.33 pg/mL |
34–170 pg/mL (女性なめし工 ステージ5) |
| テストステロン | 269 ng/dL |
20–38 ng/dL (女性なめし工 ステージ5) |
| TSH | 1.94 mIU/L | 0.47–4.68 mIU/L |
| 染色体解析 | 46、XY |
女性:46歳、XX 男性:46歳、XY |
初期の検査は、視床下部-下垂体-卵巣軸に関連する問題、例えば卵泡刺激ホルモン(FSH)、黄体形成ホルモン(LH)、プロラクチン、テストステロンなどを評価するために行われました。さらに、妊娠を除外するために尿中のβ-hCG検査も実施されました。当患者の検査では、正常な女性患者と比べてテストステロン値が上昇していることが判明しました。さらに、患者の核型解析では46本のXY染色体が判明しました。これらの所見は、前下垂体のアンドロゲン負のフィードバックの障害により、テストステロン値(異常な女性範囲、男性の正常範囲)と高い血清LH値が高くなるCAISの診断と一致しています。
子宮や他の女性性器の有無を評価するために骨盤超音波による画像検査が指示されました。外部病院で行われた超音波検査では、子宮、卵管、子宮頸部が存在しないことが判明しました。さらに、画像検査では卵巣が見られず、腹部内精巣の可能性の正確な位置を評価できませんでした。超音波検査は操作者によって異なることがあり、MRIは腹腔鏡的生殖腺切除術や性腺監視の手術計画において、生殖腺の診断と特定においてゴールドスタンダードと広く考えられています。5
Wisniewski ら によるある研究では、性腺切除術後に長期ホルモン補充療法(HRT)を受けていたCAIS患者14人の女性の長期アウトカムを調査しました。9 彼らは全体として、これらの女性が正常で活動的な寿命を期待できることを発見しました。これらの女性の大多数は、通常の成人女性の身長で90パーセンタイルを超えており、平均 的な女性より背が高い一方で、通常の男性人口よりは低いです。10 これらの女性の間で最も一般的に診断された医療状態は骨粗鬆症でした。大多数の女性は異性愛の女性性自認を持ち、性別逆転手術を望む者はいませんでした。大多数は性的機能に満足していると報告しています。このコホートの平均膣長は8.8cmであり、正常な膣長は7〜11cmの範囲と一致します。
現在、CAIS患者のARの基礎的な遺伝的変異を逆転させる治療法はありません。したがって、治療は予防的生殖腺切除術に焦点を当て、その後のホルモン療法(HRT)、適応が必要な場合の泌尿生殖道治療、そして心理的支援に重点を置いています。ゴナデクトミーは通常、思春期の性的成熟が完了するまで遅れ、自然発生的な思春期の発達を可能にします。3 乳児期や幼児期に早期診断された場合、痛みを伴う鼠径部や小唇部の腫瘤がある場合、早期ゴナデクトミーが検討されることがありますが、その後のHRTで約11〜12歳で思春期を誘発する必要があります。3 ゴナデクトミーのタイミングは、一部の患者やAIS支援団体から精巣の保持を推奨する議論を呼んでいます。これらの支援グループは、心理的要因、手術に伴うリスク、妊娠能力を維持したいという願望、長期的なHRTへの抵抗など、さまざまな理由を挙げています。それにもかかわらず、腹腔鏡下生殖腺切除術の報告されたリスクは非常に低く、推定死亡リスクは1000件あたり0.1人、腸の損傷や出血のリスクは2.4%と報告されています。さらに 、Hannemaらによる研究では、CAIS患者の44人の精巣を調べ、生後1年以降生殖細胞の数が急激に減少し、どの精巣にも精子生成の証拠が見つからず、CAIS患者の生殖能力が非常に低いことが判明しました。12 精巣を保持することを決めたCAIS患者では、生殖細胞腫瘍(GCT)の発症リスクが年齢とともに増加することが報告されています。11 定期的な画像診断(超音波および/またはMRI)および血清血液マーカーを活用し、これらの患者におけるGCTの発症の可能性をスクリーニングし、積極的な監視を通じて綿密なフォローアップを維持することが重要です。13 MRIは側精巣嚢胞や腺腫などの良性変化を検出できますが、生殖細胞腫瘍(GCNIS)のような前悪性変化は検出できず、これには生殖腺の生検が必要です。14 さらに、超音波検査の質は通常、操作者によって異なります。Wunsch ら が精巣を保持したい患者に対して提案した一つの方法は、腹腔鏡下の性腺生検を行い、腹壁近くの腹腔内性腺を外科的に固定して超音波での視覚化を図ることです。15
CAISの環境でゴナデクトミーを行う主な目的は、将来の悪性腫瘍のリスクを減らすことです。他の種の隠粛症と同様に、GCTの発症リスクは高まります。CAISでは、これらの患者における思春期前GCT発症リスクは非常に低いとされ、0.8〜2.0%とされています。16 思春期以降、このリスクは年齢とともに増加し、推定で約15%(0〜22%の範囲)とされています。11 予防的生殖腺切除術は、アンドロゲンからエストロゲンへの変換によって部分的に得られる精巣エストロゲンによって女性化が完了する思春期後期に行われると推奨されています。3、8 また、思春期の後半までゴナデクトミーを遅らせることで、ケア提供者は患者から直接インフォームドコンセントを得ることができます。
HPO軸がまだ未熟な子どもを評価する際、ライディヒ細胞のテストステロン分泌を正確に評価するためにhCG刺激検査が必要です。17 ゴナデクトミー後、これらの患者は自然閉経年齢(約50〜52歳)まで、正常な乳房および骨の発達、心理社会的健康、性機能を維持するために、エストロゲン補充療法を伴う長期ホルモン補充療法を必要とします。18 これらの患者には子宮がないため、プロゲスチンはエストロゲン療法の補助として必要ありません。これらの 患者は正常な二次性徴を維持し、正常な性機能を得ることができますが、膣の適切性に応じて膣拡張療法や膣形成術が必要になることがあります。不孕や性自認に関する17 問いは、これらの患者に大きな心理社会的影響をもたらす可能性があるため、多職種的アプローチの一環としてカウンセリングやサポートグループセラピーを提供することが強く推奨されます。9
CAIS(旧称モリス症候群)は、46、XY DSDの最も一般的な定義可能な原因の一つです。これは、末梢アンドロゲン耐性を引き起こす稀なX連鎖変異によるものです。これらの患者は表現型は女性で、外性器は正常です。これらの患者は一般的に思春期に原発性無月経を伴い、その後の検査で失明型膣袋を持ち、画像検査では女性の内部性器が見つからないことが判明します。卵巣の代わりに、これらの患者は腹部、鼠径管、または陰唇に精巣を持っています。小児や乳児では、CAISは鼠径ヘルニアや腫瘤として現れることがあり、鼠径ヘルニアを持つ女児の約1〜2%が46,XY核型の隠留性を有しています。7 この特定のケースでは、患者は幼少期に両側鼠径ヘルニア修復術の既往歴がありました。これは診断の見逃しや遅延を示唆しており、両側鼠径ヘルニアを呈する小児女性患者においてCAISの強い臨床疑いを維持することの重要性を強調しています。これは、隠遁症を除外するためのさらなる検査が必要です。
AIS患者がGCTを発症する推定リスクは、アンドロゲン抵抗性の程度と反比例関係にあります。CAIS患者はARのより重度の変異を持ち、機能の完全な喪失を推定します。アンドロゲン刺激がなければ精子生成が障害され、生後1年以降の生殖細胞数が急激に減少することで、理論的には後年のGCT発症リスクが低減されます。これは 、PAIS患者はAR機能をある程度保持しやすく、生殖細胞が生存しやすく、その結果成人期にGCTを発症するリスクが高まるのとは対照的です。19 歴史的に、Manuel ら はY含有DSDを持つ患者で25歳までの累積GCTリスクが3.6%であったと報告し、50歳までに33%に増加しました。20 より最近では、Deans ら のレビューで、CAIS患者が成人期に性腺悪性腫瘍を発症するリスクが15%増加していることが明らかになりました(範囲0〜22%)。11 Cools らは 、思春期前のCAIS患者におけるGCT発症の推定リスクは0.8–2%と大幅に低くなっていることを発見しました。16
成人期のCAIS患者における性腺悪性腫瘍のリスクが高いため、現在の推奨は性的成熟が完了した後、通常は15〜16歳頃で行われることであり、思春期前の腫瘍発症リスクは比較的低いと考えられています。21 このアプローチにより、精巣による生理ホルモンの産生と末梢アンドロゲンのエストロゲンへの変換により、思春期中の自然発生と骨の石灰化が促進されます。3、8 歴史的に、開腹手術および両側性腺切除術はDSDを含むY染色体患者に対して行われてきました。時間が経つにつれて、腹腔鏡手術は拡大鏡と低侵襲アプローチによる骨盤腔への容易なアクセスの利点から広く採用されるようになりました。これにより術後回復が短く入院期間が短縮され、美容効果も向上しました。22、23
腹腔鏡下ゴナデクトミーは、患者が全身麻酔下で気管挿管によって行われます。ビデオモニター、吸入器、光源は患者の足元に設置されています。この場合、腹部の膨らみは開腹腔鏡手術法を用いて行われ、臍の下側に半月形切開を行い、止血剤で筋膜を上昇させました。その後、ヴェレス針を腹部に挿入し、生理食塩水滴下試験で正しい位置を確認しました。その後、10mmのステップトロカーを臍から挿入し、CO2 を用いて気腹を得ました。その後、腹腔鏡 を腹部に挿入しました。さらに、操作器具用の5mmトロカーが2本、臍の高さに左右に設置されました。その後、患者はトレンデレンブルグ体位に置かれ、これにより腹腔鏡による骨盤の検査が容易になり、生殖腺の位置を特定し、骨盤臓器の検査が可能になりました。生殖腺がはっきり見えない場合は、性腺血管を特定し追跡することで位置特定に役立ちます。1
腹腔鏡検査では、患者の生殖腺が閉鎖された内輪の上側に両側的に確認されました。大まかに、両側精巣に嚢胞が確認されました。精管は尿道まで通っており、骨盤内にミュラー構造の痕跡は見られませんでした。後腹膜を通って、他の後腹膜構造から離れた生殖腺の周囲を切り離しました。尿管や腸骨血管などの腹膜後構造の位置と経路を特定することは、医原性損傷を避けるために重要です。その後、内精管が生殖腺に向かって横切る際に同定され、リガシュア装置で4つの連続切片でフルキュレーションされ、出血の可能性を減らすために切断されました。その後、精巣は腹膜から動員され、同様に精管も充血・分割されました。腹腔鏡は作業用ポートの一つから挿入され、中央の10mm臍帯ポートから生殖腺を摘出しました。腹部CO2 気胸を逆にし、臍筋膜は2-0ビクリル縫合糸で閉じられました。すべてのポートの皮膚は5-0モノクリルで塞ぎ、ダーマボンドで覆われました。
両方の生殖腺は合併症なく切除され、評価のため病理に送られました。腹腔鏡下ゴナデクトミーの手術時間は、切開から閉鎖まで約80分でした。推定出血量は5mL未満でした。患者は社会的要因により一晩入院し観察を受けました。彼女は処置によく耐え、多剤法による痛み管理で痛みをよくコントロールし、翌朝退院しました。彼女は2週間後に婦人科のフォローアップを受け、エストロゲン補充療法を開始する予定でした。
腹腔鏡検査では、両側の輸精管が尿道まで続いているのを可視化できたことは重要です。Hannema ら による44人のCAIS患者を対象とした症例シリーズでは、36%が精巣上体または精管障害(vas deferens)を有していることが判明しました。12 Hannema ら は、残留パラクリンアンドロゲン活性が、完全なAIS患者でもウォルフ管産物の発生を誘導できる可能性があると仮説を立てました。12
患者の外科病理検査では、両方の生殖腺が実際には萎縮性精巣であることが確認されました。興味深いことに、両精巣ともGCNISを示し、レイディッヒ細胞の過形成が顕著でした(図1–2)。腫瘍細胞はOCT3/4およびPLAPで染色されます(図3–4)。この患者に見られるレイディッヒ細胞過形成は、CAIS患者によく見られる所見です。24 前下垂体におけるアンドロゲンの負のフィードバックが欠如するため、LHの高レベルがレイディッヒ細胞の増加に関与すると提案されています。25 GCNISは前悪性腫瘍とみなされ、最大50%が5年以内にGCTに進行します。26 CAIS患者におけるGCNISの侵襲性GCTへの進行リスクは不確実です。Kaprova-Pleskacova らが提唱した「アンドロゲン欠如理論」は、CAIS患者はPAIS患者よりも異常生殖細胞の生存を促進するためのアンドロゲン応答が不十分であるため、GCTに進行しにくいと示唆しています。逆 に、Kaprova-Pleskacova ら は、Hannema らが述べたようにウォルフ管の発生を誘導する可能性のあるパラクリンアンドロゲン活性が、GCNISを侵襲的なGCTへと促進する可能性 も示唆しました。27 我々の患者における精管の存在およびGCNISの組織学的証拠は、残存副分泌アンドロゲン反応の可能性を示唆しています。したがって、この事例はCAIS患者における予防的生殖器切除術の潜在的な利益を支持するものであると考えます。
患者の外科的病理は、尿路内で非常にまれに発生する平滑筋腫瘍である両側側精巣性平骨筋腫(図5)でも重要でした。その位置は精巣内または副精巣間であり、間質間質の平滑筋細胞、白鞘膜の血管の筋層、精細管、精索、精巣上体、退化残存物、膣膜などの側精巣構造に由来すると考えられています。AIS患者で28 件の平線筋腫が報告されることは非常に稀です。実際、AIS患者の性腺切除術後の生検で平線筋腫が存在したという症例報告は文献上4件のみです。28-31 私たちの知る限り、CAIS患者においてGCNISと同時に両側側精巣側平線筋腫が発症した初めての記録例です。
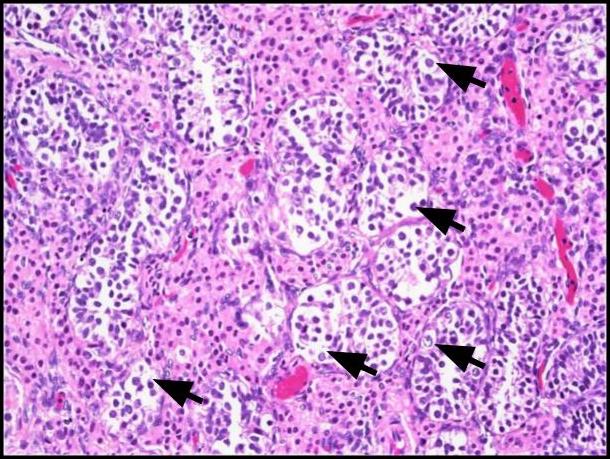
図1。 生細胞新形成(GCNIS)。大きな非定型細胞(黒い矢印)が、豊富に透明からわずかに好酸球性細胞質を持ち、中心核と顕著な核小体、均等分布のクロマチンが見られます。H&Eは200倍です。
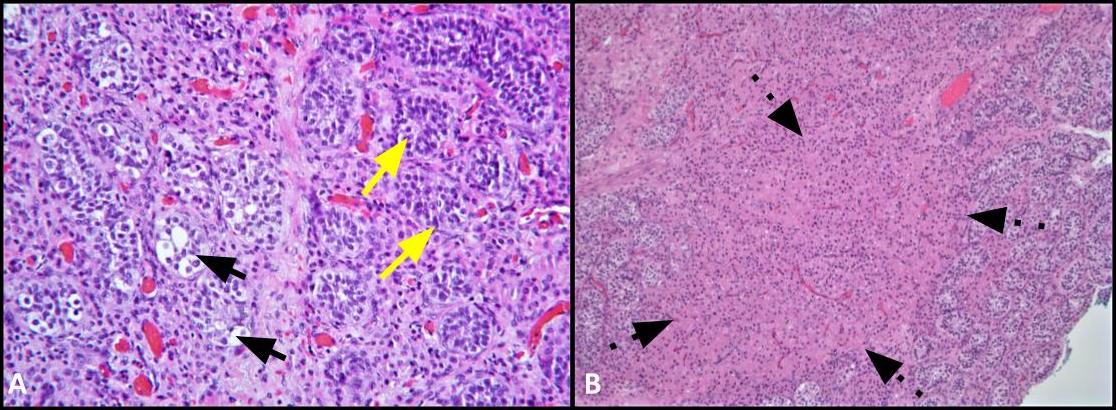
図2。 A) この画像は、GCNISに関与する小管(黒い矢印)と、正常な精子形成を持つ隣接する精細管(黄色の矢印)の比較を示しています。H&E、200x. B) 低倍率画像は間質内のレイディヒ細胞のクラスター(破線矢印)を示します。H&Eは100倍です。
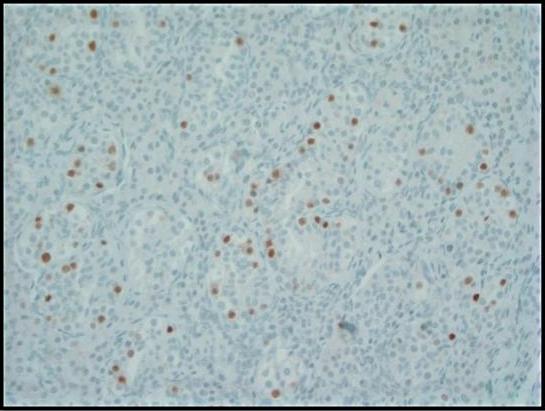
図3。 オクタマー結合転写因子(OCT)3/4用の免疫組織化学染色は、セミニセル内のGCNIS細胞で強い核免疫反応を示します。正常な胚細胞は陰性です。200倍。
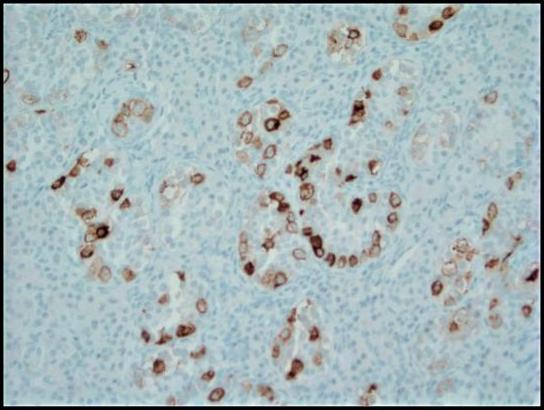
図4。 胎盤アルカリ性ホスファターゼ(PLAP)を用いた免疫組織化学染色は、GCNISの腫瘍細胞を細胞質膜状パターンで強調します;200回。
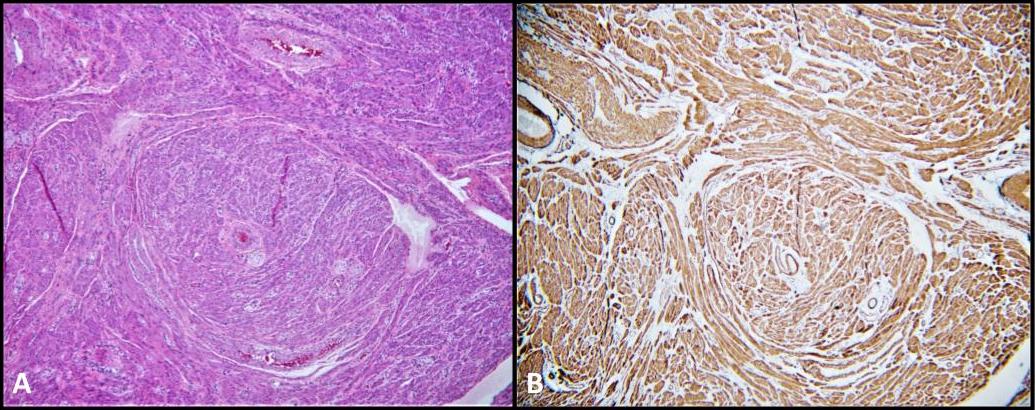
図5。 A) 赤骨筋腫;H&Eは100倍です。紡錘状の平滑筋細胞の束。B) 平滑筋アクチン(SMA)の細胞質染色は拡散性かつ強力である。
特に使われた機材はありません。
特に開示することはない。
この動画で言及されている患者は撮影に同意しており、情報や画像がオンラインで公開されることを認識しています。
References
- カルボ・A、エスコリーノ・M、セッティミ・A、ロベルティ・A、カプリオ・MG、エスポジート・C。インターセックス障害のある小児患者における性腺切除術のための腹腔鏡的アプローチ。 翻訳:Pediatr。2016;5(4):295-304. https://doi.org/10.21037/tp.2016.09.06
- 楠見M、三波M、小ノ上H ほか。腹腔鏡下ゴナデクトミーの前後で完全アンドロゲン不感受症および抗ミュラーホルモンレベル。婦 人科最小侵襲性。2017;6(3):126-128. https://doi.org/10.1016/j.gmit.2016.11.001
- シェイクラールA、ティボーE、モレル Yら。完全アンドロゲン不敏感症:診断と管理。 エキスパート・レヴ・エンドクリノールメタブ。2009;4(6):565-573. https://doi.org/10.1586/eem.09.31
- ランチョッティ L、コフィニ M、レオナルディ A、ベルトッツィ M、ペンタ L、エスポジート S. 完全アンドロゲン不敏感症候群(CAIS)における異なる臨床症状と管理。 国際環境ジャーナル 公衆衛生。2019;16(7):1268. https://doi.org/10.3390/ijerph16071268
- グラッソD、ボレッジーネC、カンパナーレC、ロンゴA、グリリG、マカリーニL. 完全アンドロゲン不敏感症候群の症例における磁気共鳴画像法の有用性と役割。 ラジオ症例報告2015;10(2):1119. https://doi.org/10.2484/rcr.v10i2.1119
- Nezzo M, De Visschere P, T'Sjoen G, Weyers S, Villeirs G. 成人における完全アンドロゲン不感受症の診断および管理における画像診断の役割。 ケースレップ・ラディオール。2013;2013:158484. https://doi.org/10.1155/2013/158484
- ヴァイナー RM、テオ・Y、ウィリアムズ DM、パターソン MN、ヒューズ アイオワ。アンドロゲン不感受症:英国における診断手法と管理の調査。 大人よ。1997;77(4):305-309. https://doi.org/10.1136/adc.77.4.305
- ガラニ A、キツィウ-ツェリ S、ソフォクルー C、カナヴァキス E、カルピニ-マヴルー A. アンドロゲン不感受症症候群:臨床的特徴と分子的欠陥。 ホルモン(アテネ)。2008;7(3):217-229. https://doi.org/10.14310/horm.2002.1201
- ヴィスニェフスキAB、ミゲオンCJ、マイヤー・バールバーグHF ら。完全アンドロゲン不感受症:長期的な医学的、外科的、心理性的転帰。 J クリン・エンドクリノール・メタブ。2000;85(8):2664-2669. https://doi.org/10.1210/jcem.85.8.6742
- ヒューズ IA、デイヴィス JD、バンチ TI、パスステルスキー V、マストロヤンノプー K、マクドゥーガル J. アンドロゲン不敏感症。 ランセット。2012;380(9851):1419-1428. https://doi.org/10.1016/S0140-6736(12)60071-3
- ディーンズR、クレイトンSM、リオLM、コンウェイGS。完全アンドロゲン不感受症(CAIS)の成人女性におけるゴナデクトミーのタイミング:患者の好みと臨床的証拠。 クリン・エンドクリノール(オックスフ)です。2012;76(6):894-898. https://doi.org/10.1111/j.1365-2265.2012.04330.x
- ハンネマSE、スコットIS、ラジパート・デ・メイツE、スカッケベークNE、コールマンN、ヒューズIA。完全アンドロゲン不敏感症における精巣の発達。 J Pathol。2006;208(4):518-527. https://doi.org/10.1002/path.1890
- Döhnert U, Wünsch L, Hiort O. 完全アンドロゲン不敏感症におけるゲナデクトミー:なぜ、そしていつ? セックスデベロップ。2017;11(4):171-174. https://doi.org/10.1159/000478082
- チャウドリーS、タドコロ・クッカロR、ハンネマSE、アセリーニCL、ヒューズIA。完全アンドロゲン不感受症症候群(CAIS)における性腺腫瘍の頻度:後ろ向き症例シリーズ解析。 J Pediatr Urol。2017;13巻5号:498.e491-498.e496。 https://doi.org/10.1016/j.jpurol.2017.02.013
- Wünsch L, Holterhus PM, Wessel L, Hiort O. 性発達障害(DSD)患者で性腺腫瘍発生のリスクがある患者:腹腔鏡生検および分子診断に基づく管理。 BJU インターナショナル。2012;110(11 Pt C):E958-965。 https://doi.org/10.1111/j.1464-410X.2012.11181.x
- クールズM、ドロップSL、ウルフフェンビューテルKP、オースターハイスJW、ルーイジェンガLH。インターセックス性腺の生殖細胞腫瘍:古い経路、新しい方向、そして変化するフロンティア。 内分泌レベラル2006;27(5):468-484. https://doi.org/10.1210/er.2006-0005
- バティスタRL、コスタEMF、ロドリゲスAdS など。アンドロゲン不感受症:レビュー。内分泌学と代謝のアーカイブ。2018;62:227-235. https://doi.org/10.20945/2359-3997000000031
- ベルテローニ・S、メリッジョーラMC、ダティ・E、バルサモ・A、バロンチェッリ・GI。完全アンドロゲン不敏感症と精巣または切除された性腺を持つ女性の骨密度。 セックスデベロップ。2017;11(4):182-189. https://doi.org/10.1159/000477599
- パイルLC、ネイサンソンKL。性器官の生殖細胞腫瘍の性発育差異に対する素因を評価するための実践的なガイド。 AM J Med Genet C セミン Med Genet。2017;175(2):304-314. https://doi.org/10.1002/ajmg.c.31562
- マヌエルM、片山PK、ジョーンズ HW、ジュニアY染色体を持つインターセックス患者における性腺腫瘍の発症年齢。 婦人科産科医です。1976;124(3):293-300.
https://doi.org/10.1016/0002-9378(76)90160-5 - チェルティンB、クーリコフD、アルバートンJ、ハダス・ハルペルンI、ライスマンP、ファルカシュA。インターセックス患者における腹腔鏡手術の利用。 小児外科国際2006;22(5):405-408. https://doi.org/10.1007/s00383-006-1662-3
- エセグボナ・G、カトナーA、カッコウP、クレイトンS。インターセックス障害を持つ小児および思春期の女児における腹腔鏡下性腺切除術。 BJOG:国際産婦人科学ジャーナル。2003;110(2):210-212.PMID: 12618168。
- Cools M, Looijenga L. 完全アンドロゲン不感受症における悪性精巣生殖細胞腫瘍の病態生理とリスク要因に関する最新情報。 セックスデベロップ。2017;11(4):175-181. https://doi.org/10.1159/000477921
- ヨッケンヘーベル、ラトガース大学JK、メイソンJS、グリフィンJE、スワードロフRS。ライフェンシュタイン症候群患者のレイディッヒ細胞腫瘍。 エクスプロスペック・クリン・エンドクリノール。1993;101(6):365-370.
- Akyüz M, Topaktaş R, Ürkmez A, Koca O, Öztürk M. 精巣腫瘍における生殖細胞新形成性の評価。 ターク・J・ウロル。2019;45(6):418-422. https://doi.org/10.5152/tud.2018.48855
- カプロヴァ・プレスカコヴァJ、ストープH、ブリュッゲンヴィルト H他。完全アンドロゲン不感受症:生殖腺組織学に影響を与える要因、生殖細胞病理を含む。 現代病理学。2014;27(5):721-730. https://doi.org/10.1038/modpathol.2013.193
- シミナス S、コカイ G、ケニー SE。両側セルトリ細胞腺腫および側精巣性平線筋腫に関連する完全アンドロゲン感受性症候群:症例報告および文献レビュー。 J Pediatr Urol。2013;9巻1号:e31-34。 https://doi.org/10.1016/j.jpurol.2012.06.013
- ゴールズDG、イリアドゥPK、パパニコラウ Aら。完全アンドロゲン不感受症および両側性精巣過密腫を持つ思春期のアンドロゲン受容体遺伝子のR831X変異。 ホルモン(アテネ)。2006;5(3):200-204. https://doi.org/10.14310/horm.2002.11185
- クリチェン・マクニ S、ムニフ・ハチチャ L、エルーズ S、 他多発性過密腫および両側側精巣性平線筋腫を伴う女性化精巣症候群。 医療インターン牧師。2005;26(12):980-983. https://doi.org/10.1016/j.revmed.2005.08.003
- サヴァシュ-エルデヴェ・Ş、アイカン・Z、ケスキン・ Mら。両側性セルトリ細胞腺腫および片側側精巣側平線筋腫に関連する完全アンドロゲン不感受症症候群:症例報告。 トルコ小児科学ジャーナル。2016;58(6):654-657. https://doi.org/10.24953/turkjped.2016.06.012
Cite this article
ノートンJC、シンA、ホレンバッハLL、ギャンブルG、ゴンザレス・クレルヴィッツLA、カノンSJ。完全アンドロゲン不感受症に対する予防的腹腔鏡下両性腺切除術。 J Med Insight。 2021;2021(313). doi:10.24296/jomi/313。
