Gonadectomie bilatérale laparoscopique prophylactique pour le syndrome d’insensibilité aux androgènes complet
1; 2; 3; 3; 2; 4
1Department of Urology, University of Arkansas for Medical Sciences
2Department of Pathology, University of Arkansas for Medical Sciences / Arkansas Children’s Hospital
3Department of Obstetrics and Gynecology, University of Arkansas for Medical Sciences
4Department of Pediatric Urology, Arkansas Children’s Hospital
Main Text
Table of Contents
Le syndrome d’insensibilité aux androgènes (SIA) est une maladie rare causée par une mutation liée à l’X du récepteur des androgènes, avec une incidence estimée de 1 à 5 pour 100 000 individus. Il existe différents degrés de présentation pour une résistance complète, partielle ou légère selon la gravité de la résistance aux androgènes. Les patients atteints d’AIS complet (CAIS) naissent phénotypiquement féminins mais ont des chromosomes XY masculins et des testicules au lieu d’ovaires. Elles présentent des caractéristiques sexuelles féminines secondaires normales telles que le développement des seins et les organes génitaux féminins externes, mais n’ont pas d’utérus et d’autres structures de canal müllérien en raison de la production testiculaire de facteur inhibiteur de Müller (MIF). En raison de la résistance aux androgènes, les produits du canal de Wolffien dépendants des androgènes ne se développent pas, tels que l’épididyme, le canal déférent et les vésicules séminales. Ces patients présentent souvent, soit pendant la petite enfance, des hernies inguinales ou des masses sous-labiales, soit à l’adolescence une aménorrhée primaire. À l’examen physique, elles auront généralement un développement mammaire normal, n’auront pas de poils pubiens ou axillaires et auront une poche vaginale à extrémité aveugle de différentes longueurs vaginales. Le bilan diagnostique est souvent effectué à l’aide d’une échographie ou d’une IRM, des taux d’hormones sériques et d’une analyse du caryotype.
Pour les patients atteints de CAIS, leurs testicules peuvent être situés dans le canal inguinal, sous-labial ou intra-abdominal. Après la puberté, les patients ayant des testicules intra-abdominaux présentent un risque accru de 15 % (plage de 0 à 22 %) de développer des tumeurs germinales (GCT). La prise en charge consiste en une gonadectomie prophylactique suivie d’un traitement hormonal substitutif (THS) pour maintenir un développement pubertaire normal et favoriser une bonne santé osseuse. Le débat concernant le moment de la gonadectomie prophylactique se poursuit, certains groupes de soutien aux patients s’opposant à la gonadectomie, invoquant des préoccupations concernant l’hormonothérapie à long terme et le désir de préserver la fertilité. La convention actuelle préconise de retarder la gonadectomie jusqu’à la fin de la puberté physiologique, car le risque de développer une GCT prépubère est relativement faible (0,8 à 2 %). Nous décrivons la présentation, le diagnostic, les techniques peropératoires et les considérations postopératoires pour la prise en charge de la CAIS par gonadectomie laparoscopique bilatérale.
La gonadectomie peut être indiquée chez les enfants présentant des différences de développement sexuel (DSD) qui hébergent des gonades du chromosome Y en raison du risque accru de malignité gonadique. 1 L’un de ces DSD est le syndrome d’insensibilité aux androgènes (AIS), qui est causé par une mutation liée à l’X du récepteur des androgènes (AR). 2 L’EAE est un diagnostic rare dont l’incidence est estimée entre 1 et 5 pour 100 000 personnes. 3 L’AIS peut avoir divers degrés de présentation en fonction de la gravité de la résistance aux androgènes, allant de complète (CAIS), partielle (PAIS) et légère (MAIS). 4 Les enfants atteints de CAIS ont une apparence phénotypiquement féminine avec des organes génitaux externes féminins normaux, mais ont des testicules au lieu d’ovaires et ont un caryotype masculin (46, XY). Chez ces patients, leurs testicules sont capables de produire de la testostérone mais, en raison du défaut de la fonction AR, ils ne parviennent pas à produire des produits du canal de Wolff tels que l’épididyme, le canal déférent et les vésicules séminales. En raison de l’aromatisation périphérique de cette testostérone en œstrogène, ces patientes ont des caractéristiques sexuelles féminines secondaires normales telles que le développement des seins. Néanmoins, les cellules de Sertoli des testicules continuent de produire le facteur inhibiteur de Müller (MIF), qui inhibe le développement des dérivés du canal de Müller. Il en résulte chez les patientes une poche vaginale aveugle avec une absence d’autres organes sexuels féminins tels que l’utérus, le col de l’utérus et les trompes de Fallope. 5 Chez ces patients, les testicules peuvent être situés dans le canal inguinal, être sous-labials ou être intra-abdominaux. 6 Les nourrissons présentant une insensibilité aux androgènes peuvent présenter des hernies inguinales unilatérales ou bilatérales ou des masses labiales. On estime que 1 à 2 % des hernies inguinales bilatérales chez les filles pourraient représenter un diagnostic de CAIS, et il est important de maintenir une forte suspicion clinique lors de votre évaluation. 7 Classiquement, le CAIS se présente à l’adolescence comme une aménorrhée primaire chez les filles ayant un développement mammaire normal mais peu ou pas de poils pubiens ou axillaires à l’examen. Le CAIS est associé à un développement testiculaire anormal ainsi qu’à un risque accru de malignité des cellules germinales après la puberté. 8
Il s’agit d’une jeune fille de 15 ans d’origine asiatique ayant des antécédents médicaux d’obésité morbide (IMC de 45), d’apnée obstructive du sommeil sous CPAP et de prédiabète (HbA1c de 5,5) actuellement sous metformine. Elle a des antécédents chirurgicaux de réparation bilatérale d’une hernie inguinale lorsqu’elle était enfant. Elle n’a pas d’antécédents de grossesse, n’est pas sexuellement active et a été référée à notre clinique pour une évaluation plus approfondie de l’aménorrhée primaire. Elle rapporte qu’elle a développé une larche à l’âge de 11 ans, mais qu’elle a peu de poils axillaires et pubiens et aucun signe d’acné. De plus, elle nie toute douleur, écoulement vaginal, hirsutisme ou galactorrhée. Dans une clinique externe, notre patiente a nié avoir saigné à la suite d’un progestatif, et aucun col de l’utérus n’a été palpé lors d’un examen pelvien précédent.
Selon les antécédents familiaux de la patiente, elle a trois sœurs aînées âgées de 19, 21 et 26 ans. Sa mère a commencé à avoir ses règles à l’âge de 14 ans. Ses sœurs de 26 et 19 ans déclarent également avoir des règles régulières qui ont commencé vers l’âge de 11 ans, et la sœur aînée a eu quatre enfants en bonne santé. Fait intéressant, sa sœur de 21 ans a également été vue par un médecin de l’extérieur de l’État pour une évaluation d’une aménorrhée primaire d’étiologie inconnue. On lui a dit que son hiatus vaginal était insuffisant pour l’accouchement et on l’a dirigée vers un spécialiste pour une évaluation plus approfondie, mais elle n’a pas été suivie.
À l’examen physique, la patiente était obèse, avait un développement mammaire de stade 5 de Tanner avec des poils axillaires clairsemés et aucun signe d’acné présent. À l’examen génito-urinaire, la patiente avait des organes génitaux féminins externes normaux avec une pilosité pubienne clairsemée. Le vagin était d’apparence normale, sans écoulement anormal et avec une poche vaginale à l’aveugle. Nous n’avons pas été en mesure de visualiser ou de palper le col de l’utérus ou l’utérus lors de l’examen. Les résultats de l’examen étaient cohérents pour une anomalie congénitale potentielle. Des tests de laboratoire et d’imagerie appropriés ont ensuite été demandés.
Résultats de laboratoire :
| Test | Résultat | Référence |
| B-hCG | Négatif | Négatif |
| FSH | 13,20 mUI/mL | 5 à 20 mUI/mL |
| LH | 22,20 mUI/mL | 5 à 20 mUI/mL |
| Prolactine | 8,1 ng/mL | 3,0 à 18,6 ng/mL |
| Estradiol | 38,33 pg/mL |
34 à 170 pg/mL (Tanneuse au stade 5) |
| Testostérone | 269 ng/dL |
20 à 38 ng/dL (Tanneuse au stade 5) |
| TSH | 1,94 mUI/L | 0,47 à 4,68 mUI/L |
| Analyse chromosomique | 46, XY |
Femmes : 46, XX Mâle : 46, XY |
Les premiers laboratoires ont été sollicités pour évaluer les problèmes associés à l’axe hypothalamo-hypophyso-ovarien (HPO), tels que l’hormone folliculo-stimulante (FSH), l’hormone lutéinisante (LH), la prolactine et la testostérone. De plus, une bêta-hCG urinaire a été réalisée pour exclure une grossesse. Les analyses de laboratoire de notre patiente ont révélé qu’elle avait un taux de testostérone élevé par rapport aux patientes normales. De plus, une analyse du caryotype de notre patient a donné 46 chromosomes XY. Ensemble, ces résultats sont cohérents avec un diagnostic de CAIS, où des taux de testostérone élevés (plage féminine anormale, mais plage masculine normale) et des taux sériques élevés de LH résultent d’une altération de la rétroaction androgénique négative sur l’hypophyse antérieure.
Une imagerie par échographie pelvienne a été demandée pour évaluer la présence ou l’absence de l’utérus et d’autres organes sexuels féminins. L’échographie réalisée dans un hôpital extérieur a montré l’absence d’utérus, de trompes de Fallope et de col de l’utérus. De plus, l’imagerie a révélé une absence d’ovaires et n’a pas permis d’évaluer avec précision l’emplacement des testicules intra-abdominaux potentiels. Les échographies peuvent dépendre de l’opérateur, et l’IRM est largement considérée comme l’étalon-or pour diagnostiquer et localiser les gonades dans la planification chirurgicale de la gonadectomie laparoscopique et de la surveillance gonadique. 5
Une étude menée par Wisniewski et coll. a examiné les résultats à long terme chez 14 femmes atteintes de CAIS qui suivaient un traitement hormonal substitutif (THS) à long terme après une gonadectomie. Ils ont constaté que, dans l’ensemble, ces femmes peuvent s’attendre à avoir une durée de vie active normale. La majorité de ces femmes dépassaient le 90e centile de la taille pour les femmes adultes normales9 , ce qui les rend plus grandes que la moyenne des femmes tout en étant plus petites que la population masculine normale. 10 L’affection médicale la plus souvent diagnostiquée chez ces femmes était l’ostéoporose. La majorité des femmes se sont identifiées comme ayant une identité de genre féminine hétérosexuelle et aucune d’entre elles ne souhaitait une chirurgie d’inversion de genre. La majorité d’entre eux ont déclaré être satisfaits de leur fonctionnement sexuel. La longueur vaginale moyenne dans cette cohorte était de 8,8 cm, ce qui correspond à une longueur vaginale normale allant de 7 à 11 cm.9
À l’heure actuelle, il n’existe aucun traitement permettant d’inverser la mutation génétique sous-jacente de l’AR chez les patients atteints de CAIS. Par conséquent, le traitement est axé sur la gonadectomie prophylactique pour prévenir une éventuelle malignité gonadique avec THS ultérieure, le traitement du tractus urogénital, si nécessaire, ainsi qu’un soutien psychologique. La gonadectomie est généralement retardée jusqu’à ce que la maturation sexuelle soit terminée à l’adolescence pour permettre un développement pubertaire spontané normal. 3 Si elle est diagnostiquée tôt dans la petite enfance ou l’enfance, la gonadectomie précoce peut être envisagée si l’enfant présente des masses inguinales ou labiales douloureuses ou inconfortables, mais nécessitera un THS ultérieur pour induire la puberté vers l’âge de 11 à 12 ans. 3 Le moment de la gonadectomie est devenu controversé, certains patients et groupes de soutien AIS préconisant le maintien de leurs testicules. Diverses raisons ont été citées par ces groupes de soutien pour conserver les testicules, telles que des facteurs psychologiques, des risques associés à la chirurgie, le désir de préserver potentiellement la fertilité et une réticence à adhérer à un THS à long terme. Néanmoins, les risques signalés pour la gonadectomie laparoscopique sont très faibles, avec un risque de décès estimé à 0,1 pour 1000 procédures, et le risque de blessure à l’intestin ou de saignement est rapporté à 2,4 %. 11 De plus, une étude menée par Hannema et al. a examiné les testicules de 44 patients atteints de CAIS et a révélé que le nombre de cellules germinales diminuait rapidement après la première année de vie et ne trouvait aucun signe de spermatogenèse dans aucun des testicules, ce qui rendait la fertilité très peu probable pour les patients atteints de CAIS. 12 Pour les patients atteints de CAIS qui décident de conserver leurs testicules, il a été rapporté que le risque de développer des tumeurs germinales (GCT) augmente avec l’âge. 11 Il est important de maintenir un suivi étroit par le biais d’une surveillance active en utilisant régulièrement l’imagerie (échographie et/ou IRM) et des marqueurs sanguins sériques pour dépister le développement potentiel de GCT chez ces patients. 13 Bien que l’IRM puisse détecter des changements bénins tels que des kystes paratesticulaires et des adénomes, elle ne peut pas détecter des changements précancéreux tels que la néoplasie germinale in situ (GCNIS), qui nécessiterait une biopsie des gonades.14 De plus, la qualité du dépistage par échographie dépend généralement de l’opérateur. Une approche proposée par Wunsch et al. pour les patients qui souhaitent conserver leurs testicules serait d’effectuer une biopsie gonadique laparoscopique et de fixer chirurgicalement les gonades intra-abdominales près de la paroi abdominale pour permettre une meilleure visualisation par échographie. 15
L’objectif principal de la gonadectomie dans le cadre d’un CAIS est de réduire le risque de malignité future. Comme dans d’autres formes de cryptorchidie, il existe un risque accru de développer une GCT. Dans le cas du CAIS, le risque de développer une GCT prépubère chez ces patients est considéré comme très faible, allant de 0,8 à 2,0 %. 16 Après la puberté, ce risque augmente avec l’âge et est estimé à environ 15 % (de 0 à 22 %). 11 Il est préconisé que la gonadectomie prophylactique se produit dans la période postpubère lorsque la féminisation est complétée en partie par l’œstrogène testiculaire qui est en partie dérivé de la conversion des androgènes en œstrogène. 3, 8 Le fait de retarder la gonadectomie jusqu’à plus tard dans l’adolescence permet également aux fournisseurs de soins d’obtenir un consentement éclairé directement de leurs patients.
Lors de l’évaluation des enfants, dont l’axe HPO est encore immature, un test de stimulation hCG est nécessaire pour évaluer correctement la sécrétion de testostérone des cellules de Leydig. 17 Après une gonadectomie, ces patientes auront besoin d’un traitement hormonal à long terme avec des œstrogènes substitutifs jusqu’à l’âge de la ménopause naturelle (environ 50 à 52 ans) pour maintenir un développement normal des seins et des os, un bien-être psychosocial et une fonction sexuelle. 18 Étant donné que ces patientes n’ont pas d’utérus, les progestatifs ne sont pas nécessaires pour compléter l’œstrogénothérapie. 17 Ces patientes continueront à conserver des caractéristiques sexuelles féminines secondaires normales et pourront atteindre une fonction sexuelle normale, mais pourraient nécessiter une dilatation vaginale ou une vaginoplastie selon l’adéquation de leur canal vaginal. 17 Les questions d’infertilité et d’identité de genre peuvent avoir un impact psychosocial important pour ces patients, et il est fortement encouragé d’offrir des conseils ou de soutenir une thérapie de groupe dans le cadre d’une approche multidisciplinaire. 9
Le CAIS (anciennement connu sous le nom de syndrome de Morris) représente l’une des causes définissables les plus courantes du DSD 46, XY. Il résulte d’une mutation rare liée à l’X de l’AR qui provoque une résistance périphérique aux androgènes. Ces patientes naissent phénotypiquement féminines avec des organes génitaux externes féminins normaux. Fréquemment, ces patientes présentent à l’adolescence une aménorrhée primaire, où l’examen ultérieur révélera que ces patientes ont une poche vaginale à fin aveugle et une absence d’organes sexuels féminins internes à l’imagerie. Au lieu d’ovaires, ces patientes ont des testicules qui peuvent se trouver dans l’abdomen, le canal inguinal ou les lèvres. Chez les enfants ou les nourrissons, le CAIS peut se présenter sous la forme d’une hernie ou d’une masse inguinale, où environ 1 à 2 % des nourrissons de sexe féminin atteints de hernies inguinales présentent une cryptorchidie avec un caryotype 46,XY. 7 Dans ce cas précis, notre patient avait des antécédents chirurgicaux de réparation bilatérale d’une hernie inguinale lorsqu’il était enfant. Cela suggère un diagnostic manqué ou retardé et souligne l’importance de maintenir une forte suspicion clinique de CAIS chez les patientes pédiatriques qui présentent des hernies inguinales bilatérales, ce qui justifie un examen plus approfondi pour exclure une cryptorchidie.
Le risque estimé pour les patients atteints d’AIS de développer une GCT est inversement proportionnel au degré de résistance aux androgènes. Les patients atteints de CAIS présentent des mutations plus graves de leur RA qui induisent une perte complète de fonction. Sans stimulation androgénique, la spermatogenèse est altérée et il y a un déclin rapide associé du nombre de cellules germinales après la première année de vie, ce qui confère théoriquement un risque réduit de développer une GCT plus tard dans la vie. 14 Cela contraste avec les patients atteints de PAIS, qui conservent encore un certain degré de fonction AR et sont donc plus susceptibles d’avoir des cellules germinales survivantes, ce qui les expose par la suite à un risque accru de développer une GCT à l’âge adulte. 19 Historiquement, Manuel et al. ont signalé un risque cumulatif de GCT de 3,6 % chez les patients atteints de DSD contenant Y jusqu’à l’âge de 25 ans, qui augmentait à 33 % à l’âge de 50 ans. 20 Plus récemment, Deans et al. ont constaté dans leur revue que les patients atteints de CAIS présentaient un risque accru de 15 % de développer une tumeur maligne gonadique à l’âge adulte (plage de 0 à 22 %). 11 Cools et al. ont constaté que le risque estimé de développer une GCT chez les patients atteints de CAIS avant la puberté était beaucoup plus faible, à 0,8 à 2 %. 16
En raison du risque accru de malignité gonadique chez les patients atteints de CAIS à l’âge adulte, la recommandation actuelle est d’effectuer une gonadectomie après la maturation sexuelle, généralement vers l’âge de 15 à 16 ans, car le risque de développer des tumeurs avant la puberté est considéré comme relativement faible. 21 Cette approche permet un développement mammaire spontané et une meilleure minéralisation osseuse pendant la puberté en raison de la production d’hormones physiologiques par les testicules et de la conversion ultérieure des androgènes périphériques en œstrogènes. 3, 8 Historiquement, la laparotomie et la gonadectomie bilatérale étaient pratiquées chez les patients porteurs d’un chromosome Y contenant du DSD. Au fil du temps, les procédures laparoscopique ont été largement adoptées pour les patients atteints de DSD en raison des avantages associés à la grossissement et à l’accès facile à la cavité pelvienne via une approche peu invasive, qui permet une récupération postopératoire plus courte et une durée d’hospitalisation plus courte, ainsi qu’une meilleure esthétique. 22, 23
La gonadectomie laparoscopique est réalisée pendant que le patient est sous anesthésie générale par intubation endotrachéale. Le moniteur vidéo, l’insufflateur et la source lumineuse sont positionnés au pied du patient. Dans ce cas, l’insufflation de l’abdomen a été réalisée à l’aide d’une technique de laparoscopie ouverte où une incision semi-lunaire a été pratiquée sur la face inférieure de l’ombilic et le fascia a été surélevé à l’aide d’hémostatiques. Une aiguille Veress a ensuite été placée dans l’abdomen, et sa position correcte a été confirmée à l’aide d’un test de chute saline. Un trocart Step de 10 mm a ensuite été inséré dans l’ombilic, et du CO2 a été utilisé pour obtenir le pneumopéritoine. Un laparoscope de 0o a ensuite été introduit dans l’abdomen. Deux trocarts supplémentaires de 5 mm pour les instruments de travail ont été placés au niveau de l’ombilic sur les côtés droit et gauche. Le patient a ensuite été placé en position de Trendelenburg, ce qui permet une inspection laparoscopique plus facile du bassin pour déterminer l’emplacement des gonades et inspecter les organes pelviens. Lorsque les gonades ne sont pas facilement apparentes, l’identification et le suivi des vaisseaux gonadiques peuvent aider à les localiser. 1
Lors de la laparoscopie, les gonades de notre patient ont été notées au-dessus des anneaux internes fermés bilatéralement. Grossièrement, les kystes ont été visualisés sur les testicules bilatéraux. Le canal déférent traversait l’urètre, et il n’y avait aucune preuve de structures müllériennes à l’intérieur du bassin. Un plan a été disséqué à travers le péritoine postérieur autour des gonades en s’éloignant des autres structures rétropéritonéales. Il est important de déterminer l’emplacement et le parcours des structures rétropéritonéales telles que les uretères et les vaisseaux iliaques pour éviter les lésions iatrogènes. Les vaisseaux spermatiques internes ont ensuite été identifiés lorsqu’ils traversent la gonade et fulgurés à l’aide du dispositif Ligasure en quatre sections successives avant de traverser pour réduire le risque de saignement. Les testicules ont ensuite été mobilisés à partir du péritoine, et les canaux déférents ont également été fulgurés et divisés de la même manière. Le laparoscope a été inséré par l’un des orifices de travail afin que les gonades puissent être retirées par l’orifice ombilical central de 10 mm. Le pneumopéritoine abdominal au CO2 a ensuite été inversé et le fascia ombilical a été fermé à l’aide d’une suture en vicryle 2-0. La peau de tous les sites portuaires a été fermée à l’aide de Monocryl 5-0 et recouverte de Dermabond.
Les deux gonades ont été excisées sans complication et envoyées en pathologie pour évaluation. La durée de l’opération de gonadectomie laparoscopique, de l’incision à la fermeture, était d’environ 80 minutes. La perte de sang estimée était inférieure à 5 ml. Le patient a été admis pour la nuit en observation en raison de facteurs sociaux. Elle a bien toléré l’intervention, sa douleur a été bien contrôlée à l’aide de la gestion multimodale de la douleur et elle est rentrée chez elle le lendemain matin. Elle devait faire l’objet d’un suivi dans deux semaines chez son gynécologue pour commencer un traitement substitutif aux œstrogènes.
Il est important de noter que sous laparoscopie, nous avons pu visualiser des canaux déférents bilatéraux qui descendaient jusqu’à l’urètre. Une série de cas de 44 patients atteints de CAIS par Hannema et al. a révélé que 36 % d’entre eux présentaient un épididyme ou un canal déférent. 12 Hannema et al. ont émis l’hypothèse que l’activité résiduelle des androgènes paracrines pourrait être en mesure d’induire le développement de produits du canal de Wolffi, même chez les patients atteints de formes complètes d’AIS. 12
La pathologie chirurgicale de notre patiente a confirmé que ses deux gonades étaient en fait des testicules atrophiques. Il est intéressant de noter que les deux testicules ont mis en évidence le GCNIS et marqué l’hyperplasie des cellules de Leydig (figures 1 et 2). Les cellules néoplasiques se colorent avec OCT3/4 et PLAP (figures 3 et 4). L’hyperplasie à cellules de Leydig, observée chez ce patient, est une constatation fréquente chez les patients atteints de CAIS. 24 Il a été proposé que des niveaux élevés de LH, en raison d’un manque de rétroaction négative aux androgènes sur l’hypophyse antérieure, sont responsables de l’augmentation de la cellularité de Leydig. 25 GCNIS est considérée comme une tumeur précancéreuse, où jusqu’à 50 % évolueront vers GCT dans les 5 ans. 26 Le risque de progression du GCNIS vers un GCT invasif est moins certain chez les patients atteints de CAIS. La « théorie de l’absence d’androgènes » proposée par Kaprova-Pleskacova et al., suggère que les patients atteints de CAIS sont moins susceptibles de progresser vers le GCT que les patients atteints de PAIS en raison d’une réponse aux androgènes insuffisante pour favoriser la survie des cellules germinales anormales. 27 À l’inverse, Kaprova-Pleskacova et al. ont également suggéré que la même activité androgène paracrine potentiellement responsable de l’induction du développement du canal wolffien, comme mentionné par Hannema et al.12, pourrait également favoriser le développement du GCNIS en GCT invasif. 27 La présence de canaux déférents et de signes histologiques de GCNIS chez notre patient suggère une réponse résiduelle potentielle aux androgènes paracrines. En tant que tel, nous pensons que ce cas aide à soutenir l’argument en faveur du bénéfice potentiel de la gonadectomie prophylactique chez les patients atteints de CAIS.
La pathologie chirurgicale de notre patient était également significative pour les léiomyomes paratesticulaires bilatéraux (Figure 5), une tumeur musculaire lisse qui survient très rarement dans le tractus urogénital. Leur localisation peut être intratesticulaire ou paratesticulaire et on pense qu’elle est dérivée des cellules musculaires lisses du stroma interstitiel, de la couche musculaire des vaisseaux de la tunique albuginée, des tubules séminifères, ainsi que des structures paratesticulaires telles que le cordon spermatique, l’épididyme, les restes vestigiaux et la tunique vaginale. 28 Les léiomyomes sont très rarement décrits chez les patients atteints de SIA. En fait, il n’y a eu que quatre rapports de cas dans la littérature décrivant la présence de léiomyomes lors d’une biopsie après une gonadectomie chez des patients atteints d’AIS. 28-31 À notre connaissance, il s’agit du premier cas documenté de léiomyomes paratesticulaires bilatéraux se développant en même temps que le GCNIS chez un patient atteint de CAIS.
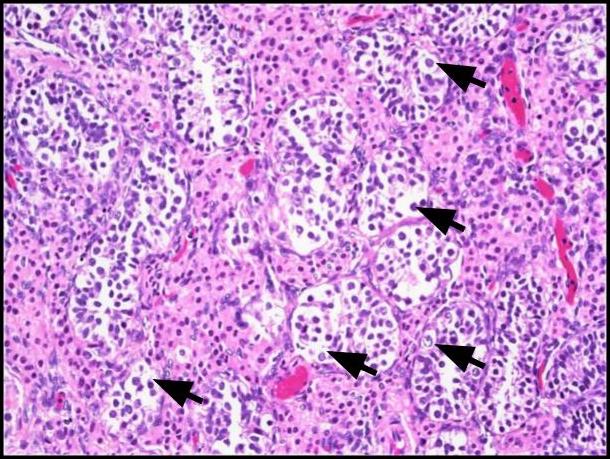
Graphique 1. Néoplasie germinale in situ (GCNIS). De grandes cellules atypiques (flèches noires) avec un cytoplasme abondant clair à faiblement éosinophile, un noyau central avec le nucléole proéminent et une chromatine uniformément répartie sont observées. H&E, 200x.
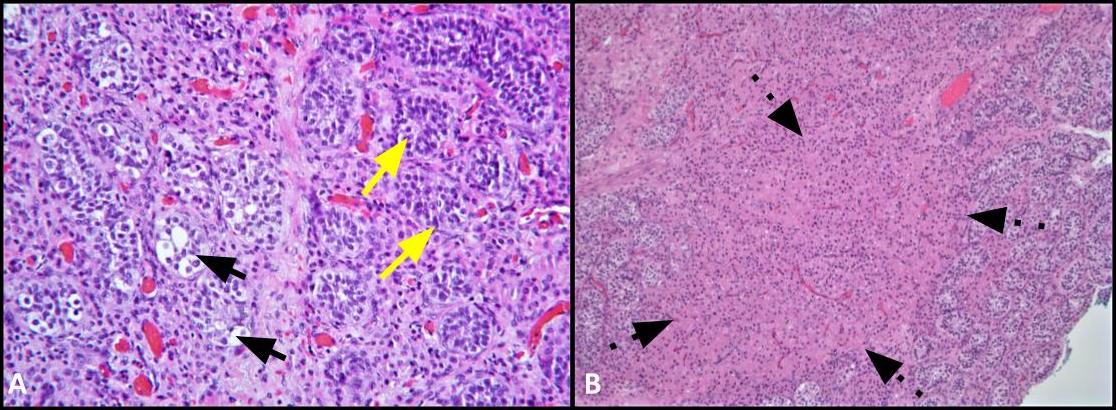
Graphique 2. A) Cette image montre une comparaison des tubules impliqués par GCNIS (flèches noires) avec des tubes séminifères adjacents avec une spermatogenèse normale (flèches jaunes) ; H&E, 200x. B) L’image de faible puissance montre des amas de cellules de Leydig dans l’interstitium (flèches pointillées) ; H&E, 100x.
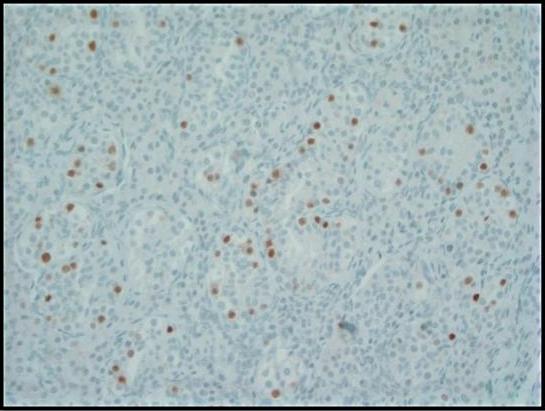
Graphique 3. La coloration immunohistochimique du facteur de transcription de liaison à l’octamère (OCT) 3/4 montre une forte immunoréactivité nucléaire dans les cellules GCNIS à l’intérieur des tubes séminifères. Les cellules germinales normales sont négatives ; 200 fois.
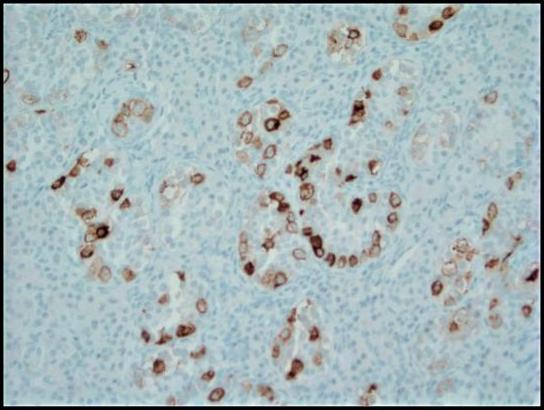
Graphique 4. La coloration immunohistochimique à la phosphatase alcaline placentaire (PLAP) met en évidence les cellules tumorales de GCNIS dans un motif membraneux cytoplasmique ; 200x.
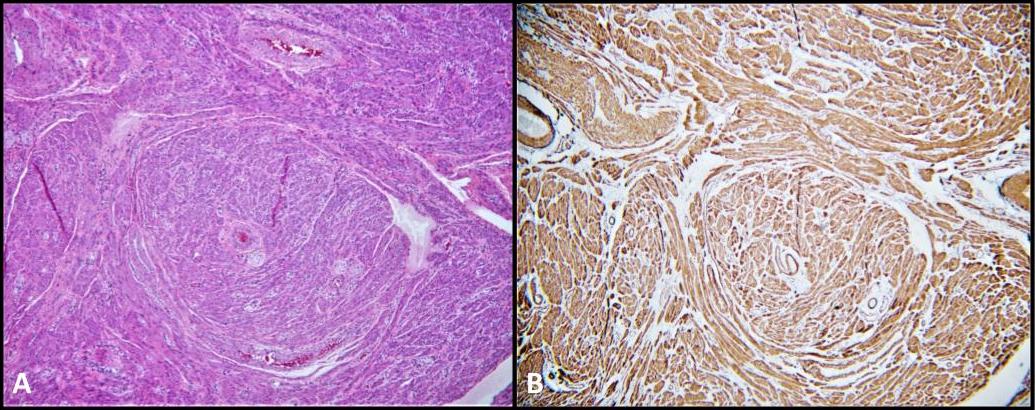
Graphique 5. A) Léiomyome ; H&E, 100x. Fascicules de cellules musculaires lisses fusiformes. B) La coloration cytoplasmique de l’actine musculaire lisse (SMA) est diffuse et forte.
Aucun équipement spécifique utilisé.
Rien à divulguer.
Le patient visé dans cet article vidéo a donné son consentement éclairé pour être filmé et est conscient que des informations et des images seront publiées en ligne.
References
- Calvo A, Escolino M, Settimi A, Roberti A, Caprio MG, Esposito C. Approche laparoscopique pour la gonadectomie chez les patients pédiatriques atteints de troubles intersexués. Trad. Pediatr. 2016; 5(4):295-304. https://doi.org/10.21037/tp.2016.09.06
- Kusumi M, Mitsunami M, Onoue H, et al. Syndrome complet d’insensibilité aux androgènes et taux d’hormones anti-Müllériennes avant et après la gonadectomie laparoscopique. Gynécol minim invasif Ther. 2017; 6(3):126-128. https://doi.org/10.1016/j.gmit.2016.11.001
- Cheikhelard A, Thibaud E, Morel Y, et al. Syndrome complet d’insensibilité aux androgènes : diagnostic et prise en charge. Expert Rev Endocrinol Metab. 2009; 4(6):565-573. https://doi.org/10.1586/eem.09.31
- Lanciotti L, Cofini M, Leonardi A, Bertozzi M, Penta L, Esposito S. Différentes présentations cliniques et prise en charge du syndrome d’insensibilité complète aux androgènes (CAIS). Int J Environ Res Santé publique. 2019; 16(7):1268. https://doi.org/10.3390/ijerph16071268
- Grasso D, Borreggine C, Campanale C, Longo A, Grilli G, Macarini L. Utilité et rôle de l’imagerie par résonance magnétique dans un cas de syndrome d’insensibilité complète aux androgènes. Radiol Case Rep. 2015; 10(2):1119. https://doi.org/10.2484/rcr.v10i2.1119
- Nezzo M, De Visschere P, T’Sjoen G, Weyers S, Villeirs G. Rôle de l’imagerie dans le diagnostic et la prise en charge du syndrome d’insensibilité complète aux androgènes chez l’adulte. Cas Rep Radiol. 2013;2013:158484. https://doi.org/10.1155/2013/158484
- Viner RM, Teoh Y, Williams DM, Patterson MN, Hughes IA. Syndrome d’insensibilité aux androgènes : une enquête sur les procédures de diagnostic et la prise en charge au Royaume-Uni. Arch Dis Enfant. 1997; 77(4):305-309. https://doi.org/10.1136/adc.77.4.305
- Galani A, Kitsiou-Tzeli S, Sofokleous C, Kanavakis E, Kalpini-Mavrou A. Syndrome d’insensibilité aux androgènes : caractéristiques cliniques et anomalies moléculaires. Hormones (Athènes). 2008; 7(3):217-229. https://doi.org/10.14310/horm.2002.1201
- Wisniewski AB, Migeon CJ, Meyer-Bahlburg HF, et al. Syndrome complet d’insensibilité aux androgènes : résultats médicaux, chirurgicaux et psychosexuels à long terme. J Clin Endocrinol Metab. 2000; 85(8):2664-2669. https://doi.org/10.1210/jcem.85.8.6742
- Hughes IA, Davies JD, Bunch TI, Pasterski V, Mastroyannopoulou K, MacDougall J. Syndrome d’insensibilité aux androgènes. Lancet. 2012; 380(9851):1419-1428. https://doi.org/10.1016/S0140-6736(12)60071-3
- Deans R, Creighton SM, Liao LM, Conway GS. Moment de la gonadectomie chez les femmes adultes atteintes du syndrome d’insensibilité aux androgènes complet (CAIS) : préférences des patientes et preuves cliniques. Clin Endocrinol (Oxf). 2012; 76(6):894-898. https://doi.org/10.1111/j.1365-2265.2012.04330.x
- Hannema SE, Scott IS, Rajpert-De Meyts E, Skakkebaek NE, Coleman N, Hughes IA. Développement testiculaire dans le syndrome d’insensibilité complète aux androgènes. J Pathol. 2006; 208(4):518-527. https://doi.org/10.1002/path.1890
- Döhnert U, Wünsch L, Hiort O. Gonadectomie dans le syndrome d’insensibilité complète aux androgènes : pourquoi et quand ? Sex Dev. 2017; 11(4):171-174. https://doi.org/10.1159/000478082
- Chaudhry S., Tadokoro-Cuccaro R., Hannema S.E., Acerini C.L., Hughes I.A. Fréquence des tumeurs gonadiques dans le syndrome d’insensibilité complète aux androgènes (CAIS) : une analyse rétrospective des séries de cas. J Pediatr Urol. 2017; 13(5) :498.e491 à 498.e496. https://doi.org/10.1016/j.jpurol.2017.02.013
- Wünsch L, Holterhus PM, Wessel L, Hiort O. Patients atteints de troubles du développement sexuel (DSD) à risque de développement de tumeurs gonadiques : prise en charge basée sur la biopsie laparoscopique et le diagnostic moléculaire. BJU Int. 2012; 110(11 Pt C) :E958 à 965. https://doi.org/10.1111/j.1464-410X.2012.11181.x
- Cools M, Drop SL, Wolffenbuttel KP, Oosterhuis JW, Looijenga LH. Tumeurs germinales dans la gonade intersexuée : anciens chemins, nouvelles directions, frontières mouvantes. Endocr Rev. 2006; 27(5):468-484. https://doi.org/10.1210/er.2006-0005
- Batista RL, Costa EMF, Rodrigues AdS, et al. Syndrome d’insensibilité aux androgènes : une revue. Archives d’endocrinologie et de métabolisme. 2018;62:227-235. https://doi.org/10.20945/2359-3997000000031
- Bertelloni S, Meriggiola MC, Dati E, Balsamo A, Baroncelli GI. Densité minérale osseuse chez les femmes atteintes d’un syndrome d’insensibilité complète aux androgènes et de testicules intacts ou de gonades enlevées. Sex Dev. 2017; 11(4):182-189. https://doi.org/10.1159/000477599
- Pyle LC, Nathanson KL. Un guide pratique pour évaluer la prédisposition tumorale des cellules germinales gonadiques dans les différences de développement sexuel. Am j med genet c semin med genet. 2017; 175(2):304-314. https://doi.org/10.1002/ajmg.c.31562
- Manuel M, Katayama PK, Jones HW, Jr. L’âge d’apparition des tumeurs gonadiques chez les patients intersexués avec un chromosome Y. Am J Obstet Gynecol. 1976; 124(3):293-300.
https://doi.org/10.1016/0002-9378(76)90160-5 - Chertin B, Koulikov D, Alberton J, Hadas-Halpern I, Reissman P, Farkas A. L’utilisation de la laparoscopie chez les patients intersexués. Pediatr Surg Int. 2006; 22(5):405-408. https://doi.org/10.1007/s00383-006-1662-3
- Esegbona G, Cutner A, Cuckow P, Creighton S. Gonadectomie laparoscopique chez les filles pédiatriques et adolescentes atteintes de troubles intersexués. BJOG : Une revue internationale d’obstétrique et de gynécologie. 2003; 110(2):210-212. PMID : 12618168.
- Cools M, Looijenga L. Mise à jour sur la physiopathologie et les facteurs de risque pour le développement de tumeurs germinales testiculaires malignes dans le syndrome d’insensibilité aux androgènes complets. Sex Dev. 2017; 11(4):175-181. https://doi.org/10.1159/000477921
- Jockenhövel, Rutgers JK, Mason JS, Griffin JE, Swerdloff RS. Néoplasie à cellules de Leydig chez un patient atteint du syndrome de Reifenstein. Exp Clin Endocrinol. 1993; 101(6):365-370.
- Akyüz M, Topaktaş R, Ürkmez A, Koca O, Öztürk M. Évaluation de l’entité in situ de néoplasie germinale dans les tumeurs testiculaires. Turc J Urol. 2019; 45(6):418-422. https://doi.org/10.5152/tud.2018.48855
- Kaprova-Pleskacova J, Stoop H, Brüggenwirth H, et al. Syndrome complet d’insensibilité aux androgènes : facteurs influençant l’histologie gonadique, y compris la pathologie des cellules germinales. Pathologie moderne. 2014; 27(5):721-730. https://doi.org/10.1038/modpathol.2013.193
- Syndrome complet d’insensibilité aux androgènes associé à des adénomes bilatéraux à cellules de Sertoli et à des léiomyomes paratesticulaires : rapport de cas et revue de la littérature. J Pediatr Urol. 2013; 9(1) :E31 à 34. https://doi.org/10.1016/j.jpurol.2012.06.013
- Goulis DG, Iliadou PK, Papanicolaou A, et al. Mutation R831X du gène du récepteur des androgènes chez un adolescent atteint d’un syndrome d’insensibilité aux androgènes complet et d’hamatomes testiculaires bilatéraux. Hormones (Athènes). 2006; 5(3):200-204. https://doi.org/10.14310/horm.2002.11185
- Krichen Makni S, Mnif Hachicha L, Ellouze S, et al. Syndrome testiculaire féminisant avec hamartomes multiples et léiomyomes paratesticulaires bilatéraux. Rév. Med Interne. 2005; 26(12):980-983. https://doi.org/10.1016/j.revmed.2005.08.003
- Savaş-Erdeve Ş, Aycan Z, Keskin M, et al. Syndrome complet d’insensibilité aux androgènes associé à des adénomes bilatéraux à cellules de Sertoli et à un léiomyome paratesticulaire unilatéral : un rapport de cas. Le Journal turc de pédiatrie. 2016; 58(6):654-657. https://doi.org/10.24953/turkjped.2016.06.012
Cite this article
Norton JC, Singh A, Hollenbach LL, Gamble G, Gonzalez-Krellwitz LA, Canon SJ. Gonadectomie bilatérale laparoscopique prophylactique pour le syndrome complet d’insensibilité aux androgènes. J Med Insight. 2021; 2021(313). doi :10.24296/jomi/313.
