Gonadectomía bilateral laparoscópica profiláctica para el síndrome de insensibilidad completa a los andrógenos
1; 2; 3; 3; 2; 4
1Department of Urology, University of Arkansas for Medical Sciences
2Department of Pathology, University of Arkansas for Medical Sciences / Arkansas Children’s Hospital
3Department of Obstetrics and Gynecology, University of Arkansas for Medical Sciences
4Department of Pediatric Urology, Arkansas Children’s Hospital
Main Text
Table of Contents
El síndrome de insensibilidad a los andrógenos (SIA) es una afección rara causada por una mutación ligada al cromosoma X del receptor de andrógenos con una incidencia estimada de 1 a 5 por cada 100.000 individuos. Existen diversos grados de presentación para la presentación completa, parcial o leve dependiendo de la gravedad de la resistencia a los andrógenos. Los pacientes con SIA completo (CAIS) nacen fenotípicamente mujeres, pero tienen cromosomas XY masculinos y testículos en lugar de ovarios. Exhiben características sexuales femeninas secundarias normales, como el desarrollo de los senos y los genitales femeninos externos, pero carecen de útero y otras estructuras del conducto mülleriano debido a la producción testicular del factor inhibidor mülleriano (FOMIN). Debido a la resistencia a los andrógenos, los productos del conducto Wolffian dependientes de andrógenos no se desarrollan, como el epidídimo, los conductos deferentes y las vesículas seminales. Estos pacientes a menudo se presentan durante la infancia con hernias inguinales o masas sublabiales, o durante la adolescencia con amenorrea primaria. En el examen físico, generalmente tendrán un desarrollo normal de los senos, carecerán de vello púbico o axilar y tendrán una bolsa vaginal de extremo ciego de diferentes longitudes vaginales. El análisis de diagnóstico a menudo se realiza mediante ultrasonido o resonancia magnética, niveles de hormonas séricas y análisis de cariotipos.
Para los pacientes con CAIS, sus testículos pueden ubicarse dentro del canal inguinal, sublabial o intraabdominal. Después de la pubertad, los pacientes con testículos intraabdominales tienen un riesgo 15% mayor (rango 0-22%) de desarrollar tumores de células germinales (TCG). El manejo consiste en gonadectomía profiláctica con terapia de reemplazo hormonal (TRH) posterior para mantener el desarrollo puberal normal y promover una salud ósea adecuada. El debate sobre el momento de la gonadectomía profiláctica está en curso con algunos grupos de apoyo de pacientes que argumentan en contra de la gonadectomía citando preocupaciones con la terapia hormonal a largo plazo y el deseo de preservar la fertilidad. La convención actual promueve retrasar la gonadectomía hasta después de que se haya logrado la pubertad fisiológica, ya que el riesgo de desarrollar TCG prepúber es relativamente bajo (0.8-2%). Describimos la presentación, el diagnóstico, las técnicas intraoperatorias y las consideraciones postoperatorias para el manejo del CAIS mediante gonadectomía laparoscópica bilateral.
La gonadectomía puede estar indicada en niños con diferencias de desarrollo sexual (DSD) que albergan gónadas del cromosoma Y debido al mayor riesgo de neoplasia maligna gonadal. 1 Uno de estos DSD es el síndrome de insensibilidad a los andrógenos (AIS), que es causado por una mutación ligada al cromosoma X del receptor de andrógenos (AR). 2 El SIA es un diagnóstico raro con una incidencia estimada entre 1 y 5 por cada 100.000 individuos. 3 El SIA puede tener diversos grados de presentación dependiendo de la gravedad de la resistencia a los andrógenos, que van desde completa (CAIS), parcial (PAIS) y leve (MAIS). 4 Los niños con CAIS son fenotípicamente de apariencia femenina con genitales externos femeninos normales, pero tienen testículos en lugar de ovarios y tienen un cariotipo masculino (46, XY). En estos pacientes, sus testículos son capaces de producir testosterona pero, debido al defecto en la función AR, no producen productos del conducto Wolffian como el epidídimo, los conductos deferentes y las vesículas seminales. Debido a la aromatización periférica de esta testosterona en estrógeno, estas pacientes tienen características sexuales femeninas secundarias normales, como el desarrollo de los senos. Sin embargo, las células de Sertoli de los testículos continúan produciendo factor inhibidor de Müllerian (MIF), que inhibe el desarrollo de los derivados del conducto de Müller. Esto resulta en pacientes con una bolsa vaginal que termina ciegamente con una ausencia de otros órganos sexuales femeninos como el útero, el cuello uterino y las trompas de Falopio. 5 En estos pacientes, los testículos pueden estar ubicados dentro del canal inguinal, ser sublabiales o ser intraabdominales. 6 Los lactantes con insensibilidad a los andrógenos pueden presentar hernias inguinales unilaterales o bilaterales o masas labiales. Se estima que el 1-2% de las hernias inguinales bilaterales entre las niñas podrían representar un diagnóstico de CAIS, y es importante mantener una fuerte sospecha clínica durante su evaluación. 7 Clásicamente, CAIS se presenta durante la adolescencia como amenorrea primaria en niñas con desarrollo mamario normal pero poco o ningún vello púbico o axilar en el examen. CAIS se asocia con un desarrollo testicular anormal, así como un mayor riesgo de neoplasia maligna de células germinales después de la pubertad. 8
Esta paciente es una mujer de 15 años de ascendencia asiática con antecedentes médicos de obesidad mórbida (IMC de 45), apnea obstructiva del sueño en CPAP y prediabetes (HbA1c de 5.5) actualmente en metformina. Ella tiene un historial quirúrgico pasado de reparación de hernia inguinal bilateral cuando era niña pequeña. No tiene antecedentes de embarazos previos, no es sexualmente activa y fue remitida a nuestra clínica para una evaluación adicional de la amenorrea primaria. Ella informa que desarrolló thelarche a los 11 años, pero tiene vello axilar y púbico escaso y no tiene signos de acné. Además, niega cualquier dolor, flujo vaginal, hirsutismo o galactorrea. En una clínica externa, nuestro paciente negó sangrado después de un desafío de progestina, y no se palpó ningún cuello uterino durante un examen pélvico previo.
Según los antecedentes familiares de la paciente, tiene tres hermanas mayores que tienen 19, 21 y 26 años de edad. Su madre comenzó la menstruación a los 14 años. Sus hermanas de 26 y 19 años también informan que tienen menstruaciones regulares que comenzaron alrededor de los 11 años, y la hermana mayor ha tenido cuatro hijos sanos. Curiosamente, su hermana de 21 años también ha sido vista por un médico de fuera del estado para la evaluación de la amenorrea primaria de etiología desconocida. Se le dijo que su hiato vaginal era insuficiente para el parto y fue remitida a un especialista para una evaluación adicional, pero se perdió en el seguimiento.
En el examen físico, la paciente era obesa, tenía desarrollo mamario en etapa 5 de Tanner con vello axilar escaso y sin signos de acné presente. En el examen genitourinario, el paciente tenía genitales femeninos externos normales con vello púbico escaso. La vagina era de apariencia normal, sin secreción anormal y una bolsa vaginal de terminación ciega. No fue posible visualizar o palpar el cuello uterino o el útero en el examen. Los hallazgos del examen fueron consistentes para una posible anomalía congénita. Luego se ordenaron pruebas de laboratorio e imágenes apropiadas.
Resultados de laboratorio:
| Prueba | Resultado | Referencia |
| B-hCG | Negativo | Negativo |
| FSH | 13,20 mUI/ml | 5–20 mUI/mL |
| LH | 22,20 mUI/ml | 5–20 mUI/mL |
| Prolactina | 8,1 ng/ml | 3,0–18,6 ng/ml |
| Estradiol | 38,33 pg/ml |
34–170 pg/ml (Curtidor Femenino Etapa 5) |
| Testosterona | 269 ng/dL |
20–38 ng/dL (Curtidor Femenino Etapa 5) |
| TSH | 1,94 mUI/L | 0,47–4,68 mUI/L |
| Análisis cromosómico | 46, XY |
Mujeres: 46, XX Hombres: 46, XY |
Los laboratorios iniciales se realizaron para evaluar los problemas asociados con el eje hipotalámico-hipofisario-ovárico (HPO), como la hormona foliculoestimulante (FSH), la hormona luteinizante (LH), la prolactina y la testosterona. Además, se realizó una beta-hCG en orina para descartar el embarazo. Los laboratorios para nuestra paciente revelaron que tenía un nivel elevado de testosterona en comparación con las pacientes femeninas normales. Además, un análisis de cariotipo para nuestro paciente dio como resultado 46 cromosomas XY. Juntos, estos hallazgos son consistentes con un diagnóstico de CAIS, donde los niveles elevados de testosterona (rango femenino anormal, pero rango masculino normal) y los niveles séricos altos de LH resultan debido al deterioro de la retroalimentación negativa de andrógenos en la hipófisis anterior.
Se ordenaron imágenes a través de ultrasonido pélvico para evaluar la presencia o ausencia del útero y otros órganos sexuales femeninos. Las imágenes de ultrasonido realizadas en un hospital externo mostraron una ausencia de útero, trompas de Falopio y cuello uterino. Además, las imágenes revelaron una ausencia de ovarios y no pudieron evaluar con precisión la ubicación de los posibles testículos intraabdominales. Los ultrasonidos pueden ser dependientes del operador, y la resonancia magnética es ampliamente considerada como el estándar de oro para diagnosticar y localizar las gónadas en la planificación quirúrgica para la gonadectomía laparoscópica y la vigilancia gonadal. 5
Un estudio realizado por Wisniewski et al. examinó los resultados a largo plazo entre 14 mujeres con CAIS que estaban en tratamiento de reemplazo hormonal (TRH) a largo plazo después de la gonadectomía. 9 Encontraron que, en general, estas mujeres pueden esperar tener una vida activa normal. La mayoría de estas mujeres excedieron el percentil 90 de estatura para las hembras adultas normales,9 haciéndolas más altas que la hembra promedio, sin dejar de ser más cortas que la población masculina normal. 10 La condición médica más común que se diagnosticó entre estas mujeres fue la osteoporosis. La mayoría de las mujeres identificadas como heterosexuales con una identidad de género femenina heterosexual y ninguna de ellas deseaba una cirugía de inversión de género. La mayoría informó estar satisfecha con su funcionamiento sexual. La longitud vaginal promedio entre esta cohorte fue de 8,8 cm, lo que es consistente con la longitud vaginal normal que varía de 7 a 11 cm.9
Actualmente, no existe una terapia disponible para revertir la mutación genética subyacente de la AR en pacientes con CAIS. Por lo tanto, el tratamiento se centra en la gonadectomía profiláctica para prevenir la posible neoplasia maligna gonadal con la TRH posterior, el tratamiento del tracto urogenital, si está indicado, así como el apoyo psicológico. La gonadectomía generalmente se retrasa hasta que se completa la maduración sexual durante la adolescencia para permitir el desarrollo puberal espontáneo normal. 3 Si se diagnostica temprano en la infancia o la niñez, se puede considerar la gonadectomía temprana si el niño presenta masas inguinales o labiales dolorosas o incómodas, pero requerirá TRH posterior para inducir la pubertad aproximadamente a los 11-12 años de edad. 3 El momento de la gonadectomía se ha vuelto controvertido con algunos pacientes y grupos de apoyo de AIS que abogan por conservar sus testículos. Una variedad de razones han sido citadas por estos grupos de apoyo para mantener los testículos, como los factores psicológicos, los riesgos asociados con la cirugía, el deseo de preservar potencialmente la fertilidad y la renuencia a adherirse a la TRH a largo plazo. Sin embargo, los riesgos reportados para la gonadectomía laparoscópica son muy bajos, con un riesgo estimado de muerte de 0,1 por 1000 procedimientos, y el riesgo de lesión en el intestino o sangrado se informa en 2,4%. 11 Por otra parte, un estudio realizado por Hannema et al. examinó los testículos de 44 pacientes con CAIS y constató que las células germinales disminuyeron rápidamente en número después del primer año de vida y no encontró evidencia de espermatogénesis en ninguno de los testículos, lo que hace que la fertilidad sea muy poco probable para los pacientes con CAIS. 12 Para los pacientes con CAIS que deciden conservar sus testículos, se ha informado que el riesgo de desarrollar tumores de células germinales (TCG) aumenta con la edad. 11 Es importante mantener un seguimiento estrecho a través de la vigilancia activa mediante la utilización de imágenes regulares (ultrasonido y / o resonancia magnética) y marcadores sanguíneos séricos para detectar el posible desarrollo de TCG en estos pacientes. 13 Si bien la resonancia magnética puede detectar cambios benignos como quistes paratesticulares y adenomas, no puede detectar cambios premalignos como la neoplasia de células germinales in situ (GCNIS), lo que requeriría una biopsia de las gónadas.14 Además, la calidad de la ecografía suele depender del operador. Un enfoque propuesto por Wunsch et al. para los pacientes que desean retener sus testículos, sería realizar una biopsia gonadal laparoscópica y fijar quirúrgicamente las gónadas intraabdominales cerca de la pared abdominal para permitir una mejor visualización a través del ultrasonido. 15
El objetivo principal de realizar la gonadectomía en el contexto de CAIS es disminuir el riesgo de neoplasia maligna futura. Al igual que en otras formas de criptorquidia, existe un mayor riesgo de desarrollar TCG. En CAIS, el riesgo de desarrollar TCG prepuberal entre estos pacientes se considera muy bajo, oscilando entre 0,8 y 2,0%. 16 Después de la pubertad, este riesgo aumenta con la edad y se estima que es de aproximadamente el 15% (oscila entre el 0 y el 22%). 11 Se recomienda que la gonadectomía profiláctica ocurre en el período postpuberal cuando la feminización se completa en parte por el estrógeno testicular que se deriva en parte de la conversión de andrógenos en estrógeno. 3, 8 Retrasar la gonadectomía hasta más adelante en la adolescencia también permite a los proveedores de atención obtener el consentimiento informado directamente de sus pacientes.
Al evaluar a los niños, cuyo eje HPO aún es inmaduro, es necesaria una prueba de estimulación de hCG para evaluar adecuadamente la secreción de testosterona de las células de Leydig. 17 Después de la gonadectomía, estas pacientes necesitarán terapia hormonal con suplementos hormonales a largo plazo con reemplazo de estrógenos hasta la edad de la menopausia natural (alrededor de los 50-52 años de edad) para mantener el desarrollo normal de los senos y los huesos, el bienestar psicosocial y la función sexual. 18 Debido a que estas pacientes no tienen útero, las progestinas no son necesarias para complementar la terapia con estrógenos. 17 Estas pacientes continuarán conservando las características sexuales femeninas secundarias normales y pueden alcanzar una función sexual normal, pero pueden requerir terapia de dilatación vaginal o vaginoplastia dependiendo de la adecuación de su canal vaginal. 17 Las cuestiones de infertilidad e identidad de género pueden tener un gran impacto psicosocial para estos pacientes, y se recomienda encarecidamente ofrecer asesoramiento o terapia de grupo de apoyo como parte de un enfoque multidisciplinario. 9
CAIS (anteriormente conocido como síndrome de Morris) representa una de las causas definibles más comunes de 46, XY DSD. Es el resultado de una rara mutación ligada al cromosoma X de la RA que causa resistencia a los andrógenos periféricos. Estos pacientes nacen fenotípicamente femeninos con genitales externos femeninos normales. Comúnmente, estos pacientes se presentan en la adolescencia con amenorrea primaria, donde el examen posterior revelará que estos pacientes tienen una bolsa vaginal que termina ciegamente y una ausencia de órganos sexuales femeninos internos en las imágenes. En lugar de ovarios, estos pacientes tienen testículos que se pueden encontrar en el abdomen, el canal inguinal o los labios. En niños o bebés, CAIS puede presentarse como una hernia o masa inguinal, donde aproximadamente el 1-2% de las mujeres con hernias inguinales se encuentran con criptorquidia con cariotipo 46,XY. 7 En este caso específico, nuestro paciente tenía antecedentes quirúrgicos de reparación de hernia inguinal bilateral cuando era un niño pequeño. Esto sugiere un diagnóstico erróneo o tardío y destaca la importancia de mantener una fuerte sospecha clínica de CAIS en pacientes femeninas pediátricas que presentan hernias inguinales bilaterales, lo que justifica un examen más detallado para descartar la criptorquidia.
El riesgo estimado para los pacientes con SIA que desarrollan TCG está inversamente relacionado con el grado de resistencia a los andrógenos. Los pacientes con CAIS tienen mutaciones más graves de su AR que infieren una pérdida completa de la función. Sin la estimulación de andrógenos, la espermatogénesis se ve afectada y hay una rápida disminución asociada en el número de células germinales después del primer año de vida que teóricamente confiere un riesgo reducido de desarrollar GCT más adelante en la vida. 14 Esto contrasta con los pacientes con PAIS, que aún conservan cierto grado de función AR y, por lo tanto, tienen más probabilidades de tener células germinales sobrevivientes, lo que posteriormente los pone en mayor riesgo de desarrollar TCG en la edad adulta. 19 Históricamente, Manuel et al. reportaron un riesgo acumulado de 3.6% de GCT en pacientes con DSD que contienen Y hasta la edad de 25 años que aumentó a 33% a los 50 años de edad. 20 Más recientemente, Deans et al. encontraron en su revisión que los pacientes con CAIS tenían un riesgo 15% mayor de desarrollar una neoplasia maligna gonadal en la edad adulta (rango 0-22%). 11 Cools et al. encontraron que el riesgo estimado de desarrollar TCG en pacientes con CAIS antes de la pubertad era mucho menor en 0.8-2%. 16
Debido al mayor riesgo de neoplasia maligna gonadal entre los pacientes con CAIS en la edad adulta, la recomendación actual es realizar una gonadectomía después de que se complete la maduración sexual, generalmente alrededor de los 15-16 años de edad, ya que el riesgo de desarrollar tumores antes de la pubertad se considera relativamente bajo. 21 Este enfoque permite el desarrollo espontáneo de los senos y una mejor mineralización ósea durante la pubertad debido a la producción fisiológica de hormonas por los testículos y la posterior conversión periférica de andrógenos en estrógenos. 3, 8 Históricamente, la laparotomía y la gonadectomía bilateral se realizaban para pacientes con cromosoma Y que contenía DSD. Con el tiempo, los procedimientos laparoscópicos se adoptaron ampliamente para los pacientes con DSD debido a las ventajas asociadas de la ampliación y el fácil acceso a la cavidad pélvica a través de un enfoque mínimamente invasivo, que proporciona una recuperación postoperatoria más corta y la duración de la hospitalización, y una cosmesis mejorada. 22, 23
La gonadectomía laparoscópica se realiza mientras el paciente está bajo anestesia general mediante intubación endotraqueal. El monitor de video, el insuflador y la fuente de luz se colocan al pie del paciente. En este caso, la insuflación del abdomen se realizó mediante una técnica de laparoscopia abierta donde se realizó una incisión semilunar en la cara inferior del ombligo y se elevó la fascia mediante hemostáticos. Luego se colocó una aguja Veress en el abdomen y se confirmó su posición correcta mediante una prueba de caída salina. Luego se insertó un trocar Step de 10 mm a través del ombligo, y se utilizó CO2 para obtener neumoperitoneo. Luego se introdujo un laparoscopio 0o en el abdomen. Se colocaron dos trocares adicionales de 5 mm para instrumentos de trabajo al nivel del ombligo en los lados derecho e izquierdo. Luego, el paciente se colocó en la posición de Trendelenburg, lo que permite una inspección laparoscópica más fácil de la pelvis para determinar la ubicación de las gónadas e inspeccionar los órganos pélvicos. Cuando las gónadas no son evidentes, identificar y seguir los vasos gonadales puede ayudar a localizarlos. 1
Durante la laparoscopia, las gónadas de nuestro paciente se observaron bilateralmente por encima de los anillos internos cerrados. Grossly, los quistes se visualizaron en los testículos bilaterales. Los conductos deferentes atravesaron la uretra, y no hubo evidencia de ninguna estructura mülleriana dentro de la pelvis. Se diseccionó un plano a través del peritoneo posterior alrededor de las gónadas lejos de las otras estructuras retroperitoneales. Es importante determinar la ubicación y el curso de las estructuras retroperitoneales como los uréteres y los vasos ilíacos para evitar lesiones iatrogénicas. Los vasos espermáticos internos se identificaron a medida que se transvían a la gónada y se fulguramos utilizando el dispositivo Ligasure en cuatro secciones sucesivas antes de transectarse para reducir la probabilidad de sangrado. Los testículos se movilizaron desde el peritoneo, y los conductos deferentes también se fulguramos y dividieron de manera similar. El laparoscopio se insertó a través de uno de los puertos de trabajo para que las gónadas pudieran extraerse a través del puerto umbilical central de 10 mm. El neumoperitoneo de CO2 abdominal se invirtió y la fascia umbilical se cerró con sutura vicril 2-0. La piel en todos los sitios del puerto se cerró con 5-0 Monocryl y se cubrió con Dermabond.
Ambas gónadas fueron extirpadas sin complicaciones y enviadas a patología para su evaluación. El tiempo de operación de la gonadectomía laparoscópica, desde la incisión hasta el cierre, fue de aproximadamente 80 minutos. Hubo menos de 5 ml de pérdida de sangre estimada. El paciente ingresó durante la noche para observación debido a factores sociales. Ella toleró bien el procedimiento, su dolor estaba bien controlado usando el manejo multimodal del dolor, y fue dada de alta a casa a la mañana siguiente. Estaba programada para un seguimiento en dos semanas con su ginecólogo para comenzar la terapia de reemplazo de estrógeno.
Es significativo notar que bajo la laparoscopia pudimos visualizar conductos deferentes bilaterales que se trazaron hasta la uretra. Una serie de casos de 44 pacientes con CAIS realizada por Hannema et al. encontró que el 36% tenía epidídimo o conducto deferente presentes. 12 Hannema et al. plantearon la hipótesis de que la actividad residual de los andrógenos paracrinos puede inducir el desarrollo de productos del conducto wolffiano, incluso en pacientes con formas completas de SIA. 12
La patología quirúrgica de nuestra paciente confirmó que sus dos gónadas eran en realidad testículos atróficos. Curiosamente, ambos testículos demostraron GCNIS y marcaron hiperplasia de células de Leydig (Figuras 1-2). Las células neoplásicas se tiñen con OCT3/4 y PLAP (Figuras 3-4). La hiperplasia de células de Leydig, como se observa en este paciente, es un hallazgo común en pacientes con CAIS. 24 Se ha propuesto que los altos niveles de LH, debido a la falta de retroalimentación negativa de andrógenos en la hipófisis anterior, son responsables del aumento de la celularidad de Leydig. 25 GCNIS se considera un tumor premaligna, donde hasta el 50% progresará a GCT dentro de los 5 años. 26 El riesgo de progresión del GCNIS a TCG invasivo es menos seguro en pacientes con CAIS. La "teoría de la falta de andrógenos" propuesta por Kaprova-Pleskacova et al., sugiere que los pacientes con CAIS tienen menos probabilidades de progresar a GCT que los pacientes con PAIS debido a la respuesta insuficiente de los andrógenos para promover la supervivencia de las células germinales anormales. 27 Por el contrario, Kaprova-Pleskacova et al. también sugirieron que la misma actividad de andrógenos paracrinos potencialmente responsable de inducir el desarrollo del conducto de Wolffian como lo mencionan Hannema et al.12 también podría promover que gcNIS se convierta en GCT invasivo. 27 La presencia de conductos deferentes y la evidencia histológica de GCNIS en nuestro paciente sugieren una posible respuesta residual de andrógenos paracrinos. Como tal, creemos que este caso ayuda a apoyar el argumento del beneficio potencial de la gonadectomía profiláctica entre los pacientes con CAIS.
La patología quirúrgica de nuestro paciente también fue significativa para los leiomiomas paratesticulares bilaterales (Figura 5), un tumor del músculo liso que muy raramente ocurre dentro del tracto urogenital. Su ubicación puede ser intratesticular o paratesticular y se cree que se deriva de las células musculares lisas del estroma intersticial, la capa muscular de los vasos de la túnica albugínea, los túbulos seminíferos, así como las estructuras paratesticulares como el cordón espermático, el epidídimo, los restos vestigiales y la túnica vaginal. 28 Los leiomiomas se describen muy raramente en pacientes con SIA. De hecho, solo ha habido cuatro informes de casos dentro de la literatura que describen la presencia de leiomiomas en la biopsia después de la gonadectomía en pacientes con SIA. 28-31 Hasta donde sabemos, este es el primer caso documentado de leiomiomas paratesticulares bilaterales que se desarrollan simultáneamente con GCNIS en un paciente con CAIS.
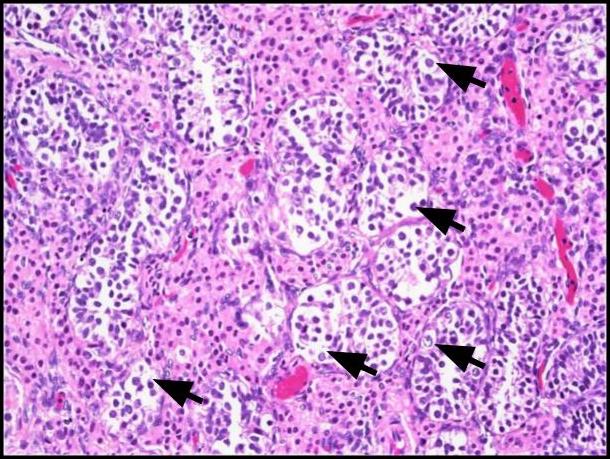
Figura 1. Neoplasia de células germinales in situ (GCNIS). Se ven grandes células atípicas (flechas negras) con abundante citoplasma claro a débilmente eosinofílico, un núcleo central con el nucléolo prominente y cromatina distribuida uniformemente. H&E, 200x.
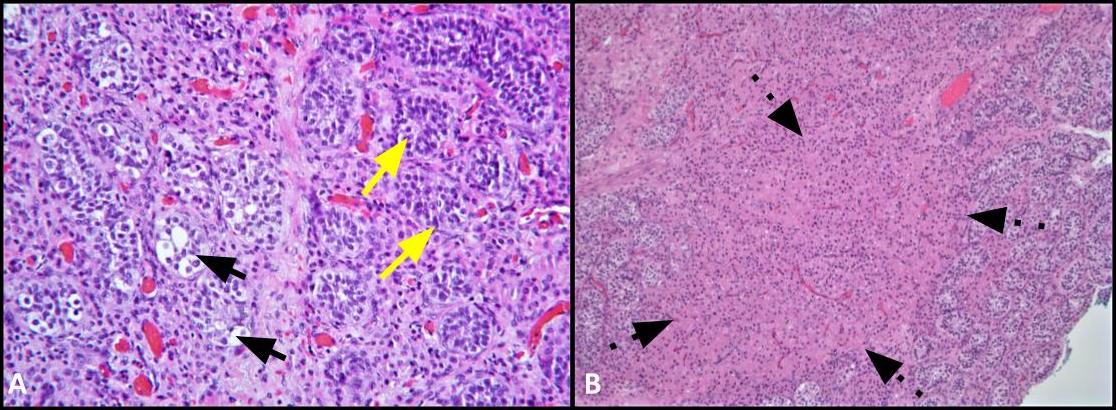
Figura 2. A) Esta imagen muestra la comparación de los túbulos involucrados por GCNIS (flechas negras) con túbulos seminíferos adyacentes con espermatogénesis normal (flechas amarillas); H&E, 200x. B) La imagen de baja potencia muestra grupos de células de Leydig dentro del intersticio (flechas discontinuas); H&E, 100x.
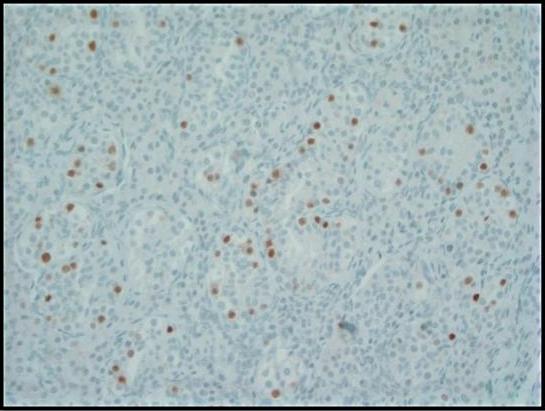
Figura 3. La tinción inmunohistoquímica para el factor de transcripción de unión a octámeros (OCT) 3/4 muestra una fuerte inmunorreactividad nuclear en las células GCNIS dentro de los túbulos seminíferos. Las células germinales normales son negativas; 200x.
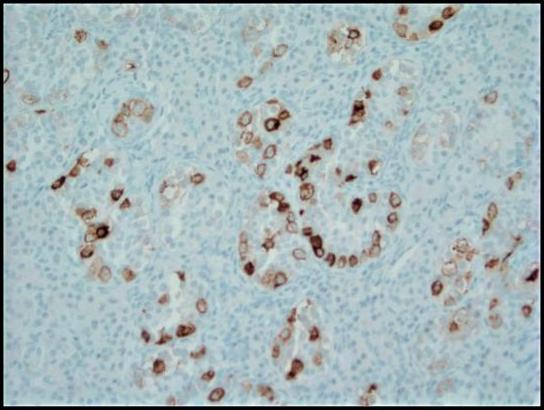
Figura 4. La tinción inmunohistoquímica con fosfatasa alcalina placentaria (PLAP) resalta las células tumorales de GCNIS en un patrón membranoso citoplasmático; 200x.
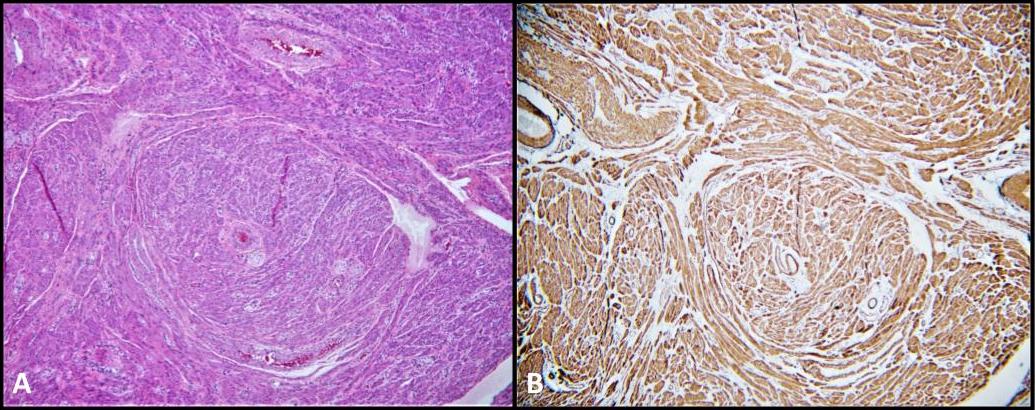
Figura 5. A) Leiomioma; H&E, 100x. Fascículos de células musculares lisas discontinuas. B) La tinción citoplasmática de actina del músculo liso (AME) es difusa y fuerte.
No se utiliza ningún equipo específico.
Nada que revelar.
El paciente al que se hace referencia en este video artículo ha dado su consentimiento informado para ser filmado y es consciente de que la información y las imágenes se publicarán en línea.
References
- Calvo A, Escolino M, Settimi A, Roberti A, Caprio MG, Esposito C. Abordaje laparoscópico para gonadectomía en pacientes pediátricos con trastornos intersexuales. Transl Pediatr. 2016;5(4):295-304. https://doi.org/10.21037/tp.2016.09.06
- Kusumi M, Mitsunami M, Onoue H, et al. Síndrome de insensibilidad a los andrógenos completo y niveles de hormona antimülleriana antes y después de la gonadectomía laparoscópica. Gynecol Minim Invasivo Ther. 2017;6(3):126-128. https://doi.org/10.1016/j.gmit.2016.11.001
- Cheikhelard A, Thibaud E, Morel Y, et al. Síndrome de insensibilidad completa a los andrógenos: diagnóstico y manejo. Experto Rev Endocrinol Metab. 2009;4(6):565-573. https://doi.org/10.1586/eem.09.31
- Lanciotti L, Cofini M, Leonardi A, Bertozzi M, Penta L, Esposito S. Diferentes presentaciones clínicas y manejo en el síndrome de insensibilidad completa a los andrógenos (CAIS). Int J Environ Res Salud Pública. 2019;16(7):1268. https://doi.org/10.3390/ijerph16071268
- Grasso D, Borreggine C, Campanale C, Longo A, Grilli G, Macarini L. Utilidad y papel de la resonancia magnética en un caso de síndrome de insensibilidad completa a los andrógenos. Representante de Casos Radiol 2015;10(2):1119. https://doi.org/10.2484/rcr.v10i2.1119
- Nezzo M, De Visschere P, T'Sjoen G, Weyers S, Villeirs G. Papel de las imágenes en el diagnóstico y tratamiento del síndrome de insensibilidad completa a los andrógenos en adultos. Caso Rep Radiol. 2013;2013:158484. https://doi.org/10.1155/2013/158484
- Viner RM, Teoh Y, Williams DM, Patterson MN, Hughes IA. Síndrome de insensibilidad a los andrógenos: una encuesta de procedimientos de diagnóstico y manejo en el Reino Unido. Arch Dis Niño. 1997;77(4):305-309. https://doi.org/10.1136/adc.77.4.305
- Galani A, Kitsiou-Tzeli S, Sofokleous C, Kanavakis E, Kalpini-Mavrou A. Síndrome de insensibilidad a los andrógenos: características clínicas y defectos moleculares. Hormonas (Atenas). 2008;7(3):217-229. https://doi.org/10.14310/horm.2002.1201
- Wisniewski AB, Migeon CJ, Meyer-Bahlburg HF, et al. Síndrome de insensibilidad completa a los andrógenos: resultado médico, quirúrgico y psicosexual a largo plazo. J Clin Endocrinol Metab. 2000;85(8):2664-2669. https://doi.org/10.1210/jcem.85.8.6742
- Hughes IA, Davies JD, Bunch TI, Pasterski V, Mastroyannopoulou K, MacDougall J. Síndrome de insensibilidad a los andrógenos. Lanceta. 2012;380(9851):1419-1428. https://doi.org/10.1016/S0140-6736(12)60071-3
- Decanos R, Creighton SM, Liao LM, Conway GS. Momento de la gonadectomía en mujeres adultas con síndrome de insensibilidad completa a los andrógenos (CAIS): preferencias del paciente y evidencia clínica. Clin Endocrinol (Oxf). 2012;76(6):894-898. https://doi.org/10.1111/j.1365-2265.2012.04330.x
- Hannema SE, Scott IS, Rajpert-De Meyts E, Skakkebaek NE, Coleman N, Hughes IA. Desarrollo testicular en el síndrome de insensibilidad completa a los andrógenos. J Pathol. 2006;208(4):518-527. https://doi.org/10.1002/path.1890
- Döhnert U, Wünsch L, Hiort O. Gonadectomía en el síndrome de insensibilidad a los andrógenos completos: ¿por qué y cuándo? Desarrollo sexual. 2017;11(4):171-174. https://doi.org/10.1159/000478082
- Chaudhry S, Tadokoro-Cuccaro R, Hannema SE, Acerini CL, Hughes IA. Frecuencia de tumores gonadales en el síndrome de insensibilidad a los andrógenos completos (CAIS): Análisis retrospectivo de series de casos. J Pediatr Urol. 2017;13(5):498.e491-498.e496. https://doi.org/10.1016/j.jpurol.2017.02.013
- Wünsch L, Holterhus PM, Wessel L, Hiort O. Pacientes con trastornos del desarrollo sexual (DSD) en riesgo de desarrollo tumoral gonadal: manejo basado en biopsia laparoscópica y diagnóstico molecular. BJU Int. 2012;110(11 Pt C):E958-965. https://doi.org/10.1111/j.1464-410X.2012.11181.x
- Cools M, Drop SL, Wolffenbuttel KP, Oosterhuis JW, Looijenga LH. Tumores de células germinales en la gónada intersexual: viejos caminos, nuevas direcciones, fronteras en movimiento. Endocr Rev. 2006;27(5):468-484. https://doi.org/10.1210/er.2006-0005
- Batista RL, Costa EMF, Rodrigues AdS, et al. Síndrome de insensibilidad a los andrógenos: una revisión. Archivos de Endocrinología y Metabolismo. 2018;62:227-235. https://doi.org/10.20945/2359-3997000000031
- Bertelloni S, Meriggiola MC, Dati E, Balsamo A, Baroncelli GI. Densidad mineral ósea en mujeres que viven con síndrome de insensibilidad completa a los andrógenos y testículos intactos o gónadas extirpadas. Desarrollo sexual. 2017;11(4):182-189. https://doi.org/10.1159/000477599
- Pyle LC, Nathanson KL. Una guía práctica para evaluar la predisposición tumoral de células germinativas gonadales en las diferencias de desarrollo sexual. Am J Med Genet C Semin Med Genet. 2017;175(2):304-314. https://doi.org/10.1002/ajmg.c.31562
- Manuel M, Katayama PK, Jones HW, Jr. La edad de aparición de tumores gonadales en pacientes intersexuales con un cromosoma Y. Am J Obstet Gynecol. 1976;124(3):293-300.
https://doi.org/10.1016/0002-9378(76)90160-5 - Chertin B, Koulikov D, Alberton J, Hadas-Halpern I, Reissman P, Farkas A. El uso de la laparoscopia en pacientes intersexuales. Pediatr Surg Int. 2006;22(5):405-408. https://doi.org/10.1007/s00383-006-1662-3
- Esegbona G, Cutner A, Cuckow P, Creighton S. Gonadectomía laparoscópica en niñas pediátricas y adolescentes con trastornos intersexuales. BJOG: Una revista internacional de obstetricia y ginecología. 2003;110(2):210-212. PMID: 12618168.
- Cools M, Looijenga L. Actualización sobre la fisiopatología y los factores de riesgo para el desarrollo de tumores malignos de células germinativas testiculares en el síndrome de insensibilidad completa a los andrógenos. Desarrollo sexual. 2017;11(4):175-181. https://doi.org/10.1159/000477921
- Jockenhövel, Rutgers JK, Mason JS, Griffin JE, Swerdloff RS. Neoplasia de células de Leydig en un paciente con síndrome de Reifenstein. Exp Clin Endocrinol. 1993;101(6):365-370.
- Akyüz M, Topaktaş R, Ürkmez A, Koca O, Öztürk M. Evaluación de la neoplasia de células germinales in situ en tumores testiculares. Turco J Urol. 2019;45(6):418-422. https://doi.org/10.5152/tud.2018.48855
- Kaprova-Pleskacova J, Stoop H, Brüggenwirth H, et al. Síndrome de insensibilidad completa a los andrógenos: factores que influyen en la histología gonadal, incluida la patología de las células germinales. Patología moderna. 2014;27(5):721-730. https://doi.org/10.1038/modpathol.2013.193
- Siminas S, Kokai G, Kenny SE. Síndrome de insensibilidad completa a los andrógenos asociado con adenomas bilaterales de células de Sertoli y leiomiomas paratesticulares: informe de caso y revisión de la literatura. J Pediatr Urol. 2013;9(1):e31-34. https://doi.org/10.1016/j.jpurol.2012.06.013
- Goulis DG, Iliadou PK, Papanicolaou A, et al. Mutación R831X del gen del receptor de andrógenos en un adolescente con síndrome de insensibilidad completa a los andrógenos y hamartomas testiculares bilaterales. Hormonas (Atenas). 2006;5(3):200-204. https://doi.org/10.14310/horm.2002.11185
- Krichen Makni S, Mnif Hachicha L, Ellouze S, et al. Síndrome testicular feminizante con hamartomas múltiples y leiomiomas paratesticulares bilaterales. Rev Med Interne. 2005;26(12):980-983. https://doi.org/10.1016/j.revmed.2005.08.003
- Savaş-Erdeve Ş, Aycan Z, Keskin M, et al. Síndrome de insensibilidad completa a los andrógenos asociado con adenomas bilaterales de células sertoli y leiomioma paratesticular unilateral: un informe de caso. El Diario Turco de Pediatría. 2016;58(6):654-657. https://doi.org/10.24953/turkjped.2016.06.012
Cite this article
Norton JC, Singh A, Hollenbach LL, Gamble G, Gonzalez-Krellwitz LA, Canon SJ. Gonadectomía bilateral laparoscópica profiláctica para el síndrome de insensibilidad completa a los andrógenos. J Med Insight. 2021;2021(313). doi:10.24296/jomi/313.
