Prophylaktische laparoskopische bilaterale Gonadektomie bei vollständigem Androgeninsensitivitätssyndrom
1; 2; 3; 3; 2; 4
1Department of Urology, University of Arkansas for Medical Sciences
2Department of Pathology, University of Arkansas for Medical Sciences / Arkansas Children’s Hospital
3Department of Obstetrics and Gynecology, University of Arkansas for Medical Sciences
4Department of Pediatric Urology, Arkansas Children’s Hospital
Main Text
Table of Contents
Das Androgeninsensitivitätssyndrom (AIS) ist eine seltene Erkrankung, die durch eine X-chromosomale Mutation des Androgenrezeptors mit einer geschätzten Inzidenz von 1-5 pro 100.000 Personen verursacht wird. Je nach Schweregrad der Androgenresistenz gibt es unterschiedliche Darstellungsgrade für vollständige, partielle oder milde. Patienten mit vollständigem AIS (CAIS) werden phänotypisch weiblich geboren, haben aber männliche XY-Chromosomen und Hoden anstelle von Eierstöcken. Sie zeigen normale sekundäre weibliche Geschlechtsmerkmale wie Brustentwicklung und äußere weibliche Genitalien, aber es fehlt ihnen eine Gebärmutter und andere Müllersche Gangstrukturen aufgrund der Hodenproduktion des Müllerschen Hemmfaktors (MIF). Aufgrund der Androgenresistenz entwickeln sich keine androgenabhängigen Wolffian-Duct-Produkte wie der Nebenhoden, Vas deferens und die Samenbläschen. Diese Patienten präsentieren sich häufig entweder im Säuglingsalter mit Leistenbrüchen oder sublabialen Massen oder während der Adoleszenz mit primärer Amenorrhoe. Bei körperlicher Untersuchung haben sie typischerweise eine normale Brustentwicklung, haben keine Scham- oder Achselhaare und haben einen blind endenden Vaginalbeutel unterschiedlicher Vaginallänge. Die diagnostische Aufarbeitung wird häufig mit Ultraschall oder MRT, Serumhormonspiegeln und Karyotypanalyse durchgeführt.
Bei Patienten mit CAIS können sich ihre Hoden sublabiell oder intraabdominal im Leistenkanal befinden. Nach der Pubertät haben Patienten mit intraabdominalen Hoden ein um 15% erhöhtes Risiko (Bereich 0-22%), Keimzelltumoren (GCT) zu entwickeln. Das Management besteht aus einer prophylaktischen Gonadektomie mit anschließender Hormonersatztherapie (HRT), um eine normale pubertäre Entwicklung aufrechtzuerhalten und eine angemessene Knochengesundheit zu fördern. Die Debatte über den Zeitpunkt der prophylaktischen Gonadektomie ist im Gange, wobei einige Patientenunterstützungsgruppen gegen die Gonadektomie argumentieren und Bedenken hinsichtlich der langfristigen Hormontherapie und des Wunsches, die Fruchtbarkeit zu erhalten, anführen. Die derzeitige Konvention fördert die Verzögerung der Gonadektomie bis nach Erreichen der physiologischen Pubertät, da das Risiko, eine präpubertäre GCT zu entwickeln, relativ gering ist (0,8-2%). Wir skizzieren die Präsentation, Diagnose, intraoperativen Techniken und postoperativen Überlegungen zur Behandlung von CAIS über die bilaterale laparoskopische Gonadektomie.
Gonadektomie kann bei Kindern mit Unterschieden in der sexuellen Entwicklung (DSD) indiziert sein, die Y-Chromosom-Gonaden aufgrund des erhöhten Risikos einer Gonadenmalignität beherbergen. 1 Eine solche DSD ist das Androgeninsensitivitätssyndrom (AIS), das durch eine X-chromosomale Mutation des Androgenrezeptors (AR) verursacht wird. 2 AIS ist eine seltene Diagnose mit einer geschätzten Inzidenz zwischen 1-5 pro 100.000 Personen. 3 AIS kann je nach Schweregrad der Androgenresistenz unterschiedliche Präsentationsgrade aufweisen, die von vollständig (CAIS), partiell (PAIS) und mild (MAIS) reichen. 4 Kinder mit CAIS sind phänotypisch weiblich im Aussehen mit normalen weiblichen äußeren Genitalien, haben aber Hoden anstelle von Eierstöcken und haben einen männlichen Karyotyp (46, XY). Bei diesen Patienten sind ihre Hoden in der Lage, Testosteron zu produzieren, aber aufgrund des Defekts in der AR-Funktion können Wolffian-Duct-Produkte wie die Nebenhoden, Vas deferens und die Samenbläschen nicht produzieren. Aufgrund der peripheren Aromatisierung dieses Testosterons zu Östrogen haben diese Patienten normale sekundäre weibliche Geschlechtsmerkmale wie die Brustentwicklung. Dennoch produzieren die Sertoli-Zellen der Hoden weiterhin den Müllerschen Inhibitierungsfaktor (MIF), der die Entwicklung der Müllerschen Kanalderivate hemmt. Dies führt bei Patienten mit einem blind endenden Vaginalbeutel ohne andere weibliche Geschlechtsorgane wie Gebärmutter, Gebärmutterhals und Eileiter. 5 Bei diesen Patienten können sich die Hoden innerhalb des Leistenkanals befinden, sublabial oder intraabdominal sein. 6 Säuglinge mit Androgenunempfindlichkeit können einseitige oder bilaterale Leistenbrüche oder Labialmassen aufweisen. Es wird geschätzt, dass 1-2% der bilateralen Leistenbrüche bei Mädchen eine CAIS-Diagnose darstellen könnten, und es ist wichtig, während Ihrer Beurteilung einen starken klinischen Verdacht aufrechtzuerhalten. 7 Klassischerweise präsentiert sich CAIS während der Adoleszenz als primäre Amenorrhoe bei Mädchen mit normaler Brustentwicklung, aber wenig bis gar keinen Scham- oder Achselhaaren bei der Untersuchung. CAIS ist mit einer abnormalen Hodenentwicklung sowie einem erhöhten Risiko für Keimzellmalignität nach der Pubertät verbunden. 8
Diese Patientin ist eine 15-jährige Frau asiatischer Abstammung mit einer Vorgeschichte von krankhafter Fettleibigkeit (BMI von 45), obstruktiver Schlafapnoe unter CPAP und Prädiabetes (HbA1c von 5,5), die derzeit Metformin erhält. Sie hat eine chirurgische Vorgeschichte der bilateralen Leistenbruchreparatur als kleines Kind. Sie hat keine Vorgeschichte von früheren Schwangerschaften, ist nicht sexuell aktiv und wurde zur weiteren Beurteilung der primären Amenorrhoe an unsere Klinik überwiesen. Sie berichtet, dass sie im Alter von 11 Jahren Thelarche entwickelte, aber spärliche Achsel- und Schamhaare und keine Anzeichen von Akne hat. Darüber hinaus leugnet sie Schmerzen, vaginalen Ausfluss, Hirsutismus oder Galaktorrhoe. In einer externen Klinik leugnete unser Patient Blutungen nach einer Gestagein-Herausforderung, und während einer früheren Beckenuntersuchung wurde kein Gebärmutterhals palpiert.
Laut der Familiengeschichte der Patientin hat sie drei ältere Schwestern, die 19, 21 und 26 Jahre alt sind. Ihre Mutter begann im Alter von 14 Jahren mit der Menstruation. Ihre 26-jährigen und 19-jährigen Schwestern berichten auch, dass sie eine regelmäßige Menstruation hatten, die im Alter von etwa 11 Jahren begann, und die älteste Schwester hatte vier gesunde Kinder. Interessanterweise wurde ihre 21-jährige Schwester auch von einem Arzt außerhalb des Staates zur Beurteilung der primären Amenorrhoe unbekannter Ätiologie gesehen. Ihr wurde gesagt, dass ihre vaginale Pause für die Geburt nicht ausreichte und zur weiteren Beurteilung an einen Spezialisten überwiesen wurde, aber für die Nachsorge verloren ging.
Bei der körperlichen Untersuchung war die Patientin fettleibig, hatte eine Brustentwicklung im Tanner-Stadium 5 mit spärlichen Achselhaaren und keine Anzeichen von Akne. Bei der Urogenitaluntersuchung hatte die Patientin normale äußere weibliche Genitalien mit spärlichen Schamhaaren. Die Vagina war normal im Aussehen, ohne abnormalen Ausfluss und einem blind endenden Vaginalbeutel. Wir waren nicht in der Lage, den Gebärmutterhals oder die Gebärmutter bei der Untersuchung zu visualisieren oder zu tasten. Die Prüfungsergebnisse waren konsistent für eine mögliche angeborene Anomalie. Anschließend wurden entsprechende Labor- und Bildgebungstests angeordnet.
Laborergebnisse:
| Test | Ergebnis | Referenz |
| B-hCG | Negativ | Negativ |
| FSH | 13,20 mIU/ml | 5–20 mIU/ml |
| LH | 22,20 mIU/ml | 5–20 mIU/ml |
| Prolaktin | 8,1 ng/ml | 3,0–18,6 ng/ml |
| Östradiol | 38,33 pg/ml |
34–170 pg/ml (Female Tanner Stufe 5) |
| Testosteron | 269 ng/dl |
20–38 ng/dl (Female Tanner Stufe 5) |
| TSH | 1,94 mIU/L | 0,47–4,68 mIU/l |
| Chromosomenanalyse | 46, XY |
Weiblich: 46, XX Männlich: 46, XY |
Erste Labore wurden angezogen, um Probleme im Zusammenhang mit der Hypothalamus-Hypophysen-Ovarial-Achse (HPO) zu beurteilen, wie follikelstimulierendes Hormon (FSH), luteinisierendes Hormon (LH), Prolaktin und Testosteron. Zusätzlich wurde ein Urin-Beta-hCG durchgeführt, um eine Schwangerschaft auszuschließen. Labore für unsere Patientin zeigten, dass sie im Vergleich zu normalen weiblichen Patienten einen erhöhten Testosteronspiegel hatte. Darüber hinaus ergab eine Karyotypanalyse für unseren Patienten 46, XY-Chromosomen. Zusammen stimmen diese Ergebnisse mit einer Diagnose von CAIS überein, bei der erhöhte Testosteronspiegel (abnormaler weiblicher Bereich, aber normaler männlicher Bereich) und hohe Serum-LH-Spiegel aufgrund einer Beeinträchtigung der negativen Rückkopplung von Androgen auf die vordere Hypophyse resultieren.
Die Bildgebung mittels Beckenultraschall wurde angeordnet, um das Vorhandensein oder Fehlen der Gebärmutter und anderer weiblicher Geschlechtsorgane zu beurteilen. Ultraschallbildgebung, die in einem externen Krankenhaus durchgeführt wurde, zeigte das Fehlen einer Gebärmutter, Eileitern und Gebärmutterhals. Darüber hinaus zeigte die Bildgebung ein Fehlen von Eierstöcken und war nicht in der Lage, den Standort potenzieller intraabdominaler Hoden genau zu beurteilen. Ultraschall kann vom Bediener abhängig sein, und die MRT gilt weithin als der Goldstandard für die Diagnose und Lokalisierung der Gonaden in der chirurgischen Planung für laparoskopische Gonadektomie und Gonadenüberwachung. 5
Eine Studie von Wisniewski et al . untersuchte die langfristigen Ergebnisse bei 14 Frauen mit CAIS, die nach einer Gonadektomie eine langfristige Hormonersatztherapie (HRT) erhielten. 9 Sie fanden heraus, dass diese Frauen insgesamt eine normale aktive Lebensdauer erwarten können. Eine Mehrheit dieser Frauen überschritt das 90. Perzentil für die Körpergröße für normale erwachsene Frauen,9 was sie größer als die durchschnittliche Frau macht, während sie immer noch kleiner als die normale männliche Bevölkerung ist. 10 Die häufigste Erkrankung, die bei diesen Frauen diagnostiziert wurde, war Osteoporose. Die Mehrheit der Frauen, die eine heterosexuelle weibliche Geschlechtsidentität hatten, und keine von ihnen wünschte eine geschlechtsumkehrende Operation. Die Mehrheit gab an, mit ihrer sexuellen Funktion zufrieden zu sein. Die durchschnittliche Vaginallänge in dieser Kohorte betrug 8,8 cm, was mit der normalen Vaginallänge von 7 bis 11 cm übereinstimmt.9
Derzeit gibt es keine Therapie, um die zugrunde liegende genetische Mutation der AR bei Patienten mit CAIS umzukehren. Daher konzentriert sich die Behandlung auf die prophylaktische Gonadektomie, um eine mögliche Gonadenmalignität mit anschließender HRT, die Behandlung des Urogenitaltraktes, falls angezeigt, sowie psychologische Unterstützung zu verhindern. Die Gonadektomie wird normalerweise verzögert, bis die sexuelle Reifung während der Adoleszenz abgeschlossen ist, um eine normale spontane pubertäre Entwicklung zu ermöglichen. 3 Bei früher Diagnose im Säuglings- oder Kindesalter kann eine frühe Gonadektomie in Betracht gezogen werden, wenn das Kind schmerzhafte oder unangenehme Leisten- oder Labialmassen aufweist, aber eine nachfolgende HRT benötigt, um die Pubertät im Alter von etwa 11 bis 12 Jahren zu induzieren. 3 Der Zeitpunkt der Gonadektomie ist bei einigen Patienten und AIS-Selbsthilfegruppen, die sich für die Beibehaltung ihrer Hoden einsetzen, umstritten geworden. Eine Vielzahl von Gründen wurde von diesen Selbsthilfegruppen für die Beibehaltung der Hoden angeführt, wie psychologische Faktoren, Risiken im Zusammenhang mit der Operation, der Wunsch, die Fruchtbarkeit möglicherweise zu erhalten, und eine Zurückhaltung, sich an die langfristige HRT zu halten. Dennoch sind die berichteten Risiken für eine laparoskopische Gonadektomie sehr gering, mit einem geschätzten Sterberisiko von 0,1 pro 1000 Eingriffe, und das Risiko von Verletzungen des Darms oder Blutungen wird mit 2,4% angegeben. 11 Darüber hinaus untersuchte eine Studie von Hannema u. a. die Hoden von 44 Patienten mit CAIS und stellte fest, dass die Anzahl der Keimzellen nach dem ersten Lebensjahr rapide abnahm und in keinem der Hoden Anzeichen einer Spermatogenese vorlag, was eine Fruchtbarkeit für CAIS-Patienten höchst unwahrscheinlich machte. 12 Für CAIS-Patienten, die sich entscheiden, ihre Hoden zu behalten, wurde berichtet, dass das Risiko, Keimzelltumoren (GCT) zu entwickeln, mit zunehmendem Alter zunimmt. 11 Es ist wichtig, eine enge Nachsorge durch aktive Überwachung aufrechtzuerhalten, indem regelmäßige Bildgebung (Ultraschall und / oder MRT) und Serumblutmarker verwendet werden, um auf die mögliche Entwicklung von GCT bei diesen Patienten zu untersuchen. 13 Während die MRT gutartige Veränderungen wie paratestikuläre Zysten und Adenome erkennen kann, können sie keine prämalignen Veränderungen wie Keimzellneoplasien in situ (GCNIS) erkennen, die eine Biopsie der Gonaden erfordern würden.14 Darüber hinaus ist die Qualität des Ultraschallscreenings in der Regel vom Bediener abhängig. Ein von Wunsch et al . vorgeschlagener Ansatz für Patienten, die ihre Hoden behalten möchten, besteht darin, eine laparoskopische Gonadenbiopsie durchzuführen und die intraabdominalen Gonaden in der Nähe der Bauchdecke chirurgisch zu fixieren, um eine bessere Visualisierung durch Ultraschall zu ermöglichen. 15
Das primäre Ziel der Durchführung einer Gonadektomie im Rahmen von CAIS ist es, das Risiko einer zukünftigen Malignität zu verringern. Wie bei anderen Formen des Kryptorchismus besteht ein erhöhtes Risiko, GCT zu entwickeln. Bei CAIS wird das Risiko, bei diesen Patienten eine präpubertäre GCT zu entwickeln, als sehr niedrig eingeschätzt und liegt zwischen 0,8 und 2,0%. 16 Nach der Pubertät steigt dieses Risiko mit zunehmendem Alter und wird auf etwa 15% geschätzt (Bereiche von 0–22%). 11 Es wird befürwortet, dass die prophylaktische Gonadektomie in der postpubertären Periode auftritt, wenn die Feminisierung teilweise durch Hodenöstrogen abgeschlossen wird, das teilweise aus der Umwandlung von Androgenen in Östrogen stammt. 3, 8 Die Verzögerung der Gonadektomie auf einen späteren Zeitpunkt in der Adoleszenz ermöglicht es den Leistungserbringern auch, die Einwilligung nach Aufklärung direkt von ihren Patienten einzuholen.
Bei der Beurteilung von Kindern, deren HPO-Achse noch unreif ist, ist ein hCG-Stimulationstest erforderlich, um die Testosteronsekretion der Leydig-Zelle richtig zu bewerten. 17 Nach der Gonadektomie benötigen diese Patienten eine langfristige hormonelle Ergänzungstherapie mit Östrogenersatz bis zum Alter der natürlichen Menopause (etwa 50-52 Jahre), um eine normale Brust- und Knochenentwicklung, psychosoziales Wohlbefinden und sexuelle Funktion aufrechtzuerhalten. 18 Da diese Patienten keine Gebärmutter haben, sind Gestagene nicht erforderlich, um die Östrogentherapie zu ergänzen. 17 Diese Patienten behalten weiterhin normale sekundäre weibliche Geschlechtsmerkmale bei und können eine normale sexuelle Funktion erreichen, können jedoch je nach Angemessenheit ihres Vaginalkanals eine vaginale Dilatationstherapie oder Vaginoplastik benötigen. 17 Fragen der Unfruchtbarkeit und Geschlechtsidentität können für diese Patienten starke psychosoziale Auswirkungen haben, und es wird dringend empfohlen, Beratung oder Selbsthilfegruppentherapie als Teil eines multidisziplinären Ansatzes anzubieten. 9
CAIS (früher bekannt als Morris-Syndrom) stellt eine der häufigsten definierbaren Ursachen für 46, XY DSD dar. Es resultiert aus einer seltenen X-chromosomalen Mutation der AR, die eine periphere Androgenresistenz verursacht. Diese Patienten werden phänotypisch weiblich mit normalen weiblichen äußeren Genitalien geboren. Häufig präsentieren sich diese Patienten in der Adoleszenz mit primärer Amenorrhoe, wobei die nachfolgende Untersuchung zeigt, dass diese Patienten einen blind endenden Vaginalbeutel und ein Fehlen von inneren weiblichen Geschlechtsorganen bei der Bildgebung haben. Anstelle von Eierstöcken haben diese Patienten Hoden, die im Bauch, im Leistenkanal oder in den Schamlippen gefunden werden können. Bei Kindern oder Säuglingen kann CAIS als Leistenbruch oder -masse auftreten, wobei etwa 1-2% der weiblichen Säuglinge mit Leistenbrüchen Kryptorchismus mit 46,XY-Karyotyp aufweisen. 7 In diesem speziellen Fall hatte unser Patient als kleines Kind eine chirurgische Vorgeschichte der bilateralen Leistenbruchreparatur. Dies deutet auf eine verpasste oder verzögerte Diagnose hin und unterstreicht die Bedeutung eines starken klinischen Verdachts auf CAIS bei pädiatrischen weiblichen Patienten, die bilaterale Leistenbrüche aufweisen, was eine weitere Untersuchung rechtfertigt, um Kryptorchismus auszuschließen.
Das geschätzte Risiko für Patienten mit AIS, die eine GCT entwickeln, ist umgekehrt proportional zum Grad der Androgenresistenz. Patienten mit CAIS haben schwerere Mutationen ihrer AR, die auf einen vollständigen Funktionsverlust hindeuten. Ohne Androgenstimulation ist die Spermatogenese beeinträchtigt und es kommt zu einem damit verbundenen raschen Rückgang der Keimzellzahlen nach dem ersten Lebensjahr, der theoretisch ein geringeres Risiko für die Entwicklung einer GCT im späteren Leben mit sich bringt. 14 Dies steht im Gegensatz zu Patienten mit PAIS, die immer noch ein gewisses Maß an AR-Funktion behalten und daher eher überlebende Keimzellen haben, was sie anschließend einem erhöhten Risiko für die Entwicklung einer GCT im Erwachsenenalter aussetzt. 19 In der Vergangenheit berichteten Manuel et al . über ein kumulatives GCT-Risiko von 3,6 % bei Patienten mit Y-haltigen DSDs bis zum Alter von 25 Jahren, das im Alter von 50 Jahren auf 33 % anstieg. 20 In jüngerer Zeit fanden Deans et al. in ihrem Review heraus, dass CAIS-Patienten ein um 15% erhöhtes Risiko hatten, im Erwachsenenalter eine Gonadenmalignität zu entwickeln (Bereich 0-22%). 11 Cools et al . fanden heraus, dass das geschätzte Risiko, bei CAIS-Patienten vor der Pubertät an GCT zu erkranken, mit 0,8-2% viel niedriger war. 16
Aufgrund des erhöhten Risikos für Gonadenmalignität bei CAIS-Patienten im Erwachsenenalter wird derzeit empfohlen, eine Gonadektomie nach Abschluss der sexuellen Reifung durchzuführen, typischerweise im Alter von etwa 15 bis 16 Jahren, da das Risiko, vor der Pubertät an Tumoren zu erkranken, als relativ gering angesehen wird. 21 Dieser Ansatz ermöglicht eine spontane Brustentwicklung und eine bessere Knochenmineralisierung während der Pubertät aufgrund der physiologischen Hormonproduktion durch die Hoden und der anschließenden peripheren Androgenumwandlung in Östrogene. 3, 8 In der Vergangenheit wurden Laparotomie und bilaterale Gonadektomie bei Patienten mit Y-Chromosom, das DSD enthielt, durchgeführt. Im Laufe der Zeit wurden laparoskopische Verfahren für DSD-Patienten aufgrund der damit verbundenen Vorteile der Vergrößerung und des einfachen Zugangs zur Beckenhöhle über einen minimal-invasiven Ansatz, der eine kürzere postoperative Genesung und Dauer des Krankenhausaufenthalts sowie eine verbesserte Kosmesis ermöglicht, weit verbreitet. 22, 23
Die laparoskopische Gonadektomie wird während der Vollnarkose durch endotracheale Intubation durchgeführt. Der Videomonitor, der Insufflator und die Lichtquelle befinden sich am Fuße des Patienten. In diesem Fall wurde die Insufflation des Abdomens mit einer offenen Laparoskopie-Technik durchgeführt, bei der ein semilunarer Schnitt am unteren Aspekt des Nabels vorgenommen wurde und die Faszie mit Hämostaten erhöht wurde. Eine Veress-Nadel wurde dann in den Bauch eingeführt und ihre korrekte Position wurde mit einem Kochsalztropfentest bestätigt. Ein 10-mm-Schritttrokar wurde dann durch den Nabel eingeführt, und CO2 wurde verwendet, um Pneumoperitoneum zu erhalten. Ein 0o Laparoskop wurde dann in den Bauch eingeführt. Zwei weitere 5-mm-Trokrare für Arbeitsinstrumente wurden auf Höhe des Nabels auf der rechten und linken Seite platziert. Der Patient wurde dann in Trendelenburg-Position gebracht, was eine einfachere laparoskopische Inspektion des Beckens ermöglicht, um die Position der Gonaden zu bestimmen und die Beckenorgane zu inspizieren. Wenn die Gonaden nicht ohne weiteres erkennbar sind, kann die Identifizierung und Verfolgung der Gonadengefäße helfen, sie zu lokalisieren. 1
Während der Laparoskopie wurden die Gonaden unseres Patienten bilateral über den geschlossenen inneren Ringen notiert. Grob wurden Zysten an bilateralen Hoden visualisiert. Der Vas deferens durchquerte die Harnröhre, und es gab keine Hinweise auf Müllersche Strukturen im Becken. Eine Ebene wurde durch das hintere Peritoneum um die Gonaden weg von den anderen retroperitonealen Strukturen seziert. Es ist wichtig, den Ort und den Verlauf retroperitonealer Strukturen wie der Harnleiter und der Beckengefäße zu bestimmen, um iatrogene Verletzungen zu vermeiden. Die inneren Samengefäße wurden dann identifiziert, als sie zur Gonade durchquerten, und mit dem Ligasure-Gerät in vier aufeinanderfolgenden Abschnitten vor der Transektion fulguiert, um die Wahrscheinlichkeit von Blutungen zu verringern. Die Hoden wurden dann aus dem Peritoneum mobilisiert, und die Vas deferens wurden ebenfalls in ähnlicher Weise vollzogen und geteilt. Das Laparoskop wurde durch einen der Arbeitsanschlüsse eingeführt, so dass die Gonaden durch den zentralen 10-mm-Nabelanschluss entfernt werden konnten. Das abdominale CO 2 pneumoperitoneum wurde dann umgekehrt und die Nabelschnurfaszie wurde mit2-0 Vicryl Naht geschlossen. Die Haut an allen Portstellen wurde mit 5-0 Monocryl verschlossen und mit Dermabond bedeckt.
Beide Gonaden wurden ohne Komplikationen herausgeschnitten und zur Beurteilung in die Pathologie geschickt. Die laparoskopische Gonadektomie von der Inzision bis zum Verschluss betrug etwa 80 Minuten. Es gab weniger als 5 ml geschätzten Blutverlust. Der Patient wurde aufgrund sozialer Faktoren über Nacht zur Beobachtung aufgenommen. Sie vertrug den Eingriff gut, ihre Schmerzen wurden durch multimodales Schmerzmanagement gut kontrolliert und sie wurde am nächsten Morgen nach Hause entlassen. Sie sollte in zwei Wochen mit ihrem Gynäkologen nachverfolgt werden, um mit der Östrogenersatztherapie zu beginnen.
Es ist wichtig anzumerken, dass wir unter der Laparoskopie bilaterale Vas deferens visualisieren konnten, die bis zur Harnröhre zurückreichten. Eine Fallserie von 44 CAIS-Patienten von Hannema et al . ergab, dass 36% Nebenhoden oder Vas deferens hatten. 12 Hannema et al. stellten die Hypothese auf, dass eine verbleibende parakrine Androgenaktivität in der Lage sein könnte, die Entwicklung von Wolffian-Duct-Produkten auch bei Patienten mit vollständigen Formen von AIS zu induzieren. 12
Die chirurgische Pathologie für unsere Patientin bestätigte, dass ihre beiden Gonaden tatsächlich atrophische Hoden waren. Interessanterweise zeigten beide Hoden GCNIS und markierten die Leydig-Zellhyperplasie (Abbildungen 1–2). Die neoplastischen Zellen färben sich mit OCT3/4 und PLAP (Abbildungen 3–4). Die Leydig-Zellhyperplasie, wie sie bei diesem Patienten beobachtet wurde, ist ein häufiger Befund bei Patienten mit CAIS. 24 Es wurde vorgeschlagen, dass hohe LH-Spiegel aufgrund eines Mangels an androgennegativer Rückkopplung auf die vordere Hypophyse für eine erhöhte Leydig-Zellularität verantwortlich sind. 25 GCNIS gilt als prämaligner Tumor, bei dem bis zu 50% innerhalb von 5 Jahren zur GCT fortschreiten. 26 Das Risiko einer Progression von GCNIS zu invasiver GCT ist bei Patienten mit CAIS weniger sicher. Die von Kaprova-Pleskacova et al. vorgeschlagene "Mangel-androgen-Theorie" legt nahe, dass Patienten mit CAIS aufgrund einer unzureichenden Androgenreaktion, um das Überleben abnormaler Keimzellen zu fördern, weniger wahrscheinlich zu einer GCT fortschreiten als Patienten mit PAIS. 27 Umgekehrt schlugen Kaprova-Pleskacova et al. auch vor, dass die gleiche parakrine Androgenaktivität, die möglicherweise für die Induktion der Wolffian-Kanalentwicklung verantwortlich ist, wie von Hannema et al.,12 erwähnt, auch die Entwicklung von GCNIS zu invasiver GCT fördern könnte. 27 Das Vorhandensein von Vas deferens und histologische Hinweise auf GCNIS bei unserem Patienten deuten auf eine mögliche Restreaktion auf parakrine Androgen hin. Daher glauben wir, dass dieser Fall dazu beiträgt, das Argument für den potenziellen Nutzen der prophylaktischen Gonadektomie bei CAIS-Patienten zu unterstützen.
Die chirurgische Pathologie unseres Patienten war auch für bilaterale paratestikuläre Leiomyome signifikant (Abbildung 5), einen glatten Muskeltumor, der sehr selten im Urogenitaltrakt auftritt. Es wird angenommen, dass ihre Lage intratestikulär oder paratestikulär ist und aus den glatten Muskelzellen des interstitiellen Stroma, der Muskelschicht der Gefäße der Tunica albuginea, den Samentubuli sowie den paratestikulären Strukturen wie dem Samenstrang, Nebenhoden, Restresten und der Tunica vaginalis stammt. 28 Leiomyome werden bei Patienten mit AIS sehr selten beschrieben. Tatsächlich gab es in der Literatur nur vier Fallberichte, in denen beschrieben wurde, dass Leiomyome bei der Biopsie nach Gonadektomie bei AIS-Patienten vorhanden sind. 28-31 Unseres Wissens ist dies der erste dokumentierte Fall von bilateralen paratestikulären Leiomyomen, die sich gleichzeitig mit GCNIS bei einem Patienten mit CAIS entwickeln.
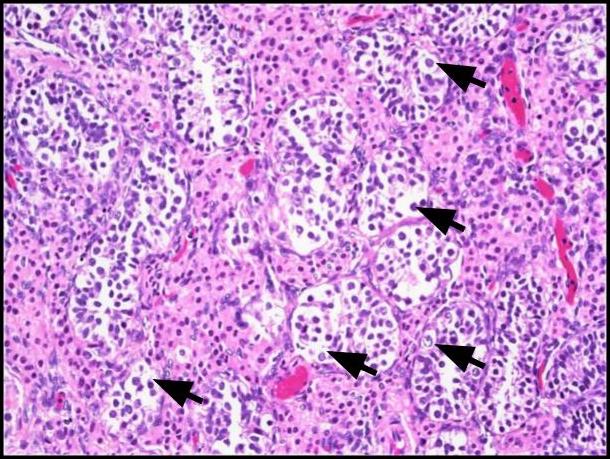
Abbildung 1. Keimzellneoplasie in situ (GCNIS). Große atypische Zellen (schwarze Pfeile) mit reichlich klarem bis schwach eosinophilem Zytoplasma, einem zentralen Kern mit dem prominenten Nukleolus und gleichmäßig verteiltem Chromatin sind zu sehen. H & E, 200x
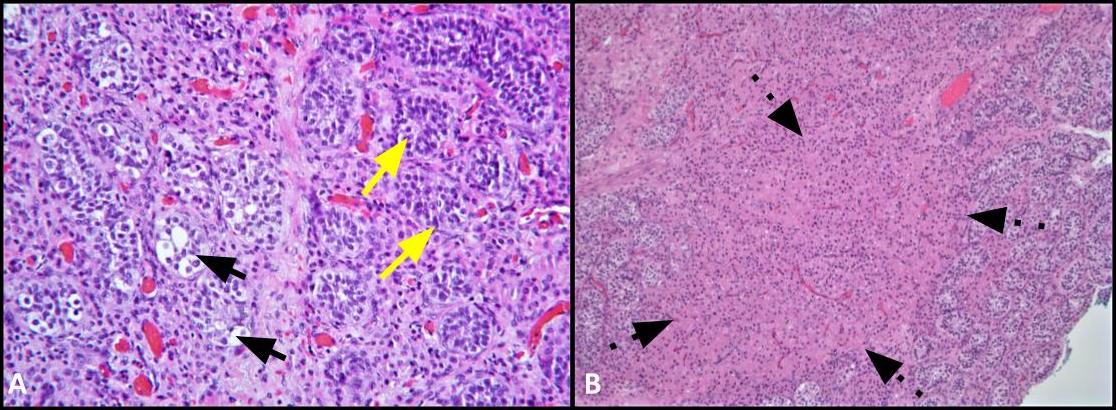
Abbildung 2. A) Dieses Bild zeigt den Vergleich der von GCNIS (schwarze Pfeile) beteiligten Tubuli mit benachbarten Samenkanälchen mit normaler Spermatogenese (gelbe Pfeile); H&E, 200x. B) Low-Power-Bild zeigt Cluster von Leydig-Zellen innerhalb des Interstitiums (gestrichelte Pfeile); H&E, 100-fach.
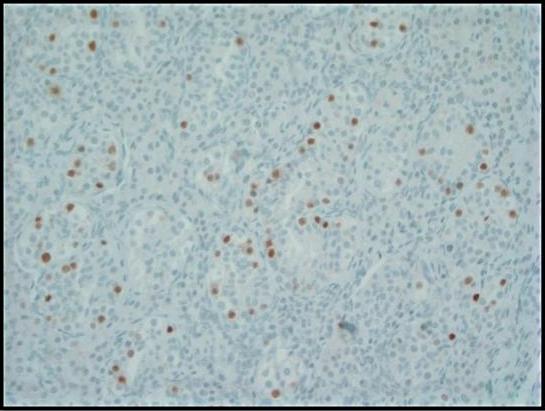
Abbildung 3. Die immunhistochemische Färbung für den Octamer-bindenden Transkriptionsfaktor (OCT) 3/4 zeigt eine starke nukleare Immunreaktivität in GCNIS-Zellen innerhalb der Samenkanälchen. Normale Keimzellen sind negativ; 200-fach.
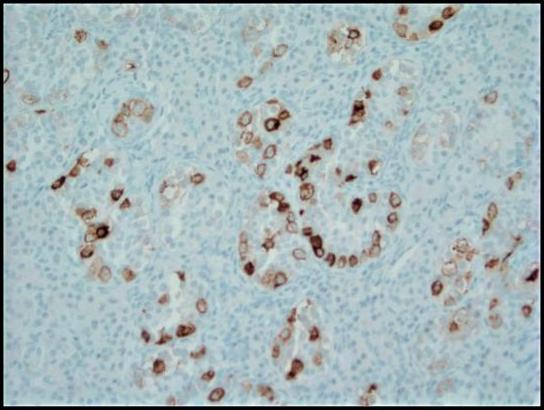
Abbildung 4. Immunhistochemische Färbung mit plazentarer alkalischer Phosphatase (PLAP) hebt die Tumorzellen von GCNIS in einem zytoplasmatischen membranösen Muster hervor; 200x.
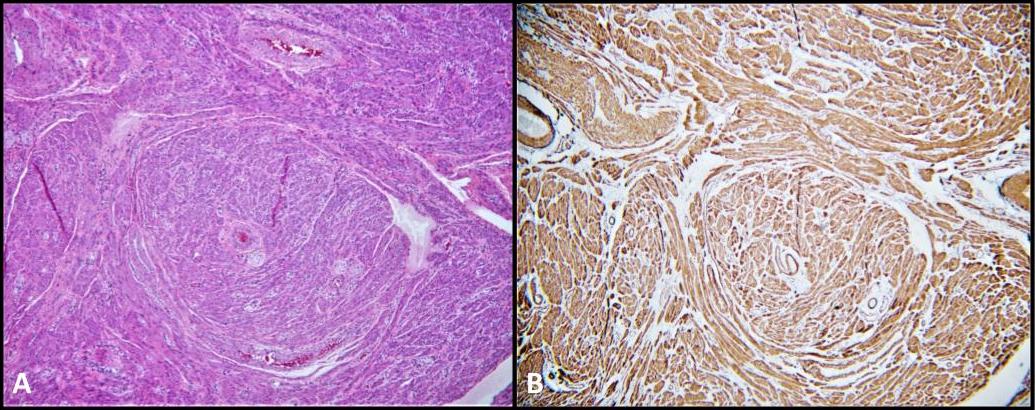
Abbildung 5. A) Leiomyom; H&E, 100-fach. Faszikel der spindelförmigen glatten Muskelzellen. B) Die zytoplasmatische Färbung von Glattmuskelaktin (SMA) ist diffus und stark.
Keine spezielle Ausrüstung verwendet.
Nichts zu offenbaren.
Der Patient, auf den in diesem Videoartikel Bezug genommen wird, hat seine Einverständniserklärung gegeben, gefilmt zu werden, und ist sich bewusst, dass Informationen und Bilder online veröffentlicht werden.
References
- Calvo A, Escolino M, Settimi A, Roberti A, Caprio MG, Esposito C. Laparoskopischer Ansatz zur Gonadektomie bei pädiatrischen Patienten mit intersexuellen Störungen. Transl Pädiatr. 2016;5(4):295-304. https://doi.org/10.21037/tp.2016.09.06
- Kusumi M, Mitsunami M, Onoue H, et al. Vollständiges Androgeninsensitivitätssyndrom und Anti-Müller-Hormonspiegel vor und nach der laparoskopischen Gonadektomie. Gynecol minim invasiv ther. 2017;6(3):126-128. https://doi.org/10.1016/j.gmit.2016.11.001
- Cheikhelard A, Thibaud E, Morel Y, et al. Vollständiges Androgeninsensitivitätssyndrom: Diagnose und Management. Experte Rev Endocrinol Metab. 2009;4(6):565-573. https://doi.org/10.1586/eem.09.31
- Lanciotti L, Cofini M, Leonardi A, Bertozzi M, Penta L, Esposito S. Verschiedene klinische Präsentationen und Management beim vollständigen Androgeninsensitivitätssyndrom (CAIS). Int J Environ Res Öffentliche Gesundheit. 2019;16(7):1268. https://doi.org/10.3390/ijerph16071268
- Grasso D, Borreggine C, Campanale C, Longo A, Grilli G, Macarini L. Nutzen und Rolle der Magnetresonanztomographie im Falle eines vollständigen Androgeninsensitivitätssyndroms. Radiol Fall Rep. 2015;10(2):1119. https://doi.org/10.2484/rcr.v10i2.1119
- Nezzo M, De Visschere P, T'Sjoen G, Weyers S, Villeirs G. Rolle der Bildgebung bei der Diagnose und Behandlung des vollständigen Androgeninsensitivitätssyndroms bei Erwachsenen. Fallvertreter Radiol. 2013;2013:158484. https://doi.org/10.1155/2013/158484
- Viner RM, Teoh Y, Williams DM, Patterson MN, Hughes IA. Androgen-Insensitivitätssyndrom: eine Umfrage zu diagnostischen Verfahren und Management in Großbritannien. Arch Dis Kind. 1997;77(4):305-309. https://doi.org/10.1136/adc.77.4.305
- Galani A, Kitsiou-Tzeli S, Sofokleous C, Kanavakis E, Kalpini-Mavrou A. Androgen-Insensitivitätssyndrom: klinische Merkmale und molekulare Defekte. Hormone (Athen). 2008;7(3):217-229. https://doi.org/10.14310/horm.2002.1201
- Wisniewski AB, Migeon CJ, Meyer-Bahlburg HF, et al. Vollständiges Androgeninsensitivitätssyndrom: langfristiges medizinisches, chirurgisches und psychosexuelles Ergebnis. J Clin Endocrinol Metab. 2000;85(8):2664-2669. https://doi.org/10.1210/jcem.85.8.6742
- Hughes IA, Davies JD, Bunch TI, Pasterski V, Mastroyannopoulou K, MacDougall J. Androgen-Insensitivitätssyndrom. Lanzett. 2012;380(9851):1419-1428. https://doi.org/10.1016/S0140-6736(12)60071-3
- Deans R, Creighton SM, Liao LM, Conway GS. Timing der Gonadektomie bei erwachsenen Frauen mit vollständigem Androgeninsensitivitätssyndrom (CAIS): Patientenpräferenzen und klinische Beweise. Clin Endocrinol (Oxf). 2012;76(6):894-898. https://doi.org/10.1111/j.1365-2265.2012.04330.x
- Hannema SE, Scott IS, Rajpert-De Meyts E, Skakkebaek NE, Coleman N, Hughes IA. Hodenentwicklung beim vollständigen Androgeninsensitivitätssyndrom. J. Pathol. 2006;208(4):518-527. https://doi.org/10.1002/path.1890
- Döhnert U, Wünsch L, Hiort O. Gonadektomie bei vollständigem Androgen-Insensitivitätssyndrom: Warum und wann? Sex-Entwickler 2017;11(4):171-174. https://doi.org/10.1159/000478082
- Chaudhry S, Tadokoro-Cuccaro R, Hannema SE, Acerini CL, Hughes IA. Häufigkeit von Gonadentumoren beim vollständigen Androgeninsensitivitätssyndrom (CAIS): Eine retrospektive Fallserienanalyse. J Pädeter Urol. 2017;13(5):498.e491-498.e496. https://doi.org/10.1016/j.jpurol.2017.02.013
- Wünsch L, Holterhus PM, Wessel L, Hiort O. Patienten mit Störungen der Geschlechtsentwicklung (DSD) mit Risiko für die Entwicklung von Gonadentumoren: Management auf der Grundlage einer laparoskopischen Biopsie und molekularen Diagnostik. BJU Int. 2012;110(11 Pt C):E958-965. https://doi.org/10.1111/j.1464-410X.2012.11181.x
- Kühlt M, Drop SL, Wolffenbuttel KP, Oosterhuis JW, Looijenga LH. Keimzelltumoren in der Intersex-Gonade: alte Wege, neue Richtungen, sich bewegende Grenzen. Endocr Rev. 2006;27(5):468-484. https://doi.org/10.1210/er.2006-0005
- Batista RL, Costa EMF, Rodrigues AdS, et al. Androgen-Insensitivitätssyndrom: eine Überprüfung. Archiv für Endokrinologie und Stoffwechsel. 2018;62:227-235. https://doi.org/10.20945/2359-3997000000031
- Bertelloni S, Meriggiola MC, Dati E, Balsamo A, Baroncelli GI. Knochenmineraldichte bei Frauen, die mit vollständigem Androgeninsensitivitätssyndrom und intakten Hoden oder entfernten Gonaden leben. Sex-Entwickler 2017;11(4):182-189. https://doi.org/10.1159/000477599
- Pyle LC, Nathanson KL Ein praktischer Leitfaden zur Beurteilung der Prädisposition von Gonadenkeimzelltumoren bei Unterschieden in der Geschlechtsentwicklung. Am J med Genet C Semin med genet. 2017;175(2):304-314. https://doi.org/10.1002/ajmg.c.31562
- Manuel M, Katayama PK, Jones HW, Jr. Das Alter des Auftretens von Gonadentumoren bei intersexuellen Patienten mit einem Y-Chromosom. Am J Obstet Gynecol. 1976;124(3):293-300.
https://doi.org/10.1016/0002-9378(76)90160-5 - Chertin B, Koulikov D, Alberton J, Hadas-Halpern I, Reissman P, Farkas A. Die Verwendung der Laparoskopie bei intersexuellen Patienten. Pediatr Surg Int. 2006;22(5):405-408. https://doi.org/10.1007/s00383-006-1662-3
- Esegbona G, Cutner A, Cuckow P, Creighton S. Laparoskopische Gonadektomie bei pädiatrischen und jugendlichen Mädchen mit intersexuellen Störungen. BJOG: Eine internationale Zeitschrift für Geburtshilfe und Gynäkologie. 2003;110(2):210-212. PMID: 12618168.
- Cools M, Looijenga L. Update über die Pathophysiologie und Risikofaktoren für die Entwicklung von malignen Hodenkeimzelltumoren beim vollständigen Androgeninsensitivitätssyndrom. Sex-Entwickler 2017;11(4):175-181. https://doi.org/10.1159/000477921
- Jockenhövel, Rutgers JK, Mason JS, Griffin JE, Swerdloff RS. Leydig-Zell-Neoplasie bei einem Patienten mit Reifenstein-Syndrom. Exp Clin Endocrinol. 1993;101(6):365-370.
- Akyüz M, Topaktaş R, Ürkmez A, Koca O, Öztürk M. Evaluation of keim-cell neoplasia in situ entity in testicular tumors. Türke J Urol. 2019;45(6):418-422. https://doi.org/10.5152/tud.2018.48855
- Kaprova-Pleskacova J, Stoop H, Brüggenwirth H, et al. Vollständiges Androgeninsensitivitätssyndrom: Faktoren, die die Gonadenhistologie beeinflussen, einschließlich Keimzellpathologie. Moderne Pathologie. 2014;27(5):721-730. https://doi.org/10.1038/modpathol.2013.193
- Siminas S, Kokai G, Kenny SE. Vollständiges Androgeninsensitivitätssyndrom im Zusammenhang mit bilateralen Sertolizelladenomen und paratestikulären Leiomyomen: Fallbericht und Überprüfung der Literatur. J Pädeter Urol. 2013;9(1):E31-34. https://doi.org/10.1016/j.jpurol.2012.06.013
- Goulis DG, Iliadou PK, Papanicolaou A, et al. R831X-Mutation des Androgenrezeptorgens bei einem Jugendlichen mit vollständigem Androgeninsensitivitätssyndrom und bilateralen Hodenhamartomen. Hormone (Athen). 2006;5(3):200-204. https://doi.org/10.14310/horm.2002.11185
- Krichen Makni S, Mnif Hachicha L, Ellouze S, et al. Feminisierendes Hodensyndrom mit multiplen Hamartomen und bilateralen paratestikulären Leiomyomen. Rev Med Interne. 2005;26(12):980-983. https://doi.org/10.1016/j.revmed.2005.08.003
- Savaş-Erdeve Ş, Aycan Z, Keskin M, et al. Vollständiges Androgeninsensitivitätssyndrom im Zusammenhang mit bilateralen Sertolizelladenomen und einseitigem paratestikulärem Leiomyom: Ein Fallbericht. Die türkische Zeitschrift für Pädiatrie. 2016;58(6):654-657. https://doi.org/10.24953/turkjped.2016.06.012
Cite this article
Norton JC, Singh A, Hollenbach LL, Gamble G, Gonzalez-Krellwitz LA, Canon SJ. Prophylaktische laparoskopische bilaterale Gonadektomie bei vollständigem Androgenunempfindlichkeitssyndrom. J Med Einblick. 2021;2021(313). doi:10.24296/jomi/313.
