Suture laparoscopique rectopexie avec culdoplastie, réparation de la paroi vaginale et périnéorraphie pour le prolapsus rectal
1,2; 1,2*; 1,3*
1Pelvic Floor Disorders Center, Massachusetts General Hospital, Boston, MA
2Department of Obstetrics, Gynecology and Reproductive Biology, Massachusetts General Hospital, Boston, MA
3Section of Colorectal Surgery, Department of Surgery, Massachusetts General Hospital, Boston, MA
*Operating Surgeons
Main Text
Table of Contents
Il s’agit d’une femme de 87 ans qui présentait des antécédents de constipation et de prolapsus rectal gênant nécessitant une réduction manuelle du prolapsus rectal. À l’examen, on a constaté qu’elle souffrait d’un prolapsus rectal de pleine épaisseur et d’un prolapsus des organes pelviens postérieurs de la paroi vaginale postérieure de stade II. Elle souhaitait une prise en charge chirurgicale définitive de son prolapsus et a opté pour une suture laparoscopique, une rectopexie, une réparation de la paroi vaginale postérieure et une périnéorraphie. Elle a subi des tests de physiologie anorectale et d’urodynamique, ainsi qu’une débiographie avant l’opération pour aider à la planification chirurgicale. L’opération s’est déroulée sans complication. Elle a reçu son congé le premier jour postopératoire et son rétablissement postopératoire n’a pas été remarquable.
Il s’agit d’une femme de 87 ans ayant des antécédents médicaux importants pour le syndrome de l’intestin irritable avec constipation qui présentait des symptômes de constipation réfractaires aux changements alimentaires et un renflement rectal gênant nécessitant une réduction manuelle. Elle a nié l’incontinence urinaire. Elle est nullipare, et n’est pas sexuellement active.
À l’examen, son abdomen était mou, non distendu et non sensible, sans aucun signe de hernie. Elle avait une incision cutanée verticale bien cicatrisée. Lors de l’examen pelvien, avec Valsalva, la paroi vaginale postérieure est descendue de 1 cm au-delà de l’hymen. Lors de l’examen rectovaginal, elle avait une poche rectovaginale. Enfin, alors qu’elle était assise sur la chaise d’aisance, on a constaté qu’elle avait un prolapsus rectal de pleine épaisseur avec effort, ainsi qu’un anus patule au repos.
Le patient a subi une déféchographie, et les résultats peuvent être vus dans la figure 1.
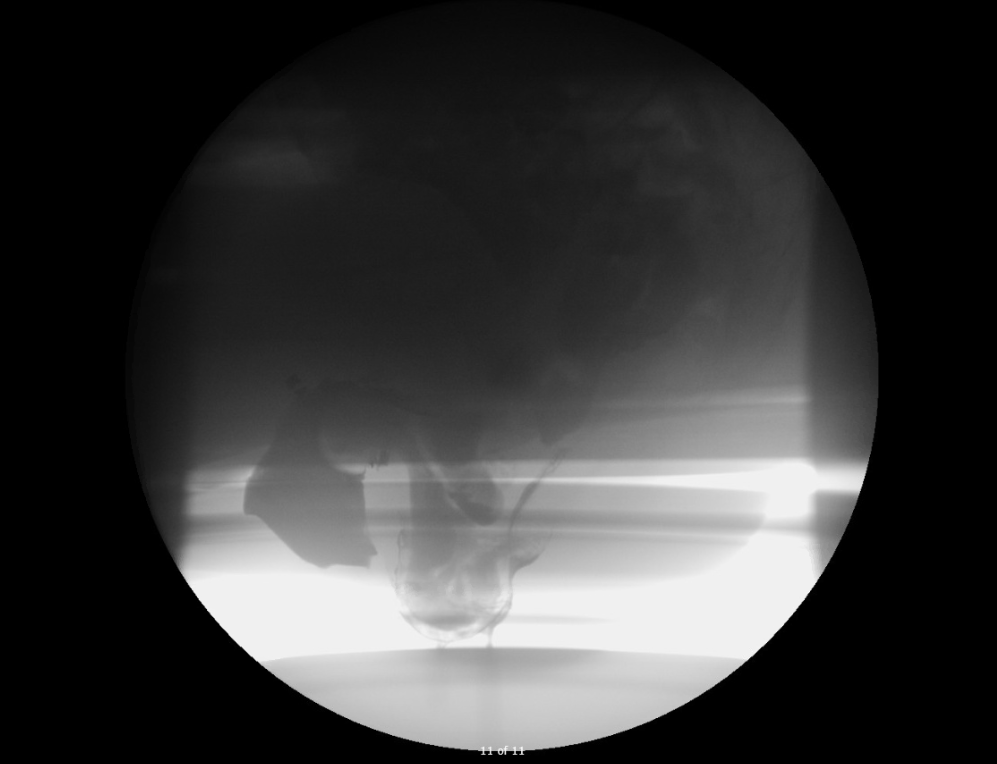
Graphique 1. Résultats de la défécographie
Invagination rectorectale pleine épaisseur avec prolapsus rectal.
Invagination subséquente d’un entérocèle dans le rectum et le vagin.
La manométrie anorectale a révélé qu’elle avait un tonus très faible au repos et à la compression. Un test urodynamique (UDT) a été effectué pour exclure l’incontinence urinaire à l’effort occulte. Sur l’UDT, il n’y avait pas d’incontinence urinaire à l’effort avec réduction du prolapsus, pas d’hyperactivité du détrusor et une capacité vésicale normale. Il était recommandé qu’il n’y ait pas de procédure anti-incontinence au moment de la réparation du prolapsus.
À la défographie, il y avait un prolapsus rectal avec un entérocèle prolapsus dans le rectum et le vagin.
Ses études de laboratoire préopératoires comprenaient une formule sanguine complète, un panel métabolique de base et un électrocardiogramme (ECG). Toutes les valeurs étaient dans les limites normales. L’ECG a montré un rythme sinusal normal. Elle a été médicalement autorisée à subir une intervention chirurgicale.
S’il n’est pas traité, le prolapsus rectal peut entraîner une incontinence anale secondaire à un étirement chronique du sphincter anal et une neuropathie ultérieure. La constipation ou la défécation obstruée peuvent également être observées. Rarement, le prolapsus rectal peut entraîner l’incarcération ou l’étranglement du rectum prolabé. 1 De rares cas de prolapsus rectal, d’ischémie2 et de gangrène ont été rapportés. 3
Le traitement du prolapsus rectal dépend des symptômes, des objectifs et des antécédents médicaux et chirurgicaux du patient. Malheureusement, il n’existe pas d’options de traitement non chirurgical pour cette affection et, en général, la prise en charge expectative est déconseillée car le prolapsus rectal a tendance à s’aggraver avec le temps ; Si elle n’est pas traitée, elle peut entraîner une incontinence anale.
Les options chirurgicales pour le traitement du prolapsus rectal comprennent :
- Rectopexie de suture postérieure ouverte ou mini-invasive (laparoscopique ou robotique) :
- Sans résection sigmoïde – ceci est particulièrement indiqué pour les patients souffrant d’incontinence ou qui présentent un risque élevé d’incontinence (c’est-à-dire avec des pressions anales très faibles lors des tests de physiologie anorectale).
- Avec résection sigmoïde – pour les patients présentant une constipation concomitante.
- La décision de procéder à une technique ouverte ou peu invasive est guidée par l’expérience du prestataire et l’aptitude du patient.
- Rectopexie ventrale à maille ouverte ou mini-invasive (laparoscopique ou robotique) : Cette approche omet la dissection du rectum postérieurement et est donc considérée comme épargnant les nerfs. Il a été décrit pour les patients atteints d’invagination interne et de prolapsus de pleine épaisseur. C’est une bonne option pour les patients atteints de hernies concomitantes en cul-de-sac (entérocèles, sigmoïdocèles) ou les patients présentant des symptômes d’incontinence fécale et de constipation. Il est important de mentionner que les patientes atteintes d’une rectocèle associée pourraient se voir proposer une sacrocolpopexie combinée lorsque l’apex du vagin est mal suspendu. Dans les cas où un entérocèle doit être traité, les patients qui recherchent une réparation des tissus natifs se voient souvent proposer une culdoplastie.
- Périnéal: Cette approche est associée à une moindre morbidité ; Cependant, beaucoup pensent qu’il entraîne un risque beaucoup plus élevé de récidive. Il y a également beaucoup de débats sur l’issue fonctionnelle, certains experts suggérant une augmentation de l’incontinence fécale postopératoire par rapport aux patients traités par des approches abdominales non résectionnelles. Compte tenu de ces préoccupations, cette approche est généralement réservée aux patients présentant des comorbidités importantes.
L’American Society of Colon and Rectal Surgeons recommande des procédures abdominales telles que la fixation rectale chez des patients par ailleurs en bonne santé. 4 Les approches périnéales doivent être réservées aux patients présentant des comorbidités préexistantes et lorsqu’il est souhaitable de minimiser la morbidité de l’intervention.
Malgré la réparation chirurgicale, des problèmes fonctionnels tels que la constipation peuvent persister. 1, 3 Le choix de la procédure peut également aggraver la fonction chez certains patients en précipitant l’incontinence fécale (après une résection intestinale) ou la constipation (après dénervation du plancher pelvien).
Aux États-Unis, jusqu’à 3 % des femmes déclarent souffrir d’une forme de prolapsus des organes pelviens, et le prolapsus rectal touche 1 % des adultes de plus de 65 ans. 5
Les facteurs de risque de prolapsus rectal comprennent le sexe féminin,1, 5 l’âge supérieur à 40,1, 5 la multiparité,1, 6 l’accouchement vaginal de nourrissons de grande taille pour l’âge gestationnel,1 et la constipation chronique. 1 D’autres facteurs de risque comprennent des anomalies anatomiques pelviennes telles qu’une poche profonde de Douglas, des conditions atoniques du plancher pelvien ou du canal anal et un manque de fixation normale du rectum. 1 Les troubles du tissu conjonctif tels que les syndromes de Marfan et d’Ehlers-Danlos et certaines affections neurologiques telles que les accidents vasculaires cérébraux, la démence et les lésions de la moelle épinière ont également été associés au prolapsus rectal. 1
La cause du prolapsus rectal est multifactorielle. Généralement, il commence par une invagination du rectum qui progresse vers l’éviscération finale du rectum via un anus patuleux. 1, 5, 6
Il existe des caractéristiques anatomiques qui ont été décrites comme étant associées au prolapsus rectal, telles qu’un côlon sigmoïde redondant, un diastasis du releveur de l’anus, un cul-de-sac profond et un manque de fixation normale du rectum, donnant lieu à un mésorectum exceptionnellement hypermobile et à une laxité des ligaments latéraux. Le but de la chirurgie est de restaurer l’anatomie et de traiter ces caractéristiques.
Pour cette patiente, parce que la manométrie anorectale a montré un faible tonus du sphincter au repos et avec compression, on a estimé que ces basses pressions l’exposaient à un risque d’incontinence fécale avec toute intervention chirurgicale nécessitant une résection intestinale. Cela a conduit à la décision de proposer une rectopexie sans résection au lieu de la rectopexie de résection.
Compte tenu des résultats de l’entérocèle sur sa défécographie, nous avons discuté des meilleurs moyens de le traiter au moment de l’opération. L’option de la culdoplastie par rapport à une rectopexie ventrale a été discutée. En fin de compte, il a été déterminé que, compte tenu du fait que la paroi postérieure du vagin était bien suspendue, elle se porterait probablement très bien avec une réparation native telle qu’une culdoplastie, et que ce maillage pourrait être effectué s’il y avait une récidive future.
Après une évaluation et des conseils, ce patient a choisi de subir une intervention chirurgicale.
Le patient a été emmené au bloc opératoire où une anesthésie générale avec une sonde endotrachéale a été obtenue. Une sonde gastrique buccale a été placée. Elle a reçu de l’héparine sous-cutanée pour la prophylaxie de la thromboembolie veineuse et de la céfazoline et du métronidazole par voie intraveineuse pour la prophylaxie antibiotique. Elle a été placée en position de lithotomie dorsale dans des étriers à nageoires jaunes. Un cathéter de Foley à demeure a été placé dans la vessie et la vessie a été drainée.
L’entrée dans l’abdomen a été réalisée en vision directe à l’aide de la technique de Hasson. Une fois l’entrée abdominale confirmée, l’abdomen a été insufflé du CO2. Une enquête abdominale a été effectuée, et il a été noté qu’il y avait une poche profonde de Douglas, un petit et un gros intestin normaux, ainsi qu’un utérus et des annexes normaux. Trois ports laparoscopique supplémentaires ont été placés sous visualisation directe : un port de 10 mm dans le quadrant inférieur droit, un port de 5 mm dans le quadrant supérieur droit et un port de 5 mm dans le quadrant inférieur gauche. Le prolapsus rectal a été réduit. Une fois que l’anatomie présacrée a été identifiée au niveau S1, le promontoire sacré a été dégagé avec le dispositif Harmonic. À l’aide de l’Harmonique, le rectum a été libéré de ses attaches sacrées et latérales jusqu’aux releveurs, avec une attention particulière pour transecter la tige latérale droite du rectum tout en préservant la gauche pour maintenir une partie de l’innervation vers le rectum. La poche profonde de Douglas a été ouverte à l’extrémité la plus distale et le rectum antérieur a été séparé du vagin au corps périnéal.
Le rectum a ensuite été fixé en tension au promontoire sacré par trois sutures de 0 Gore-Tex. Le rectum a été élevé vers l’abdomen et le bord coupé de la poche de Douglas a été élevé au niveau du promontoire sacré. Toutes les sutures ont été attachées extracorporellement.
Une fois la rectopexie de suture terminée, l’attention s’est tournée vers la culdoplastie laparoscopique. À l’aide des orifices laparoscopique précédemment placés, des sutures barbelées 3-0 V-Loc ont été placées. Le péritoine recouvrant le rectum antérieur et la paroi latérale pelvienne a été approximé, oblitérant ainsi le cul-de-sac postérieur.
Une cystoscopie a ensuite été effectuée, caractérisée par de forts jets urétéraux bilatéraux et une muqueuse vésicale normale sans signe de calculs, de lésions ou de corps étrangers.
La fascia de l’orifice du quadrant inférieur droit de 12 mm a été fermée à l’aide d’un vicryl 0 (Polyglactin 910) à l’aide d’un dispositif de fermeture du fascia par laparoscopie. Le fascia ombilical a été fermé avec 0 Vicryl (Polyglactin 910) sous visualisation directe. Les incisions cutanées ont ensuite été réapprochées à l’aide de 4-0 Monocryl (Poliglecaprone 25) suivi de Steri-Strips.
Une fois la procédure laparoscopique terminée, l’attention a été portée sur la réparation postérieure et la périnéorraphie étendue pour traiter le prolapsus de la paroi vaginale postérieure. La fourchette postérieure a été saisie des deux côtés à l’aide de pinces Allis. La zone de dissection anticipée a ensuite été injectée avec 0,25 % de marcaine avec de l’épinéphrine. Une incision en forme de losange a ensuite été pratiquée sur la peau du corps périnéal et l’épithélium vaginal postérieur. La peau recouvrant le corps périnéal et l’épithélium vaginal postérieur a été excisée. Le corps périnéal a été disséqué brusquement à partir de la cloison recto-vaginale. L’incision vaginale médiane a ensuite été pratiquée du périnée jusqu’au bord proximal de la rectocèle. L’épithélium vaginal a ensuite été disséqué du tissu conjonctif recto-vaginal sous-jacent. À l’aide d’un doigt placé dans le rectum pour le guider, la couche fibromusculaire recto-vaginale a été imbriquée à l’aide de 2-0 PDS II (Polydioxanone) de manière courante. Une couche supplémentaire a été placée pour le renforcement. Un excellent soutien de la paroi vaginale postérieure a ainsi été obtenu et l’excès d’épithélium vaginal a été coupé. Le corps périnéal a été rattaché au fascia recto-vaginal et recréé à l’aide d’une série de points de suture couronne de 0 Vicryl (Polyglactin 910). L’incision médiane a ensuite été fermée de manière courante à l’aide de Vicryl 2-0 (Polyglactin 910). Le périnée était fermé par des sutures sous-muqueuses et sous-cutanées. Une lésion rectale a été exclue lors d’un toucher rectal après la réparation.
Le patient a subi un essai de miction de remplacement le premier jour postopératoire. La vessie a été remplie par le cathéter de Foley avec 300 ml d’eau stérile. Le cathéter de Foley a été retiré et le patient a pu uriner plus de 200 ml, réussissant ainsi l’essai de miction. Par la suite, elle a satisfait à tous les critères de sortie et a été renvoyée à la maison le premier jour postopératoire après un séjour à l’hôpital banal.
Le patient a été vu à deux et sept semaines après l’opération. Lors de ces visites, elle a déclaré qu’elle se portait bien et a nié tout symptôme de prolapsus, d’incontinence anale ou urinaire ou de dysfonction mictionnelle.
- Scalpel harmonique (Johnson & Johnson USA)
- Cystoscope à 70 degrés
Rien à divulguer.
Le patient visé dans cet article vidéo a donné son consentement éclairé pour être filmé et est conscient que des informations et des images seront publiées en ligne.
References
- Bordeianou L, Hicks CW, Kaiser AM, Alavi K, Sudan R, Wise PE. Prolapsus rectal : un aperçu des caractéristiques cliniques, du diagnostic et des stratégies de prise en charge spécifiques au patient. J Gastrointest Surg Off J Soc Surg Aliment Tract. 2014; 18(5):1059-1069. doi :10.1007/s11605-013-2427-7.
- La Torre F, La Torre V, Mazzi M, Giuliani A, Pontone S, La Gioia G. Traitement chirurgical de l’ischémie du prolapsus rectal. Coloproctologie technique. 2005; 9(2):170.
- Borgaonkar VD, Deshpande SS, Borgaonkar VV, Rathod MD. Rectosigmoïdectomie périnéale d’urgence pour le prolapsus rectal gangreneux : une expérience monocentrique avec revue de la littérature. Indien J Surg. 2017; 79(1):45-50. doi :10.1007/s12262-016-1562-2.
- Bordeianou L, Paquette I, Johnson E, et al. Lignes directrices de pratique clinique pour le traitement du prolapsus rectal. Dis Colon Rectum. 2017; 60(11):1121-1131. doi :10.1097/DCR.000000000000889.
- Hatch Q, Steele SR. Prolapsus rectal et invagination. Gastroenterol Clin North Am. 2013; 42(4):837-861. doi :10.1016/j.gtc.2013.08.002.
- Fox A, Tietze PH, Ramakrishnan K. Affections anorectales : prolapsus rectal. FP Essent. 2014;419:28-34.
Cite this article
Ortega MV, Von Bargen EC, Bordeianou LG. Suture laparoscopique rectopexie avec culdoplastie, réparation de la paroi vaginale et périnéorraphie pour prolapsus rectal. J Med Insight. 2022; 2022(272). doi :10.24296/jomi/272.


