Parathyroïdectomie mini-invasive sous anesthésie parlodique cervicale locale pour l’hyperparathyroïdie primaire et l’adénome parathyroïdien
Main Text
Table of Contents
Grâce à l’amélioration de l’identification préopératoire des tumeurs parathyroïdiennes et à l’utilisation du dosage peropératoire de l’hormone parathyroïdienne (PTH), la parathyroïdectomie mini-invasive (MIP) est désormais pratiquée plus fréquemment chez les patients atteints d’hyperparathyroïdie primaire (pHPT) par rapport à l’histoire et à l’exploration cervicale. Pourtant, de nombreux établissements ne sont pas familiers avec la réalisation de la PIM sous anesthésie régionale ou locale. Nous présentons une telle opération sous anesthésie locale du bloc cervical.
Environ 85 % des patients atteints d’hyperparathyroïdie primaire (HPT) présentent un adénome unique et sont guéris par résection de la lésion unique. Les autres patients présentent des adénomes doubles (3 à 5 %) ou une hyperplasie des quatre glandes (10 à 15 %). 1 La parathyroïdectomie mini-invasive focalisée (PIO) est désormais réalisable sous anesthésie régionale ou locale. La MIP est réalisée après une localisation parathyroïdienne préopératoire, généralement avec des scintigraphies au sestamibi de haute qualité, une échographie ou une tomodensitométrie parathyroïdienne quadridimensionnelle (4DCT). Un dosage peropératoire rapide de l’hormone parathyroïdienne (PTH) est utilisé pour confirmer une résection adéquate.
Il s’agit d’une femme de 60 ans atteinte d’hyperparathyroïdie primaire sans équivoque sur le plan biochimique. Elle a été évaluée pour un nodule thyroïdien et, lors de son travail, on a constaté qu’elle avait des taux élevés de calcium dans le sang et l’urine. Les symptômes du patient comprennent une ostéoporose franche avec un score T de -2,6 dans le col du fémur et de -2,3 dans la colonne lombaire. Elle n’a pas d’antécédents de néphrolithiase ni de symptômes neurocognitifs manifestes. Il n’y a pas de plaintes d’enrouement, de difficulté à avaler ou de difficulté à respirer. Elle n’a aucun antécédent de radiothérapie au cou ou au visage.
L’évaluation biochimique met en évidence une calcémie totale de 10,7 mg/dl (plage de référence de 8,8 à 10,2 mg/dl), des taux élevés de PTH de 76 à 81 pg/ml (plage de référence de 10 à 65 pg/ml) et une hypercalciurie avec une calcique urinaire de 438 mg/24 h sur 24 h. L’imagerie préopératoire par échographie et sestamibi avec tomodensitométrie par émission monophotonique (SPECT) a suggéré une lésion parathyroïdienne inférieure gauche.
La modalité d’imagerie la plus précise pour la planification préopératoire chez les patients atteints de TPHP est la 4DCT parathyroïdienne. La 4DCT parathyroïdienne est similaire à l’angiographie par tomodensitométrie. 2 Le terme est dérivé de la tomodensitométrie tridimensionnelle avec une dimension supplémentaire faisant référence aux changements de perfusion du contraste au fil du temps. Des images multiplanaires extrêmement détaillées sont obtenues qui accentuent les différences dans les caractéristiques de perfusion des glandes parathyroïdes hyperfonctionnelles (par exemple, absorption et lavage rapides) par rapport à celles des glandes parathyroïdes normales et d’autres structures du cou. Comparé au sestamibi avec TEMP, le 4DCT est significativement moins coûteux mais associé à une exposition plus élevée aux rayonnements ionisants et doit donc être utilisé avec prudence chez les enfants et les jeunes adultes. 3 De plus, en raison de l’utilisation d’un produit de contraste intraveineux, il doit être évité chez les patients insuffisants rénaux ainsi que chez les patients atteints d’un carcinome thyroïdien concomitant et bien différencié.
La modalité la plus couramment utilisée reste le sestamibi avec SPECT, qui génère une localisation tridimensionnelle. L’une des principales limites de la scintigraphie au sestamibi est la coexistence de nodules thyroïdiens ou d’autres tissus métaboliquement actifs (par exemple, les ganglions lymphatiques, les nodules thyroïdiens et le cancer métastatique de la thyroïde) qui peuvent imiter les adénomes parathyroïdiens, provoquant ainsi des résultats faussement positifs. Le sestamibi avec SPECT ne fournit pas de représentation anatomique détaillée et ne peut détecter les adénomes doubles et l’hyperplasie multiglandulaire que dans 25 à 45 % des cas. deux
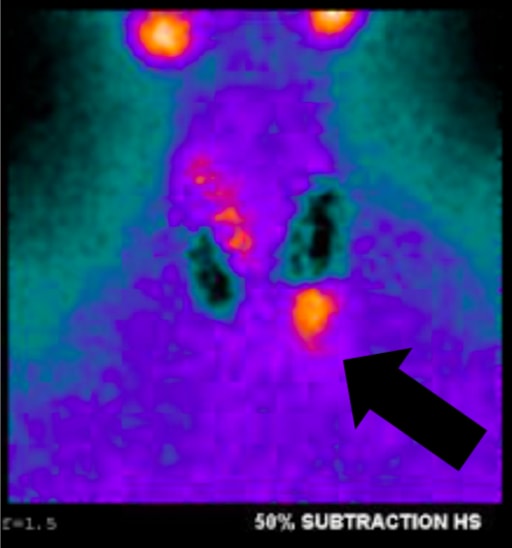 Fig. 1a, Sestamibi avec SPECT du patient de cet article. La flèche indique l’adénome parathyroïdien en position inférieure gauche.
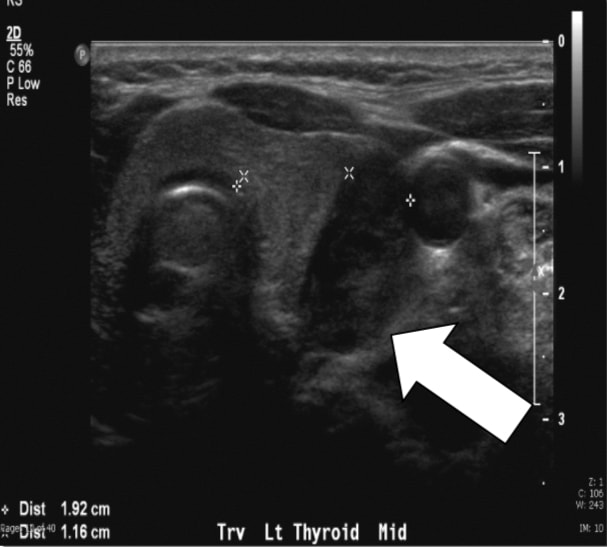
Fig. 1a, Sestamibi avec SPECT du patient de cet article. La flèche indique l’adénome parathyroïdien en position inférieure gauche.Nous effectuons régulièrement des échographies car elles sont efficaces, non invasives et peu coûteuses. Les limitations comprennent à la fois la dépendance à l’opérateur et l’incapacité d’imager les adénomes médiastinaux car ils sont limités au cou. La glande parathyroïde normale est généralement trop petite pour être visualisée par échographie, tandis que l’hypertrophie parathyroïdienne observée dans la pHPT est souvent identifiée comme une masse ovoïde extrathyroïdienne hypoéchogène homogène. Les adénomes parathyroïdiens sont généralement vasculaires, et une branche artérielle peut souvent être suivie jusqu’au pôle supérieur ou inférieur de la lésion. En soi, l’échographie a un taux de vrais positifs d’environ 50 à 75 %, avec des taux généralement meilleurs pour les glandes plus grandes. deux
Ce patient a été référé après une imagerie positive par l’endocrinologue (l’échographie et le sestamibi avec SPECT ont suggéré une lésion parathyroïdienne inférieure gauche). Dans un tel scénario, je ne soumettrais pas le patient à un scanner 4DCT.
L’histoire naturelle de la TPHP non traitée a été étudiée en détail et implique la détérioration des fonctions osseuses et rénales, neurocognitives et cardiovasculaires, qui dépassent toutes la portée de l’article. 4
Il n’existe pas d’autre traitement curatif pour la TPHP que la chirurgie. Cependant, une réduction temporaire du calcium sérique peut être effectuée pharmacologiquement. 4
Les indications de la MIP sont les mêmes que celles de l’exploration cervicale traditionnelle : les patients symptomatiques ou ceux atteints de pHPT asymptomatique remplissent les critères établis par la plus récente réunion de consensus des National Institutes of Health (NIH). 4 De plus, il existe maintenant des données significatives en faveur d’un recours plus libéral à la chirurgie, car la maladie a été associée à plusieurs morbidités « non classiques », dont certaines semblent s’améliorer en postopératoire. 4 Il s’agit notamment de troubles neurocognitifs et d’anomalies cardiovasculaires.
La chirurgie unilatérale de la TPHP a été préconisée pour la première fois en 1975, et le côté à explorer a été choisi en fonction de la palpation, de l’imagerie œsophagienne, de la phlégraphie ou de l’artériographie. 5 Le succès de la MIP a été confirmé par des preuves de taux de guérison et de complications qui sont au moins aussi bons que ceux obtenus par l’exploration bilatérale conventionnelle. 6 Le taux de complications de la MIP est similaire ou inférieur à celui de l’approche cervicale standard. 7 Une lésion récurrente du nerf laryngé peut survenir dans 0,5 à 1,0 % des cas. 6 Le risque d’hypoparathyroïdie permanente est absent si une seule glande est explorée et enlevée, mais il y a toujours une préoccupation chez les patients subissant une parathyroïdectomie subtotale pour une maladie multiglandulaire.
La patiente actuelle a démontré une guérison biochimique de son TPHP et n’a présenté aucune complication.
Je préfère l’anesthésie en bloc locale et régionale avec des soins d’anesthésie surveillés (MAC) par opposition à l’anesthésie générale utilisant une sonde endotrachéale (ETT) ou un masque respiratoire laryngé (LMA). Le bloc régional est effectué par le chirurgien au bloc opératoire, et la supplémentation intraveineuse est dirigée par l’anesthésiste. Chez la plupart des patients, de la lidocaïne à 1 % contenant 1:100 000 d’épinéphrine est utilisée et ajoutée pendant l’opération au besoin. On prend soin d’aspirer avant d’administrer l’anesthésique pour éviter l’administration intravasculaire. Le volume cumulé total de lidocaïne administré est généralement de 18 à 25 ml. La sédation intraveineuse est utilisée pour minimiser l’anxiété du patient tout en maintenant un patient éveillé et conscient qui peut téléphoner. 1
L’anesthésie régionale évite les complications associées à l’anesthésie générale, telles que les nausées et les vomissements. Éviter l’intubation endotrachéale est bénéfique car il a été rapporté qu’elle provoque des modifications des cordes vocales chez jusqu’à 5 % des patients. 6, 8 De plus, l’exploration d’un patient conscient permet une évaluation peropératoire des fonctions nerveuses laryngées supérieures et récurrentes, car le patient peut vocaliser pendant la procédure.
Aucune modalité d’imagerie préopératoire ne remplacera le besoin d’un chirurgien parathyroïdien bien formé et réfléchi. 9 Les chirurgiens qui pratiquent la MIP doivent comprendre l’embryologie et l’anatomie des glandes parathyroïdes. Le développement embryonnaire et la descente dans le col cervical des glandes parathyroïdes conduisent à une anatomie très variable. Le tissu parathyroïdien ectopique est couramment rencontré dans la thyroïde, le thymus, le médiastin, la gaine carotide et le sillon trachéo-œsophagien. Les glandes non descendues peuvent être situées le long de la bifurcation carotidienne ou le long du larynx.
La technique MIP est individualisée après la localisation de l’adénome parathyroïdien. En règle générale, une incision de Kocher abrégée de 2,5 à 3,5 cm est pratiquée, suivie de la création de lambeaux sous-platysmaux limités et de l’ouverture du raphé médian. La glande thyroïde est alors mobilisée en antéromédialement. L’adénome parathyroïdien est alors identifié, aidé par l’imagerie préopératoire. Il est important de manipuler l’adénome parathyroïdien en douceur pour éviter la rupture de sa capsule, ce qui peut déverser des cellules tumorales parathyroïdiennes. Si la glande parathyroïde est saisie, il est préférable de manipuler la parathyroïde par le coussinet adipeux qui s’étend souvent autour de la glande ou de son irrigation sanguine artérielle terminale. L’apport sanguin de l’artère terminale est ligaturé à l’aide de clips ou d’attaches en soie. Avant l’excision de l’adénome parathyroïdien, le nerf laryngé récurrent est protégé. La chirurgie parathyroïdienne est une procédure méticuleuse et l’expérience opératoire est corrélée avec les taux de récidive et de persistance ainsi que les complications. 1 La procédure est guidée par des mesures PTH peropératoires.
La mesure peropératoire de la PTH est utilisée régulièrement. La demi-vie circulante de la PTH est de 3,5 à 4,0 minutes, et les niveaux de PTH sont donc obtenus avant la chirurgie et à 5 et 10 minutes après l’extraction de la tumeur. Les taux de PTH devraient diminuer (>50 %) dans les 5 ou 10 minutes suivant l’ablation de l’adénome parathyroïdien hyperfonctionnel, car les glandes parathyroïdes normales restantes sont la seule source de PTH. Si c’est le cas, le patient n’a pas besoin d’exploration supplémentaire. L’incapacité du taux de PTH veineux périphérique à diminuer de manière adéquate suggère que le tissu parathyroïdien restant hyperfonctionnel, et une intervention chirurgicale supplémentaire est indiquée sous anesthésie régionale ou générale. En plus d’être un complément précieux pour confirmer l’exhaustivité de la résection parathyroïdienne, le dosage rapide de la PTH est un complément utile à d’autres aspects du traitement de la pHPT. Nous effectuons régulièrement des aspirations à l’aiguille fine ex vivo des tissus excisés lors d’une chirurgie parathyroïdienne pour mesurer la PTH. Une aspiration positive démontrera des taux de PTH supérieurs à 1 000 pg/ml. Dans la plupart des cas, il n’est donc plus nécessaire de procéder à une analyse de section figée. Bien que nous nous appuyions fortement sur le test PTH peropératoire, il ne remplace pas le jugement clinique, et le test doit être interprété dans ce contexte. 1
La pathologie a révélé une hypertrophie (1,8 cm) et une glande parathyroïde cellulaire pesant 507 mg (normale autour de 30-40 mg). Lors de la visite postopératoire huit jours après l’opération, la calcémie totale de la patiente était normale à 9,5 mg/dl (plage de référence 8,8 à 10,2 mg/dl), et elle avait un taux de PTH normal de 32 pg/ml (plage de référence 10 à 65 pg/ml). La fonction de ses cordes vocales était également normale.
Aucun équipement spécial n’a été utilisé.
Rien à divulguer.
Le patient mentionné dans cet article vidéo a donné son consentement éclairé pour être filmé et est conscient que des informations et des images seront publiées en ligne.
References
- Carling T, Udelsman R. Approche ciblée de la parathyroïdectomie. Monde J Surg. 2008; 32(7):1512-1517. doi :10.1007/s00268-008-9567-z.
- Starker LF, Mahajan A, Björklund P, Sze G, Udelsman R, Carling T. TDM parathyroïdienne 4D comme étude de localisation initiale pour les patients atteints d’hyperparathyroïdie primaire de novo. Ann Surg Oncol. 2011; 18(6):1723-1728. doi :10.1245/s10434-010-1507-0.
- Mahajan A, Starker LF, Ghita M, Udelsman R, Brink JA, Carling T. Tomographie parathyroïdienne quadridimensionnelle : évaluation de l’exposition à la dose de rayonnement lors de la localisation préopératoire des tumeurs parathyroïdiennes dans l’hyperparathyroïdie primaire. Monde J Surg. 2012; 36(6):1335-1339. doi :10.1007/s00268-011-1365-3.
- Bilezikian JP, Brandi ML, Eastell R, et al. Lignes directrices pour la prise en charge de l’hyperparathyroïdie primaire asymptomatique : résumé du quatrième atelier international. J Clin Endocrinol Metab. 2014; 99(10):3561-3569. doi :10.1210/jc.2014-1413.
- Roth SI, Wang CA, Potts JT Jr. L’approche d’équipe de l’hyperparathyroïdie primaire. Bourdonnement pathol. 1975; 6(6):645-648. doi :10.1016/S0046-8177(75)80073-6.
- Udelsman R, Lin Z, Donovan P. La supériorité de la parathyroïdectomie mini-invasive basée sur 1650 patients consécutifs atteints d’hyperparathyroïdie primaire. Ann Surg. 2011; 253(3):585-591. doi :10.1097/SLA.0b013e318208fed9.
- Bergenfelz A, Lindblom P, Tibblin S, Westerdahl J. Exploration unilatérale ou bilatérale du cou pour l’hyperparathyroïdie primaire : un essai contrôlé randomisé prospectif. Ann Surg. 2002; 236(5):543-551. doi :10.1097/01.SLA.0000032949.36504.C3.
- Kark AE, Kissin MW, Auerbach R, Meikle M. Changements de voix après thyroïdectomie : rôle du nerf laryngé externe. Br J Med (Clin Res Ed). 1984; 289(6456):1412-1415. doi :10.1136/bmj.289.6456.1412.
- Stålberg P, Carling T. Tumeurs parathyroïdiennes familiales : diagnostic et gestion. Monde J Surg. 2009; 33(11):2234-2243. doi :10.1007/s00268-009-9924-6.
Cite this article
Carling T. Parathyroïdectomie mini-invasive sous anesthésie locale du bloc cervical pour l’hyperparathyroïdie primaire et l’adénome parathyroïdien. J Med Insight. 2022; 2022(225). doi :10.24296/jomi/225.