Leiomiosarcoma de la vena cava inferior: resección y reconstrucción
Main Text
Table of Contents
Los leiomiosarcomas primarios de la vena cava inferior (VCI) son tumores raros con relaciones anatómicas complejas. La resección quirúrgica sigue siendo el enfoque principal para el tratamiento, con el uso selectivo de radiación y quimioterapia preoperatorias. Dada la propensión a la invasión local de estos tumores, a menudo se requiere una resección radical de las estructuras circundantes. En este trabajo describimos la presentación, el estudio, el manejo operatorio y los resultados de estas lesiones a través del caso de un paciente con un tumor que compromete el segmento medio de la VCI. Dado el grado de afectación, se realizó resección de VCI con nefrectomía derecha en bloque, adrenalectomía derecha y resección parcial de la vena renal izquierda con reconstrucción vascular mediante injerto protésico. Con una planificación preoperatoria adecuada y un enfoque multidisciplinario bien coordinado, se puede realizar una resección quirúrgica agresiva de forma segura y los pacientes pueden beneficiarse de una supervivencia favorable a largo plazo.
El leiomiosarcoma (LMS) de la vena cava inferior (IVC), que representa menos del 0,5% de todos los sarcomas de tejido blando, es una neoplasia poco frecuente que afecta al músculo liso de la vena. 1 La enfermedad se observa con mayor frecuencia en las mujeres (3:1) en la quinta década de la vida. 2 Se ha observado que el diámetro máximo del tumor oscila entre 8 y 37 cm. 3 Además de la afectación del riñón derecho o de las glándulas suprarrenales, se ha observado diseminación directa al hígado derecho o izquierdo, la aorta infrarrenal, la región intracardíaca y el pulmón derecho supradiafragmático. 3 En la mayoría de los casos, los pacientes reciben un diagnóstico histológico preoperatorio mediante biopsia percutánea o laparotomía. 3
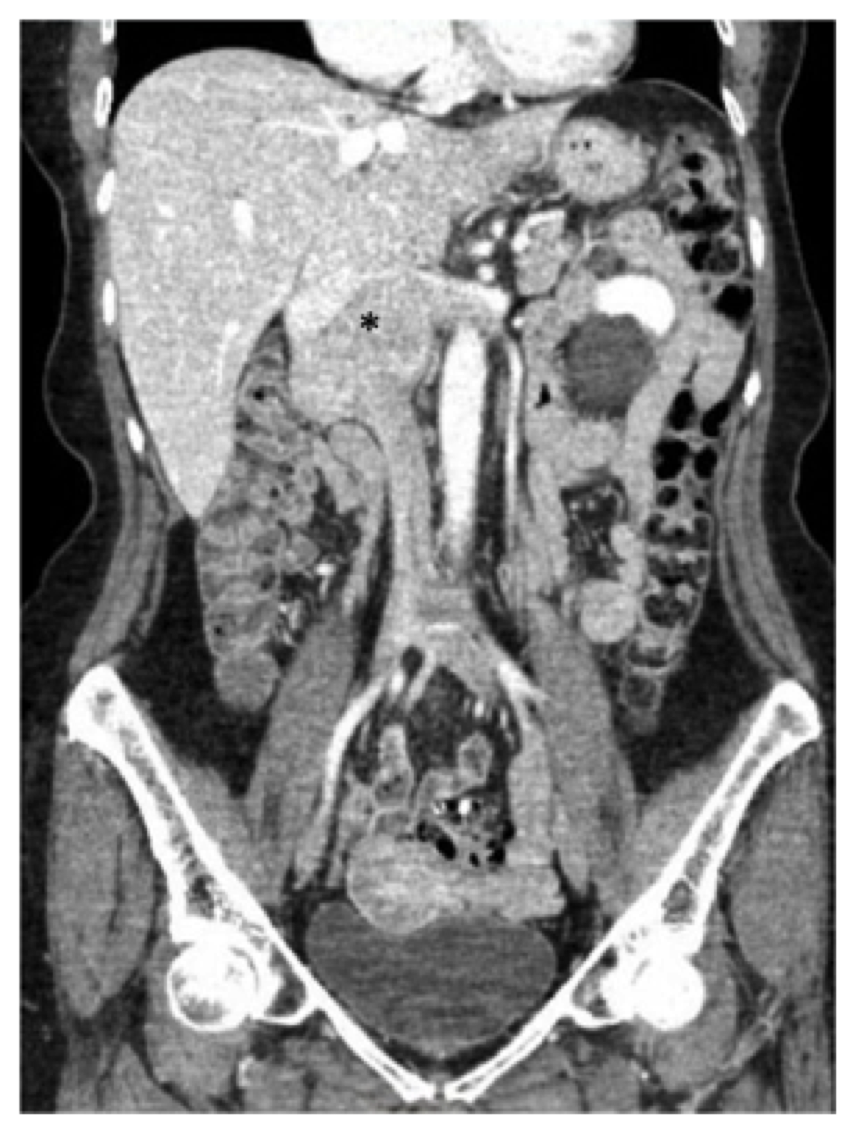
Una mujer de 73 años presentó antecedentes de dolor lumbar intermitente, hinchazón de las extremidades inferiores y una pérdida de peso de seis libras en el transcurso de un año. Sus antecedentes médicos eran notables por hipertensión, por lo que tomaba atenolol, hidroclorotiazida y nifedipino, así como por reflujo, por lo que se le mantenía con omeprazol. Tras el examen de su médico de atención primaria, se le realizó una tomografía computarizada (TC) del abdomen y la pelvis que mostraba una masa a lo largo de la VCI yuxtarenal de la que se realizó una biopsia y se determinó que era compatible con leiomiosarcoma (Figura 1).
El síntoma de presentación más común para los pacientes con IVC LMS es el dolor abdominal (59,9 %), seguido de edema de las extremidades inferiores (14,8 %), pérdida de peso (11,4 %), dolor de espalda (9,7 %) y distensión abdominal (9,3 %). 1-4 Se cree que el edema de las extremidades inferiores solo ocurre en una fracción de los pacientes, probablemente debido al desarrollo de colaterales venosos en el contexto de un crecimiento tumoral lento. Con mucha menos frecuencia, la trombosis venosa profunda (1,7%) o el síndrome de Budd-Chiari (1,3%) son responsables de la presentación. 1-4 Es posible que haya signos adicionales, como arritmia cardíaca, en pacientes con diseminación tumoral intracardíaca a la aurícula derecha. Como se mencionó, nuestro paciente presentó antecedentes de dolor lumbar intermitente, hinchazón de las extremidades inferiores y pérdida de peso. Sin embargo, en el examen físico presentaba un buen aspecto, un abdomen blando y no doloroso a la palpación sin hepatoesplenomegalia y se observó que las extremidades distales no estaban edematosas. Por lo demás, su examen no tuvo nada de especial.
Las imágenes axiales mediante TC o resonancia magnética nuclear (RMN) constituyen la principal modalidad de imágenes para evaluar a los pacientes que presentan LMS, ya que estas exploraciones proporcionan detalles sobre la extensión del tumor, la invasión local y la enfermedad a distancia. En la TC, la LMS de la VCI aparece como una masa heterogénea, no calcificada y con realce periférico. 5 Las imágenes de resonancia magnética se caracterizan por la baja intensidad de la señal en las imágenes ponderadas en T1 y la alta intensidad de la señal en las imágenes ponderadas en T2. 5 Una parte de los pacientes también pueden recibir una ecografía abdominal, donde el Doppler en tiempo real puede delinear el grado de obstrucción vascular y trombosis. Aunque algunos autores han defendido estudios invasivos como la cavografía ascendente o retrógrada y la arteriografía selectiva3, cada vez son menos frecuentes debido al aumento de la resolución y las reconstrucciones que se pueden obtener mediante imágenes axiales no invasivas. Las imágenes de TC pueden mejorarse aún más con imágenes de fase retardada o de fase venosa que pueden delinear mejor la VCI y la luz de flujo residual. Por último, en los pacientes en los que existe preocupación por la extensión intracardíaca del tumor, se debe obtener una ecocardiografía transesofágica antes de la operación.
Al paciente de este informe se le realizó una tomografía computarizada con contraste de abdomen y pelvis, y observamos una masa de 7,5 cm que afectaba a la VCI desde el nivel de las venas renales (la vena renal derecha estaba ampliamente comprometida y también había compromiso del origen de la vena renal izquierda) hasta el nivel de las venas hepáticas, pero sin afectación (Figura 1). Se observó que el duodeno y el páncreas estaban desplazados anteriormente sin evidencia de invasión directa.
Se encontró que la LMS de VCI primaria es uniformemente mortal y sin supervivencia a 3 años en pacientes que recibieron resección incompleta. 1 En el análisis combinado, en los pacientes sometidos a resección quirúrgica, se observó que la supervivencia sin enfermedad (SSE) a 1 y 5 años es baja (57 % y 6 %, respectivamente). Sin embargo, la supervivencia global ha sido favorable (92% y 55%, respectivamente). número arábigo
La resección quirúrgica completa es el tratamiento preferido para los pacientes que pueden tolerar la cirugía y, a menudo, requiere la resección en bloque de los órganos adyacentes afectados. La resección con ligadura de la VCI se puede realizar para tumores infrarrenales o aquellos que requieren resección del riñón derecho en los que se han formado colaterales sustanciales para el riñón izquierdo. En aproximadamente una cuarta parte de los pacientes, se puede realizar una resección parcial de la VCI. 3 Se ha sugerido que si se reseca < 75% de la VCI, se puede utilizar la resección primaria o la cavoplastia con parche, pero en los casos en los que se extirpa > 75% de la circunferencia, se necesita una resección y reconstrucción completas. 6 Para aquellos que requieren reconstrucción, una prótesis de politetrafluoroetileno (PTFE) anillada puede tener el tamaño adecuado y se puede suturar en su lugar con una sutura de polipropileno 4-0 o 5-0. El uso de quimioterapia o radioterapia, ya sea como terapia neoadyuvante o adyuvante, puede tener un papel cada vez mayor. Sin embargo, dada la rareza de esta enfermedad y la escasez de datos sobre los resultados del tratamiento disponibles hasta la fecha, estas modalidades se adaptan actualmente a cada paciente individual después de una discusión multidisciplinaria, y existe variabilidad en su aplicación.
Dada la rareza de la LMS IVC primaria, hay estudios limitados que apoyan un abordaje no quirúrgico, y la resección quirúrgica completa sigue siendo la estrategia de tratamiento óptima. 2 En un esfuerzo por disminuir el riesgo de recidiva en el margen retroperitoneal, así como la diseminación tumoral de la cavidad peritoneal en el momento de la resección quirúrgica, nuestra práctica institucional para el tratamiento del sarcoma retroperitoneal incluye radioterapia neoadyuvante seguida de resección radical y quimioterapia si se considera necesario después de revisar y analizar la patología final del explante. Específicamente, nuestro paciente se inscribió en un ensayo patrocinado por el Instituto Nacional del Cáncer (NCI) (DFCI/HCC 12-100) en el que se trató con 63 Gray (Gy) en el margen retroperitoneal y 50,4 Gy en toda el área tumoral utilizando protones de barrido con haz de lápiz durante cinco semanas. La paciente lo toleró bien, se le realizó una reestadificación estable y, posteriormente, se procedió a la resección radical de su sarcoma retroperitoneal con resección en bloque del riñón derecho, la glándula suprarrenal derecha, la vena cava inferior y una porción de la vena renal izquierda, como se detalla a continuación (consulte la descripción del procedimiento).
La primera descripción de una IVC LMS primaria fue en 1871 por Perl,7 seguida de la primera resección por Melchior en 1928 en la que el paciente murió 2 semanas después de la cirugía. 8 Con los avances que permiten la planificación preoperatoria, el refinamiento de la técnica quirúrgica y la exposición, y las mejoras en los cuidados críticos, la mortalidad perioperatoria a los 30 días después de la resección de la LMS de IVC es ahora del 1,9%. 2 Sin embargo, sigue habiendo una morbilidad sustancial a 30 días (24,7%). 2 No obstante, la resección quirúrgica sigue siendo la estrategia de tratamiento principal. Con este abordaje, se observó que la SSE a 5 años a largo plazo es baja (6 %), mientras que la supervivencia general a 5 años ha sido favorable (55 %). número arábigo
Hasta hace poco, una serie de informes en la literatura que estudiaban IVC LMS estaban limitados por el pequeño tamaño de la muestra. Un análisis conjunto de Wachtel et al. ha permitido el estudio más completo que incluye 377 pacientes. 2 Tras el análisis ajustado, los factores identificados como causantes de una disminución de la supervivencia general fueron el tamaño grande del tumor (≥9 cm), la edad avanzada (≥55 años), la necesidad de resección en bloque, el estado de los márgenes positivos, la quimioterapia adyuvante y la localización del tumor. Específicamente, los leiomiosarcomas primarios de VCI se clasifican según el grado de compromiso venoso y se describen según el límite superior del tumor y el grado de extensión tumoral. Utilizando este sistema de clasificación, los tumores del segmento I son infrarrinales, los del segmento II son interrenales y/o suprarrenales hasta las venas suprahepáticas, pero sin incluirlas, y los del segmento III son aquellos que se extienden hacia las venas suprahepáticas y tienen posible extensión intracardíaca. Los tumores del segmento II, o segmento medio, son los más comunes y se ha encontrado que tienen mejores resultados que los que surgen en el segmento I o el segmento III. 2,9 En parte, se cree que esto se debe al reconocimiento temprano de tumores en el segmento II debido a una proximidad anatómica más cercana de estos tumores a múltiples órganos, lo que puede provocar dolor u obstrucción. 2 El tumor de nuestro paciente podría clasificarse como una lesión del segmento II.
Algunos comentarios sobre el procedimiento quirúrgico para la resección y reconstrucción de IVC LMS ameritan una discusión más profunda. En cuanto a la exposición, en la mayoría de los casos (60%) se ha utilizado un abordaje abdominal (laparotomía mediana o incisión subcostal derecha), mientras que se puede emplear un abordaje toracoabdominal con posible esternotomía dependiendo de la anatomía específica del tumor que se está resecando. 3 En concreto, para los tumores que se extienden hacia la vena cava retrohepática o suprahepática, puede ser necesaria la exclusión hepática total mediante el pinzamiento de la VCI por encima y por debajo del hígado, además del pinzamiento de la vena porta. En pacientes con extensión intracardíaca, puede estar justificada una exposición adecuada para permitir la derivación cardiopulmonar. En general, los pacientes con tumores aislados en la cava infrahepática y pararenal probablemente tolerarán el pinzamiento cruzado completo de la VCI sin alteraciones hemodinámicas significativas, siempre y cuando se asegure una precarga adecuada con una reanimación intraoperatoria adecuada por parte del equipo de anestesia. En cuanto a la técnica, en pacientes con hipertensión venosa (presiones venosas proximales de 30 mmHg o más), se recomienda la reconstrucción (a diferencia de la ligadura, la resección primaria o la cavoplastia) para prevenir el edema postoperatorio de las extremidades inferiores. 3 Además, puede ser necesario el reimplante de las venas renales o hepáticas dependiendo de la extensión del tumor resecado. Actualmente no existe un estándar para el manejo de la anticoagulación postoperatoria, y el tratamiento con aspirina antiagregante plaquetaria, como el utilizado en nuestro paciente que fue dado de alta con 325 mg de aspirina diarios, se asocia con bajas tasas de trombosis postoperatoria del injerto. 10
Es posible que nunca se publiquen ensayos controlados aleatorizados que evalúen la eficacia de la quimioterapia o la radioterapia en el tratamiento del IVC LMS debido a la rareza de la enfermedad. La patología final de nuestro paciente fue notable por un leiomiosarcoma grado 2/3 (yPT2bN0) con márgenes negativos. Tras hablar con oncología médica, decidimos que no requería ninguna terapia adyuvante adicional. Con respecto al seguimiento, se deben utilizar tomografías computarizadas a intervalos para evaluar la recidiva local y la metástasis a distancia en función del riesgo de recurrencia. 6 Obtuvimos nuestra primera exploración de vigilancia a los 3 meses, y fue normal. En casos de recidiva a distancia, se recomienda la resección quirúrgica y el uso de terapia sistémica para aquellos que no pueden tolerar una operación. 4
La supervivencia prolongada en pacientes con LMS de IVC es posible y requiere un abordaje multidisciplinario. Aunque la cirugía sigue siendo la piedra angular del tratamiento, se recomienda la participación de la oncología médica y radioterápica, así como de múltiples subespecialidades quirúrgicas (p. ej., oncología quirúrgica y cirugía de trasplante) para manejar e individualizar de manera óptima el tratamiento de los pacientes con esta neoplasia maligna poco frecuente.
Los autores no tienen divulgaciones relevantes.
El paciente al que se refiere este videoartículo ha dado su consentimiento informado para ser filmado y es consciente de que la información y las imágenes se publicarán en línea.
References
- Hollenbeck ST, Grobmyer SR, Kent KC, Brennan MF. Tratamiento quirúrgico y resultados de los pacientes con leiomiosarcoma primario de vena cava inferior. J Am Coll Surg. 2003; 197(4):575-579. doi:10.1016/S1072-7515(03)00433-2.
- Wachtel H, Gupta M, Bartlett EK, et al. Resultados después de la resección de leiomiosarcomas de la vena cava inferior: análisis de datos agrupados de 377 casos. Surg Oncol. 2015; 24(1):21-27. doi:10.1016/j.suronc.2014.10.007.
- Kieffer E, Alaoui M, Piette JC, Cacoub P, Chiche L. Leiomiosarcoma de la vena cava inferior: experiencia en 22 casos. Ann Surg. 2006; 244(2):289-295. doi:10.1097/01.sla.0000229964.71743.db.
- Cananzi FCM, Mussi C, Bordoni MG, et al. Papel de la cirugía en el tratamiento multimodal del leiomiosarcoma primario y recidivante de la vena cava inferior. J Surg Oncol. 2016; 114(1):44-49. doi:10.1002/jso.24244.
- Ganeshalingam S, Rajeswaran G, Jones RL, Thway K, Moskovic E. Leiomiosarcomas de la vena cava inferior: características diagnósticas de las imágenes transversales. Clin Radiol. 2011; 66(1):50-56. doi:10.1016/j.crad.2010.08.004.
- Dull BZ, Smith B, Tefera G, Weber S. Tratamiento quirúrgico del leiomiosarcoma retroperitoneal que surge de la vena cava inferior. J Gastrointest Surg. 2013; 17(12):2166-2171. doi:10.1007/s11605-013-2385-0.
- Perl L, Virchow R. Ein Fall von Sarkom der Vena cava inferior. Archiv für pathologische Anatomie und Physiologie und für klinische Medicin. 1871; 53(4):378-383. doi:10.1007/BF01957198.
- Melchior E. Sarkom der Vena cava inferior. Deutsche Zeitschrift für Chirurgie. 1928; 213(1-2):135-140. doi:10.1007/BF02796714.
- Mingoli A, Cavallaro A, Sapienza P, Di Marzo L, Feldhaus RJ, Cavallari N. Registro internacional de leiomiosarcoma de vena cava inferior: análisis de una serie mundial en 218 pacientes. Res. Anticancerígeno 1996; 16(5B):3201-3205.
- Fiore M, Colombo C, Locati P, et al. Técnica quirúrgica, morbilidad y desenlace del sarcoma retroperitoneal primario con compromiso de vena cava inferior. Ann Surg Oncol. 2012; 19(2):511-518. doi:10.1245/s10434-011-1954-2.
Cite this article
Patel MS, Mohebali J, Vagefi PA, Haynes AB. Leiomiosarcoma de la vena cava inferior: resección y reconstrucción. J Med Insight. 2024; 2024(184). doi:10.24296/jomi/184.