Leiomyosarkom der Vena cava inferior: Resektion und Rekonstruktion
Main Text
Table of Contents
Primäre Leiomyosarkome der Vena cava inferior (IVC) sind seltene Tumoren mit komplexen anatomischen Verwandtschaftsverhältnissen. Die chirurgische Resektion ist nach wie vor der primäre Ansatz für die Behandlung, wobei präoperative Bestrahlung und Chemotherapie selektiv eingesetzt werden. Aufgrund der Neigung zur lokalen Invasion dieser Tumoren ist häufig eine radikale Resektion der umgebenden Strukturen erforderlich. Im Folgenden beschreiben wir das Erscheinungsbild, die Aufarbeitung, das operative Management und die Ergebnisse dieser Läsionen am Beispiel eines Patienten mit einem Tumor, der das mittlere Segment der IVC betrifft. Aufgrund des Ausmaßes der Beteiligung wurde eine IVC-Resektion mit en-bloc-Nephrektomie, rechter Adrenalektomie und partieller Resektion der linken Nierenvene mit Gefäßrekonstruktion unter Verwendung eines prothetischen Transplantats durchgeführt. Mit einer angemessenen präoperativen Planung und einem gut koordinierten multidisziplinären Ansatz kann eine aggressive chirurgische Resektion sicher durchgeführt werden und die Patienten können von einem günstigen Langzeitüberleben profitieren.
Mit einem Anteil von weniger als 0,5 % aller Weichteilsarkome ist das Leiomyosarkom (LMS) der Vena cava inferior (IVC) eine seltene Neubildung, die die glatte Muskulatur der Vene betrifft. 1 Die Krankheit tritt häufiger bei Frauen (3:1) im fünften Lebensjahrzehnt auf. 2 Es wurde festgestellt, dass der maximale Tumordurchmesser zwischen 8 und 37 Zentimetern liegt. 3 Neben der Beteiligung der rechten Niere oder Nebenniere wurde eine direkte Streckung auf die rechte oder linke Leber, die infrarenale Aorta, die intrakardiale Region und die supradiaphragmatische rechte Lunge festgestellt. 3 In den meisten Fällen erhalten die Patienten eine präoperative histologische Diagnose entweder durch perkutane Biopsie oder Laparotomie. 3
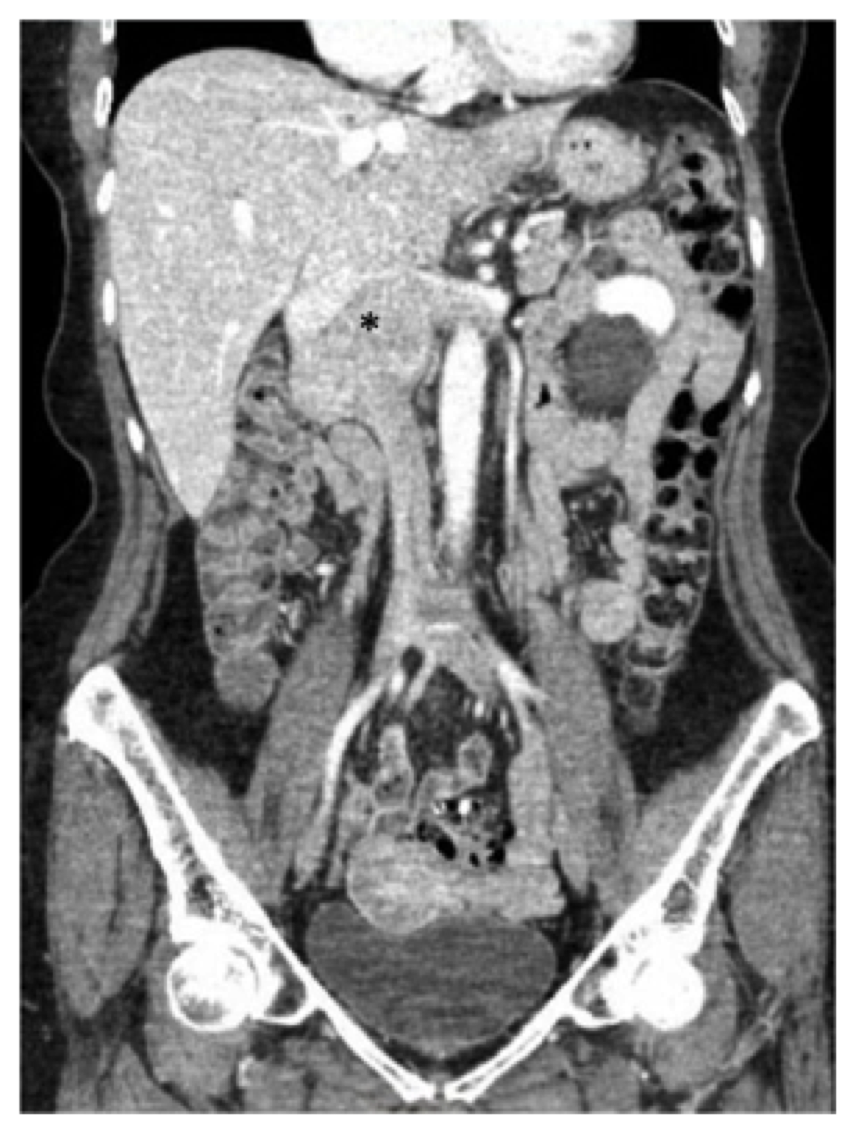
Eine 73-jährige Frau stellte sich im Laufe eines Jahres mit intermittierenden Schmerzen im unteren Rückenbereich, Schwellungen der unteren Extremitäten und einem Gewichtsverlust von sechs Pfund vor. Ihre medizinische Vorgeschichte war bemerkenswert für Bluthochdruck, gegen den sie Atenolol, Hydrochlorothiazid und Nifedipin einnahm, sowie durch Reflux, für den sie mit Omeprazol behandelt wurde. Nach der Abklärung durch ihren Hausarzt erhielt sie eine Computertomographie (CT) des Bauches und des Beckens, die eine Raumforderung entlang der juxtalalen IVC zeigte, die biopsiert wurde und sich als konsistent mit einem Leiomyosarkom herausstellte (Abbildung 1).
Das häufigste Symptom bei Patienten mit IVC LMS sind Bauchschmerzen (59,9 %), gefolgt von Ödemen der unteren Extremitäten (14,8 %), Gewichtsverlust (11,4 %), Rückenschmerzen (9,7 %) und Blähungen (9,3 %). Es wird angenommen, dass Ödeme der unteren Extremitäten nur bei einem Bruchteil der Patienten auftreten, wahrscheinlich aufgrund der Entwicklung venöser Kollateralen im Rahmen eines langsamen Tumorwachstums. Deutlich seltener sind tiefe Venenthrombosen (1,7 %) oder das Budd-Chiari-Syndrom (1,3 %) für das Erscheinungsbild verantwortlich. 1-4 Zusätzliche Anzeichen wie Herzrhythmusstörungen können bei Patienten mit intrakardialer Tumorausdehnung in den rechten Vorhof auftreten. Wie bereits erwähnt, hatte unser Patient in der Vorgeschichte intermittierende Schmerzen im unteren Rückenbereich, Schwellungen der unteren Extremitäten und Gewichtsverlust. Bei der körperlichen Untersuchung sah sie jedoch gut aus, hatte einen weichen, nicht empfindlichen Bauch ohne Hepatosplenomegalie und es wurde festgestellt, dass sie nicht ödematöse distale Extremitäten hatte. Ansonsten verlief ihre Prüfung unauffällig.
Die axiale Bildgebung mittels CT oder Magnetresonanztomographie (MRT) stellt die primäre Bildgebungsmodalität für die Beurteilung von Patienten mit LMS dar, da diese Scans Details über das Ausmaß des Tumors, der lokalen Invasion und der Fernerkrankung liefern. In der CT erscheint das LMS der IVC als heterogene, nicht verkalkte Masse mit peripherer Verstärkung. 5 MRT-Bilder zeichnen sich durch eine niedrige Signalintensität bei T1-gewichteten Bildern und eine hohe Signalintensität bei T2-gewichteten Bildern aus. 5 Ein Teil der Patienten kann auch abdominalen Ultraschall erhalten, bei dem der Echtzeit-Doppler den Grad der Gefäßobstruktion und -thrombose abgrenzen kann. Obwohl invasive Studien wie die aufsteigende oder retrograde Cavographie und die selektive Arteriographie von einigen Autoren befürwortet wurden,3 werden sie aufgrund der erhöhten Auflösung und der Rekonstruktionen, die durch nichtinvasive axiale Bildgebung erzielt werden können, immer seltener. CT-Bilder können durch Bilder der verzögerten Phase oder der venösen Phase, die das IVC und das Restflusslumen besser abgrenzen können, weiter verbessert werden. Schließlich sollte bei Patienten, bei denen Bedenken hinsichtlich einer intrakardialen Ausdehnung des Tumors bestehen, präoperativ eine transösophageale Echokardiographie durchgeführt werden.
Der Patient in diesem Bericht wurde einer CT-Untersuchung mit Kontrast des Bauches und des Beckens unterzogen, und wir stellten eine 7,5 cm große Masse fest, die die IVC betraf, beginnend auf der Ebene der Nierenvenen (die rechte Nierenvene war großflächig betroffen und es gab auch eine Beteiligung des Ursprungs der linken Nierenvene) bis zur Höhe der Lebervenen, die jedoch nicht beteiligt waren (Abbildung 1). Es wurde festgestellt, dass der Zwölffingerdarm und die Bauchspeicheldrüse nach anterior verschoben waren, ohne dass eine direkte Invasion nachgewiesen wurde.
Es wurde festgestellt, dass die primäre IVC LMS bei Patienten, die eine unvollständige Resektion erhielten, einheitlich tödlich und ohne 3-Jahres-Überleben war. 1 In der gepoolten Analyse wurde bei Patienten, die sich einer chirurgischen Resektion unterzogen, ein 1- bzw. 5-jähriges krankheitsfreies Überleben (DFS) als gering (57 % bzw. 6 %) festgestellt. Das Gesamtüberleben war jedoch günstig (92 % bzw. 55 %). arabische Ziffer
Die vollständige chirurgische Resektion ist die bevorzugte Behandlung für Patienten, die eine Operation vertragen und oft eine En-bloc-Resektion der betroffenen Nachbarorgane erforderlich machen. Die Resektion mit Ligatur der IVC kann bei infrarenalen Tumoren oder bei Tumoren durchgeführt werden, die eine Resektion der rechten Niere erforderlich machen und bei denen sich erhebliche Kollateralen für die linke Niere gebildet haben. Bei etwa einem Viertel der Patienten kann eine partielle IVC-Resektion durchgeführt werden. 3 Es wurde vorgeschlagen, dass, wenn < 75 % der IVC reseziert werden, eine primäre Resektion oder eine Patch-Kavoplastik angewendet werden kann, aber in Fällen, in denen > 75 % des Umfangs entfernt werden, ist eine vollständige Resektion und Rekonstruktion erforderlich. 6 Für diejenigen, die eine Rekonstruktion benötigen, kann eine ringförmige Prothese aus Polytetrafluorethylen (PTFE) entsprechend angepasst und mit einer 4-0- oder 5-0-Polypropylen-Naht vernäht werden. Der Einsatz von Chemotherapie oder Strahlentherapie entweder als neoadjuvante oder adjuvante Therapie kann eine zunehmende Rolle spielen. Angesichts der Seltenheit dieser Krankheit und des Mangels an bisher verfügbaren Daten zu den Behandlungsergebnissen werden diese Modalitäten derzeit nach multidisziplinärer Diskussion auf jeden einzelnen Patienten zugeschnitten, und ihre Anwendung ist unterschiedlich.
Angesichts der Seltenheit des primären IVC-LMS gibt es nur wenige Studien, die einen nicht-operativen Ansatz unterstützen, und eine vollständige chirurgische Resektion bleibt die optimale Behandlungsstrategie. 2 In dem Bestreben, das Risiko eines Rezidivs am retroperitonealen Rand sowie der Tumoraussaat der Peritonealhöhle zum Zeitpunkt der chirurgischen Resektion zu verringern, umfasst unsere institutionelle Praxis zur Behandlung des retroperitonealen Sarkoms eine neoadjuvante Strahlentherapie, gefolgt von einer radikalen Resektion und Chemotherapie, falls dies nach Überprüfung und Besprechung der endgültigen Explantatpathologie als notwendig erachtet wird. Konkret wurde unser Patient in eine vom National Cancer Institute (NCI) gesponserte Studie (DFCI/HCC 12-100) aufgenommen, in der er über einen Zeitraum von fünf Wochen mit 63 Gray (Gy) bis zum retroperitonealen Rand und 50,4 Gy bis zum gesamten Tumorbereich mit Bleistiftstrahl-Scanning-Protonen behandelt wurde. Die Patientin vertrug dies gut, hatte einen stabilen Re-Staging-Scan und fuhr anschließend mit einer radikalen Resektion ihres retroperitonealen Sarkoms mit En-bloc-Resektion der rechten Niere, der rechten Nebenniere, der unteren Hohlvene und eines Teils der linken Nierenvene fort, wie unten beschrieben (siehe Verfahrensskizze).
Die erste Beschreibung eines primären IVC LMS erfolgte 1871 durch Perl,7 gefolgt von der ersten Resektion durch Melchior im Jahr 1928, bei der der Patient 2 Wochen postoperativ verstarb. 8 Mit Fortschritten, die eine präoperative Planung, eine Verfeinerung der Operationstechnik und -exposition sowie Verbesserungen in der Intensivpflege ermöglichen, liegt die perioperative Mortalität nach einer Resektion der IVC LMS in 30 Tagen nun bei 1,9 %. 2 Es besteht jedoch nach wie vor eine beträchtliche 30-Tage-Morbidität (24,7 %). 2 Dennoch bleibt die chirurgische Resektion die primäre Behandlungsstrategie. Bei diesem Ansatz wurde festgestellt, dass die langfristige 5-Jahres-DFS niedrig ist (6 %), während das 5-Jahres-Gesamtüberleben günstig ist (55 %). arabische Ziffer
Bis vor kurzem waren eine Reihe von Berichten in der Literatur, die sich mit IVC LMS befassten, durch kleine Stichprobengrößen begrenzt. Eine gepoolte Analyse von Wachtel et al. ermöglichte die umfassendste Studie mit 377 Patienten. 2 Zu den Faktoren, die bei der adjustierten Analyse als Ursache für ein vermindertes Gesamtüberleben identifiziert wurden, gehörten die große Tumorgröße (≥9 cm), das höhere Alter (≥55 Jahre), die Notwendigkeit einer En-bloc-Resektion, der positive Margin-Status, die adjuvante Chemotherapie und die Tumorlokalisation. Konkret werden die primären IVC-Leiomyosarkome nach dem Ausmaß der venösen Beteiligung klassifiziert und durch die Obergrenze des Tumors und den Grad der Tumorausdehnung beschrieben. Nach diesem Klassifikationssystem sind Segment-I-Tumoren infrarenal, Segment-II-Tumoren internieren und/oder suprarenal bis zu den suprahepatischen Venen, aber ohne Berücksichtigung der suprahepatischen Venen, und Segment-III-Tumoren sind solche, die sich in die suprahepatischen Venen erstrecken und eine mögliche intrakardiale Verlängerung aufweisen. Tumoren des Segments II oder des mittleren Segments sind am häufigsten und es wurde festgestellt, dass sie bessere Ergebnisse erzielen als diejenigen, die in Segment I oder Segment III auftreten. 2,9 Es wird angenommen, dass dies zum Teil auf die frühzeitige Erkennung von Tumoren in Segment II zurückzuführen ist, da diese Tumoren enger anatomisch in der Nähe mehrerer Organe liegen, was zu Schmerzen oder Obstruktion führen kann. 2 Der Tumor unseres Patienten kann am besten als Segment-II-Läsion klassifiziert werden.
Einige Bemerkungen zum operativen Verfahren bei der IVC LMS-Resektion und -Rekonstruktion bedürfen einer weiteren Erörterung. In Bezug auf die Exposition wurde in der Mehrzahl der Fälle (60%) ein abdominaler Zugang (mediane Laparotomie oder rechtssubkostaler Schnitt) verwendet, während ein thorakoabdominaler Zugang mit möglicher Sternotomie in Abhängigkeit von der unterschiedlichen Anatomie des zu resezierenden Tumors angewendet werden kann. 3 Konkret kann bei Tumoren, die sich in die retrohepatische oder suprahepatische Hohlvene erstrecken, ein totaler Leberausschluss mittels Klemmen der IVC oberhalb und unterhalb der Leber zusätzlich zum Einklemmen der Pfortader erforderlich sein. Bei Patienten mit intrakardialer Extension kann eine angemessene Exposition gerechtfertigt sein, um einen kardiopulmonalen Bypass zu ermöglichen. Im Allgemeinen tolerieren Patienten mit Tumoren, die in der infrahepatischen und pararenalen Cava isoliert wurden, wahrscheinlich eine vollständige Kreuzklemmung der IVC ohne signifikante hämodynamische Veränderungen, solange eine angemessene Vorlast durch eine angemessene intraoperative Wiederbelebung durch das Anästhesieteam sichergestellt wird. In Bezug auf die Technik wird bei Patienten mit venöser Hypertonie (proximaler venöser Druck von 30 mmHg oder mehr) eine Rekonstruktion (im Gegensatz zu Ligatur, primärer Resektion oder Kavoplastik) empfohlen, um ein postoperatives Ödem der unteren Extremitäten zu verhindern. 3 Darüber hinaus kann je nach Ausmaß des resezierten Tumors eine Reimplantation der Nieren- oder Lebervenen erforderlich sein. Derzeit gibt es keinen Standard für das postoperative Antikoagulationsmanagement, und eine Thrombozytenaggregationshemmer-Aspirin-Therapie, wie sie bei unserem Patienten angewendet wurde, der täglich mit 325 mg Aspirin entlassen wurde, ist mit einer niedrigen Rate an postoperativen Transplantatthrombosen verbunden. 10
Randomisierte kontrollierte Studien, in denen die Wirksamkeit von Chemo- oder Strahlentherapie bei der Behandlung von IVC LMS untersucht wird, werden aufgrund der Seltenheit der Erkrankung möglicherweise nie veröffentlicht. Die endgültige Pathologie unseres Patienten war bemerkenswert für ein Leiomyosarkom Grad 2/3 (yPT2bN0) mit negativen Rändern. Nach Gesprächen mit der medizinischen Onkologie entschieden wir, dass sie keine zusätzliche adjuvante Therapie benötigte. In Bezug auf die Nachsorge sollten Intervall-CT-Scans verwendet werden, um das Lokalrezidiv und die Fernmetastasierung basierend auf dem Rezidivrisiko zu bewerten. 6 Wir erhielten unseren ersten Überwachungsscan nach 3 Monaten, und er war normal. Bei Fernrezidiven wird eine chirurgische Resektion empfohlen, ebenso wie der Einsatz einer systemischen Therapie bei Patienten, die eine Operation nicht vertragen. 4
Ein verlängertes Überleben bei Patienten mit IVC LMS ist möglich und erfordert einen multidisziplinären Ansatz. Obwohl die Operation der Eckpfeiler der Behandlung bleibt, wird die Einbeziehung der medizinischen und Radioonkologie sowie mehrerer chirurgischer Subspezialitäten (z. B. chirurgische Onkologie und Transplantationschirurgie) gefördert, um die Behandlung von Patienten mit dieser seltenen Malignität optimal zu steuern und zu individualisieren.
Den Autoren liegen keine relevanten Angaben vor.
Der Patient, auf den in diesem Videoartikel Bezug genommen wird, hat seine Einverständniserklärung gegeben, gefilmt zu werden, und ist sich bewusst, dass Informationen und Bilder online veröffentlicht werden.
References
- Hollenbeck ST, Grobmyer SR, Kent KC, Brennan MF. Chirurgische Behandlung und Ergebnisse von Patienten mit primär inferiorer Hohlvene, Leiomyosarkom. J Am Coll Surg. 2003; 197(4):575-579. doi:10.1016/S1072-7515(03)00433-2.
- Wachtel H, Gupta M, Bartlett EK, et al. Ergebnisse nach Resektion von Leiomyosarkomen der unteren Hohlvene: eine gepoolte Datenanalyse von 377 Fällen. Surg Oncol. 2015; 24(1):21-27. doi:10.1016/j.suronc.2014.10.007.
- Kieffer E, Alaoui M, Piette JC, Cacoub P, Chiche L. Leiomyosarkom der unteren Hohlvene: Erfahrung in 22 Fällen. Ann Surg. 2006; 244(2):289-295. doi:10.1097/01.sla.0000229964.71743.db.
- Cananzi FCM, Mussi C, Bordoni MG, et al. Rolle der Chirurgie bei der multimodalen Behandlung des primären und rezidivierenden Leiomyosarkoms der Vena cava inferior. J Surg Oncol. 2016; 114(1):44-49. doi:10.1002/jso.24244.
- Ganeshalingam S., Rajeswaran G., Jones RL., Thway K., Moskovic E. Leiomyosarkome der unteren Hohlvene: diagnostische Merkmale in der Schnittbildgebung. Clin Radiol. 2011; 66(1):50-56. doi:10.1016/j.crad.2010.08.004.
- Dull BZ, Smith B, Tefera G, Weber S. Chirurgische Behandlung des retroperitonealen Leiomyosarkoms, das von der Vena cava inferior ausgeht. J Gastrointest Surg. 2013; 17(12):2166-2171. doi:10.1007/s11605-013-2385-0.
- Perl L, Virchow R. Ein Fall von Sarkom der Vena cava inferior. Archiv für pathologische Anatomie und Physiologie und für klinische Medicin. 1871; 53(4):378-383. doi:10.1007/BF01957198.
- Melchior E. Sarkom der Vena cava inferior. Deutsche Zeitschrift für Chirurgie. 1928; 213(1-2):135-140. doi:10.1007/BF02796714.
- Mingoli A, Cavallaro A, Sapienza P, Di Marzo L, Feldhaus RJ, Cavallari N. Internationales Register der Vena cava inferior Leiomyosarkom: Analyse einer weltweiten Serie an 218 Patienten. Antikrebs Res. 1996; 16(5B):3201-3205.
- Fiore M, Colombo C, Locati P, et al. Operationstechnik, Morbidität und Ergebnis des primären retroperitonealen Sarkoms mit Beteiligung der Vena cava inferior. Ann Surg Oncol. 2012; 19(2):511-518. doi:10.1245/s10434-011-1954-2.
Cite this article
Patel MS, Mohebali J, Vagefi PA, Haynes AB. Leiomyosarkom der unteren Hohlvene: Resektion und Rekonstruktion. J Med Insight. 2024; 2024(184). doi:10.24296/jomi/184.