来自活体供体的受者肾移植
Main Text
终末期肾病 (ESRD) 是慢性肾病 (CKD) 进展的最后阶段。CKD 有多种病因,以多种方式出现,并且以患者依赖性方式进展。尽管 CKD 存在异质性,但一旦 ESRD 随之而来,患者需要肾脏替代疗法 (RRT)。RRT 是以下三个方面之一:血液透析、腹膜透析或肾移植。其中,肾移植为患者提供了最好的生活质量、更高的生存率和治愈的机会。然而,尽管已故器官供体有所增加,但肾移植的成功率提高了结果和对所需免疫抑制的耐受性,导致器官极度短缺。因此,推动活体捐献者变得越来越重要。对于受者来说,最好的结果是活体供体的移植,因为移植物质量优越,并且无需等待和透析。本文将介绍这种情况,并讨论医生在进行肾移植时必须在术前和术中考虑的重要因素。
美国国家肾脏基金会 (National Kidney Foundation) 对慢性肾脏病 (CKD) 的定义旨在标准化该患者群体的护理方法。CKD 定义为肾脏结构或功能异常和/或肾小球滤过率 (GFR) < 60 mL/min/1.73m2 造成的肾脏损伤大于或等于 3 个月。CKD 的分期因 GFR 水平而异:I 期 GFR ≥ 90;在 II 期,GFR 为 60-89;在 III 期,GFR 为 30-59;在 IV 期,GFR 为 15-29;在 V 期(肾衰竭),GFR < 15 或透析依赖。2 在本病例报告中,我们将讨论一名终末期肾病(V 期 CKD)患者,该患者在透析开始前接受了活体相关肾移植。
该患者是一名 56 岁女性,既往有 I 型糖尿病、高血压、甲状腺功能减退、高脂血症和继发于糖尿病和高血压肾病的 ESRD 病史,她到麻省总医院接受了她姐姐的活体相关肾移植手术。
她的既往手术史对于剖宫产和左上肢 AV 瘘具有重要意义。她著名的药物包括氨氯地平、骨化三醇、左旋甲状腺素、奥美沙坦、普伐他汀、lasix 和 kayexalate。她对阿司匹林和青霉素过敏。在社交方面,患者与丈夫住在一起,并在当地的一所小学任教。她有一只接种疫苗的狗和一只作为宠物,但指出移植后她将不再照顾她的。她不喝酒,以前吸烟,有 1 包年的历史,于 1979 年戒烟。她否认使用过任何非法药物。她否认过去曾有过任何旅行史或肺结核暴露史。
术前检查发现患者为一名面貌良好的 56 岁女性。她的腹部检查记录在正常范围内,腹部柔软、未膨胀,剖宫产手术切口愈合良好。她的股动脉和踏板脉搏在双侧可触及。对于正在考虑进行肾移植的 ESRD 患者,评估下肢脉搏是否有显著外周血管疾病的证据很重要。这是为了确保最小的动脉粥样硬化疾病,其中移植的肾脏动脉将在受者的髂血管上吻合。主髂动脉系统中任何严重的外周动脉疾病 (PAD) 都可能由于远端髂股动脉夹层而影响同种异体移植物或同侧下肢的血液循环,或者它可能通过同种异体移植物从下肢循环中窃取。阿拉伯数字
一般来说,肾移植前的心脏评估包括:心电图和超声心动图。此外,对于有 CAD 病史或有显著危险因素(糖尿病、血液透析超过 1 年、左心室肥厚、年龄 > 60 岁、吸烟史、高血压或高脂血症)的住院患者,应进行负荷试验和/或冠状动脉造影。对于有排尿异常或尿路梗阻(例如 前列腺)症状或体征的患者,需要进行排尿膀胱尿路造影和完整的下尿路评估,以排除出口梗阻。3 如果患者有任何外周血管疾病史或血管检查有任何令人担忧的发现,患者应进行下肢脉搏容量记录 (PVR) 和/或腹部和骨盆 CT 扫描(无造影剂),以评估髂骨钙化。
该患者术前心电图显示无心律失常或缺血。然而,鉴于她既往史包括几种冠状动脉疾病 (CAD) 危险因素,她接受了冠状动脉造影,排除了严重的动脉粥样硬化病变。术前胸部 X 光片显示既往肉芽肿病的证据,后续胸部 CT 扫描证实了这一点,没有其他令人担忧的发现(图 1-3)。
此外,她的捐献者姐姐接受了标准的捐献者术前检查。这包括确保足够的肾功能和术后非肾功能的最小风险。还需要清除传染病和恶性肿瘤。最后,进行肾脏成像以比较肾脏的大小及其脉管系统,以确定供体手术的偏侧性。。
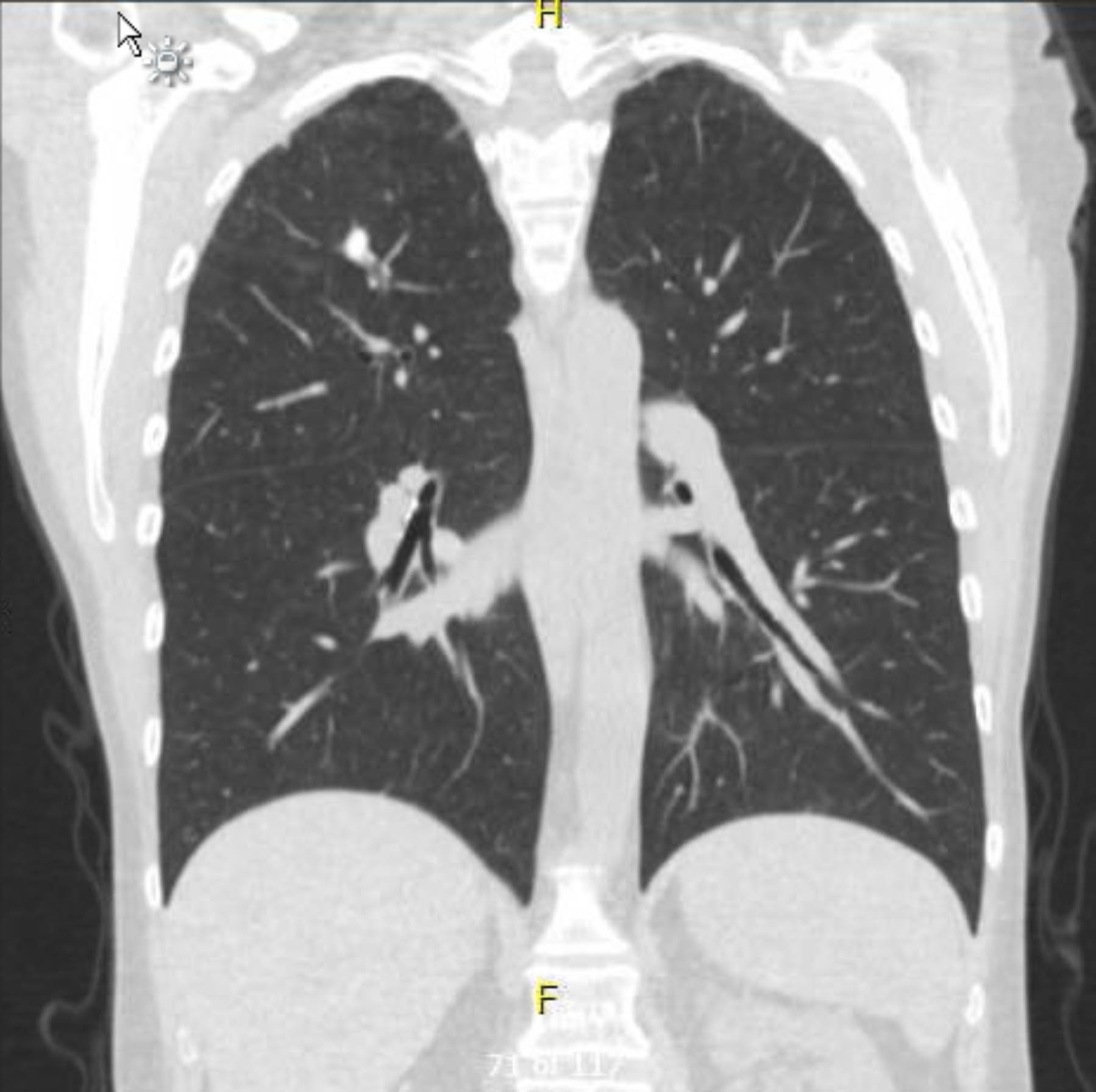
图 1.术前非对比胸部 CT。 冠状视图。右心尖肉芽肿性改变。
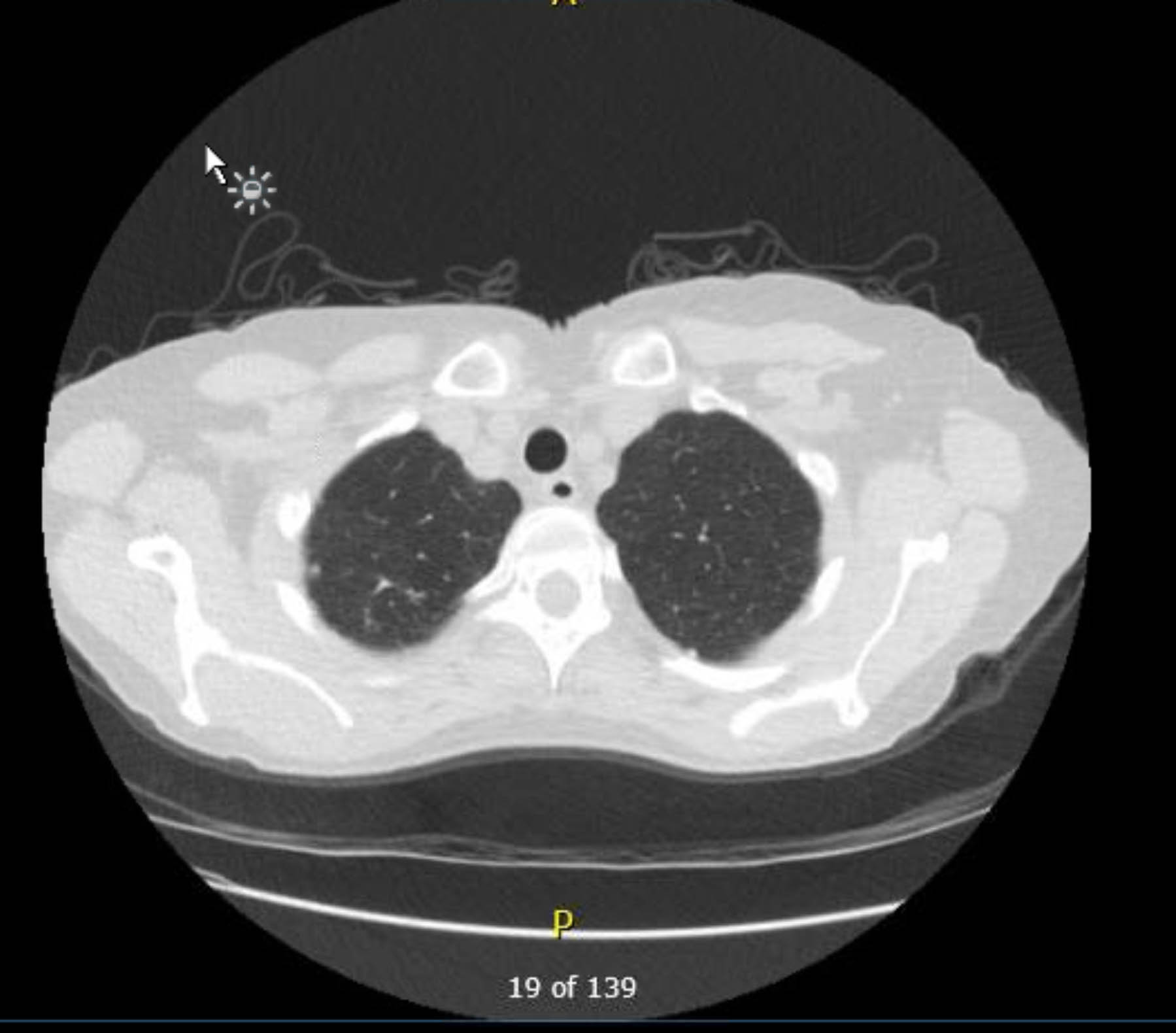
图 2.术前非对比胸部 CT。轴向视图。右心尖肉芽肿性改变。
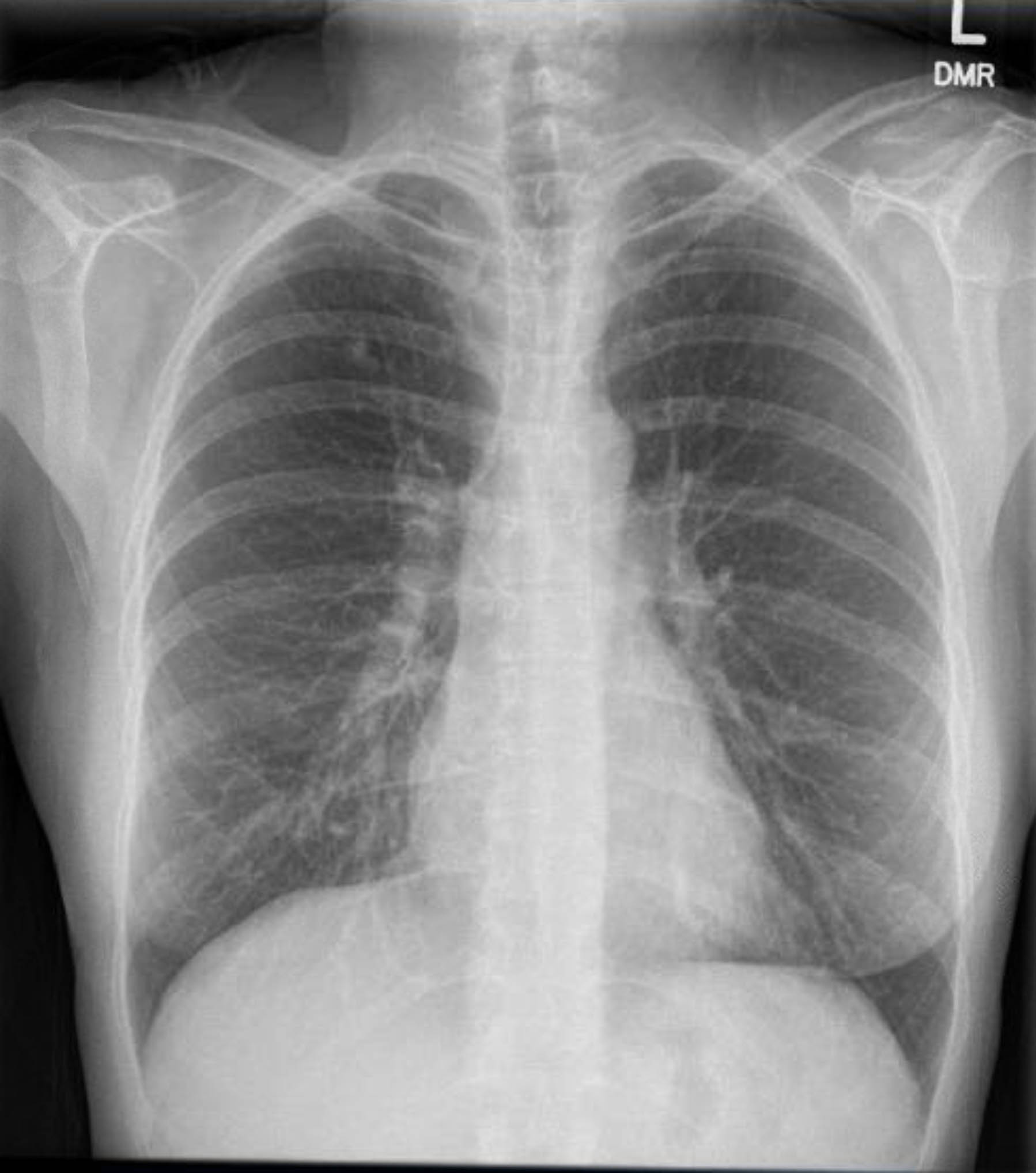
图 3.术前胸部 X 光检查。右上叶钙化肉芽肿。
ESRD 具有非常异质的表现和疾病进展。在美国,慢性肾功能衰竭的最常见原因是糖尿病,占所有肾功能衰竭的 45%。第二和第三最常见的原因分别是高血压肾病 (27%) 和慢性肾小球肾炎 (11%)。4 CKD 进展为 ESRD 需要患者接受血液透析,以帮助维持全身液体平衡和电解质、代谢物、激素和毒素的过滤。如果患者不进行透析,则必须进行肾移植,否则他们的疾病将是致命的。
ESRD 的治疗选择是透析(腹膜透析或血液透析)和/或移植。2018 年在美国,85.9% 的 ESRD 病例开始血液透析肾脏替代治疗,10.9% 从腹膜透析开始,2.9% 接受抢先肾移植。5
肾移植发生在已故或活体供体上。如果家人或朋友希望捐献但不相容,则可以选择活体捐献者配对交换(捐献者与另一位捐献者交换捐献,以便接受者获得相容的肾脏),这将交换与其预期受者不相容的捐献者,以便每个捐献者捐献一个肾脏给相容的受者。最后,非定向利他主义捐献者需要一个非常严格的过程来仔细选择捐献者,在一项研究中发现,近 60% 的非定向利他捐献者在初步评估和教育会议后退出,从而使其成为不可持续的捐助者来源。6 如果无私的捐献者完成了评估并被接受为潜在的捐献者候选人,我们的做法是让他们开始一个配对的交换链。这是通过将他们与具有不相容捐赠者的接受者匹配,然后该接受者将捐赠给其他人来完成的,依此类推。多个收件人将受益,而不是将他们与一个收件人匹配。
尽管 ESRD 有多种治疗方式,但肾移植仍然是最明确和最持久的肾脏替代疗法。它提高了生活质量,比透析更具成本效益,并且总体上提高了生存率。3 事实上,在比较移植前患者和移植后患者的死亡率时,所有年龄段的肾移植患者的预期寿命大约翻了一番。4
在已故供体肾脏和活体供体肾脏之间进行选择时,几项研究确定,鉴于缺血时间短,活体供体肾脏具有更好的移植后结果,术后移植物功能延迟的发生率较低。活体供体还为受者提供更长的肾移植功能,这可能与供体的健康有关。其他好处包括避免长时间的透析等待时间,以及及时协调供体和受体程序的能力。3 在接受肾移植透析前开始的患者中发现了最佳的术后移植物存活率。4 对于此处介绍的患者,她能够在开始血液透析之前找到活体相关供体,因此与在透析后接受已故供体肾脏或移植的患者相比,移植物存活的可能性最高。
如上所述,鉴于 ESRD 的可变表现和疾病进展的差异,有必要进行非常全面的术前评估,包括完整的病史、体格检查和适当的影像学检查。术前需要排除的肾移植绝对禁忌症包括活动性感染、恶性肿瘤、活性物质滥用和精神疾病控制不佳。3 其他重要的考虑因素包括全面的心血管和外周血管评估,因为这两者都可能使患者无法成为合适的肾脏接受者。
Emerich Ullman 于 1902 年报告了第一次肾移植尝试,但直到 1954 年约瑟夫·默里 (Joseph Murray) 绕过免疫屏障并在不使用任何免疫抑制的情况下完成了两个同卵双胞胎之间的肾移植,第一次成功的肾移植才完成。3 在同一十年中,类固醇和放疗是最早使用的免疫抑制剂,但直到 1960 年左右硫唑嘌呤 (Imuran) 的推出才开启了肾移植的新时代。在接下来的三十年里,免疫抑制不断发展,因此这些药物现在具有较低的毒性特征,并且患者耐受性更好。7
不幸的是,移植的最大挑战是有需要的人可用的器官短缺。具有讽刺意味的是,实体器官移植的成功是导致严重短缺的最主要因素;存活率和免疫抑制耐受性的提高鼓励医生和患者选择移植。1,8 需要这些器官的患者是患有 ESRD 的患者。2018 年,美国 ESRD 的患病率为 785,883 例,发病率为 131,779 例。5 肾移植等待名单上有 88,627 人,每月增加约 3,700 名患者。每年对活体和已故肾脏捐献者进行的肾移植数量都有所增加,但仍不到 30,000 例(2022 年为 25,500 例)。9 因此,等待时间的中位数为 3.6 年。10 本病例中介绍的患者是一名 56 岁的女性,她患有继发于糖尿病和高血压肾病的 ESRD,并接受了抢先性活体相关肾移植。
抢先肾移植是一种独特的情况,因为 ESRD 患者在接受移植之前尚未开始透析。在美国,只有 2.9% 的患者接受肾移植作为 ESRD 治疗的初始模式。5 在文献综述中,有几篇论文表明,与已故供体移植相比,活体捐献提供了更好的患者和同种异体移植物存活率,尤其是当活体供体移植在没有透析的情况下先发制人地进行时。6 活体供体移植减少了透析的等待时间,住院时间更短、费用更低,移植后结局总体上得到了改善。11 在透析开始前进行透析时,患者能够避免透析的并发症、透析通路程序以及与这种治疗相关的费用。已经研究了移植前透析的等待时间,并定量显示这是肾移植后移植物丢失的最大独立危险因素之一。12 与非抢先性移植相比,接受移植前透析的患者的术后结局显示移植物功能延迟率较低。13 从供体的角度来看,活体肾脏供体的生存率与非供体相似,他们患 ESRD 的风险没有显著增加。14
从手术的角度来看,整个案件中做出了几个值得进一步讨论的决定。第一个临床决定与手术暴露有关。在肾移植的历史中,曾几何时大腿上部是移植的地点。然而,这已被停止,因为它需要皮肤输尿管造口术,而皮肤输尿管造口术的上行感染风险明显更高。1956 年,Merrill 和 Murray 描述了第一例使用髂窝的移植手术。他们指出,没有选择肾窝,因为它需要同时进行肾切除术并且需要输尿管尿管吻合术,这使输尿管处于狭窄形成的高风险中。因此,得出结论,髂窝允许使用髂血管获得足够的血液供应,以及通过输尿管膀胱造口术直接将输尿管引流到膀胱中。15 肾脏通常放置在右髂窝(捐献肾脏的对侧),因为鉴于肾静脉长度增加,大多数供体肾切除术位于左侧。2 然而,在这种情况下,鉴于患者有 I 型糖尿病病史,将来可能需要胰腺移植(通常放置在右髂窝),患者接受了左髂窝移植。在患者既往手术史和血管解剖结构之前,有时考虑的最后一种方法是腹膜内入路。
该手术的下一个重要步骤是血管吻合。肾静脉最常首先吻合,通常以端对侧的方式吻合到髂外静脉,但这个位置相对于动脉吻合不同。动脉吻合术可以将供体肾动脉与受体髂总动脉、髂外动脉或内动脉连接起来,并且该程序随着时间的推移而发展。从历史上看,优先选择髂内动脉进行供体肾动脉的端到端吻合术;然而,这并未显示优于后来的肾动脉端到端入路至髂总动脉或髂外动脉。因此,今天最常见的吻合术是在供体肾动脉和受体髂外动脉的一侧之间,因为该血管在骨盆中没有分支,并且靠近膀胱,这有助于建立输尿管膀胱造口术,而不会影响远端输尿管血液供应。如果肾脏是从已故供体那里恢复的,则供体主动脉也会被恢复,并且可以制成 Carrel 补片并用于吻合髂总动脉或髂外动脉。2 在获取供体肾脏时,一个重要的考虑因素是肾动脉的数量。当供体是已故供体时,可以保留源自供体主动脉的所有肾动脉,包括它们在 Carrel 补片中的起源。然而,在活体供体中,这是不可行的,多条动脉要么单独吻合,要么更常见的是,在植入肾脏之前将它们吻合在一起形成一条动脉。如果有小的副动脉供血于肾脏的上极,它们通常会被结扎。下极动脉更有可能供应输尿管,因此不太可能被结扎,因为输尿管的血液供应需要达到最佳状态。
最后要考虑的吻合是供体输尿管到受体膀胱吻合的构造。在肾移植的这些年里,输尿管膀胱造口术有几种方法,即将供体输尿管植入受者膀胱。最初,使用最广泛的吻合术是 Leadbetter-Politano 技术,这是一种膀胱内技术,需要通过前膀胱造口术暴露,以允许输尿管粘膜下隧道并将新腔口放置在靠近解剖位置的位置。16 由 Lich 和 Gregoir 开发的较新的膀胱外方法,今天被大多数移植中心采用,也是本例中使用的方法。在膀胱穹顶处创建一个小的膀胱切开术,并将远端供体输尿管与膀胱粘膜吻合。然后在输尿管上闭合浆膜层。2 最后一种方法是输尿管脊髓造口术,即受者输尿管与供体肾盂最低部分之间的吻合术。这种方法不常使用,因为它通常需要同侧自体肾切除术,并且已被证明具有更高的输尿管渗漏率。阿拉伯数字
在这种情况下,最后一个考虑因素 - 也是肾移植文献中仍然存在争议的 - 是输尿管支架的使用。几项研究调查了输尿管支架的风险和益处。在肾移植后的泌尿系统并发症中,大多数起源于膀胱输尿管吻合。输尿管支架的治疗益处在于,它简化了水密输尿管粘膜与膀胱粘膜吻合的创建,并减少了解剖扭结。然而,与使用支架相关的重大风险包括复发性尿路感染和最终的移植物丢失。总体而言,文献无法充分评估通用支架置入术的发病率和成本,因此,这种做法仍然是手术时外科医生之间的评估和决定。17 在这个案例中,主治外科医生发现供体肾脏有一个额外的肾盂,并且在完成输尿管吻合之前,肾盂似乎充盈。因此,放置了一个 4.7 Fr. 双 J 支架。
总之,本病例突出了一例活体相关的先发制人肾移植。所介绍的患者很幸运,有一位活体捐献者,他不仅愿意捐献,而且被认为也适合捐献。活体捐献的结果优于已故捐献,尤其是在透析开始前进行时,就像该患者的情况一样。随着肾移植等待名单的不断增加,活体捐献的重要性将继续增加。因此,美国各地的肾移植中心必须鼓励活体捐献。一个有前途的进展是腹腔镜供体肾切除术的传播。这项技术现在用于超过 90% 的供体肾切除术,可缩短活体供体的恢复时间。11 这是需要继续激励捐献(包括减少的和活体的)的工作的一个例子,以帮助解决 ESRD 患者的器官短缺问题。
夹紧髂血管时使用 Fogarty Hydragrip 夹。Edward Lifesciences 为 Fogarty Clamp 提供 Hydragrip 插件。这些创伤较小的夹子被认为可以降低夹层的风险。在进行动脉吻合术时,泰利福医疗的主动脉打孔器用于动脉切开术。
没有。
MGH 移植研究员 Corey Eymard 与 Nahel Elias 博士一起进行了这项手术。
从参与编写本病例报告和拍摄的患者和提供者那里获得了使用临床病史、放射学和术中视频的同意。
References
- 医疗保健改进研究所。器官捐献更新:成功带来新的挑战。见: http://www.ihi.org/resources/Pages/ImprovementStories/OrganDonationUpdateSuccessBringsNewChallenges.aspx
- Pereira BJG, Sayegh MH, Blake P. 慢性肾病、透析和移植。第 2 版。宾夕法尼亚州费城:Elsevier Saunders;2005.
- 胡马尔 A,邓恩 DL。第 11 章:移植。在:施瓦茨的外科原理。9e 版。纽约州纽约市:麦格劳-希尔;2010.
- 潘趣,JD。第 45 章:器官移植。在:当前的诊断和治疗。13e ed. 16,纽约,纽约:麦格劳-希尔;2006.16. Monga M. 输尿管镜检查。纽约:Humana Press,2013 年。
- 美国肾脏数据系统。2020 年 USRDS 年度数据报告:美国肾脏疾病流行病学。美国国立卫生研究院,国家糖尿病、消化和肾脏疾病研究所,马里兰州贝塞斯达,2020 年。
- Davis CL, Delmonico FL. 活体供体肾移植:活体供体当前做法的回顾。 J Am Soc 肾素。2005 年 7 月;16(7):2098-110. doi:10.1681/ASN.2004100824.
- Murray JE、Merrill JP、Harrison JH、Wilson RE、Dammin GJ。通过免疫抑制药物治疗延长人肾同源移植物的存活率。 N Engl J Med.1963 年 6 月 13;268:1315-23。 doi:10.1056/NEJM196306132682401.
- Klein AS、Messersmith EE、Ratner LE、Kochik R、Baliga PK、Ojo AO。1999-2008 年美国器官捐献和利用。 Am J 移植。2010 年 4 月;10(4 第 2 部分):973-86。 doi:10.1111/j.1600-6143.2009.03008.x.
- 器官获取和移植网络。数据。见: https://optn.transplant.hrsa.gov/data。
- 器官捐献和移植统计。国家肾脏基金会。2016. 可在: https://www.kidney.org/news/newsroom/factsheets/Organ-Donation-and-Transplantation-Stats。
- Axelrod DA、McCullough KP、Brewer ED、Becker BN、Segev DL、Rao PS. 1999-2008 年美国肾脏和胰腺移植:活体捐献不断变化的面貌。 Am J 移植。2010 年 4 月;10(4 第 2 部分):987-1002。 doi:10.1111/j.1600-6143.2010.03022.x.
- Meier-Kriesche 胡, Kaplan B. 透析等待时间是肾移植结果的最强可改变风险因素:配对供体肾脏分析。移植。2002 年 11 月 27 日;74(10):1377-81. doi:10.1097/00007890-200211270-00005.
- Kasiske BL、Snyder JJ、Matas AJ、Ellison MD、Gill JS、Kausz AT。抢先式肾移植:优点和优点。 J Am Soc 肾素。2002 年 5 月;13(5):1358-64. doi:10.1097/01.asn.0000013295.11876.c9.
- Ibrahim HN、Foley R、Tan L 等人。肾脏捐献的长期后果。 N Engl J Med.2009 年 1 月 29 日;360(5):459-69. doi:10.1056/NEJMoa0804883.
- Merrill JP、Murray JE、Harrison JH、Guild WR。同卵双胞胎之间成功进行人肾同源移植。 J Am Med 协会。1956 年 1 月 28 日;160(4):277-82. doi:10.1001/jama.1956.02960390027008.
- 蒙加 M. 输尿管镜检查。纽约:Humana Press,2013 年。
- Wilson CH, Bhatti AA, Rix DA, Manas DM. 肾移植受者的常规术中支架置入术。 移植。2005 年 10 月 15 日;80(7):877-82. doi:10.1097/01.tp.0000181197.21706.fa.
- Aravindan N, Shaw A. 呋塞米输注对急性肾缺血/再灌注中肾血流动力学和血管生成基因表达的影响。 任失败。2006;28(1):25-35. doi:10.1080/08860220500461229.
- Siedlecki A,爱尔兰 W,布伦南 DC。肾移植中的移植物功能延迟。 Am J 移植。2011 年 11 月;11(11):2279-96. doi:10.1111/j.1600-6143.2011.03754.x.
Cite this article
Westfal ML, Elias N. 来自活体供体的受体肾移植。 J Med Insight. 2023;2023(171). doi:10.24296/jomi/171.

