Transplante de rim receptor de um doador vivo
Main Text
Table of Contents
A doença renal terminal (DRT) é o estágio final na progressão da doença renal crônica (DRC). A DRC tem uma infinidade de etiologias, apresenta-se de várias maneiras e evolui de maneira dependente do paciente. Apesar da heterogeneidade da DRC, uma vez que a DRT ocorre, os pacientes necessitam de Terapia Renal Substitutiva (TRS). A TRS é uma das três pontas: hemodiálise, diálise peritoneal ou transplante renal. Destes, o transplante renal proporciona ao paciente a melhor qualidade de vida, uma sobrevida melhorada e uma oportunidade de cura. No entanto, o sucesso do transplante renal com melhores resultados e tolerância à imunossupressão necessária levou a uma extrema escassez de órgãos, apesar do aumento de doadores de órgãos falecidos. Como resultado, a pressão por doadores vivos tornou-se cada vez mais importante. Para os receptores, os melhores resultados são com transplantes de um doador vivo devido à qualidade superior do enxerto e à eliminação da necessidade de espera e diálise. Este artigo apresentará esse caso e discutirá as considerações importantes que um médico deve fazer no pré e intraoperatório ao realizar transplantes renais.
A definição de doença renal crônica (DRC) da National Kidney Foundation foi estabelecida com o objetivo de padronizar a abordagem do cuidado a essa população de pacientes. A DRC é definida como lesão renal por mais ou igual a 3 meses por anormalidades estruturais ou funcionais do rim e/ou taxa de filtração glomerular (TFG) de < 60 mL/min/1,73m2. Os estágios da DRC variam de acordo com o nível de TFG: no estágio I, a TFG é ≥ 90; no estágio II, a TFG é de 60 a 89; no estágio III, a TFG é de 30 a 59; no estágio IV, a TFG é de 15 a 29; e no estágio V (insuficiência renal), a TFG é < 15 ou dependência de diálise. 2 Neste relato de caso, discutiremos um paciente com doença renal terminal (DRC estágio V) que foi submetido a transplante renal vivo antes do início da diálise.
Esta paciente é uma mulher de 56 anos com história médica pregressa de diabetes mellitus tipo I, hipertensão, hipotireoidismo, hiperlipidemia e DRT secundária a nefropatias diabéticas e hipertensivas que se apresentou ao Hospital Geral de Massachusetts para um transplante de rim relacionado à vida de sua irmã.
Sua história cirúrgica pregressa é significativa para uma cesariana e fístula AV do membro superior esquerdo. Seus medicamentos notáveis incluem amlodipina, calcitriol, levotiroxina, olmesartan, pravastatina, lasix e kayexalato. Ela é alérgica à aspirina e à penicilina. Socialmente, a paciente mora com o marido e leciona em uma escola primária local. Ela tem um cachorro vacinado e uma tartaruga como animais de estimação, mas observa que não cuidará mais de sua tartaruga após o transplante. Ela não bebe álcool e era uma ex-fumante com uma história de 1 maço-ano, parando em 1979. Ela nega qualquer uso de drogas ilícitas. Ela nega qualquer viagem recente ou exposição à tuberculose em seu passado.
No exame pré-operatório, observou-se que a paciente era uma mulher de 56 anos de boa aparência. Seu exame abdominal foi observado dentro dos limites normais, com um abdômen mole e não distendido e uma incisão cirúrgica bem cicatrizada de sua cesariana. Seus pulsos femoral e pedioso eram palpáveis bilateralmente. Em um paciente com DRT que está sendo considerado para transplante renal, é importante avaliar os pulsos dos membros inferiores quanto a evidências de doença vascular periférica significativa. Isso é para garantir o mínimo de doença aterosclerótica, onde a artéria do rim transplantado será anastomosada nos vasos ilíacos do receptor. Qualquer doença arterial periférica (DAP) significativa no sistema aorto-ilíaco pode comprometer a circulação para o aloenxerto ou para a extremidade inferior ipsilateral devido à dissecção nas artérias iliofemorais distalmente, ou pode roubar a circulação da extremidade inferior pelo aloenxerto. algarismo
Em geral, a avaliação cardíaca antes do transplante renal inclui: eletrocardiograma e ecocardiografia. Além disso, um teste ergométrico e/ou angiografia coronariana é realizado para pacientes hospitalizados com história de DAC ou fatores de risco significativos (diabetes mellitus, hemodiálise há mais de um ano, hipertrofia ventricular esquerda, idade de > 60 anos, história de tabagismo, hipertensão ou hiperlipidemia). Em pacientes com sintomas ou sinais de anormalidades miccionais ou obstrução urinária (por exemplo, prostático), é necessário um cistoretrograma miccional e uma avaliação completa do trato urinário inferior para descartar obstrução da saída. 3 Se o paciente tiver algum histórico de doença vascular periférica ou qualquer achado preocupante no exame vascular, o paciente deve ser submetido a registros de volume de pulso (RVPs) dos membros inferiores e/ou tomografia computadorizada do abdome e pelve (sem contraste) para avaliar calcificações ilíacas.
Este paciente foi submetido a eletrocardiograma pré-operatório que não mostrou arritmia ou isquemia. No entanto, como sua história médica pregressa incluía vários fatores de risco para doença arterial coronariana (DAC), ela foi submetida a angiografia coronariana que excluiu lesões ateroscleróticas graves. Uma radiografia de tórax pré-operatória mostrou evidência de doença granulomatosa prévia, e uma tomografia computadorizada de tórax de acompanhamento confirmou isso sem outros achados preocupantes (Figuras 1–3).
Além disso, sua irmã doadora foi submetida ao exame pré-operatório padrão do doador. Isso inclui garantir a função renal adequada e o risco mínimo de ser unineférico no pós-operatório. Doenças infecciosas e eliminação de malignidade também são necessárias. Finalmente, exames de imagem renal para comparar o tamanho dos rins e sua vasculatura foram realizados para determinar a lateralidade do procedimento do doador. .
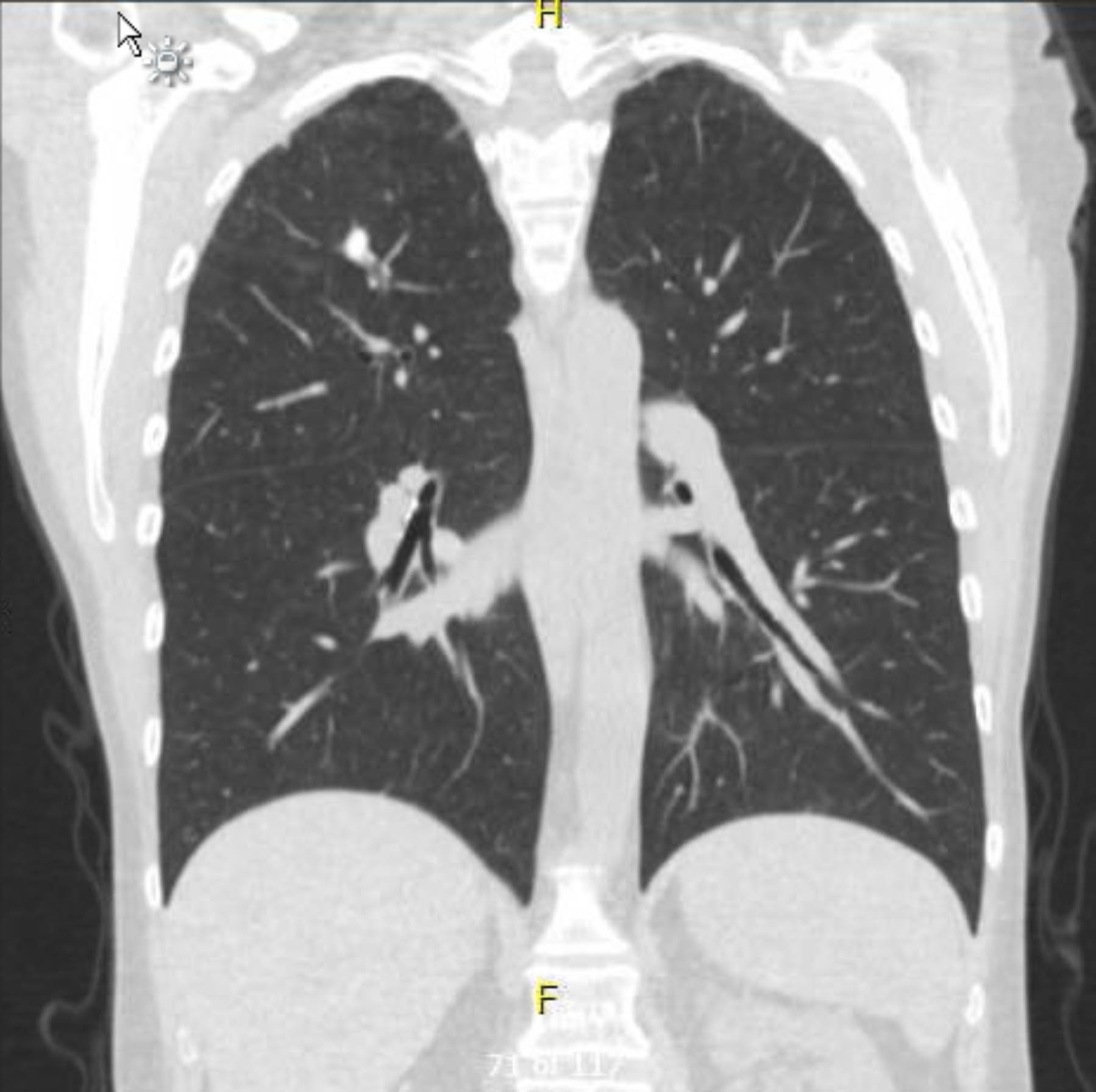
Figura 1. TC de tórax pré-operatória sem contraste. Visão coronal. Alterações granulomatosas no ápice direito.
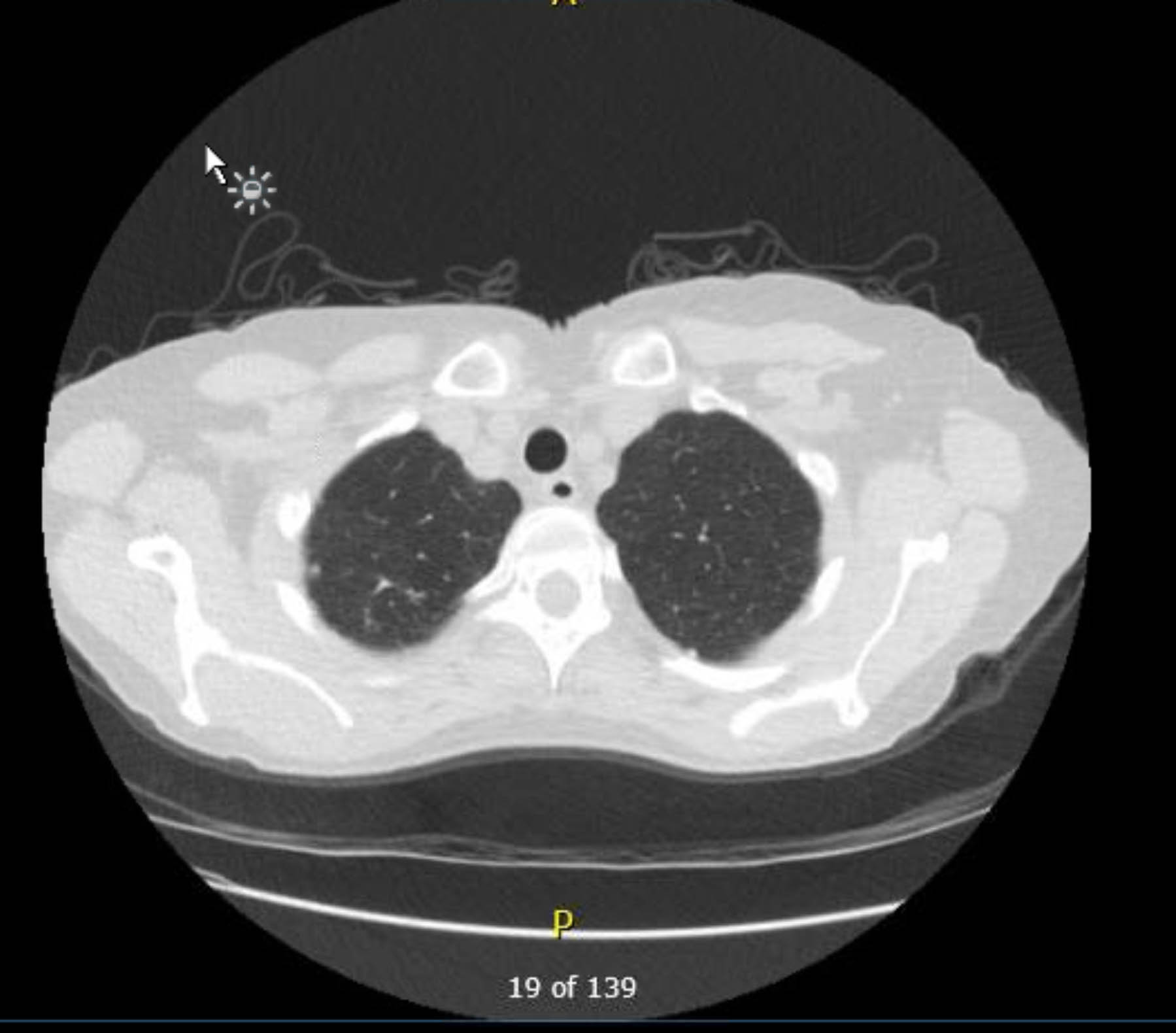
Figura 2. TC de tórax pré-operatória sem contraste. Vista axial. Alterações granulomatosas no ápice direito.
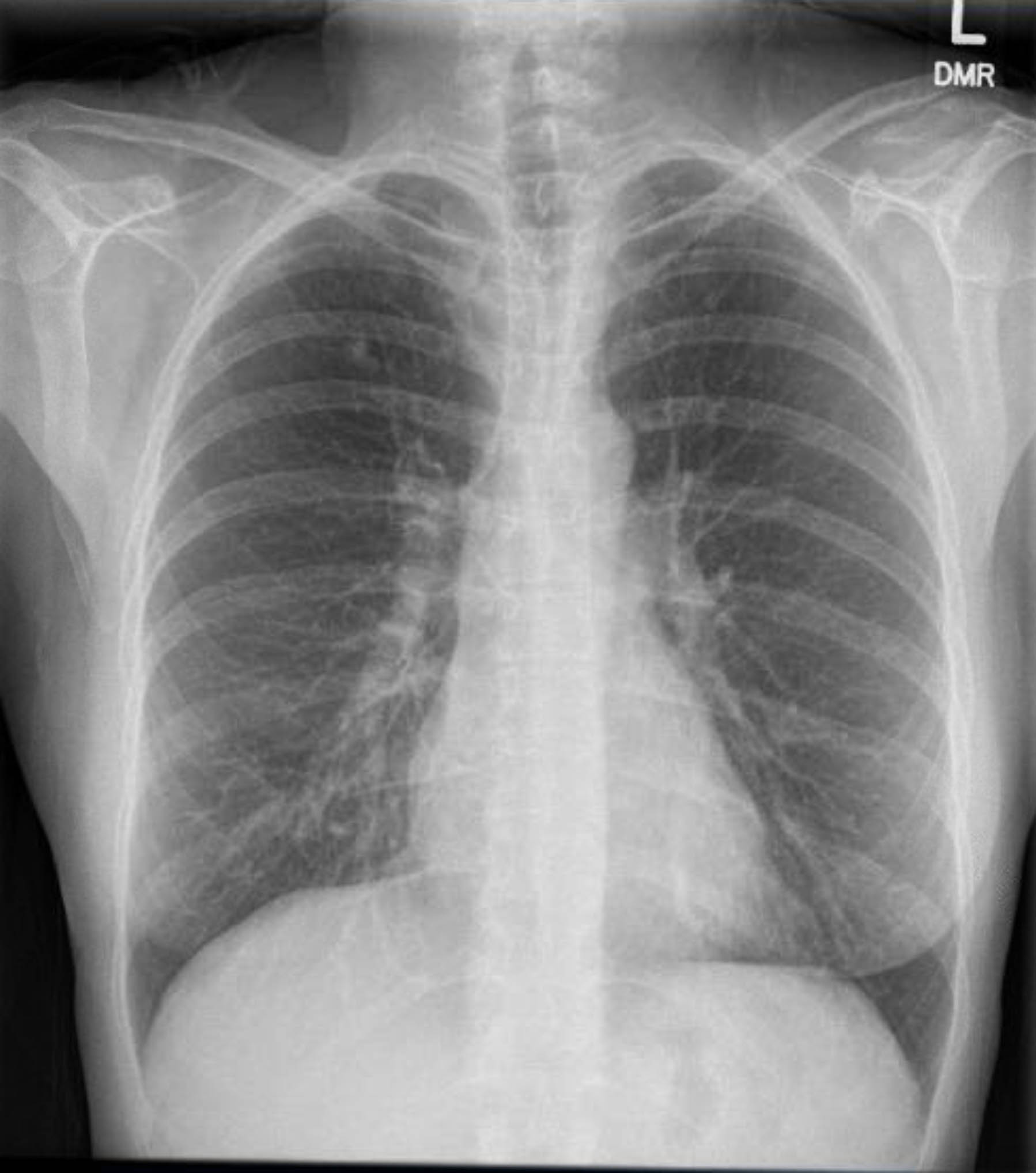
Figura 3. Radiografia de tórax pré-operatória. Granulomas calcificados no lobo superior direito.
A DRCT tem uma apresentação e progressão da doença muito heterogêneas. Nos Estados Unidos, a causa mais comum de insuficiência renal crônica é o diabetes mellitus, que representa 45% de toda a insuficiência renal. A segunda e a terceira causas mais comuns são nefropatia hipertensiva (27%) e glomerulonefrite crônica (11%), respectivamente. 4 A progressão da DRC para DRT requer que o paciente seja submetido a hemodiálise para auxiliar no equilíbrio de fluidos de corpo inteiro e na filtração de eletrólitos, metabólitos, hormônios e toxinas. Se o paciente não for submetido a diálise, ele deve ser submetido a transplante renal ou sua doença será fatal.
As opções de tratamento para DRCT são diálise (diálise peritoneal ou hemodiálise) e/ou transplante. Nos Estados Unidos, em 2018, 85,9% de todos os casos incidentes de DRCT iniciaram terapia renal substitutiva com hemodiálise, 10,9% iniciaram diálise peritoneal e 2,9% receberam transplante renal preventivo. 5
O transplante renal ocorre de um doador falecido ou vivo. Se um membro da família ou amigo deseja doar, mas é incompatível, a troca de doadores vivos pareados (onde um doador troca sua doação com outro doador para que os receptores recebam rins compatíveis) pode ser uma opção, que trocaria doadores incompatíveis com seus receptores pretendidos para que, em vez disso, cada doador doe um rim para um receptor compatível. Finalmente, os doadores altruístas não direcionados exigem um processo muito rigoroso para selecionar cuidadosamente um doador e, em um estudo, descobriu-se que quase 60% dos doadores altruístas não direcionados desistiram após a avaliação inicial e a sessão de educação, tornando-se uma fonte não sustentável de doadores. 6 Se os doadores altruístas concluírem a avaliação e forem aceitos como potenciais candidatos a doadores, é nossa prática fazer com que eles iniciem uma cadeia de troca pareada. Isso é feito combinando-os com um receptor que tenha um doador incompatível, que então doará para outra pessoa e assim por diante. Vários destinatários se beneficiarão em vez de combiná-los com um destinatário.
Apesar de uma variedade de modalidades de tratamento para DRT, o transplante renal continua sendo a terapia renal substitutiva mais definitiva e durável. Oferece uma melhor qualidade de vida, é mais econômica do que a diálise e tem uma sobrevida geral melhorada. 3 De fato, a expectativa de vida aproximadamente dobra com o transplante renal em todas as faixas etárias ao comparar a mortalidade de pacientes pré-transplante com pacientes pós-transplante. 4
Ao escolher entre um rim de doador falecido e um de doador vivo, vários estudos determinaram que os rins de doadores vivos têm melhores resultados pós-transplante com menor incidência de função tardia do enxerto no pós-operatório, devido ao curto tempo isquêmico. Os doadores vivos também fornecem funções de enxerto renal mais longas no receptor, provavelmente relacionadas à saúde do doador. Outros benefícios incluem evitar o tempo de espera prolongado na diálise e a capacidade de coordenar os procedimentos do doador e do receptor em tempo hábil. 3 A melhor sobrevida pós-operatória do enxerto foi encontrada em pacientes que receberam transplante renal no início da pré-diálise. 4 Para a paciente aqui apresentada, ela foi capaz de encontrar um doador vivo antes de iniciar a hemodiálise, portanto, tem a maior probabilidade de sobrevivência do enxerto quando comparada aos pacientes que recebem um rim de doador falecido ou transplante após estarem em diálise.
Como mencionado acima, dada a apresentação variável da DRCT e as diferenças na progressão da doença, é necessária uma avaliação pré-operatória muito completa com história completa, exame físico e imagem apropriada. As contraindicações absolutas ao transplante renal que precisam ser descartadas no pré-operatório incluem infecção ativa, malignidade, abuso de substâncias ativas e doença psiquiátrica mal controlada. 3 Outras considerações importantes incluem uma avaliação cardiovascular e vascular periférica completa, pois ambas podem impedir que o paciente seja um receptor renal adequado.
Emerich Ullman relatou a primeira tentativa de transplante renal em 1902, mas o primeiro transplante renal bem-sucedido não foi concluído até 1954, quando Joseph Murray contornou a barreira imunológica e completou um transplante de rim entre dois gêmeos idênticos sem usar qualquer imunossupressão. 3 Na mesma década, os esteróides e a radiação foram os primeiros imunossupressores usados, mas foi a introdução da azatioprina (Imuran) por volta de 1960 que deu início a uma nova era de transplante renal. Ao longo das três décadas seguintes, a imunossupressão continuou a evoluir de tal forma que esses medicamentos agora têm um perfil de toxicidade mais baixo e são mais bem tolerados pelos pacientes. 7
Infelizmente, o maior desafio para o transplante é a escassez de órgãos disponíveis para os necessitados. O sucesso do transplante de órgãos sólidos é ironicamente o único fator mais responsável pela escassez crítica; A melhora das taxas de sobrevida e a tolerância à imunossupressão incentivaram médicos e pacientes a optarem pelo transplante. 1,8 Os pacientes que necessitam desses órgãos são aqueles que sofrem de DRCT. Em 2018, a prevalência de DRT nos Estados Unidos foi de 785.883, com uma incidência de 131.779. 5 Existem 88.627 pessoas na lista de espera para transplante renal, com aproximadamente 3.700 pacientes sendo adicionados a cada mês. O número de transplantes renais realizados anualmente de doadores de rim vivos e falecidos aumentou, mas permanece inferior a 30.000 (25.500 em 2022). 9 Assim, o tempo médio de espera é de 3,6 anos. 10 A paciente apresentada neste caso é uma mulher de 56 anos que sofria de DRCT secundária a nefropatias diabéticas e hipertensivas e foi submetida a um transplante renal preemptivo relacionado à vida.
O transplante renal preventivo é uma situação única, pois o paciente com DRT ainda não iniciou a diálise antes de ser submetido ao transplante. Apenas 2.9% dos pacientes nos EUA foram submetidos a transplante renal como modo inicial de terapia com DRT. 5 Em revisão da literatura, existem vários trabalhos que sugerem que a doação em vida proporciona melhor sobrevida do paciente e do aloenxerto quando comparada ao transplante de doador falecido, especialmente quando o transplante de doador vivo é realizado preventivamente sem diálise. 6 O transplante de doador vivo reduz o tempo de espera na diálise, tem internações hospitalares mais curtas e menos dispendiosas e melhora geral os resultados pós-transplante. 11 Quando feito antes do início da diálise, o paciente é capaz de evitar a morbidade da diálise, os procedimentos de acesso à diálise e o custo associado a esse tratamento. O tempo de espera em diálise antes do transplante foi estudado e demonstrou ser quantitativamente um dos maiores fatores de risco independentes para perda do enxerto após transplante renal. 12 Os resultados pós-operatórios de pacientes que recebem um transplante pré-dialítico mostram taxas mais baixas de função tardia do enxerto quando comparados aos transplantes não preemptivos. 13 Do ponto de vista do doador, os doadores vivos de rim têm sobrevida semelhante à dos não doadores, e seu risco de DRCT não é significativamente aumentado. 14
Do ponto de vista cirúrgico, várias decisões foram tomadas ao longo deste caso que merecem uma discussão mais aprofundada. A primeira decisão clínica foi relacionada à exposição cirúrgica. Na história do transplante renal, houve um tempo em que a parte superior da coxa era o local do transplante. No entanto, isso foi descontinuado porque requer uma ureterostomia da pele, que tem um risco significativamente maior de infecção ascendente. Em 1956, Merrill e Murray descreveram o primeiro transplante usando a fossa ilíaca. Eles observaram que a fossa renal não foi escolhida porque requer nefrectomia simultânea e necessita de uma anastomose ureteriteral, o que coloca o ureter em alto risco de formação de estenose. Como resultado, concluiu-se que a fossa ilíaca permitiu o acesso ao suprimento sanguíneo adequado usando os vasos ilíacos, bem como uma drenagem ureteral acessível para a bexiga diretamente via ureteroneocistostomia. 15 Os rins são normalmente colocados na fossa ilíaca direita (o lado contralateral do rim doado) porque a maioria das nefrectomias de doadores é do lado esquerdo, devido ao aumento do comprimento da veia renal. 2 No entanto, nesta apresentação de caso, a paciente foi submetida a transplante para a fossa ilíaca esquerda, uma vez que tem história de diabetes mellitus tipo I e pode necessitar de transplante de pâncreas no futuro (que geralmente são colocados na fossa ilíaca direita). A última abordagem que às vezes é considerada, dependendo da história cirúrgica prévia e da anatomia vascular do paciente, é uma abordagem intraperitoneal.
O próximo passo significativo nesta operação são as anastomoses vasculares. A veia renal é mais frequentemente anastomosada primeiro e geralmente à veia ilíaca externa de forma término-lateral, mas essa localização varia em relação à anastomose arterial. A anastomose arterial pode conectar a artéria renal doadora com a artéria ilíaca comum, externa ou interna do receptor, e o procedimento evoluiu ao longo do tempo. Historicamente, o ilíaco interno foi preferencialmente selecionado para uma anastomose término-terminal à artéria renal doadora; no entanto, isso não se mostrou superior à abordagem posterior da artéria renal término-lateral à artéria ilíaca comum ou externa. Assim, a anastomose mais comum realizada hoje é entre a artéria renal doadora e o lado da artéria ilíaca externa receptora, pois esse vaso não possui ramos na pelve e está próximo à bexiga, o que facilita a criação da ureteronocistostomia sem comprometer o suprimento sanguíneo ureteral distal. Se o rim foi recuperado de um doador falecido, a aorta do doador também é recuperada e pode ser transformada em um adesivo de Carrel e usada para a anastomose com a artéria ilíaca comum ou externa. 2 Durante a obtenção do rim do doador, uma consideração importante é o número de artérias renais. Quando o doador é um doador falecido, é possível preservar todas as artérias renais originadas da aorta do doador, incluindo suas origens no adesivo de Carrel. No entanto, em um doador vivo, isso não é viável e várias artérias são anastomosadas separadamente ou, mais comumente, são anastomosadas juntas em uma artéria antes de implantar o rim. Se houver pequenas artérias acessórias que suprem o pólo superior do rim, elas geralmente estão ligadas. As artérias do pólo inferior são mais propensas a fornecer o ureter e, consequentemente, menos propensas a serem ligadas, pois o suprimento de sangue para o ureter precisa ser ideal.
A anastomose final a ser considerada é a construção da anastomose ureteral do doador para a bexiga receptora. Ao longo dos anos de transplante renal, houve várias abordagens para a ureteroneocistostomia, a implantação do ureter doador na bexiga receptora. Inicialmente, a anastomose mais utilizada foi a técnica de Leadbetter-Politano, uma técnica intravesical que requer exposição por meio de cistostomia anterior para permitir a tunelização submucosa do ureter e a colocação do neoorifício em um local quase anatômico. 16 A abordagem extravesical mais recente, desenvolvida por Lich e Gregoir, é empregada pela maioria dos centros de transplante hoje e é a abordagem usada neste caso. Uma única pequena cistotomia é criada na cúpula da bexiga e o ureter doador distal é anastomosado à mucosa da bexiga. Uma camada seromuscluar é então fechada sobre o ureter. 2 O método final é a ureteropielostomia, uma anastomose entre o ureter receptor e a porção mais baixa da pelve renal do doador. Essa abordagem não é usada com frequência porque geralmente requer uma nefrectomia nativa ipsilateral e demonstrou ter uma taxa de vazamento ureteral mais alta. algarismo
A consideração final neste caso - e que permanece controversa na literatura de transplante renal - é o uso de um stent ureteral. Vários estudos investigaram os riscos e benefícios dos stents ureterais. Das complicações urológicas após o transplante renal, a maioria se origina da anastomose vesicoureteral. O benefício terapêutico de um stent ureteral é que ele simplifica a criação de uma mucosa ureteral estanque à anastomose da mucosa da bexiga e reduz a torção anatômica. No entanto, os riscos significativos associados ao uso de um stent incluem infecções recorrentes do trato urinário e eventual perda do enxerto. No geral, a literatura não foi capaz de avaliar adequadamente a morbidade e o custo do implante universal de stent e, portanto, essa prática continua sendo uma avaliação e decisão de cirurgião para cirurgião no momento da cirurgia. 17 Nesse caso, o cirurgião assistente descobriu que o rim doador tinha uma pelve extra renal e, antes de completar a anastomose ureteral, parecia haver uma plenitude da pelve renal. Consequentemente, foi colocado um stent duplo J de 4,7 Fr.
Em resumo, este caso destaca um transplante renal preventivo relacionado à vida. O paciente apresentado teve a sorte de ter um doador vivo que não apenas estava disposto a doar, mas também foi considerado adequado para doação. Os resultados da doação em vida são superiores aos da doação de falecidos, principalmente quando realizada antes do início da diálise, como foi o caso deste paciente. À medida que a lista de espera para transplante de rim continua a crescer, a importância da doação em vida continuará a aumentar. Portanto, é imperativo que os centros de transplante renal nos Estados Unidos incentivem a doação em vida. Um desenvolvimento promissor é a disseminação de nefrectomias laparoscópicas de doadores. Essa técnica, agora usada em mais de 90% das nefrectomias de doadores, reduz o tempo de recuperação de doadores vivos. 11 Este é um exemplo do trabalho que precisa continuar a incentivar a doação - tanto diminuída quanto viva - para ajudar a combater a escassez de órgãos para aqueles com DRT.
As pinças Fogarty Hydragrip foram usadas ao pinçar os vasos ilíacos. A Edward Lifesciences fornece as pastilhas Hydragrip para o grampo Fogarty. Acredita-se que esses grampos menos traumáticos diminuam o risco de dissecção. Ao realizar a anastomose arterial, um punção aórtica da Teleflex Medical é usado para a arteriotomia.
Nenhum.
Corey Eymard, MGH Transplant Fellow realizou este procedimento com o Dr. Nahel Elias.
O consentimento para o uso da história clínica, radiologia e vídeo intraoperatório foi obtido do paciente e dos profissionais envolvidos na compilação deste relato de caso e filmagem.
References
- Instituto de Melhoria da Saúde. Atualização sobre doação de órgãos: o sucesso traz novos desafios. Disponível em: http://www.ihi.org/resources/Pages/ImprovementStories/OrganDonationUpdateSuccessBringsNewChallenges.aspx
- Pereira BJG, Sayegh MH, Blake P. Doença renal crônica, diálise e transplante. 2ª ed. Filadélfia, PA: Elsevier Saunders; 2005.
- Humar A, Dunn DL. Capítulo 11: Transplante. In: Princípios de Cirurgia de Schwartz. 9ª ed. Nova York, NY: McGraw-Hill; 2010.
- Soco, JD. Capítulo 45: Transplante de Órgãos. In: Diagnóstico e Tratamento Atuais. 13ª ed. 16, Nova York, NY: McGraw-Hill; 2006.16. Monga M. Ureteroscopia. Nova Iorque: Humana Press, 2013.
- Sistema de Dados Renais dos Estados Unidos. Relatório Anual de Dados do USRDS de 2020: Epidemiologia da doença renal nos Estados Unidos. Institutos Nacionais de Saúde, Instituto Nacional de Diabetes e Doenças Digestivas e Renais, Bethesda, MD, 2020.
- Transplante renal de doador vivo: uma revisão das práticas atuais para o doador vivo. J Am Soc Nefrol. Julho de 2005; 16(7):2098-110. DOI:10.1681/ASN.2004100824.
- Murray JE, Merrill JP, Harrison JH, Wilson RE, Dammin GJ. Sobrevida prolongada de homoenxertos de rim humano por terapia medicamentosa imunossupressora. N Engl J Med. 13 de junho de 1963;268:1315-23. DOI:10.1056/NEJM196306132682401.
- Klein AS, Messersmith EE, Ratner LE, Kochik R, Baliga PK, Ojo AO. Doação e utilização de órgãos nos Estados Unidos, 1999-2008. Am J Transplante. Abril de 2010; 10(4 Pt 2):973-86. DOI:10.1111/j.1600-6143.2009.03008.x.
- Rede de Aquisição e Transplante de Órgãos. Dados. Disponível em: https://optn.transplant.hrsa.gov/data.
- Estatísticas de Doação e Transplante de Órgãos. Fundação Nacional do Rim. 2016. Disponível em: https://www.kidney.org/news/newsroom/factsheets/Organ-Donation-and-Transplantation-Stats.
- Axelrod DA, McCullough KP, Brewer ED, Becker BN, Segev DL, Rao PS. Transplante de rim e pâncreas nos Estados Unidos, 1999-2008: a mudança da face da doação em vida. Am J Transplante. Abril de 2010; 10(4 Pt 2):987-1002. DOI:10.1111/j.1600-6143.2010.03022.x.
- Meier-Kriesche HU, Kaplan B. Tempo de espera na diálise como o fator de risco modificável mais forte para resultados de transplante renal: uma análise renal de doador pareado. Transplante. 27 de novembro de 2002; 74(10):1377-81. DOI:10.1097/00007890-200211270-00005.
- Kasiske BL, Snyder JJ, Matas AJ, Ellison MD, Gill JS, Kausz AT. Transplante renal preventivo: a vantagem e a vantagem. J Am Soc Nefrol. Maio de 2002; 13(5):1358-64. DOI:10.1097/01.ASN.0000013295.11876.C9.
- Ibrahim HN, Foley R, Tan L, et al. Consequências a longo prazo da doação de rim. N Engl J Med. 29 de janeiro de 2009; 360(5):459-69. DOI:10.1056/NEJMoa0804883.
- Merrill JP, Murray JE, Harrison JH, Guilda WR. Homotransplante bem-sucedido do rim humano entre gêmeos idênticos. J Am Med Assoc. 28 de janeiro de 1956; 160(4):277-82. DOI:10.1001/jama.1956.02960390027008.
- Monga M. Ureteroscopia. Nova Iorque: Humana Press, 2013.
- Wilson CH, Bhatti AA, Rix DA, Manas DM. Transplante. 15 de outubro de 2005; 80(7):877-82. DOI:10.1097/01.tp.0000181197.21706.fa.
- Aravindan N, Shaw A. Efeito da infusão de furosemida na hemodinâmica renal e na expressão gênica da angiogênese na isquemia/reperfusão renal aguda. Ren Fail. 2006; 28(1):25-35. DOI:10.1080/08860220500461229.
- Siedlecki A, Irlandês W, Brennan DC. Função tardia do enxerto no transplante renal. Am J Transplante. Novembro de 2011; 11(11):2279-96. DOI:10.1111/j.1600-6143.2011.03754.x.
Cite this article
Westfal ML, Elias N. Transplante de rim receptor de um doador vivo. J Med Insight. 2023; 2023(171). DOI:10.24296/jomi/171.

