生体ドナーからの腎臓移植
Main Text
末期腎疾患(ESRD)は、慢性腎臓病(CKD)の進行の最終段階です。CKDは多様な病因を持ち、多様な症状を呈し、患者依存的に進行します。CKDの多様性にもかかわらず、ESRDが発症すると患者は腎置換療法(RRT)を必要とします。RRTは血液透析、腹膜透析、腎移植の3つの支柱のうちの一つです。その中で、腎移植は患者に最良の生活の質、生存率の向上、そして治癒の機会を提供します。しかし、腎移植の成功により、必要な免疫抑制に対する治療結果と耐性が向上したことで、亡くなった臓器提供者の増加にもかかわらず、極度の臓器不足が生じています。その結果、生体ドナーの獲得がますます重要になっています。受血者にとっては、優れた移植片の質と待機や透析の必要性が不要な生体ドナーからの移植が最も良い結果です。この記事では、そのようなケースを紹介し、腎移植を行う際に医師が術前および術中で考慮すべき重要な点について論じます。
国立腎臓財団による慢性腎臓病(CKD)の定義は、この患者集団のケアアプローチを標準化するために制定されました。CKDとは、腎臓の構造的または機能的異常および/または糸球体濾過率(GFR)が60 mL/min/1.73m2<、3か月以上にわたり腎臓が損傷していることを指します。慢性腎臓病の病期はGFRのレベルによって異なります。ステージIではGFRが≥90です。第II期ではGFRは60〜89です。ステージIIIではGFRは30〜59です。ステージIVではGFRは15〜29です。ステージV(腎不全)ではGFRが<15、透析依存となります。2 本症例報告では、透析開始前に生体腎移植を受けた末期腎疾患(ステージVのCKD)患者について論じます。
この患者は56歳の女性で、1型糖尿病、高血圧、甲状腺機能低下症、高脂血症、糖尿病および高血圧性腎症に続発するESRDの既往歴があり、姉妹からの生体関連腎移植のためにマサチューセッツ総合病院に受診しました。
彼女の過去の手術歴は、帝王切開と左上肢のAV瘻孔で重要な例です。彼女の代表的な薬には、アムロジピン、カルシトリオール、レボチロキシン、オルメサルタン、プラバスタチン、ラシックス、カイエクサレートがあります。彼女はアスピリンとペニシリンにアレルギーがあります。社会的には、患者は夫と同居し、地元の小学校で教えています。彼女はワクチン接種済みの犬とカメをペットとして飼っていますが、移植後はカメの世話をしなくなると述べています。彼女はアルコールを飲まず、1箱の喫煙歴を持つ元喫煙者で、1979年に禁煙しました。彼女は違法薬物使用を否定しています。彼女は過去に最近の旅行や結核への曝露を否定しています。
術前検査で患者は56歳の良好な女性であることが確認されました。腹部検査は正常範囲内で、腹部は柔らかく膨らんでおらず、帝王切開の切開部はよく治癒していました。大腿動脈と足部の脈拍は両側で触覚されていました。腎移植が検討されているESRD患者では、下肢の脈拍に重大な末梢血管疾患の証拠がないか評価することが重要です。これは、移植された腎臓の動脈が受容者の腸骨血管に吻合される動脈硬化性疾患を最小限に抑えるためです。大腸関節系における重大な末梢動脈疾患(PAD)は、円大腿動脈の離脱により同種移植片や同側下肢への循環を損なうか、同種移植片によって下肢の循環を奪う可能性があります。2
一般的に、腎移植前の心臓評価には心電図(EKG)と心エコーが含まれます。さらに、CADの既往や重大なリスク要因(糖尿病、1年以上の血液透析、左心室肥大、60歳>歳、喫煙歴、高血圧、高脂血症)の入院患者には、ストレス検査および/または冠動脈造影検査が実施されます。排尿異常や尿閉塞(例:前立立腺)の症状や兆候がある患者では、排尿膀胱閉塞を除外するために排尿膀胱尿道検査と下部尿路の完全な評価が必要です。3 末梢血管疾患の既往や血管検査で懸念すべき所見がある場合は、下肢のパルスボリューム記録(PVR)および/または腹部および骨盤のCT(造影剤なし)を受けて腸骨石灰化の有無を評価するべきです。
この患者は術前心電図を受けましたが、不整脈や虚血は認められませんでした。しかし、過去の病歴に複数の冠動脈疾患(CAD)リスク因子が含まれていたため、重度の動脈硬化病変は除外する冠動脈造影検査を受けました。術前胸部X線検査で肉芽腫性疾患の既往の証拠が示され、追跡胸部CTスキャンでも他に懸念すべき所見なしに確認されました(図1–3)。
さらに、ドナーの姉妹は標準的なドナー術前検査を受けました。これには、適切な腎機能の確保と術後の単腎リスクの最小化が含まれます。感染症および悪性腫瘍のクリアランスも必要です。最後に、腎臓の大きさと血管を比較するための腎画像検査を行い、ドナー手術の側方位置を特定しました。。
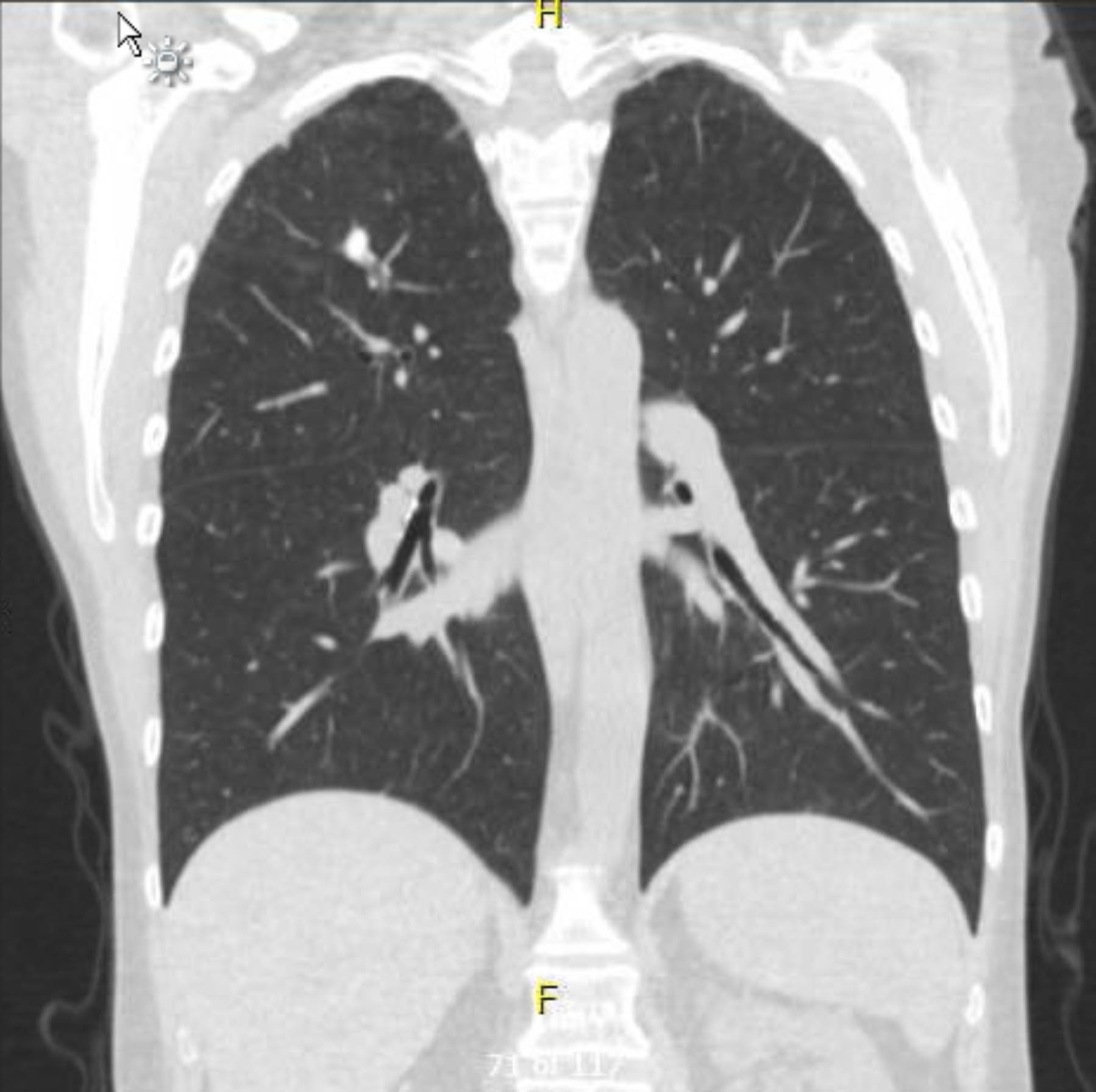
図1。術前造影なし胸部CT。 コロナビュー。右頂端の肉芽腫性変化。
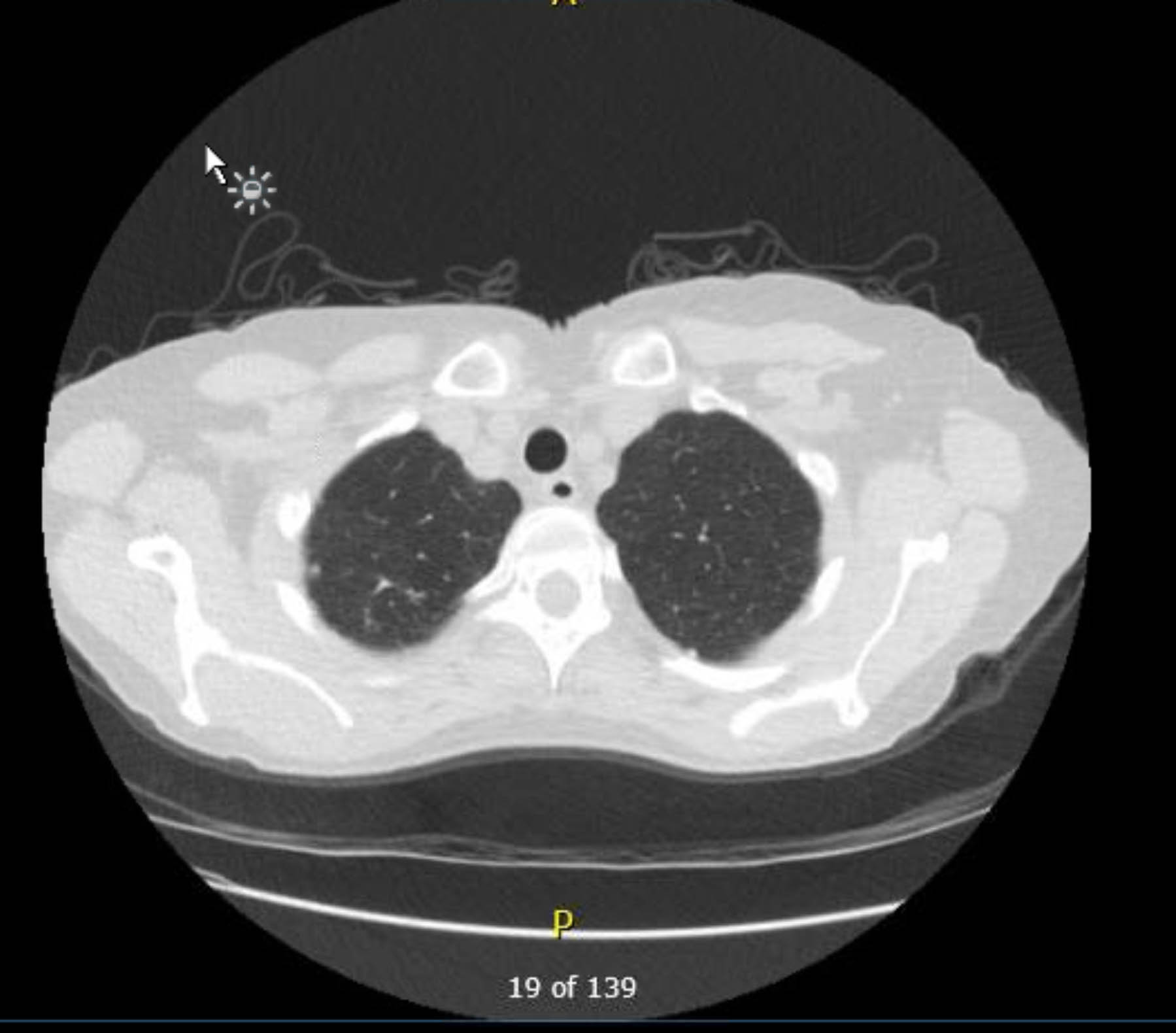
図2。術前造影なし胸部CT。軸方向の視点。右頂端の肉芽腫性変化。
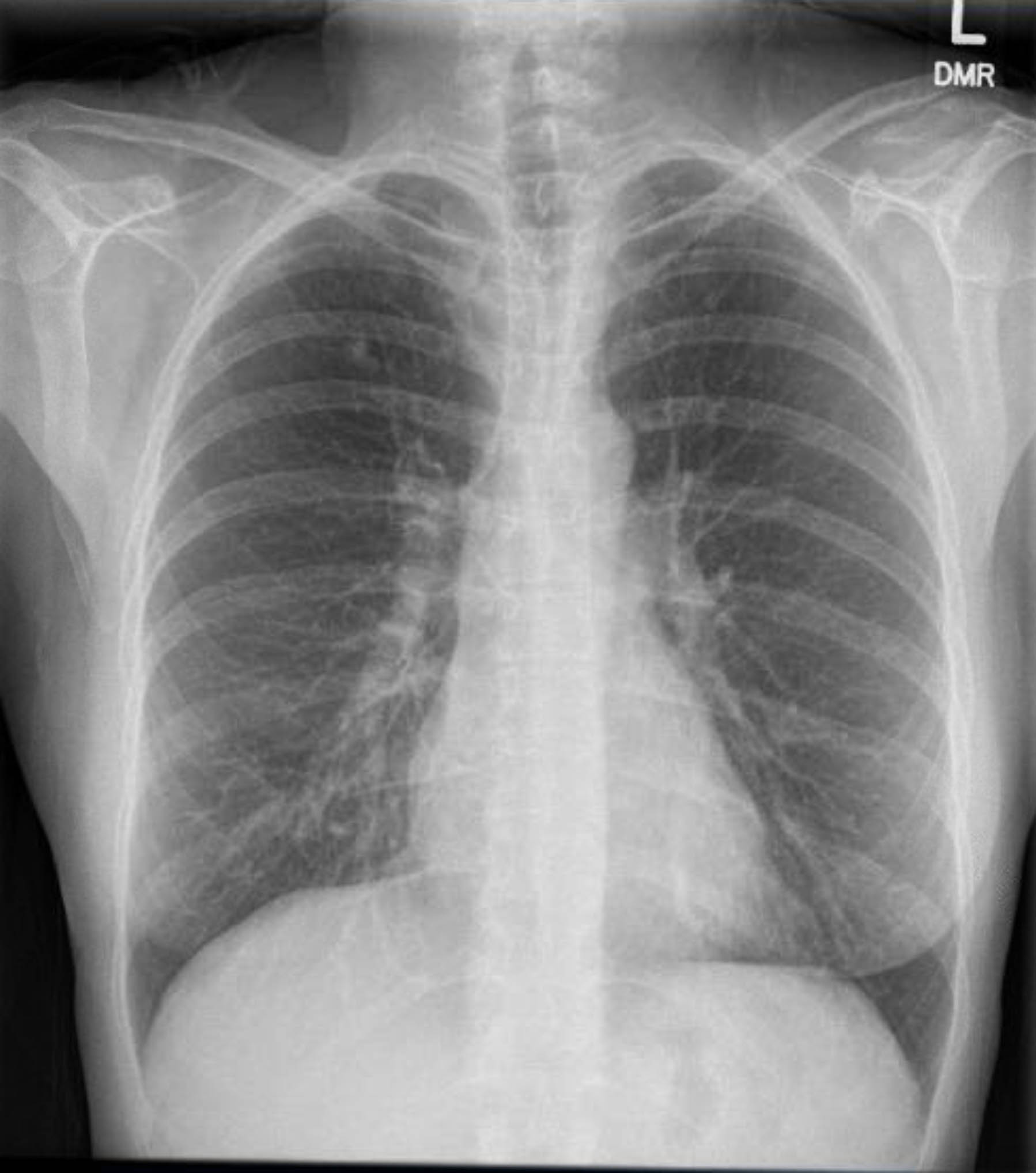
図3。術前胸部X線。右上葉に石灰化肉芽腫。
ESRDは非常に多様な症状と進行を呈します。アメリカ合衆国では、慢性腎不全の最も一般的な原因は糖尿病であり、全腎不全の45%を占めています。2番目と3番目に多い原因は、それぞれ高血圧性腎症(27%)と慢性腎球体腎炎(11%)です。4 CKDからESRDへの進行には、全身の液体バランスと電解質、代謝物、ホルモン、毒素のろ過を助けるために血液透析を受ける必要があります。透析を受けない場合、腎移植を受けなければ病気は致命的となります。
ESRDの治療法は透析(腹膜透析または血液透析)および/または移植です。2018年のアメリカ合衆国では、ESRDの全感染例のうち85.9%が血液透析を伴う腎代替療法を開始し、10.9%が腹膜透析から始め、2.9%が予防的な腎移植を受けました。5
腎移植は、故人または生存ドナーのいずれかから行われます。家族や友人が提供を希望するが互換性がない場合、生体ドナーペア交換(ドナー同士が他のドナーと提供を交換し、受贈者が適合する腎臓を受け取る方法)が選択肢となり得ます。これは、予定された受贈者と適合しないドナーを交換し、各ドナーが適合する受給者に腎臓を提供できるようにするものです。最後に、非指向的利他的ドナーは慎重にドナーを選ぶために非常に厳格なプロセスが必要であり、ある研究では非指向的利他的ドナーの約60%が初期評価と教育後に辞退し、持続可能でないドナー源となっています。6 利他的なドナーが評価を完了し潜在的なドナー候補として受け入れられた場合、私たちは彼らにペア交換チェーンを開始させるのが私たちの慣例です。これは、適合しないドナーを持つ受取人とマッチングし、その受取人が他の誰かに寄付するという仕組みで行われます。複数の受給者が一人の受給者とマッチングするよりも恩恵を受けられます。
ESRDにはさまざまな治療法がありますが、腎移植は依然として最も決定的で持続的な腎置換療法です。生活の質が向上し、透析よりも費用対効果が高く、全体的な生存率も向上します。実際 、移植前患者の死亡率と移植後の患者の死亡率を比較すると、腎移植はすべての年齢層で約2倍になります。4
死亡腎臓と生体ドナー腎臓のどちらかを選ぶ際、いくつかの研究では生体ドナー腎臓の方が移植後の転帰が良く、術後の移植片機能遅延の発生率が低いことが示されています。生体ドナーは、受容者の腎臓移植機能も長く提供しており、これはドナーの健康状態に関連していると考えられます。その他の利点としては、透析の長期待ち時間を回避できることや、ドナーとレシピエントの手続きをタイムリーに調整できることが挙げられます。3 腎移植前透析開始を受けた患者で、術後最良のグラフト生存率が認められています。4 ここで紹介された患者は、血液透析を開始する前に生存する近縁ドナーを見つけることができたため、透析後に死亡したドナー腎臓や移植を受けた患者と比べて移植片生存率が最も高いです。
前述の通り、ESRDの症状の多様さや疾患の進行度の違いを考慮すると、術前での詳細な評価、完全な病歴、身体検査、適切な画像診断が必要です。術前で除外すべき腎移植の絶対的な禁忌には、活動性感染症、悪性腫瘍、活性薬物乱用、そして管理不十分な精神疾患が含まれます。3 その他の重要な考慮事項としては、心血管および末梢血管の徹底的な評価があります。これらは患者が適切な腎臓受領者として不利になる可能性があります。
エメリッヒ・ウルマンは1902年に最初の腎移植の試みを報告しましたが、最初の成功した腎移植は1954年まで完了しませんでした。ジョセフ・マレーが免疫学的障壁を回避し、免疫抑制を一切使わずに二つの一卵性双生児間の腎臓移植を成功させたのです。3 同じ10年間に、ステロイドと放射線が最初の免疫抑制剤として使われましたが、1960年頃にアザチオプリン(イムラン)が導入されて、腎移植の新たな時代が幕開けました。その後の30年間にわたり免疫抑制は進化し、これらの薬剤は毒性プロファイルが低く、患者にとってより良く耐えられるようになっています。7
残念ながら、移植の最大の課題は、必要な人々に提供される臓器の不足です。皮肉なことに、固体臓器移植の成功こそが重大な臓器不足の最大の要因です。免疫抑制の生存率と寛容性の向上により、医師と患者の双方が移植を選択することが促されています。これらの 臓器を必要とする患者はESRD患者です。2018年のアメリカ合衆国におけるESRDの有病率は785,883人、発生率は131,779人でした。腎 移植の待機リストには88,627人がおり、毎月約3,700人の患者が増えています。生存者および死亡者の腎臓ドナーから毎年行われる腎移植件数は増加していますが、依然として30,000件未満(2022年には25,500件)にとどまっています。9 したがって、中央値の待ち時間は3.6年となります。10 本症例に提示された患者は56歳の女性で、糖尿病性および高血圧性腎症に続発的なESRDを患い、予防的に生体関連腎移植を受けました。
予防的腎移植は、ESRD患者が移植を受ける前に透析を開始していないという特殊な状況です。米国では、腎移植をESRD治療の初期方法として受けた患者はわずか2.9%でした。文献 のレビューでは、生体ドナーの提供が死亡ドナー移植と比較して患者および同種移植の生存率が向上することを示唆する論文がいくつかあり、特に生体ドナー移植が透析なしで予防的に行われる場合にそうである。6 生体ドナー移植は透析の待ち時間を短縮し、入院期間が短く費用も安く、移植後の転後結果が全体的に改善します。11 透析開始前に行うことで、患者は透析の罹患率、透析アクセス手順、そしてこの治療に伴う費用を回避できます。移植前の透析待ち時間は、腎移植後の移植片喪失における最大の独立リスク要因の一つであることが定量的に示されています。12 移植前透析を受けた患者の術後転帰は、非予防的移植と比較して移植片機能遅延率が低いことが示されました。13 ドナーの観点から見ると、生存腎臓ドナーの生存率は非ドナーとほぼ同様であり、ESRDのリスクは有意に高まらない。14
外科的な観点から見ると、この事件を通じていくつかの決定がなされ、さらなる議論が必要でした。最初の臨床判断は手術への曝露に関するものでした。腎臓移植の歴史の中で、かつては太ももの上部が移植の場所でした。しかし、皮膚尿管造開が必要であり、上行感染のリスクが大幅に高いため、この手術は中止されました。1956年、メリルとマレーは腸骨窩を用いた最初の移植を記述しました。腎窩は同時に腎切除術が必要であり、尿管吻合が必要で尿管狭窄形成のリスクが高いため選ばれなかったと指摘しました。その結果、腸骨窩は腸骨管を使った十分な血流へのアクセスと、尿管膀胱造瘻術を通じて膀胱への尿管排出を直接可能にしていることが結論づけられました。腎 臓は通常、腎静脈の長さが長いため、ほとんどのドナー腎摘出術が左側に行われるため、右腸骨窩(提供された腎臓の反対側)に設置されます。しかし 、今回の症状では、患者は1型糖尿病の既往があり、将来的に膵臓移植が必要になる可能性があるため、左腸骨窩への移植を受けました(通常は右腸骨窩に移植されます)。患者の既往の既往や血管解剖学的特徴が判明した場合、最後に検討される最後のアプローチは腹腔内アプローチです。
この手術の次の重要なステップは血管吻合です。腎静脈は多くの場合、最初に吻合され、通常は外腸骨静脈に端から側にして吻合されますが、この位置は動脈吻合によって異なります。動脈吻合は、ドナー腎動脈と受容者の共通、外腸、内腸骨動脈を接続することがあり、この手術は時間とともに進化してきました。歴史的には、内腸骨がドナー腎動脈への端から端への吻合のために優先的に選ばれてきました。しかし、これは後の腎動脈の端から外腸骨動脈へのアプローチよりも優れているとは示されませんでした。したがって、現在最も一般的な吻合は、ドナー腎動脈と受容側の外腸骨動脈間で行われます。この血管は骨盤に枝が存在せず、膀胱に近いため、遠位尿管血流を損なうことなく尿管嚢胞造りの形成を容易にしています。腎臓が亡くなったドナーから採取された場合、ドナー大動脈も回収され、カレルパッチとして作られ、総腸骨動脈または外腸骨動脈の吻合に使用されます。2 ドナー腎臓の調達において重要な考慮点の一つは腎動脈の数です。ドナーが死亡ドナーの場合、ドナー大動脈から起因するすべての腎動脈、特にカレルパッチ起源の動脈を保存することが可能です。しかし、生体ドナーではこれが現実的ではなく、複数の動脈を別々に吻合するか、より一般的には腎臓移植前に一本の動脈に吻合されます。腎臓の上部極に小さな付属動脈がある場合、それらは結紮されることが多いです。下極動脈は尿管に血液を供給する可能性が高く、その結果、尿管への血液供給が最適である必要があるため結紮される可能性が低いです。
最後に考慮すべき吻合は、ドナーの尿管から受け取り者の膀胱吻合の構築です。腎移植の長年にわたり、ドナーの尿管を受容者の膀胱に移植する尿管嚢胞造瘻術にはいくつかのアプローチが存在してきました。当初、最も広く使われていた吻合法はリードベター・ポリターノ法であり、膀胱内術で前方膀胱造瘻術を経て尿管の粘膜下トンネル形成と新開口部の解剖学的近くの位置に位置付けする手術です。16 リッチとグレゴワールによって開発されたより新しい膀胱外法は、現在ほとんどの移植センターで採用されており、本例でも用いられています。膀胱ドームに小さな膀胱切開術が1つ行われ、遠位ドナー尿管は膀胱粘膜に吻合されます。その後、尿管の上に血清筋層が閉じられます。2 最後の方法は尿管皮葉造り術で、これは受容者尿管とドナー腎骨盤の最下部との吻合です。この方法は同側の自然腎摘出術が必要で、尿管漏れ率が高いことが示されているため、あまり用いられていません。2
このケースの最後の考慮点であり、腎移植の文献で今なお議論の的となっているのは、尿管ステントの使用です。いくつかの研究で尿管ステントのリスクと利益が調査されています。腎移植後の泌尿器系合併症の多くは、膀胱尿管吻合に起因します。尿管ステントの治療効果は、膀胱粘膜吻合部への水密性尿管粘膜の形成を簡素化し、解剖学的なねじれを減らすことです。しかし、ステント使用に関連する重大なリスクには、再発性尿路感染症や最終的な移植片の喪失が含まれます。全体として、文献はユニバーサルステントの罹患率や費用を十分に評価できておらず、したがってこの実践は手術時の外科医ごとの評価と判断に委ねられています。17 この場合、担当外科医はドナー腎臓に余った腎盂があることを発見し、尿管吻合が完了する前に腎骨盤が充満しているように見えました。その結果、4.7 Fr.のダブルJステントが挿入されました。
まとめると、この症例は生きた先制腎移植を浮き彫りにしています。患者は幸運にも、提供に同意し、提供に適していると判断された生体ドナーに恵まれました。生体提供の成果は、特に透析開始前に行われる場合、この患者のように亡くなったものの提供よりも優れています。腎移植の待機リストが増え続ける中、生体提供の重要性はますます高まっていくでしょう。したがって、アメリカ全土の腎移植センターが生体提供を奨励することが不可欠です。有望な進展の一つは、腹腔鏡下ドナー腎摘出術の普及です。この技術は現在、ドナー腎摘出術の90%以上で用いられており、生体ドナーの回復時間を短縮します。11 これは、ESRD患者の臓器不足に対処するために、提供を継続して促進すべき活動の一例です。臓器提供は減少したものも生体も含めて。
腸骨血管のクランプにはフォガティ・ハイドラグリップクランプが使用されました。Edward LifesciencesはFogartyクランプ用のHydragripインサートを提供しています。これらの外傷の少ないクランプは、解離のリスクを減らすと考えられています。動脈吻合を行う際は、Teleflex Medicalによる大動脈パンチが動脈切開に用いられます。
全くありません。
MGH移植フェローのコーリー・エイマードがナヘル・エリアス医師と共にこの手術を行いました。
臨床病歴、放射線科、術中映像の使用については、患者および関与した医療提供者から同意を得て、この症例報告書の作成および撮影に関わりました。
References
- 医療改善研究所。臓器提供の最新情報:成功は新たな課題をもたらします。入手可能: http://www.ihi.org/resources/Pages/ImprovementStories/OrganDonationUpdateSuccessBringsNewChallenges.aspx
- ペレイラ・BJG、サイエグ・MH、ブレイク・P. 慢性腎臓病、透析および移植。第2版。ペンシルベニア州フィラデルフィア:エルゼビア・ソーンダース;2005.
- ヒュマー・A、ダン・DL。第11章:移植。収録:シュワルツの外科原理。9版。ニューヨーク州ニューヨーク:マグロウヒル;2010.
- パンチ、JD。第45章:臓器移植。掲載:現在の診断と治療。13版第16版、ニューヨーク州ニューヨーク:マグロウヒル;2006年16月16日。モンガ・M. 尿管鏡検査。ニューヨーク:ヒューマナ・プレス、2013年。
- アメリカ合衆国腎臓データシステム。2020年USRDS年次データ報告書:米国における腎臓病の疫学。国立衛生研究所、国立糖尿病・消化器・腎臓病研究所、メリーランド州ベセスダ、2020年。
- デイビス・CL、デルモニコ(フロリダ州)。生体ドナー腎移植:生体ドナーの現行の実践のレビュー。 J Am Soc Nephrol。2005年7月;16(7):2098-110. doi:10.1681/ASN.2004100824.
- マレーJE、メリルJP、ハリソンJH、ウィルソンレディン、ダミンGJ。免疫抑制薬剤治療によるヒト-腎臓ホモグラフトの長期生存。 N Engl J Med.1963年6月13日;268:1315-23。 doi:10.1056/NEJM196306132682401。
- クラインAS、メッサースミスEE、ラトナーLE、コチクR、バリガPK、オジョAO。アメリカ合衆国における臓器提供と利用、1999年から2008年まで。 私はJ Transplantです。2010年4月;10巻(4巻2期):973-86。 doi:10.1111/j.1600-6143.2009.03008.x.
- 臓器調達・移植ネットワーク。データ。入手可能: https://optn.transplant.hrsa.gov/data。
- 臓器提供および移植統計。全米腎臓財団。2016年。利用可能: https://www.kidney.org/news/newsroom/factsheets/Organ-Donation-and-Transplantation-Stats。
- アクセルロッドDA、マッカラフKP、ブリューワーED、ベッカーBN、セゲブDL、ラオPS。1999年から2008年までのアメリカ合衆国における腎臓および膵臓移植:生体提供の変化する姿。 私はJ Transplantです。2010年4月;10(4 Pt 2):987-1002。 DOI:10.1111/J.1600-6143.2010.03022.x。
- Meier-Kriesche HU、Kaplan B. 透析の待機時間が腎移植アウトカムの最も強い修正可能リスク因子であること:ペアドナー腎臓分析。移植。2002年11月27日;74(10):1377-81. doi:10.1097/00007890-200211270-00005。
- カシスキー BL、スナイダーJJ、マタスAJ、エリソンMD、ギルJS、カウシュ AT。予防的な腎移植:利点と利点。 J Am Soc Nephrol。2002年5月;13(5):1358-64. doi:10.1097/01.asn.0000013295.11876.c9。
- イブラヒム・HN、フォーリー・R、タン・Lら。腎臓提供の長期的な影響。 N Engl J Med.2009年1月29日;360(5):459-69. doi:10.1056/NEJMoa0804883。
- メリルJP、マレーJE、ハリソンJH、ギルドWR。一卵性双生児間のヒト腎臓の同形移植の成功例。 J Am Med協会1956年1月28日;160(4):277-82. doi:10.1001/jama.1956.02960390027008。
- モンガM。 尿管鏡検査。ニューヨーク:ヒューマナ・プレス、2013年。
- Wilson CH、Bhatti AA、Rix DA、Manas DM。腎移植受容者に対する定期的な術中ステント挿入。 移植。2005年10月15日;80(7):877-82. doi:10.1097/01.tp.0000181197.21706.fa.
- Aravindan N, Shaw A. 急性腎虚血/再灌流におけるフロセミド注入が腎血行動態および血管新生遺伝子発現に与える影響。 レン・フェイル。2006;28(1):25-35. DOI:10.1080/08860220500461229。
- シードレッキ A、アイリッシュ W、ブレナン DC。腎移植における移植片機能の遅延。 私はJ Transplantです。2011年11月;11(11):2279-96. DOI:10.1111/J.1600-6143.2011.03754.x。
Cite this article
ウェストファル ML, エリアス・N. 生体ドナーからの腎臓移植受容者。 J Med Insight。 2023;2023(171). doi:10.24296/jomi/171。

