Trapianto di rene ricevente da un donatore vivente
Main Text
Table of Contents
La malattia renale terminale (ESRD) è la fase finale della progressione della malattia renale cronica (CKD). La CKD ha molteplici emotività, si manifesta in vari modi e progredisce in modo dipendente dal paziente. Nonostante l'eterogeneità della MRC, una volta che si manifesta l'ESRD, i pazienti necessitano di Terapia Sostitutiva Renale (RRT). La RRT è uno dei tre fronti: emodialisi, dialisi peritoneale o trapianto di rene. Tra questi, il trapianto di rene offre al paziente la migliore qualità di vita, una sopravvivenza migliorata e un'opportunità di guarigione. Tuttavia, il successo del trapianto renale, con risultati migliori e tolleranza all'immunosoppressione necessaria, ha portato a una grave carenza di organi nonostante l'aumento dei donatori deceduti. Di conseguenza, la spinta per i donatori viventi è diventata sempre più importante. Per i riceventi, i migliori risultati sono i trapianti da un donatore vivente grazie alla qualità superiore dell'innesto e all'eliminazione della necessità di attesa e dialisi. Questo articolo presenterà un caso di questo tipo e discuterà le considerazioni importanti che un medico deve prendere in considerazione sia preoperatoriamente che intraoperatoriamente durante l'esecuzione di trapianti di rene.
La definizione della National Kidney Foundation di malattia renale cronica (CKD) è stata stabilita per standardizzare l'approccio alla cura di questa popolazione di pazienti. La CKD è definita come danno renale per una durata superiore o uguale a 3 mesi da anomalie strutturali o funzionali del rene e/o da un tasso di filtrazione glomerulare (GFR) di < 60 mL/min/1,73m2. Gli stadi della CKD variano a seconda del livello di GFR: nello stadio I, il GFR è ≥ 90; nella fase II, il GFR è 60–89; nella fase III, la GFR è 30–59; nella fase IV, la GFR è da 15 a 29; e nello stadio V (insufficienza renale), la GFR è < 15 o dipendenza da dialisi. 2 In questo rapporto del caso, discuteremo di un paziente con malattia renale terminale (MRC di stadio V) che ha subito un trapianto di rene vivente prima dell'inizio della dialisi.
Questa paziente è una donna di 56 anni con una storia medica passata di diabete mellito di tipo I, ipertensione, ipotiroidismo, iperlipidemia e ESRD secondarie a nefropatie diabetiche e ipertensive, che si è presentata al Massachusetts General Hospital per un trapianto di rene vivente da sua sorella.
La sua storia chirurgica passata è significativa per un cesareo e una fistola AV dell'arto superiore sinistro. I suoi farmaci più noti includono amlodipina, calcitriolo, levotiroxina, olmesartan, pravastatina, lasix e kayexalate. È allergica all'aspirina e alla penicillina. Dal punto di vista sociale, la paziente vive con il marito e insegna in una scuola elementare locale. Ha un cane vaccinato e una tartaruga come animali domestici, ma nota che non si prenderà più cura della sua tartaruga dopo il trapianto. Non beve alcolici ed era una fumatrice con una storia di 1 pacchetto annuale, smettendo nel 1979. Nega qualsiasi uso illecito di droghe. Nega qualsiasi recente viaggio o esposizione alla tubercolosi in passato.
Durante l'esame preoperatorio la paziente è stata identificata come una donna di 56 anni dall'aspetto sapore. L'esame addominale è stato rilevato entro limiti normali, con un addome morbido e non disteso e un'incisione chirurgica ben guarita dal cesareo. I suoi impulsi femorale e pedale erano palpabili bilateralmente. In un paziente con ESRD che è in considerazione per il trapianto renale, è importante valutare i pulsi degli arti inferiori per trovare evidenza di una significativa malattia vascolare periferica. Questo serve a garantire una minima malattia aterosclerotica in cui l'arteria del rene trapiantato verrà anastomizzata sui vasi iliaci del ricevente. Qualsiasi malattia arteriosa periferica (PAD) significativa nel sistema aortoiliaco potrebbe compromettere la circolazione all'alloinnesto o all'estremità inferiore ipsilaterale a causa della dissezione delle arterie iliofemorali, oppure potrebbe sottrarre dalla circolazione dell'estremità inferiore tramite l'allografto. 2
In generale, la valutazione cardiaca prima del trapianto renale include: ECG ed ecocardiografia. Inoltre, viene eseguito un test da sforzo e/o un'angiografia coronarica per pazienti ricoverati con storia di CAD o fattori di rischio significativi (diabete mellito, emodialisi da oltre un anno, ipertrofia ventricolare sinistra, età > 60 anni, storia di fumo, ipertensione o iperlipidemia). Nei pazienti con sintomi o segni di anomalie urinarie o ostruzione urinaria (ad esempio prostatica), è necessario un cistouretrombograma della micção e una valutazione completa delle vie urinarie inferiori per escludere l'ostruzione dell'uscita. 3 Se il paziente presenta una storia di malattie vascolari periferiche o riscontri preoccupanti all'esame vascolare, dovrebbe sottoporsi a registrazioni del volume del polso (PVR) degli arti inferiori e/o a una TAC di addome e bacino (senza contrasto) per valutare la presenza di calcificazioni iliache.
Questo paziente ha subito un ECG preoperatorio che non ha mostrato aritmie né ischemia. Tuttavia, dato che la sua storia medica precedente includeva diversi fattori di rischio per la cardiopatia coronarica (CAD), si è sottoposta a un'angiografia coronarica che ha escluso gravi lesioni aterosclerotiche. Una radiografia toracica preoperatoria ha mostrato evidenza di precedente malattia granulomatosa, e una TAC toracica di controllo ha confermato ciò senza altri riscontri preoccupanti (Figure 1–3).
Inoltre, la sorella donatrice ha sottoposto il classico esame preoperatorio con donatore. Questo include garantire una funzionalità renale adeguata e un rischio minimo di essere non inefriti dopo l'intervento. Sono inoltre necessarie le eliminazioni delle malattie infettive e delle tumori maligne. Infine, sono state effettuate immagini renali per confrontare la dimensione dei reni e la loro vascolarizzazione per determinare la lateralità della procedura con donatore. .
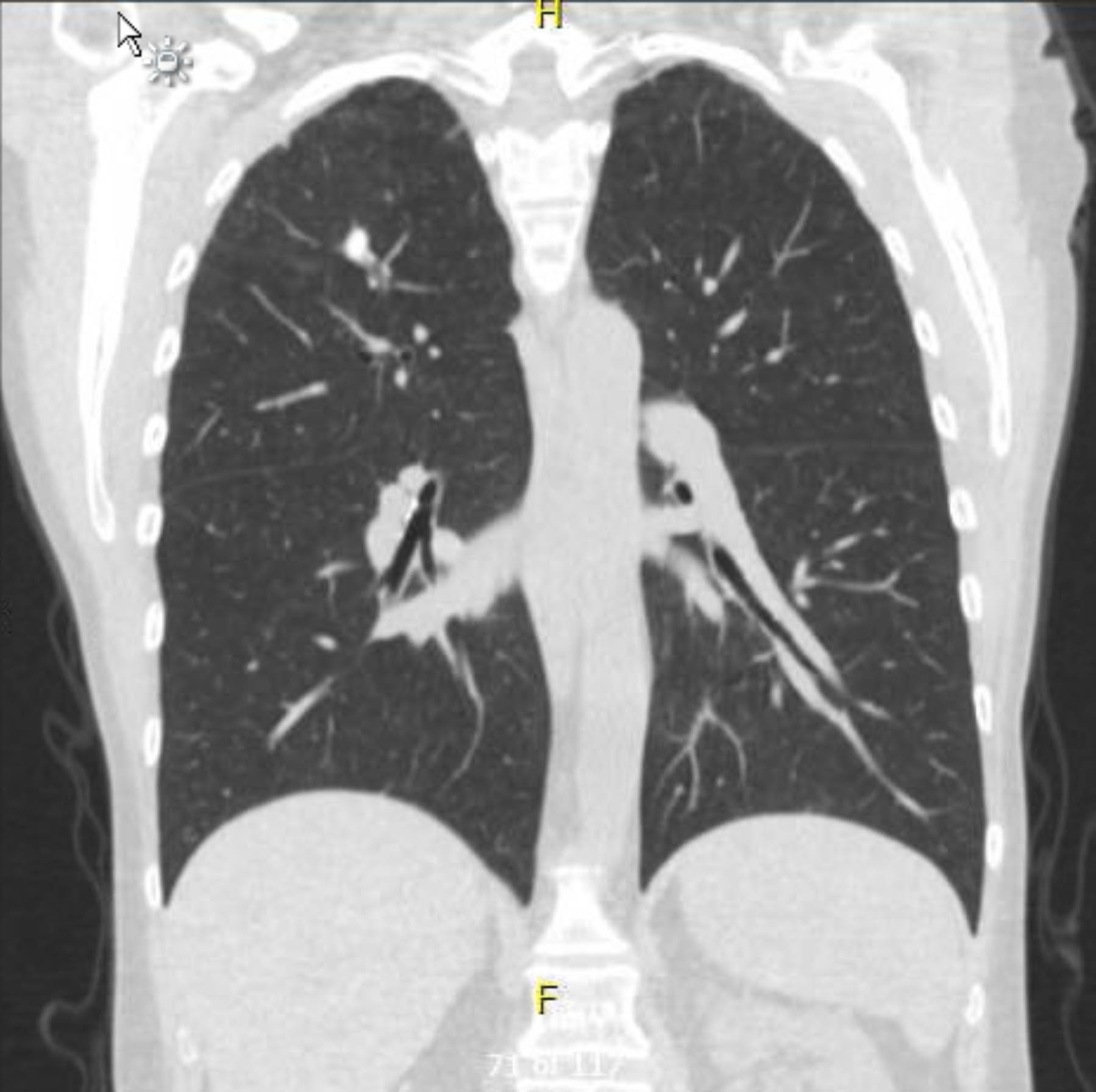
Figura 1. TAC toracico preoperatorio senza contrasto. Vista Coronale. Cambiamenti granulomatosi nell'apice destro.
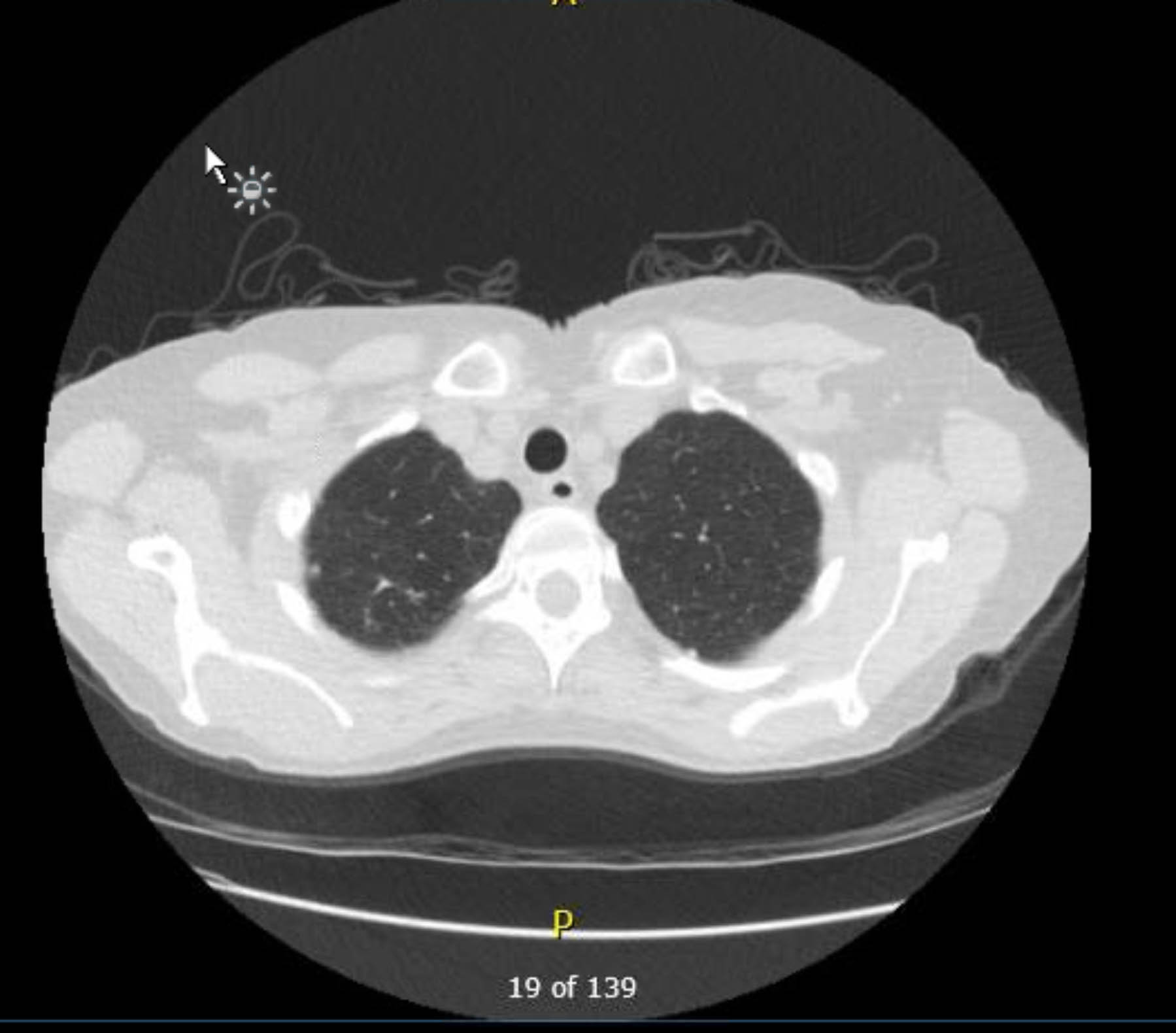
Figura 2. TAC toracico preoperatorio senza contrasto. Vista assiale. Cambiamenti granulomatosi nell'apice destro.
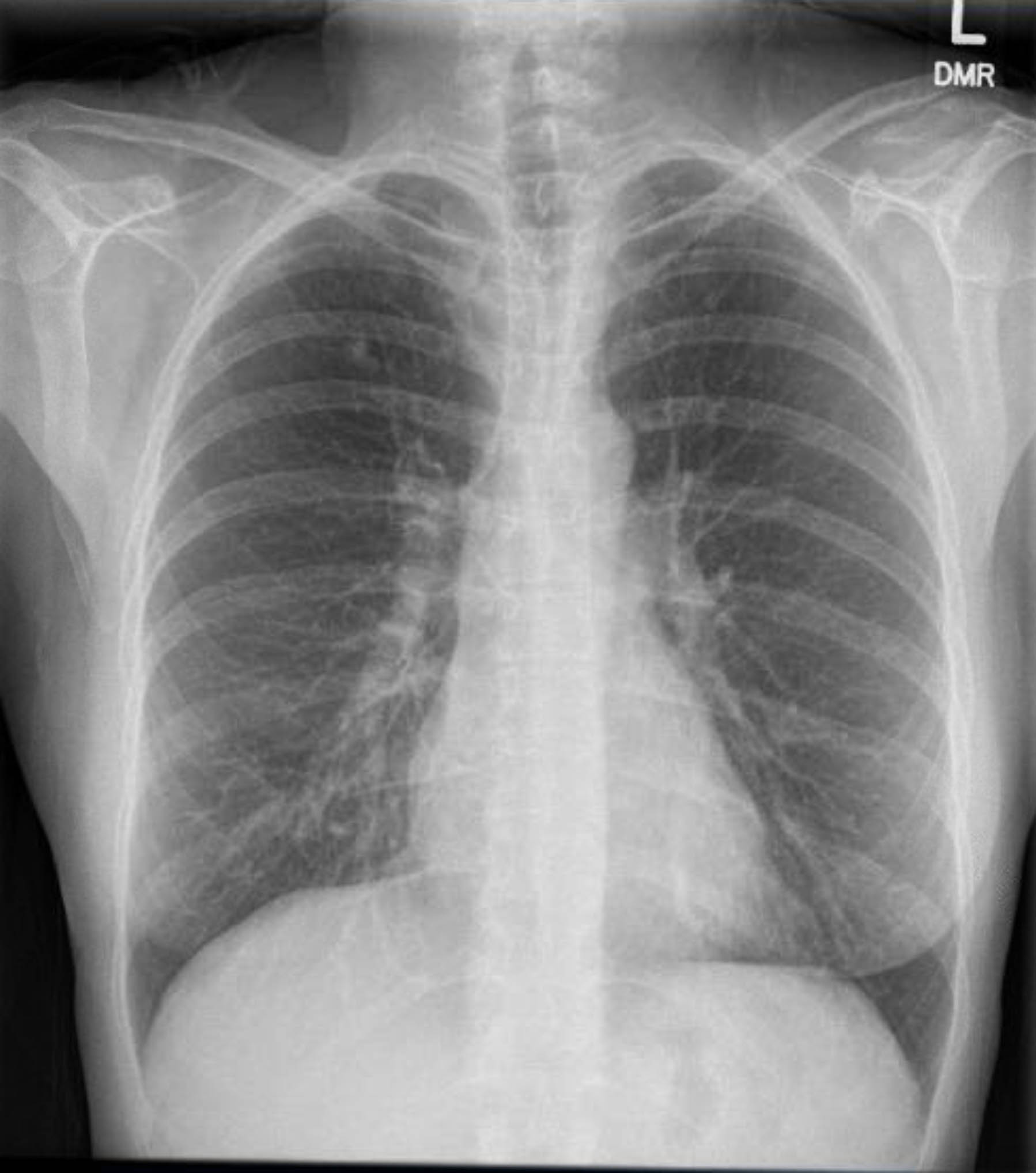
Figura 3. Radiografia toracica preoperatoria. Granulomi calcificati nel lobo superiore destro.
L'ESRD ha una presentazione e una progressione della malattia molto eterogenee. Negli Stati Uniti, la causa più comune di insufficienza renale cronica è il diabete mellitus, che rappresenta il 45% di tutta l'insufficienza renale. La seconda e la terza causa più comuni sono rispettivamente nefropatia ipertesa (27%) e glomerulonefrite cronica (11%). 4 La progressione della CKD alla ESRD richiede che il paziente si sottoponga a emodialisi per favorire l'equilibrio dei fluidi corporei integri e la filtrazione di elettroliti, metaboliti, ormoni e tossine. Se il paziente non si sottopone a dialisi, deve sottoporsi a un trapianto di rene, altrimenti la malattia sarà fatale.
Le opzioni di trattamento per l'ESRD sono la dialisi (dialisi peritoneale o emodialisi) e/o il trapianto. Negli Stati Uniti, nel 2018, l'85,9% di tutti i casi incidenti di ESRD ha iniziato la terapia sostitutiva renale con emodialisi, il 10,9% ha iniziato con dialisi peritoneale e il 2,9% ha ricevuto un trapianto preventivo di rene. 5
Il trapianto di rene avviene sia da un defunto che da un donatore vivente. Se un familiare o un amico desidera donare ma è incompatibile, lo scambio a coppia tra donatore vivo e donatore (in cui un donatore scambia la propria donazione con un altro donatore affinché i riceventi ricevano reni compatibili) potrebbe essere un'opzione, che scambierebbe donatori incompatibili con i destinatari previsti, così che ogni donatore doni invece un rene a un ricevente compatibile. Infine, i donatori altruisti non diretti richiedono un processo molto rigoroso per selezionare con cura un donatore e in uno studio è emerso che quasi il 60 percento dei donatori altruisti non diretti ha abbandonato dopo la valutazione iniziale e la sessione educativa, rendendo così questa fonte di donatori non sostenibile. 6 Se i donatori altruisti completano la valutazione e vengono accettati come potenziali candidati donatori, è nostra prassi far avviare loro una catena di scambio abbinata. Questo avviene abbinandoli a un destinatario che ha un donatore incompatibile, che poi donerà a qualcun altro, e così via. Più destinatari ne trarranno beneficio, invece di abbinarli a un solo destinatario.
Nonostante la varietà di modalità di trattamento per l'ESRD, il trapianto renale rimane la terapia sostitutiva renale più definitiva e duratura. Offre una migliore qualità della vita, è più conveniente rispetto alla dialisi e offre una sopravvivenza complessiva migliorata. 3 Infatti, l'aspettativa di vita raddoppia approssimativamente con il trapianto di rene in tutte le fasce d'età quando si confronta la mortalità dei pazienti pretrapianto con quelli post-trapianto. 4
Quando si sceglie tra un rene defunto e un rene donatore vivente, diversi studi hanno determinato che i reni donati viventi hanno migliori risultati post-trapianto con incidenze più basse di ritardo nella funzione dell'innesto postoperatorio, dato il breve tempo ischemico. I donatori viventi offrono anche una funzione di trapianto renale più lunga nel ricevente, probabilmente legata alla salute del donatore. Altri benefici includono l'evitamento di lunghi tempi di attesa per la dialisi e la possibilità di coordinare tempestivamente le procedure di donatore e ricevente. 3 La migliore sopravvivenza postoperatoria al trapianto è stata riscontrata nei pazienti che hanno ricevuto trapianto renale prima dell'inizio della dialisi. 4 Per la paziente presentata qui, è riuscita a trovare un donatore vivente imparentato prima di iniziare l'emodialisi, quindi ha la più alta probabilità di sopravvivenza dell'innesto rispetto ai pazienti che ricevono un rene di donatore deceduto o un trapianto dopo la dialisi.
Come accennato sopra, data la presentazione variabile della SRT e le differenze nella progressione della malattia, è necessaria una valutazione preoperatoria molto approfondita con storia clinica completa, esame fisico e imaging appropriato. Le assolute controindicazioni al trapianto di rene che devono essere escluse preoperatoriamente includono infezioni attive, malignità, abuso attivo di sostanze e malattie psichiatriche poco controllate. 3 Altre considerazioni importanti includono una valutazione approfondita cardiovascolare e vascolare periferica, poiché entrambe potrebbero escludere il paziente dal diventare un rene adatto.
Emerich Ullman riportò il primo tentativo di trapianto di rene nel 1902, ma il primo trapianto di rene riuscito fu completato solo nel 1954, quando Joseph Murray aggirò la barriera immunologica e completò un trapianto di rene tra due gemelli identici senza alcun uso di immunosoppressione. 3 Nello stesso decennio, steroidi e radiazioni furono i primi immunosoppressori utilizzati, ma fu l'introduzione dell'Azatioprina (Imuran) intorno al 1960 a inaugurare una nuova era del trapianto renale. Nei tre decenni successivi, l'immunosoppressione continuò a evolversi, tanto che questi farmaci ora hanno un profilo di tossicità più basso e sono meglio tollerati dai pazienti. 7
Purtroppo, la sfida più grande per il trapianto è la carenza di organi disponibili per chi ne ha bisogno. Il successo del trapianto di organi solidi è ironicamente il fattore principale responsabile della carenza critica; Il miglioramento dei tassi di sopravvivenza e della tolleranza all'immunosoppressione ha incoraggiato sia medici che pazienti a optare per il trapianto. 1,8 I pazienti bisognosi di questi organi sono quelli che soffrono di ESRD. Nel 2018, la prevalenza dell'ESRD negli Stati Uniti era di 785.883 con un'incidenza di 131.779. 5 Ci sono 88.627 persone nella lista d'attesa per il trapianto di rene, con circa 3.700 pazienti aggiunti ogni mese. Il numero di trapianti di rene effettuati ogni anno sia da donatori viventi che deceduti è aumentato, ma rimane inferiore a 30.000 (25.500 nel 2022). 9 Quindi il tempo mediano di attesa è di 3,6 anni. 10 La paziente presentata in questo caso è una donna di 56 anni che soffriva di ESRD secondaria a nefropatie diabetiche e ipertensive e ha subito un trapianto di rene correlato a vita preventiva.
Il trapianto preventivo di rene è una situazione unica in quanto il paziente con ESRD non ha ancora iniziato la dialisi prima del trapianto. Solo il 2,9% dei pazienti negli Stati Uniti ha subito un trapianto di rene come modalità iniziale di terapia ESRD. 5 Nella revisione della letteratura, ci sono diversi articoli che suggeriscono che la donazione vivente garantisce una migliore sopravvivenza al paziente e allotrapiante rispetto al trapianto di donatore deceduto, specialmente quando il trapianto di donatore vivo viene eseguito preventivamente senza dialisi. 6 Il trapianto di donatore vivente riduce i tempi di attesa per la dialisi, comporta ricoveri ospedalieri più brevi e meno costosi e migliori complessivamente i risultati post-trapianto. 11 Quando effettuato prima dell'inizio della dialisi, il paziente può evitare la morbilità della dialisi, delle procedure di accesso alla dialisi e dei costi associati a questo trattamento. Il tempo di attesa prima del trapianto prima del trapianto è stato studiato e dimostrato quantitativamente essere uno dei maggiori fattori di rischio indipendenti per la perdita di innesto dopo il trapianto di rene. 12 Gli esiti postoperatori dei pazienti che ricevono un trapianto predialisi mostrano tassi inferiori di ritardo nella funzione del trapianto rispetto ai trapianti non preventivi. 13 Dal punto di vista del donatore, i donatori viventi di rene hanno una sopravvivenza simile a quella dei non donatori, e il loro rischio di ESRD non è significativamente aumentato. 14
Dal punto di vista chirurgico, durante questo caso sono state prese diverse decisioni che meritano ulteriori discussioni. La prima decisione clinica è stata legata all'esposizione chirurgica. Nella storia del trapianto di rene, c'è stato un periodo in cui la parte superiore della coscia era il luogo del trapianto. Tuttavia, questa è stata interrotta perché richiede un'ureterostomia cutanea, che è significativamente più a rischio di infezione ascendente. Nel 1956, Merrill e Murray descrissero il primo trapianto utilizzando la fossa iliaca. Hanno osservato che la fossa renale non è stata scelta perché richiede una nefrectomia simultanea e richiede un'anastomosi ureteroureterale, che espone l'uretere ad alto rischio di formazione di estenosi. Di conseguenza, è stato concluso che la fossa iliaca permetteva l'accesso a un adeguato apporto di sangue tramite i vasi iliaci e un drenaggio ureterale accessibile direttamente alla vescica tramite ureteroneocistostomia. 15 reni sono tipicamente collocati nella fossa iliaca destra (il lato controlaterale del rene donato) perché la maggior parte delle nefrectomie donate è sul lato sinistro dato l'aumento della lunghezza della vena renale. 2 Tuttavia, in questo caso di presentazione, la paziente ha subito un trapianto nella fossa iliaca sinistra dato che ha una storia di diabete mellito di tipo I e potrebbe necessitare di un trapianto di pancreas in futuro (che di solito viene collocato nella fossa iliaca destra). L'ultimo approccio che a volte viene considerato, a seconda della storia chirurgica precedente del paziente e dell'anatomia vascolare, è l'approccio intraperitoneale.
Il passo successivo significativo in questa operazione sono le anastomosi vascolari. La vena renale viene più spesso anastomizzata prima e solitamente alla vena iliaca esterna in modo estremo, ma questa posizione varia in base all'anastomosi arteriosa. L'anastomosi arteriosa può collegare l'arteria renale donatrice con l'arteria iliaca comune, esterna o interna ricevente, e la procedura si è evoluta nel tempo. Storicamente, l'iliaca interna veniva scelta preferenzialmente per un'anastomosi end-to-end dell'arteria renale donatrice; tuttavia, non si è dimostrato che questo fosse superiore al successivo approccio di estremità laterale dell'arteria renale verso l'arteria iliaca comune o esterna. Pertanto, l'anastomosi più comune oggi si verifica tra l'arteria renale donatrice e il lato dell'arteria iliaca esterna ricevente, poiché questo vaso non ha rami nel bacino ed è in stretta vicinanza alla vescica, facilitando la creazione dell'ureteroneocistostomia senza compromettere l'apporto distale di sangue ureteretico. Se il rene è stato recuperato da un donatore deceduto, anche l'aorta del donatore viene recuperata e può essere trasformata in una patch Carrel e utilizzata per l'anastomosi dell'arteria iliaca comune o esterna. 2 Durante il prelievo del rene donatore, una considerazione importante è il numero di arterie renali. Quando il donatore è un donatore deceduto, è possibile preservare tutte le arterie renali originanti dall'aorta donatrice, incluse le loro origini nel cerotto Carrel. Tuttavia, in un donatore vivente, ciò non è fattibile e più arterie vengono anastomizzate separatamente o, più comunemente, vengono anastomose insieme in un'unica arteria prima dell'impianto del rene. Se ci sono piccole arterie accessorie che alimentano il polo superiore del rene, spesso vengono legate. Le arterie polari inferiori hanno maggiori probabilità di alimentare l'uretere e, di conseguenza, meno probabilità di essere legate, poiché l'apporto di sangue all'uretere deve essere ottimale.
L'ultima anastomosi da considerare è la costruzione dell'anastomosi da donatore tra uretere e vescica ricevente. Nel corso degli anni del trapianto renale ci sono stati diversi approcci alla ureteroneocistostomia, ovvero l'impianto dell'uretere donatore nella vescica ricevente. Inizialmente, l'anastomosi più diffusa era la tecnica Leadbetter-Politano, una tecnica intravesicale che richiede l'esposizione tramite una cistostomia anteriore per permettere la tunneling submucosa dell'uretere e la collocazione del neo-orifizio in una posizione quasi anatomica. 16 L'approccio extravesicale più recente, sviluppato da Lich e Gregoir, è impiegato dalla maggior parte dei centri di trapianti oggi ed è l'approccio impiegato in questo caso. Viene creata una piccola cistotomia unica nella cupola vescicale, e l'uretere donatore distale viene anastomizzato alla mucosa vescicale. Uno strato sieromuscolare viene quindi chiuso sopra l'uretere. 2 L'ultimo metodo è l'ureterotilostomia, un'anastomosi tra l'uretere ricevente e la porzione più bassa del bacino renale donatore. Questo approccio non è spesso utilizzato perché richiede spesso una nefrectomia nativa ipsilaterale ed è stato dimostrato che presenta un tasso di perdita ureterale più elevato. 2
L'ultima considerazione in questo caso - e che rimane controversa nella letteratura sui trapianti di rene - è l'uso dello stent ureterale. Diversi studi hanno indagato i rischi e i benefici degli stent ureterali. Tra le complicazioni urologiche dopo il trapianto renale, la maggior parte deriva dall'anastomosi vesicoureterica. Il beneficio terapeutico dello stent ureterale è che semplifica la creazione di una mucosa ureterica impermeabile all'anastomosi della mucosa della vescica e riduce il piegamento anatomico. Tuttavia, i rischi significativi associati all'uso dello stent includono infezioni urinarie ricorrenti e eventuale perdita di innesti. Nel complesso, la letteratura non è stata in grado di valutare adeguatamente la morbilità e il costo dello stent universale e, di conseguenza, questa pratica rimane una valutazione e decisione da chirurgo a chirurgo al momento dell'intervento. 17 In questo caso, il chirurgo responsabile scoprì che il rene donatore aveva un bacino renale extra e, prima di completare l'anastomosi ureterale, sembrava esserci una pienezza del bacino renale. Di conseguenza, è stato posizionato un doppio stent J da 4,7 Fr.
In sintesi, questo caso evidenzia un trapianto preventivo di rene vivente. Il paziente presentato è stato abbastanza fortunato da avere un donatore vivente che non solo era disposto a donare, ma era anche ritenuto idoneo alla donazione. Gli esiti della donazione vivente sono superiori a quelli di una donazione deceduta, specialmente se eseguiti prima dell'inizio della dialisi, come è avvenuto con questo paziente. Man mano che la lista d'attesa per il trapianto di rene continua a crescere, l'importanza della donazione di vita continuerà a crescere. È quindi fondamentale che i centri di trapianto di rene in tutti gli Stati Uniti incoraggino la donazione di vita. Uno sviluppo promettente è la diffusione delle nefrectomie laparoscopiche con donatore. Questa tecnica, ora utilizzata in oltre il 90% delle nefrectomie con donatore, riduce i tempi di recupero per i donatori viventi. 11 Questo è un esempio del lavoro che deve continuare a incentivare la donazione - sia in modo ridotto che in vita - per aiutare a combattere la carenza di organi per chi ha l'ESRD.
Le pinze Fogarty Hydragrip venivano utilizzate per la serratura dei vasi iliaci. Edward Lifesciences fornisce gli inserti Hydragrip per il Fogarty Clamp. Si ritiene che queste pinze meno traumatiche riducano il rischio di dissezione. Durante l'esecuzione dell'anastomosi arteriosa, per l'arteriotomia viene utilizzato un punzone aortico di Teleflex Medical.
Nessuno.
Corey Eymard, MGH Transplant Fellowship, ha eseguito questa procedura insieme alla Dott.ssa Nahel Elias.
Il consenso per l'uso della storia clinica, della radiologia e del video intraoperatorio è stato ottenuto dal paziente e dai medici coinvolti nella compilazione di questo rapporto e nelle riprese.
References
- Istituto per il Miglioramento dell'Assistenza Sanitaria. Aggiornamento sulla donazione di organi: il successo porta nuove sfide. Disponibile su: http://www.ihi.org/resources/Pages/ImprovementStories/OrganDonationUpdateSuccessBringsNewChallenges.aspx
- Pereira BJG, Sayegh MH, Blake P. Malattia renale cronica, dialisi e trapianto. 2ª edizione. Philadelphia, PA: Elsevier Saunders; 2005.
- Humar A, Dunn DL. Capitolo 11: Trapianto. In: I principi della chirurgia di Schwartz. 9e edizione. New York, NY: McGraw-Hill; 2010.
- Colpo, JD. Capitolo 45: Trapianto di Organo. In: Diagnosi e trattamento attuali. 13ª edizione 16, New York, NY: McGraw-Hill; 2006.16. Monga M. Ureteroscopia. New York: Humana Press, 2013.
- Sistema Dati Renali degli Stati Uniti. Rapporto annuale USRDS 2020: Epidemiologia delle malattie renali negli Stati Uniti. Istituti Nazionali di Salute, Istituto Nazionale di Diabete e Malattie Digestive e Renali, Bethesda, MD, 2020.
- Davis CL, Delmonico FL. Trapianto di rene con donatore vivente: una revisione delle pratiche attuali per il donatore vivo. J Am Soc Nephrol. luglio 2005; 16(7):2098-110. doi:10.1681/ASN.2004100824.
- Murray JE, Merrill JP, Harrison JH, Wilson RE, Dammin GJ. Sopravvivenza prolungata degli omoinnesti umano-rene tramite terapia farmacologica immunosoppressiva. N Engl J Med. 13 giugno 1963;268:1315-23. doi:10.1056/NEJM196306132682401.
- Klein AS, Messersmith EE, Ratner LE, Kochik R, Baliga PK, Ojo AO. Donazione e utilizzo di organi negli Stati Uniti, 1999-2008. Sono J Transplant. aprile 2010; 10(4 Pt 2): 973-86. doi:10.1111/j.1600-6143.2009.03008.x.
- Rete per l'Acquisizione e Trapianto di Organi. Data. Disponibile a: https://optn.transplant.hrsa.gov/data.
- Statistiche sulla donazione e il trapianto di organi. Fondazione Nazionale per i Reni. 2016. Disponibile su: https://www.kidney.org/news/newsroom/factsheets/Organ-Donation-and-Transplantation-Stats.
- Axelrod DA, McCullough KP, Brewer ED, Becker BN, Segev DL, Rao PS. Trapianto di rene e pancreas negli Stati Uniti, 1999-2008: il volto in evoluzione della donazione di vita. Sono J Transplant. aprile 2010; 10(4 Pt 2): 987-1002. doi:10.1111/j.1600-6143.2010.03022.x.
- Meier-Kriesche HU, Kaplan B. Il tempo di attesa per la dialisi è il fattore di rischio modificabile più forte per gli esiti del trapianto renale: un'analisi renale abbinata con donatore. Trapianto. 27 novembre 2002; 74(10):1377-81. doi:10.1097/00007890-200211270-00005.
- Kasiske BL, Snyder JJ, Matas AJ, Ellison MD, Gill JS, Kausz AT. Trapianto renale preventivo: il vantaggio e il vantaggio. J Am Soc Nephrol. maggio 2002; 13(5):1358-64. doi:10.1097/01.asn.0000013295.11876.c9.
- Ibrahim HN, Foley R, Tan L, e altri. Conseguenze a lungo termine della donazione di rene. N Engl J Med. 29 gennaio 2009; 360(5):459-69. doi:10.1056/NEJMoa0804883.
- Merrill JP, Murray JE, Harrison JH, WR della Guild. Trapianto riuscito del rene umano tra gemelli identici. J Am Medico Associato. 28 gennaio 1956; 160(4):277-82. doi:10.1001/jama.1956.02960390027008.
- Monga M. Ureteroscopia. New York: Humana Press, 2013.
- Wilson CH, Bhatti AA, Rix DA, Manas DM. Stent intraoperatorio di routine per i riceventi di trapianto renale. Trapianto. 15 ottobre 2005; 80(7):877-82. doi:10.1097/01.tp.0000181197.21706.fa.
- Aravindan N, Shaw A. Effetto dell'infusione di furosemide sull'emodinamica renale e sull'espressione genica dell'angiogenesi nell'ischemia renale/reperfusione acuta. Fallimento Ren. 2006; 28(1):25-35. doi:10.1080/08860220500461229.
- Siedlecki A, Irlandese W, Brennan DC. Ritardo nella funzione dell'innesto nel trapianto di rene. Sono J Transplant. novembre 2011; 11(11):2279-96. doi:10.1111/j.1600-6143.2011.03754.x.
Cite this article
Westfal ML, Elias N. Trapianto di rene ricevente da donatore vivente. J Med Insight. 2023; 2023(171). doi:10.24296/jomi/171.

