Greffe de rein receveur d’un donneur vivant
Main Text
Table of Contents
L’insuffisance rénale terminale (IRT) est le dernier stade de la progression de l’insuffisance rénale chronique (IRC). L’IRC a une multitude d’étiologies, se présente de diverses manières et progresse en fonction du patient. Malgré l’hétérogénéité de l’IRC, une fois que l’IRT s’ensuit, les patients ont besoin d’un traitement de remplacement rénal (RRT). La RRT est l’un des trois volets suivants : l’hémodialyse, la dialyse péritonéale ou la greffe de rein. Parmi ceux-ci, la transplantation rénale offre au patient la meilleure qualité de vie, une meilleure survie et une possibilité de guérison. Cependant, le succès de la transplantation rénale avec de meilleurs résultats et une tolérance à l’immunosuppression requise a conduit à une pénurie extrême d’organes malgré l’augmentation du nombre de donneurs d’organes décédés. Par conséquent, la pression pour les donneurs vivants est devenue de plus en plus importante. Pour les receveurs, les meilleurs résultats sont avec les greffes d’un donneur vivant en raison de la qualité supérieure des greffons et de l’élimination de la nécessité d’attendre et de dialyse. Cet article présentera un tel cas et discutera des considérations importantes qu’un médecin doit prendre en compte avant et pendant l’opération lors de la réalisation d’une transplantation rénale.
La définition de l’insuffisance rénale chronique (IRC) de la National Kidney Foundation a été établie afin de normaliser l’approche des soins pour cette population de patients. L’IRC est définie comme une lésion rénale d’une durée supérieure ou égale à 3 mois due à des anomalies structurelles ou fonctionnelles du rein et/ou à un débit de filtration glomérulaire (DFG) de < 60 mL/min/1,73 m2. Les stades de l’IRC varient selon le niveau de DFG : au stade I, le DFG est ≥ 90 ; au stade II, le DFG est de 60 à 89 ; au stade III, le DFG est de 30 à 59 ; au stade IV, le DFG est de 15 à 29 ; et au stade V (insuffisance rénale), le DFG est < 15 ou la dépendance à la dialyse. 2 Dans ce rapport de cas, nous discuterons d’un patient atteint d’une insuffisance rénale terminale (IRC de stade V) qui a subi une greffe de rein apparentée vivante avant le début de la dialyse.
Il s’agit d’une femme de 56 ans ayant des antécédents médicaux de diabète sucré de type I, d’hypertension, d’hypothyroïdie, d’hyperlipidémie et d’insuffisance rénale terminale secondaire à des néphropathies diabétiques et hypertensives, qui s’est présentée au Massachusetts General Hospital pour une greffe de rein apparentée vivante de sa sœur.
Ses antécédents chirurgicaux sont significatifs pour une césarienne et une fistule AV du membre supérieur gauche. Ses médicaments notables comprennent l’amlodipine, le calcitriol, la lévothyroxine, l’olmésartan, la pravastatine, le lasix et le kayexalate. Elle est allergique à l’aspirine et à la pénicilline. Sur le plan social, la patiente vit avec son mari et enseigne dans une école primaire locale. Elle a un chien vacciné et une tortue comme animaux de compagnie, mais note qu’elle ne s’occupera plus de sa tortue après la greffe. Elle ne boit pas d’alcool et était une ancienne fumeuse avec des antécédents de 1 paquet-an, arrêtant en 1979. Elle nie toute consommation de drogues illicites. Elle nie avoir récemment voyagé ou été exposée à la tuberculose dans son passé.
Lors de l’examen préopératoire, il a été noté que la patiente était une femme de 56 ans qui semblait bien paraître. Son examen abdominal s’est avéré être dans les limites normales avec un abdomen mou et non distendu et une incision chirurgicale bien cicatrisée de sa césarienne. Son pouls fémoral et pédial était palpable bilatéralement. Chez un patient atteint d’IRT qui est envisagé pour une greffe rénale, il est important d’évaluer le pouls des membres inférieurs pour détecter un signe de maladie vasculaire périphérique importante. Il s’agit d’assurer une maladie athéroscléreuse minimale où l’artère du rein transplanté sera anastomosée sur les vaisseaux iliaques du receveur. Toute maladie artérielle périphérique (MAP) importante dans le système aorto-iliaque pourrait compromettre la circulation vers l’allogreffe ou vers le membre inférieur ipsilatéral en raison de la dissection distale des artères ilio-fémorales, ou elle pourrait voler la circulation du membre inférieur par l’allogreffe. deux
En général, l’évaluation cardiaque avant la transplantation rénale comprend : l’ECG et l’échocardiographie. De plus, un test d’effort et/ou une coronarographie sont effectués pour les patients hospitalisés ayant des antécédents de coronaropathie ou des facteurs de risque importants (diabète sucré, hémodialyse depuis plus d’un an, hypertrophie ventriculaire gauche, âge de > 60 ans, antécédents de tabagisme, hypertension ou hyperlipidémie). Chez les patients présentant des symptômes ou des signes d’anomalies mictionnelles ou d’obstruction urinaire (par exemple prostatique), une cysto-uréthrographie mictionnelle et une évaluation complète des voies urinaires inférieures sont nécessaires pour exclure une obstruction de la sortie. 3 Si le patient a des antécédents de maladie vasculaire périphérique ou des résultats inquiétants à l’examen vasculaire, le patient doit subir des enregistrements du volume du pouls (PVR) des membres inférieurs et/ou une tomodensitométrie de l’abdomen et du bassin (sans contraste) pour évaluer les calcifications iliaques.
Ce patient a subi un ECG préopératoire qui n’a montré ni arythmie ni ischémie. Cependant, étant donné que ses antécédents médicaux comprenaient plusieurs facteurs de risque de maladie coronarienne, elle a subi une coronarographie qui a exclu les lésions athéroscléreuses graves. Une radiographie pulmonaire préopératoire a montré des signes de granulomatose antérieure, et une tomodensitométrie thoracique de suivi l’a confirmé sans autres résultats inquiétants (figures 1 à 3).
De plus, sa sœur donneuse a subi le bilan préopératoire standard du donneur. Il s’agit notamment d’assurer une fonction rénale adéquate et un risque minimal d’être unéphrique en postopératoire. L’élimination des maladies infectieuses et des tumeurs malignes est également requise. Enfin, une imagerie rénale a permis de comparer la taille des reins et leur système vasculaire afin de déterminer la latéralité de la procédure du donneur. .
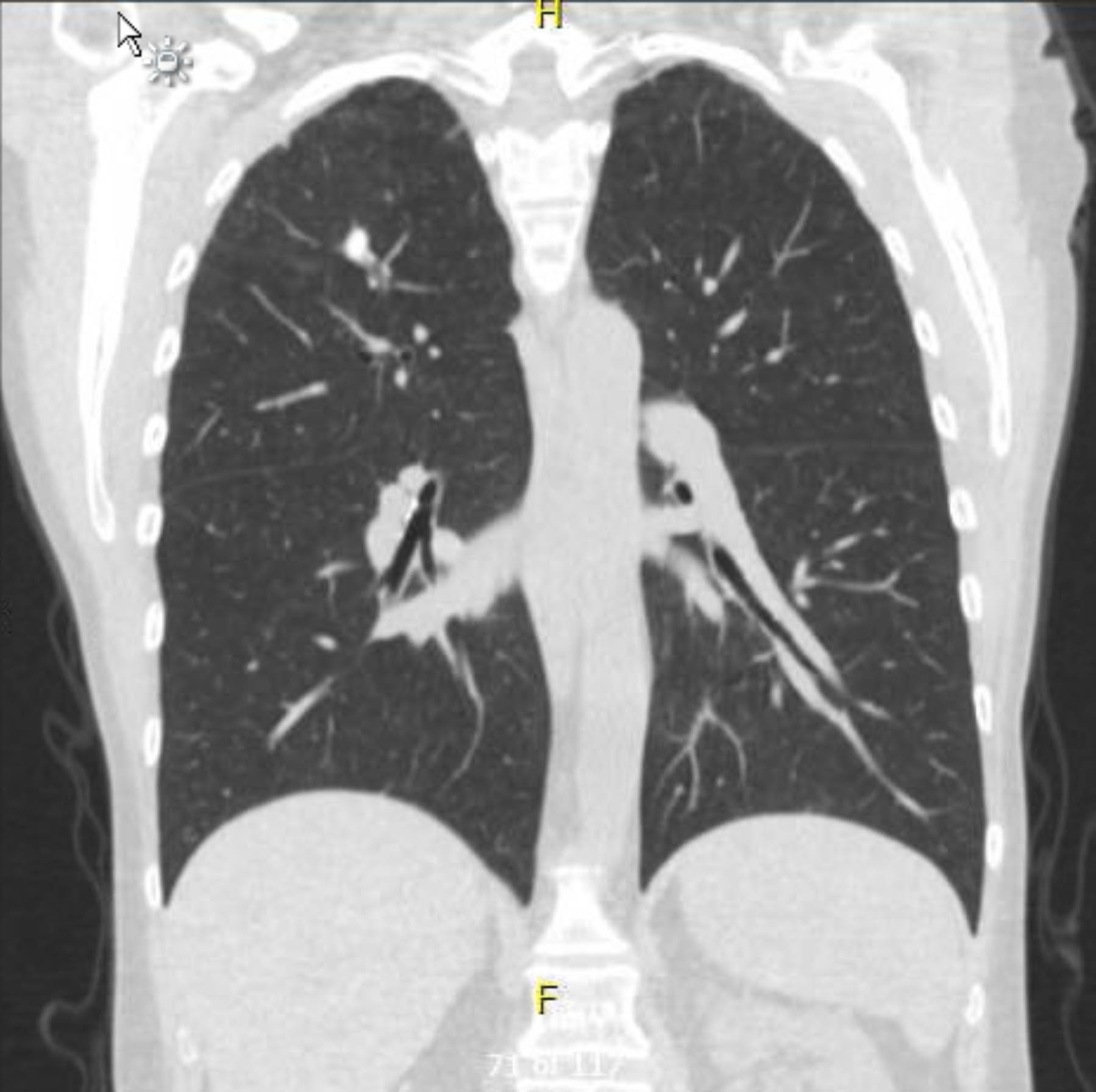
Graphique 1. TDM thoracique préopératoire sans contraste. Vue coronale. Modifications granulomateuses à l’apex droit.
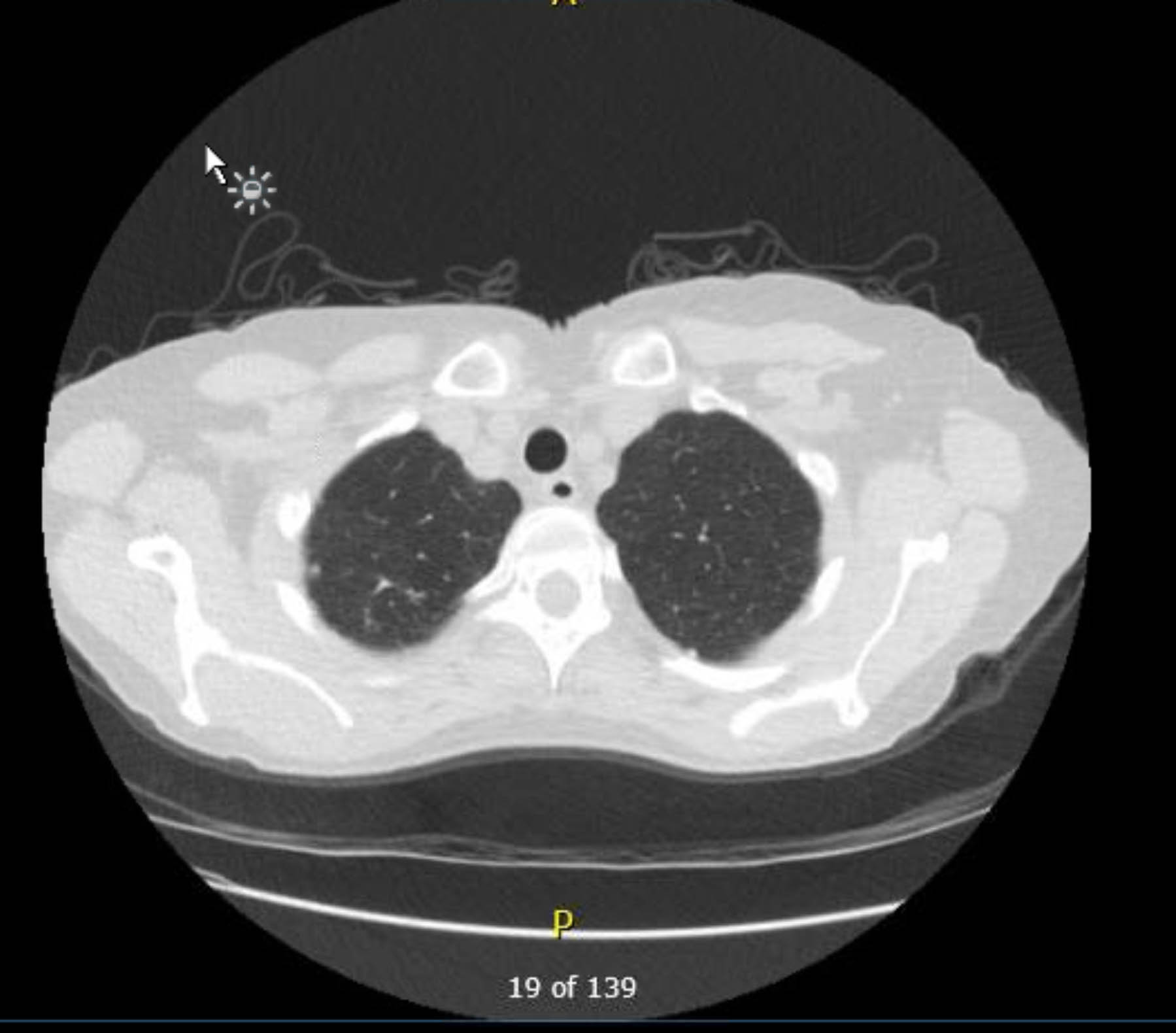
Graphique 2. TDM thoracique préopératoire sans contraste. Vue axiale. Modifications granulomateuses à l’apex droit.
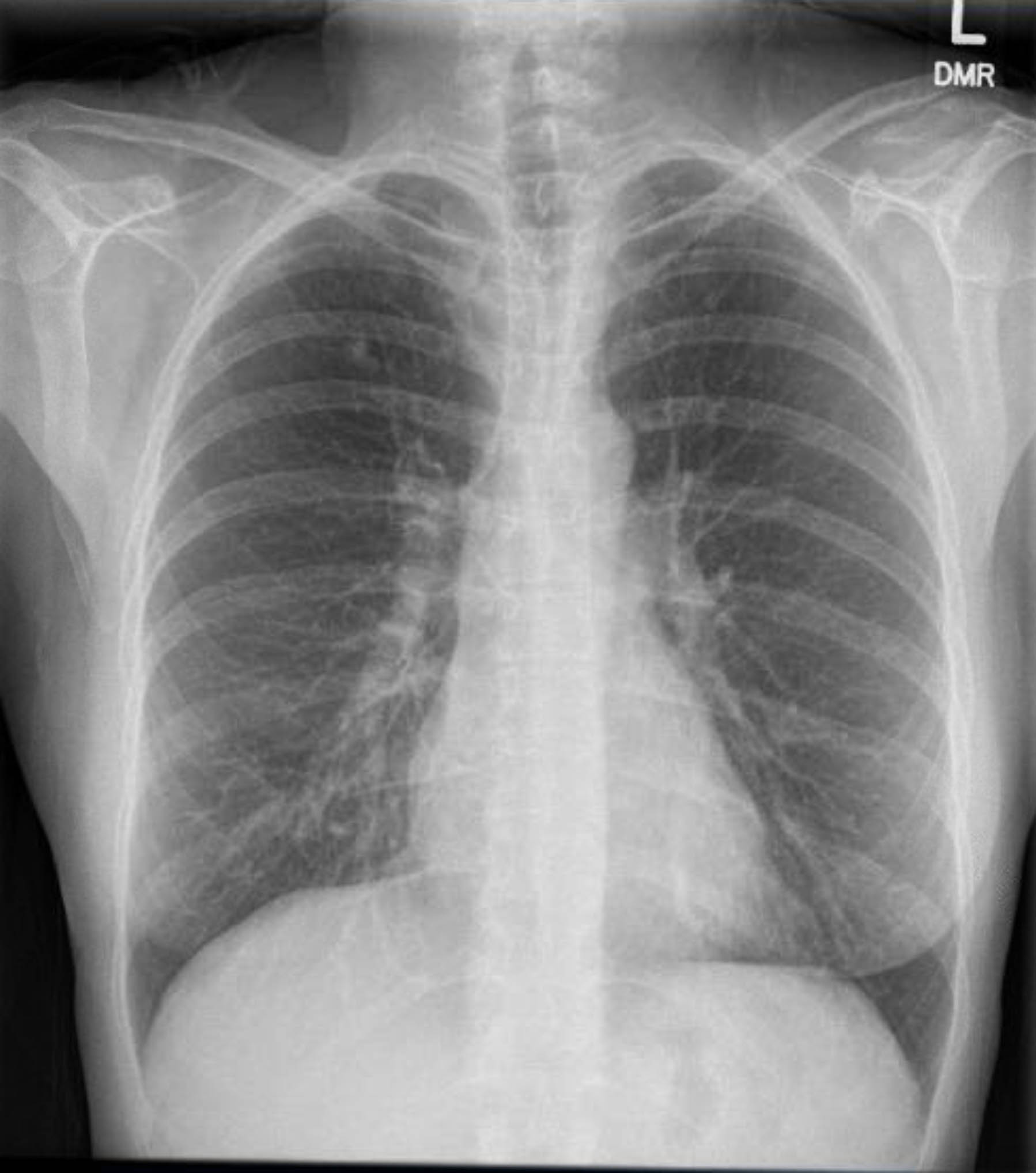
Graphique 3. Radiographie pulmonaire préopératoire. Granulomes calcifiés dans le lobe supérieur droit.
L’IRT a une présentation et une progression de la maladie très hétérogènes. Aux États-Unis, la cause la plus fréquente d’insuffisance rénale chronique est le diabète sucré, qui représente 45 % de toutes les insuffisances rénales. Les deuxième et troisième causes les plus fréquentes sont la néphropathie hypertensive (27 %) et la glomérulonéphrite chronique (11 %), respectivement. 4 La progression de l’IRC vers l’IRT nécessite qu’un patient subisse une hémodialyse pour aider à l’équilibre des fluides corporels et à la filtration des électrolytes, des métabolites, des hormones et des toxines. Si le patient ne subit pas de dialyse, il doit subir une greffe de rein ou sa maladie sera mortelle.
Les options de traitement de l’IRT sont la dialyse (dialyse péritonéale ou hémodialyse) et/ou la transplantation. Aux États-Unis, en 2018, 85,9 % de tous les nouveaux cas d’IRT ont commencé un traitement de remplacement rénal par hémodialyse, 10,9 % ont commencé par une dialyse péritonéale et 2,9 % ont reçu une greffe de rein préventive. 5
La transplantation rénale provient d’un donneur décédé ou vivant. Si un membre de la famille ou un ami souhaite faire un don, mais que celui-ci n’est pas compatible, l’échange de donneurs vivants appariés (où un donneur échange son don avec un autre donneur afin que les receveurs reçoivent des reins compatibles) pourrait être une option, qui permettrait d’échanger des donneurs incompatibles avec leurs receveurs prévus, de sorte qu’au lieu de cela, chaque donneur donne un rein à un receveur compatible. Enfin, les donneurs altruistes non dirigés nécessitent un processus très rigoureux pour sélectionner soigneusement un donneur et dans une étude, il a été constaté que près de 60 % des donneurs altruistes non dirigés abandonnent après une évaluation initiale et une séance d’éducation, ce qui en fait une source non durable de donneurs. 6 Si les donneurs altruistes terminent l’évaluation et sont acceptés comme candidats potentiels au donneur, nous avons l’habitude de leur faire démarrer une chaîne d’échange par paires. Cela se fait en les associant à un receveur qui a un donneur incompatible, qui fera ensuite un don à quelqu’un d’autre, et ainsi de suite. Plusieurs destinataires en bénéficieront au lieu de les associer à un seul destinataire.
Malgré une variété de modalités de traitement de l’IRT, la transplantation rénale reste le traitement de remplacement rénal le plus définitif et le plus durable. Elle offre une meilleure qualité de vie, est plus rentable que la dialyse et améliore la survie globale. 3 En fait, l’espérance de vie double environ avec la greffe de rein dans toutes les tranches d’âge si l’on compare la mortalité des patients pré-transplantation à celle des patients post-greffe. 4
Lors du choix entre un rein de donneur décédé et un rein de donneur vivant, plusieurs études ont déterminé que les reins de donneur vivant ont de meilleurs résultats post-greffe avec une incidence plus faible de retard de la fonction du greffon postopératoire compte tenu de la courte période ischémique. Les donneurs vivants fournissent également des fonctions de greffe rénale plus longues chez le receveur, probablement liées à la santé du donneur. Parmi les autres avantages, citons l’évitement d’un temps d’attente prolongé en dialyse et la possibilité de coordonner les procédures du donneur et du receveur en temps opportun. 3 La meilleure survie postopératoire du greffon a été observée chez les patients qui reçoivent une greffe de rein, une prédialyse. 4 Pour la patiente présentée ici, elle a été en mesure de trouver un donneur vivant apparenté avant de commencer l’hémodialyse, ce qui présente la plus grande probabilité de survie au greffon par rapport aux patients qui reçoivent un rein de donneur décédé ou une transplantation après avoir été sous dialyse.
Comme mentionné ci-dessus, compte tenu de la présentation variable de l’IRT et des différences dans la progression de la maladie, une évaluation préopératoire très approfondie avec une anamnèse complète, un examen physique et une imagerie appropriée sont nécessaires. Les contre-indications absolues à la greffe de rein qui doivent être exclues avant l’opération comprennent l’infection active, la malignité, l’abus de substances actives et les maladies psychiatriques mal contrôlées. 3 D’autres considérations importantes incluent une évaluation cardiovasculaire et vasculaire périphérique approfondie, car ces deux facteurs pourraient empêcher le patient d’être un receveur de rein approprié.
Emerich Ullman a signalé la première tentative de transplantation rénale en 1902, mais la première greffe de rein réussie n’a été achevée qu’en 1954 lorsque Joseph Murray a contourné la barrière immunologique et a réalisé une greffe de rein entre deux jumeaux identiques sans utiliser d’immunosuppression. Au cours de la même décennie, les stéroïdes et les radiations ont été les premiers immunosuppresseurs utilisés, mais c’est l’introduction de l’Azathioprine (Imuran) vers 1960 qui a marqué le début d’une nouvelle ère de transplantation rénale. Au cours des trois décennies suivantes, l’immunosuppression a continué d’évoluer, de sorte que ces médicaments ont maintenant un profil de toxicité plus faible et sont mieux tolérés par les patients. 7
Malheureusement, le plus grand défi de la transplantation est la pénurie d’organes disponibles pour les personnes dans le besoin. Le succès de la transplantation d’organes solides est, ironiquement, le facteur le plus responsable de la pénurie critique ; L’amélioration des taux de survie et de la tolérance à l’immunosuppression a encouragé les médecins et les patients à opter pour la transplantation. 1,8 Les patients qui ont besoin de ces organes sont ceux qui souffrent d’insuffisance rénale terminale. En 2018, la prévalence de l’IRT aux États-Unis était de 785 883 avec une incidence de 131 779. 5 Il y a 88 627 personnes sur la liste d’attente pour une greffe de rein, et environ 3 700 patients s’ajoutent chaque mois. Le nombre de greffes de rein effectuées chaque année chez des donneurs de rein vivants et décédés a augmenté, mais il reste inférieur à 30 000 (25 500 en 2022). 9 Ainsi, le temps d’attente médian est de 3,6 ans. 10 Le patient présenté dans ce cas est une femme de 56 ans qui souffrait d’une IRT secondaire à des néphropathies diabétiques et hypertensives et qui a subi une greffe de rein vivante préventive.
La greffe de rein préventive est une situation unique en ce sens que le patient atteint d’IRT n’a pas encore commencé la dialyse avant de subir une transplantation. Seulement 2,9 % des patients aux États-Unis ont subi une transplantation rénale comme mode initial de traitement de l’IRT. 5 Dans une revue de la littérature, plusieurs articles suggèrent que le don vivant offre une meilleure survie du patient et de l’allogreffe par rapport à la transplantation de donneur décédé, en particulier lorsque la greffe de donneur vivant est réalisée de manière préventive sans dialyse. 6 La transplantation de donneurs vivants réduit les temps d’attente en dialyse, permet des séjours à l’hôpital plus courts et moins coûteux et, dans l’ensemble, améliore les résultats post-greffe. 11 Lorsqu’il est effectué avant le début de la dialyse, le patient est en mesure d’éviter la morbidité de la dialyse, les procédures d’accès à la dialyse et le coût associé à ce traitement. Le temps d’attente en dialyse avant la transplantation a été étudié et s’est avéré quantitativement être l’un des plus grands facteurs de risque indépendants de perte de greffon après une greffe de rein. 12 Les résultats postopératoires des patients qui reçoivent une prédialyse de greffe montrent des taux plus faibles de fonction de greffe retardée par rapport aux greffes non préventives. 13 Du point de vue du donneur, les donneurs de rein vivants ont une survie similaire à celle des non-donneurs, et leur risque d’IRT n’est pas significativement augmenté. 14
D’un point de vue chirurgical, plusieurs décisions ont été prises tout au long de cette affaire qui méritent d’être approfondies. La première décision clinique était liée à l’exposition chirurgicale. Dans l’histoire de la transplantation rénale, il fut un temps où le haut de la cuisse était le lieu de la transplantation. Cependant, cela a été interrompu car il nécessite une urétérostomie cutanée, qui présente un risque significativement plus élevé d’infection ascendante. En 1956, Merrill et Murray ont décrit la première greffe à l’aide de la fosse iliaque. Ils ont noté que la fosse rénale n’a pas été choisie parce qu’elle nécessite une néphrectomie simultanée et nécessite une anastomose urétérou-rétérale, ce qui expose l’uretère à un risque élevé de formation de rétrécissement. En conséquence, il a été conclu que la fosse iliaque permettait l’accès à un apport sanguin adéquat à l’aide des vaisseaux iliaques ainsi qu’un drainage urétéral accessible dans la vessie directement par urétéronéocystostomie. 15 Les reins sont généralement placés dans la fosse iliaque droite (le côté controlatéral du rein donné) car la plupart des néphrectomies du donneur sont du côté gauche compte tenu de l’augmentation de la longueur de la veine rénale. 2 Cependant, dans ce cas, la patiente a subi une transplantation dans la fosse iliaque gauche étant donné qu’elle a des antécédents de diabète sucré de type I et qu’elle pourrait nécessiter une greffe de pancréas à l’avenir (qui est généralement placée dans la fosse iliaque droite). La dernière approche qui est parfois envisagée, en fonction des antécédents chirurgicaux et de l’anatomie vasculaire du patient, est une approche intrapéritonéale.
La prochaine étape importante de cette opération est l’anastomose vasculaire. La veine rénale est le plus souvent anastomosée en premier et généralement à la veine iliaque externe de bout en bout, mais cet emplacement varie par rapport à l’anastomose artérielle. L’anastomose artérielle peut relier l’artère rénale du donneur à l’artère iliaque commune, externe ou interne du receveur, et la procédure a évolué au fil du temps. Historiquement, l’iliaque interne était préférentiellement sélectionnée pour une anastomose de bout en bout de l’artère rénale du donneur ; Cependant, cela ne s’est pas avéré supérieur à l’approche ultérieure de l’extrémité à côté de l’artère rénale par rapport à l’artère iliaque commune ou externe. Ainsi, l’anastomose la plus courante réalisée aujourd’hui se situe entre l’artère rénale du donneur et le côté de l’artère iliaque externe receveuse car ce vaisseau n’a pas de branches dans le bassin et se trouve à proximité immédiate de la vessie, ce qui facilite la création de l’urétéronéocystostomie sans compromettre l’apport sanguin urétéral distal. Si le rein a été récupéré d’un donneur décédé, l’aorte du donneur est également récupérée et pourrait être façonnée en un patch Carrel et utilisée pour l’anastomose de l’artère iliaque commune ou externe. 2 Lors de l’obtention du rein du donneur, le nombre d’artères rénales est un facteur important. Lorsque le donneur est un donneur décédé, il est possible de conserver toutes les artères rénales provenant de l’aorte du donneur, y compris leurs origines dans le patch Carrel. Cependant, chez un donneur vivant, cela n’est pas faisable et plusieurs artères sont soit anastomosées séparément, soit plus fréquemment, elles sont anastomosées ensemble en une seule artère avant d’implanter le rein. S’il y a de petites artères accessoires alimentant le pôle supérieur du rein, elles sont souvent ligaturées. Les artères polaires inférieures sont plus susceptibles d’alimenter l’uretère et, par conséquent, moins susceptibles d’être ligaturées car l’apport sanguin à l’uretère doit être optimal.
La dernière anastomose à considérer est la construction de l’anastomose urétérale du donneur à la vessie receveuse. Tout au long des années de transplantation rénale, il y a eu plusieurs approches de l’urétéronéocystostomie, l’implantation de l’uretère du donneur dans la vessie receveuse. Initialement, l’anastomose la plus largement utilisée était la technique Leadbetter-Politano, une technique intravésicale qui nécessite une exposition via une cystostomie antérieure pour permettre le creusement d’un tunnel sous-muqueux de l’uretère et le placement du néo-orifice dans un endroit proche de l’anatomie. 16 L’approche extravésicale la plus récente, développée par Lich et Gregoir, est employée par la plupart des centres de transplantation aujourd’hui et est l’approche utilisée dans ce cas. Une seule petite cystotomie est créée au niveau du dôme de la vessie, et l’uretère distal du donneur est anastomosé à la muqueuse de la vessie. Une couche séromusculaire est ensuite fermée sur l’uretère. 2 La dernière méthode est l’urétéro-pyélostomie, une anastomose entre l’uretère receveur et la partie la plus basse du bassinet du rein du donneur. Cette approche n’est pas fréquemment utilisée car elle nécessite souvent une néphrectomie native ipsilatérale et il a été démontré qu’elle a un taux de fuite urétérale plus élevé. deux
La dernière considération dans ce cas - et qui reste controversée dans la littérature sur la transplantation rénale - est l’utilisation d’une endoprothèse urétérale. Plusieurs études ont examiné les risques et les avantages des endoprothèses urétérales. Parmi les complications urologiques après une transplantation rénale, la plupart proviennent de l’anastomose vésico-urétérale. L’avantage thérapeutique d’un stent urétéral est qu’il simplifie la création d’une anastomose étanche de la muqueuse urétérale à la muqueuse de la vessie et réduit le pliage anatomique. Cependant, les risques importants associés à l’utilisation d’un stent comprennent des infections urinaires récurrentes et une éventuelle perte de greffe. Dans l’ensemble, la littérature n’a pas été en mesure d’évaluer adéquatement la morbidité et le coût de la pose d’une endoprothèse universelle et, par conséquent, cette pratique demeure une évaluation et une décision de chirurgien à chirurgien au moment de la chirurgie. 17 Dans ce cas, le chirurgien traitant a découvert que le rein du donneur avait un bassinet extra-rénal et, avant de terminer l’anastomose urétérale, il semblait y avoir une plénitude du bassinet du rein. En conséquence, un stent double J de 4,7 Fr. a été placé.
En résumé, ce cas met en évidence une greffe de rein préventive apparentée à des êtres vivants. Le patient présenté a eu la chance d’avoir un donneur vivant qui était non seulement disposé à faire un don, mais qui a également été jugé apte au don. Les résultats du don vivant sont supérieurs à ceux du don décédé, en particulier lorsqu’il est effectué avant le début de la dialyse, comme ce fut le cas chez ce patient. À mesure que la liste d’attente pour une transplantation rénale continue de s’allonger, l’importance du don vivant continuera d’augmenter. Il est donc impératif que les centres de transplantation rénale à travers les États-Unis encouragent le don vivant. Un développement prometteur est la diffusion des néphrectomies de donneur par laparoscopie. Cette technique, maintenant utilisée dans plus de 90 % des néphrectomies de donneurs, réduit le temps de récupération des donneurs vivants. 11 Il s’agit d’un exemple du travail qui doit se poursuivre pour encourager le don - qu’il soit diminué ou vivant - afin d’aider à lutter contre la pénurie d’organes pour les personnes atteintes d’insuffisance rénale terminale.
Les pinces Fogarty Hydragrip ont été utilisées lors du serrage des vaisseaux iliaques. Edward Lifesciences fournit les inserts Hydragrip pour la pince Fogarty. On pense que ces pinces moins traumatiques diminuent le risque de dissection. Lors de la réalisation de l’anastomose artérielle, un coup de poing aortique de Teleflex Medical est utilisé pour l’artériotomie.
Aucun.
Corey Eymard, boursier en transplantation de l’HGM, a effectué cette procédure avec le Dr Nahel Elias.
Le consentement à l’utilisation de l’anamnèse, de la radiologie et de la vidéo peropératoire a été obtenu du patient et des prestataires impliqués dans la compilation de ce rapport de cas et le tournage.
References
- Institut pour l’amélioration des soins de santé. Mise à jour sur le don d’organes : le succès apporte de nouveaux défis. Disponible à l’adresse : http://www.ihi.org/resources/Pages/ImprovementStories/OrganDonationUpdateSuccessBringsNewChallenges.aspx
- Pereira BJG, Sayegh MH, Blake P. Maladie rénale chronique, dialyse et transplantation. 2e éd. Philadelphie, Pennsylvanie : Elsevier Saunders ; 2005.
- Humar A, Dunn DL. Chapitre 11 : Transplantation. Dans : Les principes de chirurgie de Schwartz. 9e éd. New York, NY : McGraw-Hill ; 2010.
- Punch, JD. Chapitre 45 : Transplantation d’organes. Dans : Diagnostic et traitement actuels. 13e éd. 16, New York, NY : McGraw-Hill ; 2006.16. Monga M. Urétéroscopie. New York : Humana Press, 2013.
- Système de données rénales des États-Unis. Rapport annuel sur les données de l’USRDS 2020 : Épidémiologie des maladies rénales aux États-Unis. Instituts nationaux de la santé, Institut national du diabète et des maladies digestives et rénales, Bethesda, MD, 2020.
- Davis CL, Delmonico FL. Transplantation rénale de donneur vivant : un examen des pratiques actuelles pour le donneur vivant. J Am Soc Nephrol. Juillet 2005 ; 16(7):2098-110. doi :10.1681/ASN.2004100824.
- Murray JE, Merrill JP, Harrison JH, Wilson RE, Dammin GJ. Survie prolongée des homogreffes de rein humain par un traitement médicamenteux immunosuppresseur. N Engl J Med. 13 juin 1963;268:1315-23. doi :10.1056/NEJM196306132682401.
- Klein AS, Messersmith EE, Ratner LE, Kochik R, Baliga PK, Ojo AO. Don et utilisation d’organes aux États-Unis, 1999-2008. Am J Greffe. avril 2010 ; 10(4 Pt 2) :973-86. doi :10.1111/j.1600-6143.2009.03008.x.
- Réseau d’approvisionnement et de transplantation d’organes. Données. Disponible à l’adresse : https://optn.transplant.hrsa.gov/data.
- Statistiques sur le don et la transplantation d’organes. Fondation nationale du rein. 2016. Disponible à l’adresse : https://www.kidney.org/news/newsroom/factsheets/Organ-Donation-and-Transplantation-Stats.
- Axelrod DA, McCullough KP, Brewer ED, Becker BN, Segev DL, Rao PS. Transplantation de rein et de pancréas aux États-Unis, 1999-2008 : le visage changeant du don vivant. Am J Greffe. avril 2010 ; 10(4 Pt 2) :987-1002. doi :10.1111/j.1600-6143.2010.03022.x.
- Meier-Kriesche HU, Kaplan B. Le temps d’attente en dialyse comme facteur de risque modifiable le plus fort pour les résultats de la transplantation rénale : une analyse rénale de donneur apparié. Transplantation. 27 novembre 2002 ; 74(10):1377-81. doi :10.1097/00007890-200211270-00005.
- Kasiske BL, Snyder JJ, Matas AJ, Ellison MD, Gill JS, Kausz AT. Transplantation rénale préventive : l’avantage et l’avantage. J Am Soc Nephrol. mai 2002 ; 13(5):1358-64. doi :10.1097/01.asn.0000013295.11876.c9.
- Ibrahim HN, Foley R, Tan L, et al. Conséquences à long terme du don de rein. N Engl J Med. 29 janvier 2009 ; 360(5):459-69. doi :10.1056/NEJMoa0804883.
- Merrill JP, Murray JE, Harrison JH, Guild WR. Homotransplantation réussie du rein humain entre jumeaux identiques. J Am Med Assoc. 28 janvier 1956 ; 160(4):277-82. doi :10.1001/jama.1956.02960390027008.
- Monga M. Urétéroscopie. New York : Humana Press, 2013.
- Wilson CH, Bhatti AA, Rix DA, Manas DM. Endoprothèse peropératoire de routine pour les receveurs de greffe rénale. Transplantation. 15 octobre 2005 ; 80(7):877-82. doi :10.1097/01.tp.0000181197.21706.fa.
- Aravindan N, Shaw A. Effet de la perfusion de furosémide sur l’hémodynamique rénale et l’expression des gènes de l’angiogenèse dans l’ischémie/reperfusion rénale aiguë. Ren Fail. 2006; 28(1):25-35. doi :10.1080/08860220500461229.
- Siedlecki A, Irish W, Brennan DC. Retard de la fonction du greffon dans la greffe de rein. Am J Greffe. novembre 2011 ; 11(11):2279-96. doi :10.1111/j.1600-6143.2011.03754.x.
Cite this article
Westfal ML, Elias N. Greffe de rein receveur d’un donneur vivant. J Med Insight. 2023; 2023(171). doi :10.24296/jomi/171.

