Trasplante de riñón receptor de un donante vivo
Main Text
Table of Contents
La enfermedad renal terminal (ESRD, por sus siglas en inglés) es la etapa final en la progresión de la enfermedad renal crónica (ERC). La ERC tiene una multitud de etiologías, se presenta de diversas maneras y progresa de forma dependiente del paciente. A pesar de la heterogeneidad de la ERC, una vez que se produce la IRCT, los pacientes requieren terapia renal sustitutiva (TRS). La TRS es una de las tres puntas: hemodiálisis, diálisis peritoneal o trasplante de riñón. De estos, el trasplante renal proporciona al paciente la mejor calidad de vida, una mejor supervivencia y una oportunidad de curación. Sin embargo, el éxito del trasplante de riñón, con mejores resultados y tolerancia a la inmunosupresión requerida, ha llevado a una escasez extrema de órganos a pesar del aumento de donantes de órganos fallecidos. Como resultado, la presión por los donantes vivos se ha vuelto cada vez más importante. Para los receptores, los mejores resultados se obtienen con trasplantes de un donante vivo debido a la calidad superior del injerto y a la eliminación de la necesidad de esperar y diálisis. Este artículo presentará un caso de este tipo y discutirá las consideraciones importantes que un médico debe hacer antes y después de la operación al realizar trasplantes de riñón.
La definición de enfermedad renal crónica (ERC) de la National Kidney Foundation se estableció con el fin de estandarizar el enfoque de atención para esta población de pacientes. La ERC se define como daño renal durante más o igual a 3 meses por anomalías estructurales o funcionales del riñón y/o una tasa de filtración glomerular (TFG) de < 60 ml/min/1,73 m2. Los estadios de la ERC varían según el nivel de TFG: en el estadio I, el FG es ≥ 90; en el estadio II, la TFG es de 60 a 89; en el estadio III, la TFG es de 30 a 59; en el estadio IV, la TFG es de 15 a 29; y en el estadio V (insuficiencia renal), la TFG es < 15 o dependencia de diálisis. 2 En este reporte de caso, hablaremos de un paciente con enfermedad renal terminal (ERC en estadio V) que se sometió a un trasplante renal relacionado con la vida antes del inicio de la diálisis.
Se trata de una mujer de 56 años de edad, con antecedentes de diabetes mellitus tipo I, hipertensión arterial, hipotiroidismo, hiperlipidemia y enfermedad renal terminal secundaria a nefropatías diabéticas e hipertensivas, que acudió al Hospital General de Massachusetts para un trasplante renal de su hermana.
Su antecedente quirúrgico es significativo para una cesárea y una fístula AV en la extremidad superior izquierda. Sus medicamentos notables incluyen amlodipino, calcitriol, levotiroxina, olmesartán, pravastatina, lasix y kayexalate. Es alérgica a la aspirina y a la penicilina. Socialmente, la paciente vive con su esposo y enseña en una escuela primaria local. Tiene un perro vacunado y una tortuga como mascotas, pero señala que ya no cuidará de su tortuga después del trasplante. Ella no bebe alcohol y era una ex fumadora con un historial de 1 paquete-año, dejando de fumar en 1979. Ella niega cualquier consumo de drogas ilícitas. Ella niega haber viajado recientemente o haber estado expuesta a la tuberculosis en su pasado.
En el examen preoperatorio se observó que la paciente era una mujer de 56 años de edad. Se observó que su examen abdominal estaba dentro de los límites normales, con un abdomen blando y no distendido y una incisión quirúrgica bien curada de su cesárea. Sus pulsos femoral y pedal eran palpables bilateralmente. En un paciente con enfermedad renal terminal que está siendo considerado para un trasplante renal, es importante evaluar los pulsos de las extremidades inferiores en busca de evidencia de enfermedad vascular periférica significativa. Esto es para garantizar una enfermedad aterosclerótica mínima en la que la arteria del riñón trasplantado se anastomosará en los vasos ilíacos del receptor. Cualquier enfermedad arterial periférica (EAP) significativa en el sistema aortoilíaco podría comprometer la circulación al aloinjerto o a la extremidad inferior ipsilateral debido a la disección en las arterias iliofemorales distalmente, o podría robar la circulación de la extremidad inferior por el aloinjerto. número arábigo
En general, la evaluación cardíaca previa al trasplante de riñón incluye: electrocardiograma y ecocardiografía. Además, se realiza una prueba de esfuerzo y/o una angiografía coronaria a los pacientes hospitalizados con antecedentes de EAC o factores de riesgo significativos (diabetes mellitus, hemodiálisis mayor de un año, hipertrofia ventricular izquierda, edad de > 60 años, antecedentes de tabaquismo, hipertensión o hiperlipidemia). En pacientes con síntomas o signos de anomalías miccionales u obstrucción urinaria (p. ej., prostática), es necesario realizar una cistouretrografía miccional y una evaluación completa del tracto urinario inferior para descartar la obstrucción de la salida. 3 Si el paciente tiene antecedentes de enfermedad vascular periférica o cualquier hallazgo preocupante en el examen vascular, el paciente debe someterse a registros del volumen del pulso (PVR) de las extremidades inferiores y/o a una tomografía computarizada del abdomen y la pelvis (sin contraste) para evaluar las calcificaciones ilíacas.
A este paciente se le realizó un electrocardiograma preoperatorio que no mostró arritmia ni isquemia. Sin embargo, dado que sus antecedentes médicos incluían varios factores de riesgo de enfermedad arterial coronaria (EAC), se le realizó una coronariografía que excluyó lesiones ateroscleróticas graves. Una radiografía de tórax preoperatoria mostró evidencia de enfermedad granulomatosa previa, y una tomografía computarizada de tórax de seguimiento confirmó esto sin otros hallazgos preocupantes (Figuras 1-3).
Además, su hermana donante se sometió al estudio preoperatorio estándar de donante. Esto incluye asegurar una función renal adecuada y un riesgo mínimo de ser uninefrrico en el postoperatorio. También se requiere la eliminación de enfermedades infecciosas y neoplasias malignas. Finalmente, se realizaron imágenes renales para comparar el tamaño de los riñones y su vasculatura para determinar la lateralidad del procedimiento del donante. .
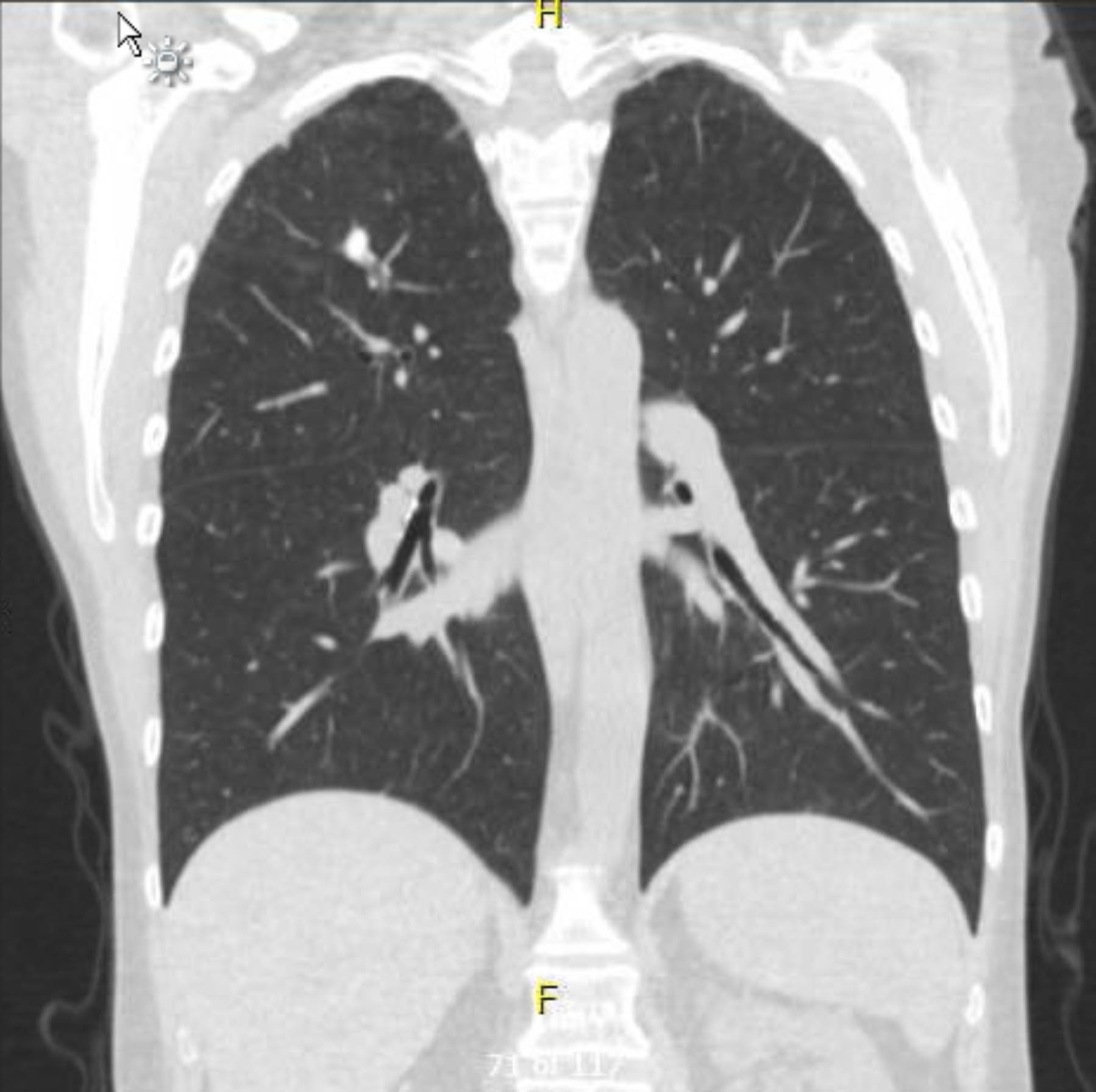
Figura 1. Tomografía computarizada de tórax sin contraste preoperatoria. Vista coronal. Cambios granulomatosos en el ápice derecho.
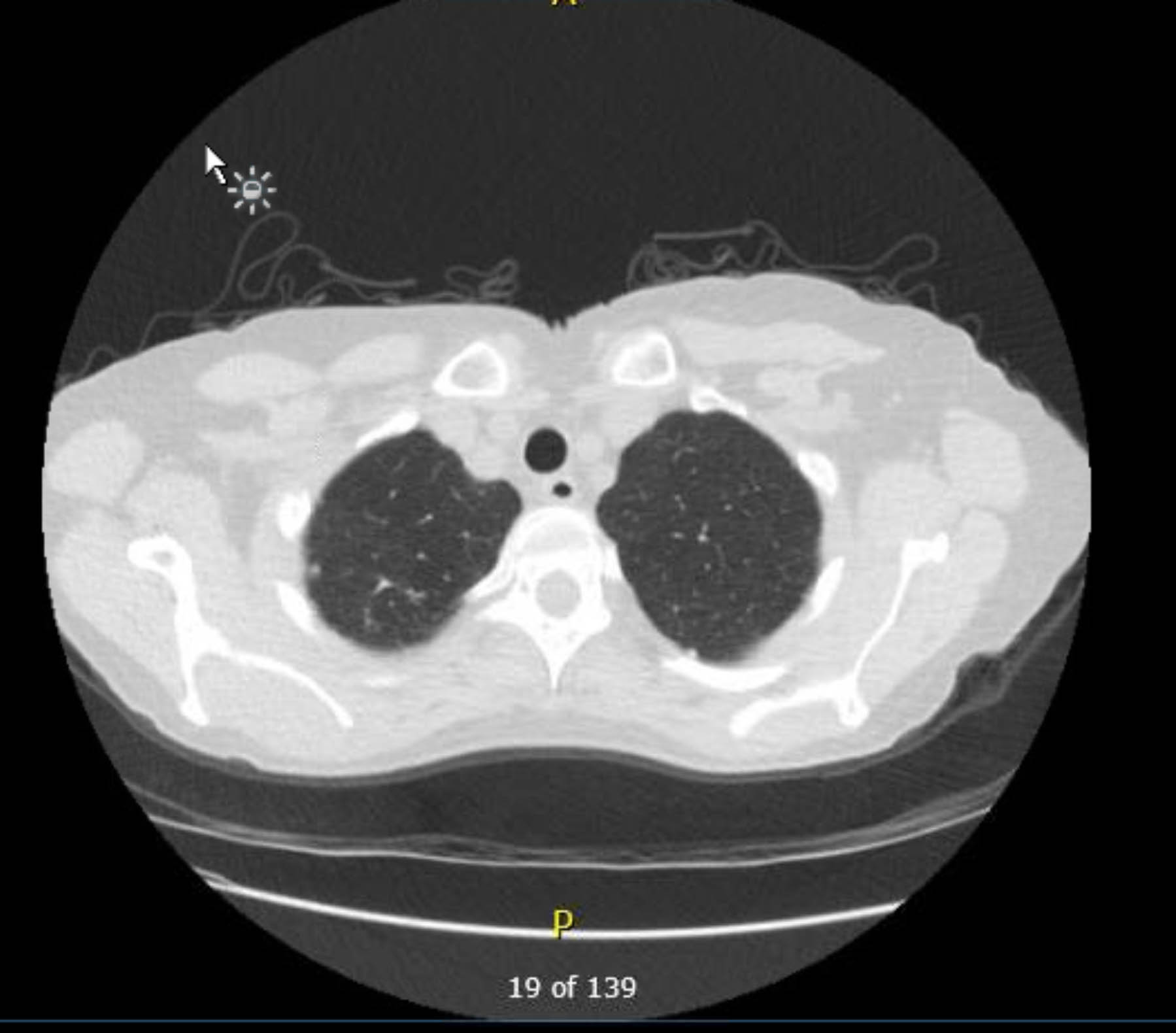
Figura 2. Tomografía computarizada de tórax sin contraste preoperatoria. Vista axial. Cambios granulomatosos en el ápice derecho.
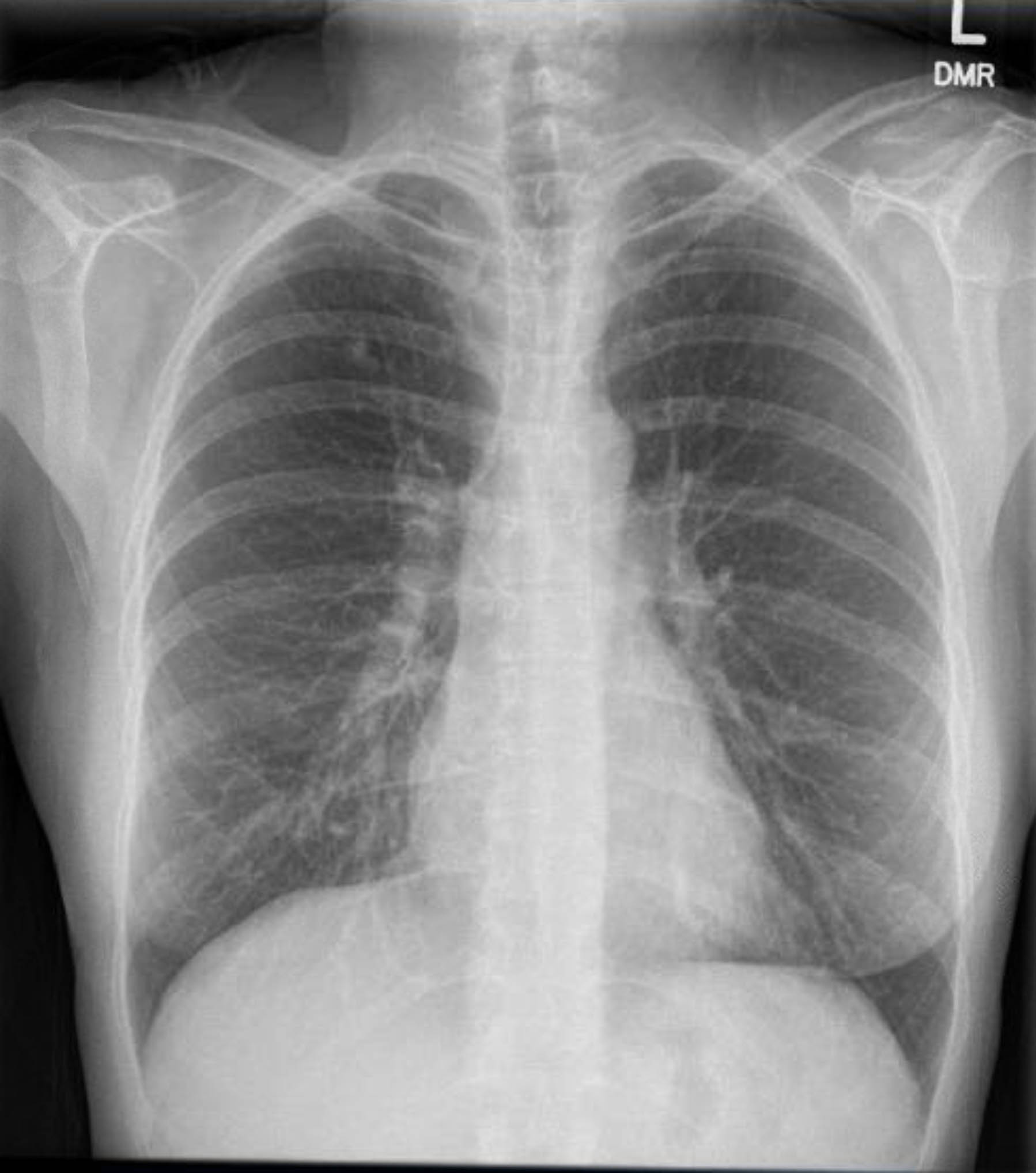
Figura 3. Radiografía de tórax preoperatoria. Granulomas calcificados en lóbulo superior derecho.
La IRT tiene una presentación y progresión de la enfermedad muy heterogéneas. En los Estados Unidos, la causa más común de insuficiencia renal crónica es la diabetes mellitus, que representa el 45% de toda la insuficiencia renal. La segunda y tercera causa más frecuentes son la nefropatía hipertensiva (27%) y la glomerulonefritis crónica (11%), respectivamente. 4 La progresión de la ERC a ESRD requiere que el paciente se someta a hemodiálisis para ayudar en el equilibrio de líquidos de todo el cuerpo y la filtración de electrolitos, metabolitos, hormonas y toxinas. Si el paciente no se somete a diálisis, debe someterse a un trasplante de riñón o su enfermedad será mortal.
Las opciones de tratamiento para la enfermedad renal terminal son la diálisis (diálisis peritoneal o hemodiálisis) y/o el trasplante. En los Estados Unidos, en el 2018, el 85,9 % de todos los casos incidentes de IRT comenzaron la terapia de reemplazo renal con hemodiálisis, el 10,9 % comenzaron con diálisis peritoneal y el 2,9 % recibieron un trasplante renal preventivo. 5
El trasplante de riñón se realiza a partir de un donante fallecido o de un donante vivo. Si un familiar o amigo desea donar pero es incompatible, el intercambio emparejado de donante vivo (en el que un donante intercambia su donación con otro donante para que los receptores reciban riñones compatibles) podría ser una opción, lo que cambiaría a los donantes que son incompatibles con sus destinatarios previstos, de modo que cada donante dona un riñón a un receptor compatible. Finalmente, los donantes altruistas no dirigidos requieren un proceso muy riguroso para seleccionar cuidadosamente a un donante y en un estudio se encontró que casi el 60 por ciento de los donantes altruistas no dirigidos abandonaron después de la evaluación inicial y la sesión de educación, lo que lo convierte en una fuente insostenible de donantes. 6 Si los donantes altruistas completan la evaluación y son aceptados como posibles candidatos a donantes, es nuestra práctica hacer que comiencen una cadena de intercambio emparejado. Esto se hace emparejándolos con un receptor que tiene un donante incompatible, que luego donará a otra persona, y así sucesivamente. Los destinatarios múltiples se beneficiarán en lugar de emparejarlos con un destinatario.
A pesar de la variedad de modalidades de tratamiento para la enfermedad renal terminal, el trasplante de riñón sigue siendo la terapia de reemplazo renal más definitiva y duradera. Ofrece una mejor calidad de vida, es más rentable que la diálisis y tiene una supervivencia general mejorada. 3 De hecho, la esperanza de vida se duplica aproximadamente con el trasplante de riñón en todos los rangos de edad cuando se compara la mortalidad de los pacientes antes del trasplante con la de los pacientes después del trasplante. 4
A la hora de elegir entre un riñón de donante fallecido y uno de donante vivo, varios estudios han determinado que los riñones de donante vivo tienen mejores resultados post-trasplante con una menor incidencia de retraso en la función del injerto postoperatoria dado el corto tiempo de isquemia. Los donantes vivos también proporcionan funciones de injerto de riñón más prolongadas en el receptor, probablemente relacionadas con la salud del donante. Otros beneficios incluyen evitar el tiempo de espera prolongado en diálisis y la capacidad de coordinar los procedimientos de donantes y receptores de manera oportuna. 3 La mejor supervivencia postoperatoria del injerto se ha encontrado en pacientes que reciben trasplante renal iniciando prediálisis. 4 En el caso de la paciente que se presenta aquí, pudo encontrar un donante vivo emparentado antes de iniciar la hemodiálisis, por lo que tiene la mayor probabilidad de supervivencia del injerto en comparación con los pacientes que reciben un riñón de donante fallecido o un trasplante después de estar en diálisis.
Como se mencionó anteriormente, dada la presentación variable de la IRT y las diferencias en la progresión de la enfermedad, es necesaria una evaluación preoperatoria muy exhaustiva con historia clínica completa, examen físico e imágenes adecuadas. Las contraindicaciones absolutas para el trasplante de riñón que deben descartarse antes de la operación incluyen infección activa, neoplasia maligna, abuso de sustancias activas y enfermedad psiquiátrica mal controlada. 3 Otras consideraciones importantes incluyen una evaluación cardiovascular y vascular periférica exhaustiva, ya que ambas podrían impedir que el paciente sea un receptor renal adecuado.
Emerich Ullman informó del primer intento de trasplante de riñón en 1902, pero el primer trasplante de riñón exitoso no se completó hasta 1954, cuando Joseph Murray eludió la barrera inmunológica y completó un trasplante de riñón entre dos gemelos idénticos sin utilizar ningún tipo de inmunosupresión. 3 En la misma década, los esteroides y la radiación fueron los primeros inmunosupresores utilizados, pero fue la introducción de la azatioprina (Imuran) alrededor de 1960 que comenzó una nueva era de trasplante de riñón. A lo largo de las siguientes tres décadas, la inmunosupresión continuó evolucionando de tal manera que estos medicamentos ahora tienen un perfil de toxicidad más bajo y son mejor tolerados por los pacientes. 7
Desafortunadamente, el mayor desafío para el trasplante es la escasez de órganos disponibles para quienes los necesitan. El éxito del trasplante de órganos sólidos es, irónicamente, el factor más responsable de la escasez crítica; La mejora de las tasas de supervivencia y la tolerancia a la inmunosupresión han animado tanto a los médicos como a los pacientes a optar por el trasplante. 1,8 Los pacientes que necesitan estos órganos son aquellos que sufren de IRCT. En el 2018, la prevalencia de la enfermedad renal terminal en los Estados Unidos fue de 785 883 con una incidencia de 131 779. 5 Hay 88,627 personas en la lista de espera para trasplante de riñón, con aproximadamente 3,700 pacientes que se agregan cada mes. El número de trasplantes de riñón realizados anualmente de donantes de riñón vivos y fallecidos ha aumentado, pero sigue siendo inferior a 30.000 (25.500 en 2022). 9 Por lo tanto, el tiempo medio de espera es de 3,6 años. 10 El paciente que se presenta en este caso es una mujer de 56 años de edad que padeció IRT secundaria a nefropatías diabéticas e hipertensivas y se sometió a un trasplante renal preventivo relacionado con la vida.
El trasplante renal preventivo es una situación única en la que el paciente con IRT aún no ha iniciado la diálisis antes de someterse al trasplante. Solo el 2,9% de los pacientes en los EE. UU. se sometieron a un trasplante de riñón como su modo inicial de terapia para la enfermedad renal terminal. 5 En la revisión de la literatura, hay varios trabajos que sugieren que la donación en vida proporciona una mejor supervivencia del paciente y del aloinjerto en comparación con el trasplante de donante fallecido, especialmente cuando el trasplante de donante vivo se realiza de forma preventiva sin diálisis. 6 El trasplante de donante vivo reduce los tiempos de espera en diálisis, tiene estadías hospitalarias más cortas y menos costosas y, en general, mejora los resultados posteriores al trasplante. 11 Cuando se realiza antes del inicio de la diálisis, el paciente puede evitar la morbilidad de la diálisis, los procedimientos de acceso a la diálisis y el costo asociado con este tratamiento. Se ha estudiado el tiempo de espera en diálisis antes del trasplante y se ha demostrado cuantitativamente que es uno de los mayores factores de riesgo independientes para la pérdida del injerto después del trasplante renal. 12 Los resultados postoperatorios de los pacientes que reciben un trasplante antes de la diálisis muestran tasas más bajas de retraso en la función del injerto en comparación con los trasplantes no preventivos. 13 Desde el punto de vista de los donantes, los donantes vivos de riñón tienen una supervivencia similar a la de los no donantes, y su riesgo de enfermedad renal terminal no aumenta significativamente. 14
Desde el punto de vista quirúrgico, se tomaron varias decisiones a lo largo de este caso que merecen una mayor discusión. La primera decisión clínica estuvo relacionada con la exposición quirúrgica. En la historia del trasplante de riñón, hubo un tiempo en que la parte superior del muslo era el lugar del trasplante. Sin embargo, esto se suspendió porque requiere una ureterostomía cutánea, que tiene un riesgo significativamente mayor de infección ascendente. En 1956, Merrill y Murray describieron el primer trasplante utilizando la fosa ilíaca. Señalaron que no se eligió la fosa renal porque requiere nefrectomía simultánea y requiere una anastomosis ureteroureteral, lo que pone al uréter en alto riesgo de formación de estenosis. Como resultado, se concluyó que la fosa ilíaca permitía el acceso a un suministro sanguíneo adecuado a través de los vasos ilíacos, así como un drenaje ureteral accesible hacia la vejiga directamente a través de ureteroneocistostomía. 15 Por lo general, los riñones se colocan en la fosa ilíaca derecha (el lado contralateral del riñón donado) porque la mayoría de las nefrectomías de donantes son del lado izquierdo debido al aumento de la longitud de la vena renal. 2 Sin embargo, en esta presentación de casos, la paciente se sometió a un trasplante de fosa ilíaca izquierda dado que tiene antecedentes de diabetes mellitus tipo I y puede requerir un trasplante de páncreas en el futuro (que generalmente se coloca en la fosa ilíaca derecha). El último abordaje que a veces se considera, a la espera de la historia quirúrgica previa y la anatomía vascular del paciente, es un abordaje intraperitoneal.
El siguiente paso importante en esta operación son las anastomosis vasculares. La vena renal se anastomosa con mayor frecuencia primero y, por lo general, a la vena ilíaca externa de un extremo a otro, pero esta ubicación varía en relación con la anastomosis arterial. La anastomosis arterial puede conectar la arteria renal donante con la arteria ilíaca común, externa o interna del receptor, y el procedimiento ha evolucionado con el tiempo. Históricamente, la ilíaca interna se seleccionaba preferentemente para una anastomosis de extremo a extremo de la arteria renal del donante; sin embargo, esto no demostró ser superior al abordaje posterior de extremo a lado de la arteria renal a la arteria ilíaca común o externa. Por lo tanto, la anastomosis más común que se realiza hoy en día es entre la arteria renal donante y el lado de la arteria ilíaca externa del receptor, ya que este vaso no tiene ramas en la pelvis y está muy cerca de la vejiga, lo que facilita la creación de la ureteroneocistostomía sin comprometer el suministro de sangre ureteral distal. Si el riñón se recuperó de un donante fallecido, la aorta del donante también se recupera y podría convertirse en un parche de Carrel y usarse para la anastomosis de la arteria ilíaca común o externa. 2 Durante la obtención del riñón del donante, una consideración importante es el número de arterias renales. Cuando el donante es un donante fallecido, es posible preservar todas las arterias renales que se originan en la aorta del donante, incluyendo su origen en el parche de Carrel. Sin embargo, en un donante vivo, esto no es factible y varias arterias se anastomosan por separado o, más comúnmente, se anastomosan juntas en una arteria antes de implantar el riñón. Si hay pequeñas arterias accesorias que irrigan el polo superior del riñón, a menudo están ligadas. Es más probable que las arterias de los polos inferiores irrigan el uréter y, en consecuencia, es menos probable que se ligen, ya que el suministro de sangre al uréter debe ser óptimo.
La última anastomosis a tener en cuenta es la construcción de la anastomosis vesical ureteral al receptor. A lo largo de los años de trasplante renal ha habido varios abordajes de la ureteroneocistostomía, la implantación del uréter donante en la vejiga receptora. Inicialmente, la anastomosis más utilizada fue la técnica de Leadbetter-Politano, una técnica intravesical que requiere la exposición a través de una cistostomía anterior para permitir la tunelización submucosa del uréter y la colocación del neoorificio en una localización anatómica cercana. 16 El enfoque extravesical más reciente, desarrollado por Lich y Gregoir, es empleado por la mayoría de los centros de trasplante hoy en día y es el enfoque utilizado en este caso. Se crea una sola cistotomía pequeña en la cúpula vesical y el uréter donante distal se anastomosa a la mucosa vesical. A continuación, se cierra una capa seromusculoar sobre el uréter. 2 El método final es una ureteropielostomía, una anastomosis entre el uréter receptor y la porción más baja de la pelvis renal del donante. Este abordaje no se utiliza con frecuencia porque a menudo requiere una nefrectomía nativa ipsilateral y se ha demostrado que tiene una mayor tasa de fuga ureteral. número arábigo
La consideración final en este caso, y que sigue siendo controvertida en la literatura sobre trasplante renal, es el uso de un stent ureteral. Varios estudios han investigado los riesgos y beneficios de los stents ureterales. De las complicaciones urológicas tras el trasplante renal, la mayoría se originan en la anastomosis vesicoureteral. El beneficio terapéutico de un stent ureteral es que simplifica la creación de una anastomosis de mucosa ureteral estanca a la mucosa vesical y reduce la torcedura anatómica. Sin embargo, los riesgos significativos asociados con el uso de un stent incluyen infecciones recurrentes del tracto urinario y eventual pérdida del injerto. En general, la literatura no ha podido evaluar adecuadamente la morbilidad y el costo de la colocación universal de stents y, por lo tanto, esta práctica sigue siendo una evaluación y decisión de cirujano a cirujano en el momento de la cirugía. 17 En este caso, el cirujano tratante descubrió que el riñón donante tenía una pelvis renal adicional, y antes de completar la anastomosis ureteral, parecía haber una plenitud de la pelvis renal. En consecuencia, se colocó un stent doble J de 4,7 Fr.
En resumen, este caso pone de manifiesto un trasplante renal preventivo relacionado con la vida. El paciente presentado tuvo la suerte de tener un donante vivo que no solo estaba dispuesto a donar, sino que también se consideró apto para la donación. Los resultados de la donación en vida son superiores a los de la donación fallecida, especialmente cuando se realiza antes del inicio de la diálisis, como fue el caso de este paciente. A medida que la lista de espera para un trasplante de riñón sigue creciendo, la importancia de la donación en vida seguirá aumentando. Por lo tanto, es imperativo que los centros de trasplante de riñón en todo Estados Unidos fomenten la donación en vida. Un avance prometedor es la diseminación de las nefrectomías laparoscópicas de donantes. Esta técnica, que ahora se utiliza en más del 90% de las nefrectomías de donante, reduce el tiempo de recuperación de los donantes vivos. 11 Este es un ejemplo del trabajo que debe continuar incentivando la donación, tanto en la disminución como en vida, para ayudar a combatir la escasez de órganos para las personas con IRT.
Se utilizaron abrazaderas Fogarty Hydragrip para sujetar los vasos ilíacos. Edward Lifesciences proporciona los insertos Hydragrip para la abrazadera Fogarty. Se cree que estas pinzas menos traumáticas disminuyen el riesgo de disección. Al realizar la anastomosis arterial, se utiliza un punzón aórtico de Teleflex Medical para la arteriotomía.
Ninguno.
Corey Eymard, becario de trasplantes de MGH, realizó este procedimiento con el Dr. Nahel Elias.
Se obtuvo el consentimiento para el uso de la historia clínica, la radiología y el video intraoperatorio del paciente y de los proveedores involucrados en la compilación de este informe de caso y la filmación.
References
- Instituto para el Mejoramiento de la Atención Médica. Actualización sobre la donación de órganos: El éxito trae nuevos desafíos. Disponible en: http://www.ihi.org/resources/Pages/ImprovementStories/OrganDonationUpdateSuccessBringsNewChallenges.aspx
- Pereira BJG, Sayegh MH, Blake P. Enfermedad renal crónica, diálisis y trasplante. 2ª ed. Filadelfia, Pensilvania: Elsevier Saunders; 2005.
- Humar A, Dunn DL. Capítulo 11: Trasplante. En: Principios de cirugía de Schwartz. 9e ed. Nueva York, NY: McGraw-Hill; 2010.
- Puñetazo, JD. Capítulo 45: Trasplante de órganos. En: Diagnóstico y tratamiento actual. 13ª ed. 16,Nueva York, NY: McGraw-Hill; 2006.16. Monga M. Ureteroscopia. Nueva York: Humana Press, 2013.
- Sistema de Datos Renales de los Estados Unidos. Informe anual de datos del USRDS de 2020: Epidemiología de la enfermedad renal en los Estados Unidos. Institutos Nacionales de Salud, Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales, Bethesda, MD, 2020.
- Davis CL, Delmonico FL. Trasplante de riñón de donante vivo: una revisión de las prácticas actuales para el donante vivo. J Am Soc Nephrol. julio de 2005; 16(7):2098-110. doi:10.1681/ASN.2004100824.
- Murray JE, Merrill JP, Harrison JH, Wilson RE, Dammin GJ. Supervivencia prolongada de homoinjertos de riñón humano mediante terapia farmacológica inmunosupresora. N Engl J Med. 13 de junio de 1963;268:1315-23. doi:10.1056/NEJM196306132682401.
- Klein AS, Messersmith EE, Ratner LE, Kochik R, Baliga PK, Ojo AO. Donación y utilización de órganos en los Estados Unidos, 1999-2008. Am J Trasplante. Abril de 2010; 10(4 Pt 2):973-86. doi:10.1111/j.1600-6143.2009.03008.x.
- Red de Procuración y Trasplante de Órganos. Datos. Disponible en: https://optn.transplant.hrsa.gov/data.
- Estadísticas de donación y trasplante de órganos. Fundación Nacional del Riñón. 2016. Disponible en: https://www.kidney.org/news/newsroom/factsheets/Organ-Donation-and-Transplantation-Stats.
- Axelrod DA, McCullough KP, Brewer ED, Becker BN, Segev DL, Rao PS. Trasplante de riñón y páncreas en los Estados Unidos, 1999-2008: el rostro cambiante de la donación en vida. Am J Trasplante. Abril de 2010; 10(4 Pt 2):987-1002. doi:10.1111/j.1600-6143.2010.03022.x.
- Meier-Kriesche HU, Kaplan B. El tiempo de espera en diálisis como el factor de riesgo modificable más fuerte para los resultados del trasplante renal: un análisis renal de donante pareado. Trasplante. 27 de noviembre de 2002; 74(10):1377-81. doi:10.1097/00007890-200211270-00005.
- Kasiske BL, Snyder JJ, Matas AJ, Ellison MD, Gill JS, Kausz AT. Trasplante renal preventivo: la ventaja y la ventaja. J Am Soc Nephrol. mayo de 2002; 13(5):1358-64. doi:10.1097/01.asn.0000013295.11876.c9.
- Ibrahim HN, Foley R, Tan L, et al. Consecuencias a largo plazo de la donación de riñón. N Engl J Med. 29 de enero de 2009; 360(5):459-69. doi:10.1056/NEJMoa0804883.
- Merrill JP, Murray JE, Harrison JH, Guild WR. Homotrasplante exitoso de riñón humano entre gemelos idénticos. J Am Med Assoc. 28 de enero de 1956; 160(4):277-82. doi:10.1001/jama.1956.02960390027008.
- Monga M. Ureteroscopia. Nueva York: Humana Press, 2013.
- Wilson CH, Bhatti AA, Rix DA, Manas DM. Colocación de stents intraoperatorios de rutina para receptores de trasplante renal. Trasplante. 15 de octubre de 2005; 80(7):877-82. doi:10.1097/01.tp.0000181197.21706.fa.
- Aravindan N, Shaw A. Efecto de la infusión de furosemida sobre la hemodinámica renal y la expresión génica de la angiogénesis en la isquemia/reperfusión renal aguda. Ren Fail. 2006; 28(1):25-35. doi:10.1080/08860220500461229.
- Siedlecki A, Irish W, Brennan DC. Retraso en la función del injerto en el trasplante renal. Am J Trasplante. Noviembre de 2011; 11(11):2279-96. doi:10.1111/j.1600-6143.2011.03754.x.
Cite this article
Westfal ML, Elias N. Trasplante de riñón receptor de un donante vivo. J Med Insight. 2023; 2023(171). doi:10.24296/jomi/171.

