Empfänger Nierentransplantation von einem lebenden Spender
Main Text
Table of Contents
Die terminale Niereninsuffizienz (ESRD) ist das letzte Stadium im Fortschreiten der chronischen Nierenerkrankung (CKD). Die CNE hat eine Vielzahl von Ätiologien, zeigt sich auf vielfältige Weise und verläuft patientenabhängig. Trotz der Heterogenität der chronischen Niereninsuffizienz benötigen die Patienten nach einer Niereninsuffizienz eine Nierenersatztherapie (RRT). Die RRT ist eine von drei Säulen: Hämodialyse, Peritonealdialyse oder Nierentransplantation. Von diesen bietet die Nierentransplantation dem Patienten die beste Lebensqualität, ein verbessertes Überleben und eine Chance auf Heilung. Der Erfolg der Nierentransplantation mit verbesserten Ergebnissen und Toleranz gegenüber der erforderlichen Immunsuppression hat jedoch trotz des Anstiegs der verstorbenen Organspender zu einem extremen Organmangel geführt. Infolgedessen ist der Schub für Lebendspender immer wichtiger geworden. Für die Empfänger sind die besten Ergebnisse mit Transplantationen von einem lebenden Spender aufgrund der überlegenen Transplantatqualität und des Wegfalls von Wartezeiten und Dialyse. In diesem Artikel wird ein solcher Fall vorgestellt und die wichtigen Überlegungen diskutiert, die ein Arzt präoperativ und intraoperativ bei der Durchführung von Nierentransplantationen anstellen muss.
Die Definition der National Kidney Foundation für chronische Nierenerkrankungen (CKD) wurde eingeführt, um den Ansatz zur Versorgung dieser Patientengruppe zu standardisieren. CKD ist definiert als Nierenschädigung für mehr als oder gleich 3 Monate durch strukturelle oder funktionelle Anomalien der Niere und/oder eine glomeruläre Filtrationsrate (GFR) von < 60 ml/min/1,73 m2. Die Stadien der CNE variieren je nach GFR-Niveau: Im Stadium I liegt die GFR bei ≥ 90; im Stadium II beträgt die GFR 60–89; im Stadium III beträgt die GFR 30–59; im Stadium IV beträgt die GFR 15–29; und im Stadium V (Nierenversagen) liegt die GFR bei < 15 oder Dialyseabhängigkeit. 2 In diesem Fallbericht werden wir einen Patienten mit terminaler Niereninsuffizienz (Stadium V CKD) besprechen, der sich vor Beginn der Dialyse einer Lebendnierentransplantation unterzogen hat.
Bei dieser Patientin handelt es sich um eine 56-jährige Frau mit einer Vorgeschichte von Typ-I-Diabetes mellitus, Bluthochdruck, Hypothyreose, Hyperlipidämie und ESRD als Folge von diabetischen und hypertensiven Nephropathien, die sich im Massachusetts General Hospital für eine Nierentransplantation ihrer Schwester vorstellte.
Ihre chirurgische Vorgeschichte ist für einen Kaiserschnitt und eine AV-Fistel der linken oberen Extremität von Bedeutung. Zu ihren bemerkenswerten Medikamenten gehören Amlodipin, Calcitriol, Levothyroxin, Olmesartan, Pravastatin, Lasix und Kayexalat. Sie ist allergisch gegen Aspirin und Penicillin. Sozial lebt die Patientin mit ihrem Mann zusammen und unterrichtet in einer örtlichen Grundschule. Sie hat einen geimpften Hund und eine Schildkröte als Haustiere, merkt aber an, dass sie sich nach der Transplantation nicht mehr um ihre Schildkröte kümmern wird. Sie trinkt keinen Alkohol und war eine ehemalige Raucherin mit einer 1-Packungs-Jahres-Geschichte, die 1979 aufhörte. Sie bestreitet jeglichen illegalen Drogenkonsum. Sie bestreitet, dass sie in der Vergangenheit mit Tuberkulose in Berührung gekommen ist.
Bei der präoperativen Untersuchung stellte sich heraus, dass es sich bei der Patientin um eine gut aussehende 56-jährige Frau handelte. Ihre Bauchuntersuchung lag innerhalb der normalen Grenzen mit einem weichen, nicht aufgeblähten Bauch und einem gut verheilten chirurgischen Schnitt aus ihrem Kaiserschnitt. Ihre Oberschenkel- und Pedalimpulse waren beidseitig tastbar. Bei einem Patienten mit Niereninsuffizienz, der für eine Nierentransplantation in Betracht gezogen wird, ist es wichtig, die Pulse der unteren Extremitäten auf Hinweise auf eine signifikante periphere Gefäßerkrankung zu untersuchen. Dies dient dazu, eine minimale atherosklerotische Erkrankung zu gewährleisten, bei der die Arterie der transplantierten Niere an den Beckengefäßen des Empfängers anastomosiert wird. Jede signifikante periphere arterielle Verschlusskrankheit (pAVK) im Aortoiliassystem könnte die Durchblutung des Allotransplantats oder der ipsilateralen unteren Extremität aufgrund einer distalen Dissektion der iliofemoralen Arterien beeinträchtigen oder durch das Allotransplantat aus dem Kreislauf der unteren Extremität stehlen. arabische Ziffer
Im Allgemeinen umfasst die kardiale Beurteilung vor einer Nierentransplantation: EKG und Echokardiographie. Zusätzlich wird ein Belastungstest und/oder eine Koronarangiographie bei stationären Patienten mit KHK in der Anamnese oder signifikanten Risikofaktoren (Diabetes mellitus, Hämodialyse für mehr als ein Jahr, linksventrikuläre Hypertrophie, Alter von > 60 Jahren, Raucheranamnese, Bluthochdruck oder Hyperlipidämie) durchgeführt. Bei Patienten mit Symptomen oder Anzeichen von Miktionsanomalien oder Harnwegsobstruktion (z. B. Prostata) ist ein Miktionszystourethrogramm und eine vollständige Untersuchung der unteren Harnwege erforderlich, um eine Auslassobstruktion auszuschließen. 3 Wenn der Patient eine periphere Gefäßerkrankung in der Vorgeschichte oder besorgniserregende Befunde bei der Gefäßuntersuchung hat, sollte der Patient Pulsvolumenaufzeichnungen (PVRs) der unteren Extremitäten und/oder eine CT-Untersuchung des Abdomens und des Beckens (ohne Kontrastmittel) durchführen, um Beckenverkalkungen zu erkennen.
Dieser Patient unterzog sich einem präoperativen EKG, das keine Arrhythmie oder Ischämie zeigte. Da ihre Krankengeschichte jedoch mehrere Risikofaktoren für die koronare Herzkrankheit (KHK) enthielt, unterzog sie sich einer Koronarangiographie, die schwere atherosklerotische Läsionen ausschloss. Eine präoperative Röntgenaufnahme des Brustkorbs zeigte Hinweise auf eine vorangegangene granulomatöse Erkrankung, und eine anschließende Thorax-CT-Untersuchung bestätigte dies ohne weitere besorgniserregende Befunde (Abbildungen 1–3).
Darüber hinaus unterzog sich ihre Spenderschwester der standardmäßigen präoperativen Spenderuntersuchung. Dazu gehört die Sicherstellung einer ausreichenden Nierenfunktion und eines minimalen Risikos durch eine ininephrische postoperative. Eine Klärung von Infektionskrankheiten und Malignomen ist ebenfalls erforderlich. Schließlich wurde eine Nierenbildgebung durchgeführt, um die Größe der Nieren und ihres Gefäßsystems zu vergleichen, um die Lateralität des Spenderverfahrens zu bestimmen. aus.
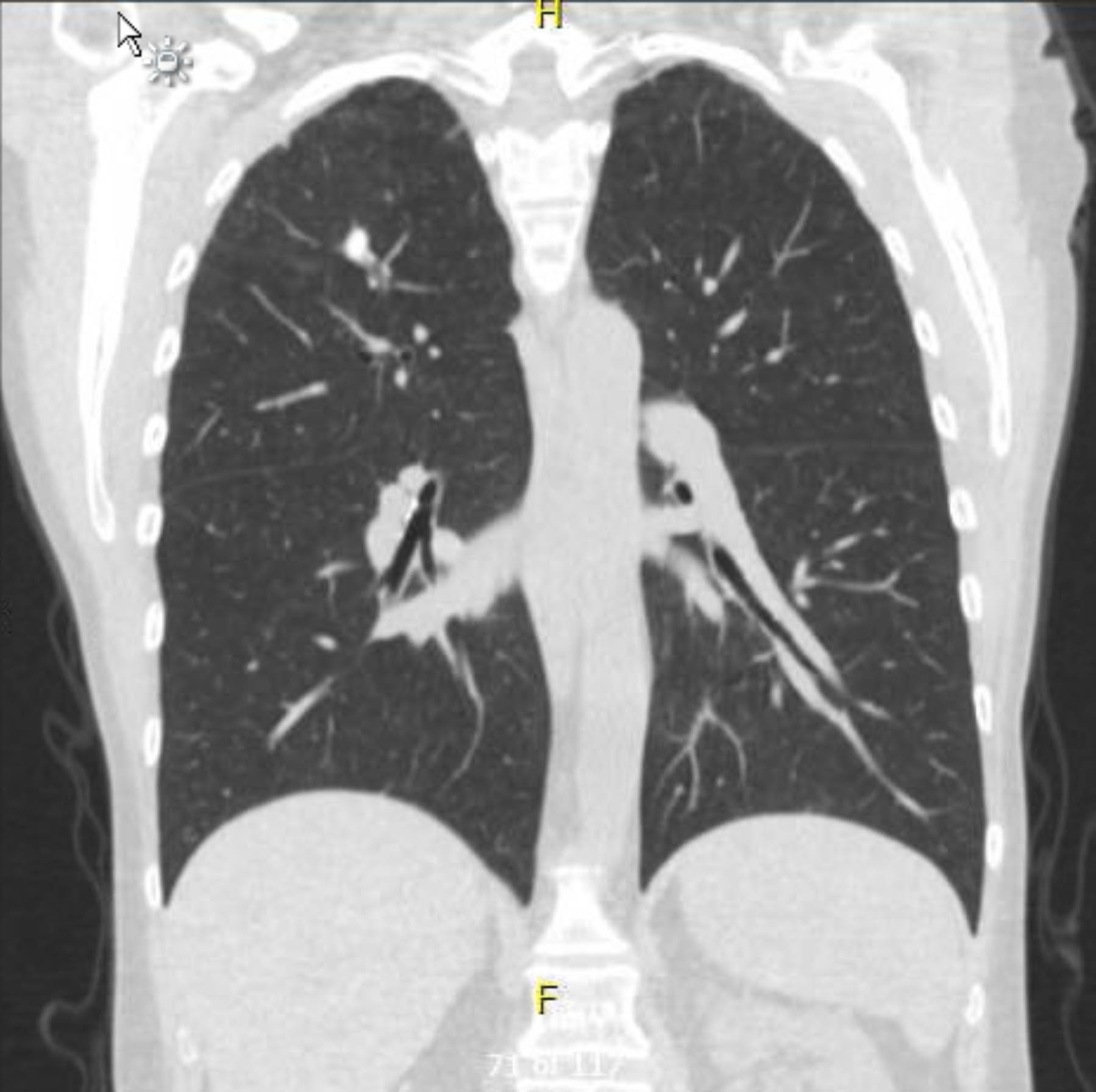
Abbildung 1. Präoperatives kontrastmittelfreies Thorax-CT. Koronale Ansicht. Granulomatöse Veränderungen in der rechten Spitze.
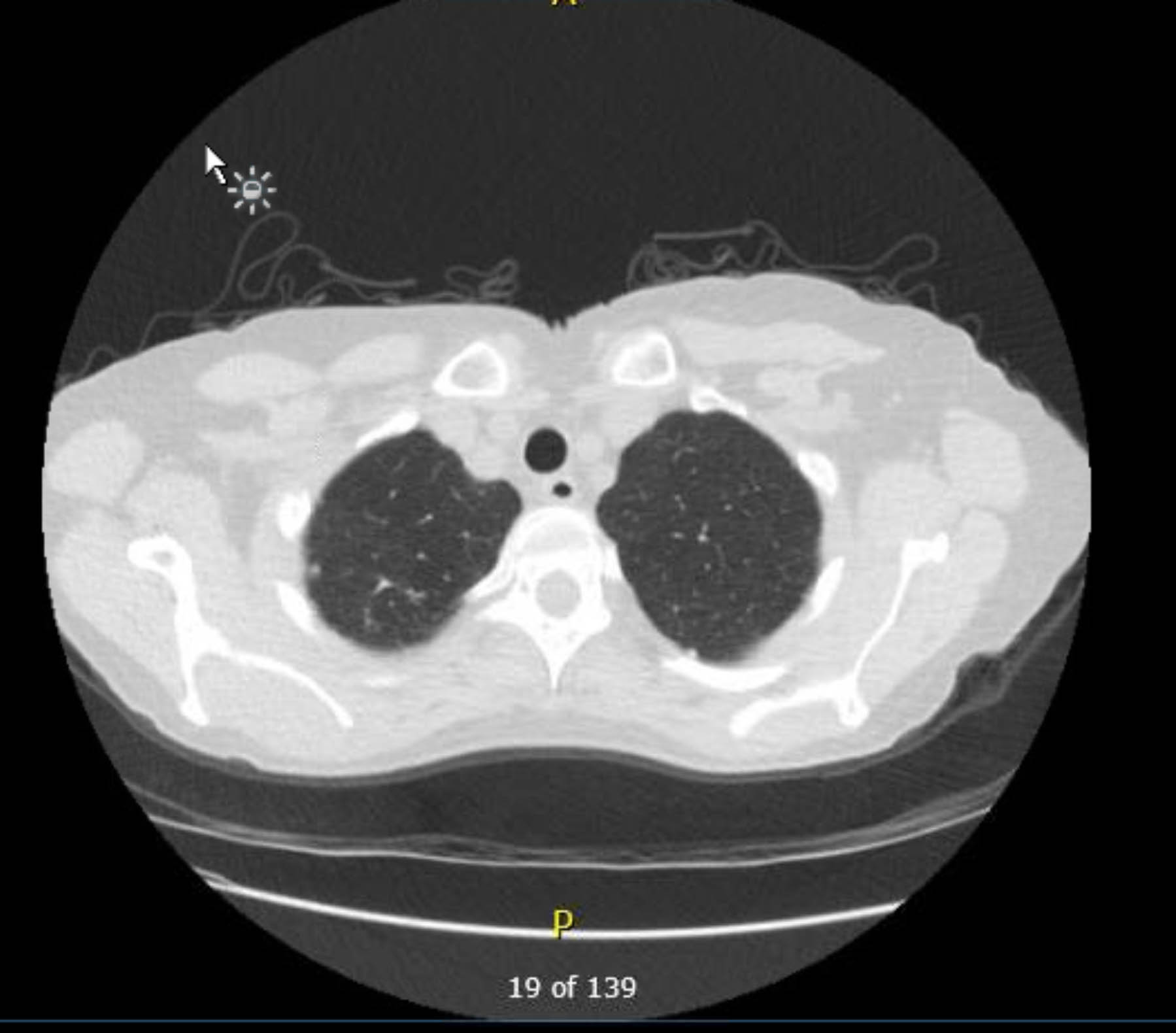
Abbildung 2. Präoperatives kontrastmittelfreies Thorax-CT. Axiale Ansicht. Granulomatöse Veränderungen in der rechten Spitze.
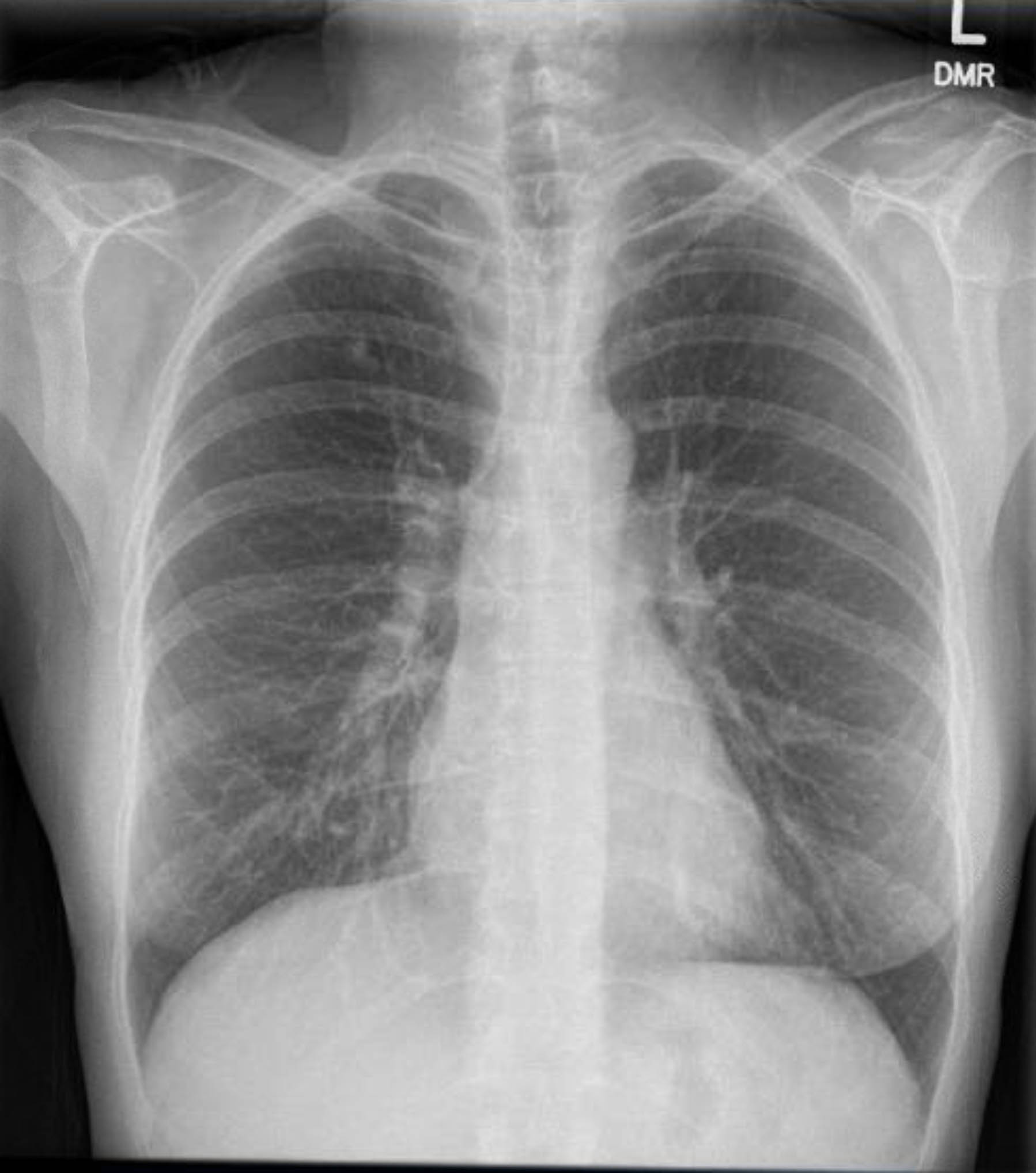
Abbildung 3. Präoperative Röntgenaufnahme des Brustkorbs. Verkalkte Granulome im rechten Oberlappen.
Die ESRD hat ein sehr heterogenes Erscheinungsbild und einen sehr heterogenen Krankheitsverlauf. In den Vereinigten Staaten ist die häufigste Ursache für chronisches Nierenversagen Diabetes mellitus, der 45 % aller Niereninsuffizienzen ausmacht. Die zweit- und dritthäufigste Ursache sind die hypertensive Nephropathie (27 %) bzw. die chronische Glomerulonephritis (11 %). 4 Das Fortschreiten von CNE zu ESRD erfordert eine Hämodialyse, um den Flüssigkeitshaushalt des gesamten Körpers und die Filtration von Elektrolyten, Metaboliten, Hormonen und Toxinen zu unterstützen. Wenn sich der Patient keiner Dialyse unterzieht, muss er sich einer Nierentransplantation unterziehen, sonst verläuft seine Krankheit tödlich.
Die Behandlungsmöglichkeiten der ESRD sind Dialyse (Peritonealdialyse oder Hämodialyse) und/oder Transplantation. In den Vereinigten Staaten begannen im Jahr 2018 85,9 % aller Fälle von ESRD eine Nierenersatztherapie mit Hämodialyse, 10,9 % begannen mit einer Peritonealdialyse und 2,9 % erhielten eine präventive Nierentransplantation. 5
Die Nierentransplantation erfolgt entweder von einem verstorbenen oder einem lebenden Spender. Wenn ein Familienmitglied oder ein Freund spenden möchte, aber nicht kompatibel ist, könnte ein Lebendspender-Paartausch (bei dem ein Spender seine Spende mit einem anderen Spender austauscht, damit die Empfänger kompatible Nieren erhalten) eine Option sein, bei der Spender ausgetauscht werden, die mit ihren beabsichtigten Empfängern nicht kompatibel sind, so dass stattdessen jeder Spender eine Niere an einen kompatiblen Empfänger spendet. Schließlich erfordern nicht-gerichtete altruistische Spender einen sehr strengen Prozess, um einen Spender sorgfältig auszuwählen, und in einer Studie wurde festgestellt, dass fast 60 Prozent der nicht-gerichteten altruistischen Spender nach der ersten Bewertung und Aufklärungssitzung ausstiegen, was dies zu einer nicht nachhaltigen Quelle von Spendern macht. 6 Wenn die altruistischen Spender die Bewertung abschließen und als potenzielle Spenderkandidaten akzeptiert werden, ist es unsere Praxis, sie eine gepaarte Tauschkette starten zu lassen. Dies geschieht, indem sie mit einem Empfänger abgeglichen werden, der einen inkompatiblen Spender hat, der dann an jemand anderen spendet und so weiter. Mehrere Empfänger profitieren davon, anstatt sie mit einem Empfänger abzugleichen.
Trotz einer Vielzahl von Behandlungsmodalitäten für ESRD ist die Nierentransplantation nach wie vor die definitivste und dauerhafteste Nierenersatztherapie. Sie bietet eine verbesserte Lebensqualität, ist kostengünstiger als die Dialyse und hat insgesamt ein verbessertes Überleben. 3 Tatsächlich verdoppelt sich die Lebenserwartung mit einer Nierentransplantation in allen Altersgruppen, wenn man die Sterblichkeit von Patienten vor der Transplantation mit der von Patienten nach der Transplantation vergleicht. 4
Bei der Wahl zwischen einer verstorbenen und einer lebenden Spenderniere haben mehrere Studien ergeben, dass Lebendspendernieren aufgrund der kurzen ischämischen Zeit bessere Ergebnisse nach der Transplantation mit einer geringeren Inzidenz einer verzögerten Transplantatfunktion postoperativ aufweisen. Lebendspender sorgen auch für längere Nierentransplantatfunktionen beim Empfänger, was wahrscheinlich damit zusammenhängt, dass der Spender gesund ist. Zu den weiteren Vorteilen gehören die Vermeidung langer Wartezeiten bei der Dialyse und die Möglichkeit, die Verfahren von Spender und Empfänger rechtzeitig zu koordinieren. 3 Das beste postoperative Transplantatüberleben wurde bei Patienten gefunden, die vor der Dialyse eine Nierentransplantation erhalten. 4 Für die hier vorgestellte Patientin konnte sie vor Beginn der Hämodialyse einen Lebendspender finden, so dass sie im Vergleich zu Patienten, die nach einer Dialyse eine verstorbene Spenderniere oder Transplantation erhalten, die höchste Überlebenswahrscheinlichkeit für das Transplantat hat.
Wie bereits erwähnt, ist angesichts des variablen Erscheinungsbildes der ESRD und der Unterschiede im Krankheitsverlauf eine sehr gründliche präoperative Abklärung mit vollständiger Anamnese, körperlicher Untersuchung und geeigneter Bildgebung erforderlich. Zu den absoluten Kontraindikationen für eine Nierentransplantation, die präoperativ ausgeschlossen werden müssen, gehören aktive Infektionen, Malignität, Wirkstoffmissbrauch und schlecht kontrollierte psychiatrische Erkrankungen. 3 Zu den weiteren wichtigen Überlegungen gehört eine gründliche kardiovaskuläre und periphere vaskuläre Untersuchung, da diese beide den Patienten als geeigneten Nierenempfänger ausschließen könnten.
Emerich Ullman berichtete 1902 über den ersten Versuch einer Nierentransplantation, aber die erste erfolgreiche Nierentransplantation wurde erst 1954 abgeschlossen, als Joseph Murray die Immunbarriere umging und eine Nierentransplantation zwischen zwei eineiigen Zwillingen ohne Immunsuppression durchführte. 3 Im selben Jahrzehnt waren Steroide und Bestrahlung die ersten Immunsuppressiva, die eingesetzt wurden, aber es war die Einführung von Azathioprin (Imuran) um 1960, die eine neue Ära der Nierentransplantation einleitete. In den folgenden drei Jahrzehnten entwickelte sich die Immunsuppression weiter, so dass diese Medikamente heute ein geringeres Toxizitätsprofil aufweisen und von den Patienten besser vertragen werden. 7
Leider ist die größte Herausforderung bei der Transplantation der Mangel an Organen, die für die Bedürftigen zur Verfügung stehen. Der Erfolg der Organtransplantation ist ironischerweise der einzige Faktor, der am meisten für den kritischen Mangel verantwortlich ist. Die verbesserten Überlebensraten und die Toleranz gegenüber Immunsuppression haben sowohl Ärzte als auch Patienten dazu ermutigt, sich für eine Transplantation zu entscheiden. 1,8 Patienten, die diese Organe benötigen, sind diejenigen, die an ESRD leiden. Im Jahr 2018 betrug die Prävalenz von ESRD in den Vereinigten Staaten 785.883 mit einer Inzidenz von 131.779. 5 Es gibt 88.627 Menschen auf der Warteliste für eine Nierentransplantation, wobei jeden Monat etwa 3.700 Patienten hinzukommen. Die Zahl der jährlich durchgeführten Nierentransplantationen sowohl von lebenden als auch von verstorbenen Nierenspendern ist gestiegen, liegt aber immer noch unter 30.000 (25.500 im Jahr 2022). 9 Die durchschnittliche Wartezeit beträgt somit 3,6 Jahre. 10 Bei der in diesem Fall vorgestellten Patientin handelt es sich um eine 56-jährige Frau, die an ESRD infolge diabetischer und hypertensiver Nephropathien litt und sich einer präventiven Nierentransplantation unterzogen hatte.
Die präventive Nierentransplantation ist eine einzigartige Situation, da der Patient mit Niereninsuffizienz vor der Transplantation noch nicht mit der Dialyse begonnen hat. Nur 2,9 % der Patienten in den USA unterzogen sich einer Nierentransplantation als erste Form der ESRD-Therapie. 5 In der Literatur gibt es mehrere Arbeiten, die darauf hindeuten, dass die Lebendspende im Vergleich zur Transplantation eines verstorbenen Spenders ein besseres Überleben des Patienten und des Allotransplantats ermöglicht, insbesondere wenn die Lebendspendertransplantation präventiv ohne Dialyse durchgeführt wird. 6 Die Transplantation von Lebendspendern verkürzt die Wartezeiten bei der Dialyse, führt zu kürzeren und kostengünstigeren Krankenhausaufenthalten und insgesamt zu besseren Ergebnissen nach der Transplantation. 11 Wenn dies vor Beginn der Dialyse geschieht, ist der Patient in der Lage, die Morbidität der Dialyse, die Dialysezugangsverfahren und die mit dieser Behandlung verbundenen Kosten zu vermeiden. Die Wartezeit auf die Dialyse vor der Transplantation wurde untersucht und hat sich quantitativ als einer der größten unabhängigen Risikofaktoren für den Transplantatverlust nach einer Nierentransplantation erwiesen. 12 Die postoperativen Ergebnisse von Patienten, die eine Transplantationsprädialyse erhalten, zeigen im Vergleich zu nicht-präemptiven Transplantaten niedrigere Raten einer verzögerten Transplantatfunktion. 13 Aus der Sicht der Spender haben die Lebendnierenspender eine ähnliche Überlebensrate wie Nichtspender, und ihr Risiko für ESRD ist nicht signifikant erhöht. 14
Aus chirurgischer Sicht wurden in diesem Fall mehrere Entscheidungen getroffen, die einer weiteren Diskussion bedürfen. Die erste klinische Entscheidung bezog sich auf die chirurgische Exposition. In der Geschichte der Nierentransplantation gab es eine Zeit, in der der Oberschenkel der Ort der Transplantation war. Diese wurde jedoch abgesetzt, da sie eine Hautureterostomie erfordert, die ein deutlich höheres Risiko für eine aufsteigende Infektion birgt. Im Jahr 1956 beschrieben Merrill und Murray die erste Transplantation mit der Fossa iliaca (Fossa). Sie stellten fest, dass die Nierengrube nicht ausgewählt wurde, da sie eine gleichzeitige Nephrektomie erfordert und eine ureteroureterale Anastomose erfordert, die den Harnleiter einem hohen Risiko für die Bildung von Strikturen aussetzt. Als Ergebnis wurde geschlussfolgert, dass die Fossa iliaca den Zugang zu einer adäquaten Blutversorgung über die Beckengefäße sowie einen zugänglichen Harnleiterabfluss in die Harnblase direkt über die Ureteroneozystostomie ermöglicht. 15 Die Nieren werden in der Regel in der rechten Fossa iliaca (der kontralateralen Seite der gespendeten Niere) platziert, da die meisten Spendennephrektomien aufgrund der zunehmenden Länge der Nierenvene linksseitig sind. 2 In diesem Fall wurde die Patientin jedoch einer Transplantation in die linke Fossa iliaca unterzogen, da sie eine Vorgeschichte von Diabetes mellitus Typ I hat und in Zukunft möglicherweise eine Pankreastransplantation benötigt (die normalerweise in der rechten Beckengrube platziert wird). Der letzte Ansatz, der manchmal in Betracht gezogen wird, abhängig von der chirurgischen Vorgeschichte des Patienten und der Gefäßanatomie, ist ein intraperitonealer Zugang.
Der nächste wichtige Schritt in dieser Operation ist die vaskuläre Anastomose. Die Nierenvene wird meistens zuerst anastomosiert und in der Regel von Anfang bis Ende mit der Vena iliaca externa, aber diese Lokalisation variiert relativ zur arteriellen Anastomose. Die arterielle Anastomose kann die Nierenarterie des Spenders mit der gemeinsamen, äußeren oder inneren Beckenarterie des Empfängers verbinden, und das Verfahren hat sich im Laufe der Zeit weiterentwickelt. In der Vergangenheit wurde das innere Darmbein bevorzugt für eine End-to-End-Anastomose zur Nierenarterie des Spenders ausgewählt; Es konnte jedoch nicht gezeigt werden, dass dies der späteren Annäherung der Nierenarterie von Seite zu Seite an die Arteria iliaca communis oder Arteria iliaca externa überlegen ist. Daher wird heute am häufigsten eine Anastomose zwischen der Nierenarterie des Spenders und der äußeren Beckenarterie des Empfängers durchgeführt, da dieses Gefäß keine Äste im Becken hat und sich in unmittelbarer Nähe der Blase befindet, was die Erstellung der Ureteroneozystostomie erleichtert, ohne die distale Harnleiterblutversorgung zu beeinträchtigen. Wenn die Niere von einem verstorbenen Spender geborgen wurde, wird auch die Aorta des Spenders wiederhergestellt und kann zu einem Carrel-Pflaster verarbeitet und für die Anastomose der Arteria iliaca communis oder der Arteria iliaca externa verwendet werden. 2 Bei der Beschaffung der Spenderniere ist die Anzahl der Nierenarterien ein wichtiger Aspekt. Wenn es sich bei dem Spender um einen verstorbenen Spender handelt, ist es möglich, alle Nierenarterien, die von der Aorta des Spenders ausgehen, einschließlich ihres Ursprungs im Carrel-Patch zu erhalten. Bei einem Lebendspender ist dies jedoch nicht möglich, und mehrere Arterien werden entweder separat anastomosiert oder, was häufiger vorkommt, vor der Implantation der Niere zu einer Arterie anastomosiert. Wenn es kleine akzessorische Arterien gibt, die den oberen Pol der Niere versorgen, werden sie oft ligiert. Die unteren Polarterien versorgen eher den Harnleiter und werden daher seltener ligiert, da die Blutversorgung des Harnleiters optimal sein muss.
Die letzte Anastomose, die in Betracht gezogen werden muss, ist die Konstruktion der Anastomose der Spender-Harnleiter-Empfänger-Blase. Im Laufe der Jahre der Nierentransplantation gab es mehrere Ansätze für die Ureteroneozystostomie, die Implantation des Spenderharnleiters in die Empfängerblase. Ursprünglich war die am weitesten verbreitete Anastomose die Leadbetter-Politano-Technik, eine intravesikale Technik, die eine Exposition über eine anteriore Zystostomie erfordert, um ein submukösales Tunneln des Harnleiters und die Platzierung der Neo-Öffnung an einer nahezu anatomischen Stelle zu ermöglichen. 16 Der neuere extravesische Ansatz, der von Lich und Gregoir entwickelt wurde, wird heute von den meisten Transplantationszentren angewandt und ist der Ansatz, der in diesem Fall verwendet wird. Eine einzelne kleine Zystotomie wird an der Blasenkuppel angelegt und der distale Spenderharnleiter wird an der Blasenschleimhaut anastomosiert. Über dem Harnleiter wird dann eine seromuskuläre Schicht verschlossen. 2 Die letzte Methode ist eine Ureteropyelostomie, eine Anastomose zwischen dem Harnleiter des Empfängers und dem untersten Teil des Nierenbeckens des Spenders. Dieser Ansatz wird nicht häufig verwendet, da er häufig eine ipsilaterale native Nephrektomie erfordert und nachweislich eine höhere ureterale Leckrate aufweist. arabische Ziffer
Die letzte Überlegung in diesem Fall - und eine, die in der Literatur zur Nierentransplantation umstritten bleibt - ist die Verwendung eines Harnleiter-Stents. Mehrere Studien haben die Risiken und Vorteile von Harnleiter-Stents untersucht. Von den urologischen Komplikationen nach Nierentransplantation sind die meisten auf die vesikourerische Anastomose zurückzuführen. Der therapeutische Nutzen eines Harnleiter-Stents besteht darin, dass er die Schaffung einer wasserdichten Anastomose der Harnleiterschleimhaut zur Blasenschleimhaut vereinfacht und das anatomische Abknicken reduziert. Zu den erheblichen Risiken, die mit der Verwendung eines Stents verbunden sind, gehören jedoch wiederkehrende Harnwegsinfektionen und ein eventueller Transplantatverlust. Insgesamt war die Literatur nicht in der Lage, die Morbidität und die Kosten des universellen Stentimplantierens angemessen zu bewerten, und daher bleibt diese Praxis eine Beurteilung und Entscheidung von Chirurg zu Chirurg zum Zeitpunkt der Operation. 17 In diesem Fall stellte der behandelnde Chirurg fest, dass die Spenderniere ein zusätzliches Nierenbecken hatte, und vor Abschluss der Harnleiteranastomose schien das Nierenbecken voll zu sein. Daraufhin wurde ein 4,7 Fr. Doppel-J-Stent platziert.
Zusammenfassend lässt sich sagen, dass es sich bei diesem Fall um eine präventive Nierentransplantation im Zusammenhang mit lebenden Menschen handelt. Die vorgestellte Patientin hatte das Glück, einen Lebendspender zu haben, der nicht nur spendenbereit war, sondern auch für eine Spende geeignet war. Die Ergebnisse der Lebendspende sind denen der Spende von Verstorbenen überlegen, insbesondere wenn sie vor Beginn der Dialyse durchgeführt wird, wie es bei diesem Patienten der Fall war. Da die Warteliste für eine Nierentransplantation immer länger wird, wird die Bedeutung der Lebendspende weiter zunehmen. Es ist daher für Nierentransplantationszentren in den gesamten Vereinigten Staaten unerlässlich, Lebendspenden zu fördern. Eine vielversprechende Entwicklung ist die Verbreitung von laparoskopischen Spendernephrektomien. Diese Technik, die heute bei mehr als 90 % der Spendernephrektomien angewendet wird, verkürzt die Genesungszeit für Lebendspender. 11 Dies ist ein Beispiel für die Arbeit, die weiterhin Anreize für Spenden schaffen muss - sowohl für verminderte als auch für lebende Spenden -, um den Organmangel für Menschen mit Niereninsuffizienz zu bekämpfen.
Fogarty Hydragrip Clamps wurden zum Abklemmen der Beckengefäße verwendet. Edward Lifesciences liefert die Hydragrip-Einsätze für die Fogarty Clamp. Es wird angenommen, dass diese weniger traumatischen Klemmen das Risiko einer Dissektion verringern. Bei der Durchführung der arteriellen Anastomose wird für die Arteriotomie eine Aortenstanze von Teleflex Medical verwendet.
Nichts.
Corey Eymard, MGH Transplant Fellow, führte dieses Verfahren zusammen mit Dr. Nahel Elias durch.
Die Zustimmung zur Verwendung von klinischer Anamnese, Radiologie und intraoperativem Video wurde vom Patienten und den an der Erstellung dieses Fallberichts und der Filmaufnahmen beteiligten Anbieter eingeholt.
References
- Institut für Verbesserung des Gesundheitswesens. Organspende-Update: Erfolg bringt neue Herausforderungen mit sich. Verfügbar unter: http://www.ihi.org/resources/Pages/ImprovementStories/OrganDonationUpdateSuccessBringsNewChallenges.aspx
- Pereira BJG, Sayegh MH, Blake P. Chronische Nierenerkrankung, Dialyse und Transplantation. 2. Aufl. Philadelphia, Pennsylvania: Elsevier Saunders; 2005.
- Humar A, Dunn DL. Kapitel 11: Transplantation. In: Schwartz' Prinzipien der Chirurgie. 9e Aufl. New York, NY: McGraw-Hill; 2010.
- Punsch, JD. 45. Kapitel: Organtransplantation. In: Aktuelle Diagnose & Behandlung. 13e Aufl. 16, New York, NY: McGraw-Hill; 2006.16. Monga M. Ureteroskopie. New York: Humana Press, 2013.
- Renal Data System der Vereinigten Staaten. USRDS-Jahresdatenbericht 2020: Epidemiologie von Nierenerkrankungen in den Vereinigten Staaten. National Institutes of Health, Nationales Institut für Diabetes und Verdauungs- und Nierenerkrankungen, Bethesda, MD, 2020.
- Davis CL, Delmonico FL. Nierentransplantation von Lebendspendern: ein Überblick über die derzeitige Praxis für Lebendspender. J Am Soc Nephrol. 2005 Juli; 16(7):2098-110. doi:10.1681/ASN.2004100824.
- Murray JE, Merrill JP, Harrison JH, Wilson RE, Dammin GJ. Verlängertes Überleben von Mensch-Nieren-Homotransplantaten durch immunsuppressive medikamentöse Therapie. N engl J Med. 1963 Jun 13;268:1315-23. doi:10.1056/NEJM196306132682401.
- Klein AS, Messersmith EE, Ratner LE, Kochik R, Baliga PK, Ojo AO. Organspende und -nutzung in den Vereinigten Staaten, 1999-2008. Am J Transplantation. 2010 Apr; 10(4 Pt 2):973-86. doi:10.1111/j.1600-6143.2009.03008.x.
- Netzwerk für Organbeschaffung und -transplantation. Daten. Verfügbar unter: https://optn.transplant.hrsa.gov/data.
- Organspende- und Transplantationsstatistiken. Nationale Nierenstiftung. 2016. Verfügbar bei: https://www.kidney.org/news/newsroom/factsheets/Organ-Donation-and-Transplantation-Stats.
- Axelrod DA, McCullough KP, Brewer ED, Becker BN, Segev DL, Rao PS. Nieren- und Bauchspeicheldrüsentransplantation in den Vereinigten Staaten, 1999-2008: das veränderte Gesicht der Lebendspende. Am J Transplantation. 2010 Apr; 10(4 Pt 2):987-1002. doi:10.1111/j.1600-6143.2010.03022.x.
- Meier-Kriesche HU, Kaplan B. Wartezeit auf die Dialyse als stärkster modifizierbarer Risikofaktor für Nierentransplantationsergebnisse: eine Analyse der gepaarten Spendernieren. Transplantation. 27. November 2002; 74(10):1377-81. doi:10.1097/00007890-200211270-00005.
- Kasiske BL, Snyder JJ, Matas AJ, Ellison MD, Gill JS, Kausz AT. Präventive Nierentransplantation: der Vorteil und der Vorteil. J Am Soc Nephrol. Mai 2002; 13(5):1358-64. doi:10.1097/01.asn.0000013295.11876.c9.
- Ibrahim HN, Foley R, Tan L, et al. Langzeitfolgen der Nierenspende. N engl J Med. 29. Januar 2009; 360(5):459-69. doi:10.1056/NEJMoa0804883.
- Merrill JP, Murray JE, Harrison JH, Gilde WR. Erfolgreiche Homotransplantation der menschlichen Niere zwischen eineiigen Zwillingen. J Am Med Assoc. 28. Januar 1956; 160(4):277-82. doi:10.1001/jama.1956.02960390027008.
- Monga M. Ureteroskopie. New York: Humana Press, 2013.
- Wilson CH, Bhatti AA, Rix DA, Manas DM. Routinemäßige intraoperative Stentimplantation für Nierentransplantatempfänger. Transplantation. 15. Oktober 2005; 80(7):877-82. doi:10.1097/01.tp.0000181197.21706.fa.
- Aravindan N, Shaw A. Wirkung der Furosemid-Infusion auf die renale Hämodynamik und die Angiogenese-Genexpression bei akuter renaler Ischämie/Reperfusion. Ren Fail. 2006; 28(1):25-35. doi:10.1080/08860220500461229.
- Siedlecki A, Irisch W, Brennan DC. Verzögerte Transplantatfunktion bei der Nierentransplantation. Am J Transplantation. 2011 Nov; 11(11):2279-96. doi:10.1111/j.1600-6143.2011.03754.x.
Cite this article
Westfal ML, Elias N. Empfänger einer Nierentransplantation von einem Lebendspender. J Med Insight. 2023; 2023(171). doi:10.24296/jomi/171.

