Patolojik Subtrokanterik Kırığın Fiksasyonu için Karbon Fiber İmplant
Massachusetts General Hospital
Main Text
Table of Contents
Burada, teşhis edilmemiş primer akciğer adenokarsinomu nedeniyle patolojik subtrokanterik femur kırığı olan bir hastayı sunuyoruz. Kırık, kalıcı travmatik uyluk ve diz ağrısı bağlamında meydana geldi ve patolojik doğasının Acil Servis'te hızla tespit edilmesini sağladı. Tedavi planı, acil stabilizasyon ihtiyacı ve altta yatan onkolojik faktörler göz önünde bulundurularak karbon fiber çivi kullanılarak açık redüksiyon ve iç fiksasyonu içeriyordu.
Ana odak, geleneksel olarak intramedullar cihazlarla gerçekleştirilen kırığın fiksasyonunu sağlamaktı. Ancak, kırığın patolojik doğası ve ardından ameliyat sonrası onkolojik müdahale ihtiyacı nedeniyle karbon fiber tırnak kullanma kararı alındı. Karbon fiberin benzersiz radyolusiyeti, ameliyat sonrası radyasyon planlamasına yardımcı olur ve kemik lezyonlarını hedeflemede optimal görselleştirme ve hassasiyet sağlar. Bu yaklaşım, kırığın azalmasına katkıda bulunurken radyasyon tedavisine müdahaleyi en aza indirir.
Cerrahi işlem, karbon fiber çivi ile intramedullar çubuk ile kullanıldı; böylece kırığın başarılı bir şekilde azaltılması ve optimal donanım konumlandırılması sağlandı. Histopatolojik değerlendirme metastatik akciğer adenokarsinomunu doğruladı. Ameliyat sonrası hasta palyatif radyasyon ve hedefe yönelik tedavi aldı; iki aylık takipte önemli bir iyileşme görüldü (Şekil 6).
Dava, patolojik kırıkların yönetiminde karbon fiber implantların stratejik kullanımını vurgulamaktadır; bu da ameliyat sonrası görüntüleme, hastalık izleme ve radyasyon tedavisi planlamasında hassasiyet açısından avantajlar sunmaktadır. Çok disiplinli yaklaşım, özellikle metastatik kemik hastalığında sonuçları optimize etmek için implant seçimi inceliklerinin dikkate alınmasının önemini vurgular.
Karbon fiber implantlar; patolojik kırık; Metastatik kemik hastalığı.
Bir hasta, başlangıçta teşhis edilmemiş birincil akciğer adenokarsinomu bağlamında gerçekleşen patolojik subtrokanterik femur kırığıyla karşılaştı. Tıbbi geçmişinde kalıcı travmasız uyluk ve diz ağrısı vardı; giderek kötüleşiyor, sonunda ani ağrı artışı, bacak zayıflığı ve merdivenlerde bacağı çöktükten sonra düşme yaşanıyordu. Acil Servis'e başvurduktan sonra, kırıkın patolojik doğası hemen tespit edildi. Onkolojik değerlendirmeden sonra, tedavi planı açık bir redüksiyon ve iç fiksasyonu içeriyordu; acil kırığın stabilizasyonu ve altta yatan onkolojik faktörler nedeniyle karbon fiber çivi tercih edildi.
Bu durumda ana odak, geleneksel olarak intramedullary cihazla gerçekleştirilen kırık fiksasyonunu sağlamaktı. Ancak, kırıkların patolojik doğası ve ameliyat sonrası onkolojik müdahale ihtiyacı göz önüne alındığında, karbon fiber çivi kullanılmasına karar verildi. Metastatik durumlarda yaygın olan patolojik kırıklar, kalıntı kanser hücrelerini tedavi etmek ve doğal kemik iyileşmesini kolaylaştırmak için ameliyat sonrası radyasyon gerektirir. BT simülasyon planlamasını içeren radyasyon tedavi planlamasının uygulanması, karbon fiber implantlarla önemli ölçüde desteklenerek kemik lezyonu hedeflenmesinde görselleştirme ve hassasiyeti artırıyor. Bu yaklaşım, geleneksel metal implantların radyasyon planlaması sırasında oluşturduğu paraziti en aza indirirken kırığı azaltma hedefine ulaşmayı amaçlar.
Yaşlı beyaz bir kadının subtrokanterik patolojik kırığı bulundu. Bu arada, daha ileri incelemelerde hastanın primer akciğer karsinomu olduğu tespit edildi. Açık indirgeme ve iç fiksasyon sırasında karbon fiber çivi kullanımı sadece kırığı stabilize etmekle kalmadı, aynı zamanda ameliyat sonrası radyasyon planlamasında hassasiyeti optimize etti.
Hasta herhangi bir kafa çarpması veya bilinç kaybı olduğunu reddetti ve deliryum veya kafa karışıklığı belirtisi göstermedi. Sağ alt ekstremite fiziksel muayenesi ağrı nedeniyle sınırlı kaldı. Sağ bacağı belirgin şekilde kısalmıştı. Muayene, ekstensör halüsis longus (EHL), fleksör halüsis longus (FHL), tibialis anterior (TA) ve gastroknemius (GS) bölgelerinde ağrı ve sınırlı güç ortaya çıktı. Dorsalis pedis (DP) ve arka tibial (PT) dahil olmak üzere distal nabızlar sağlamdı ve sağ ayak sıcaklık ve yeterli perfüzyon gösterdi. Sonraki yumuşak doku yaralanması değerlendirmesi, yüzeysel peroneal sinir (SPN), derin peroneal sinir (DPN), tibial sinir (TN), safen sinir ve sural sinirde bozulmalar ortaya koydu.
Düşme sonrası ilk sunumunda sağ kalça ve femurun röntgen görüntülemesi, distal fragmanın medial yer değiştirmesi ile yer değiştirmiş subtrokanterik kırık ortaya koydu. Femur başı asetabulumda iyi oturmuş ve uyluk kemiğinin geri kalanı sağlam kalmıştır (Şekil 1). Marjinal osteofitlerle dejeneratif eklem boşluğu daralması belirgindir. Kontrastlı bir bilgisayar tomografisi (BT) taraması, sağ ana gövde bronşunu kaplayan büyük bir sağ üst lob kütlesi gösterdi ve bu da tam sağ üst lob atelektazisi ortaya çıktı (Şekil 2). Kütle kötü huylu şüpheliydi. Birden fazla büyümüş mediastinal ve iki taraflı hiler lenf düğümleri metastatik hastalık için endişe vericidir. Sağ femurun geliştirilmemiş BT taraması, kırığın alt kenarında femoral orta şaftın spesifik olmayan intrakortikal lusensileri ortaya koydu. Bu bulgu, altta yatan permetif lezyonlar ve patolojik bir kırık konusunda endişeler doğurdu (Şekil 3). Takip manyetik rezonans görüntüleme (MR) altta yatan kemik lezyonlarının varlığını belirlemeye yardımcı olmuş olsa da, akut ortamda değerlendirme ödem ve kanama nedeniyle sınırlıdır ve bu muayeneden vazgeçme kararı verilmesine neden olmuştur.
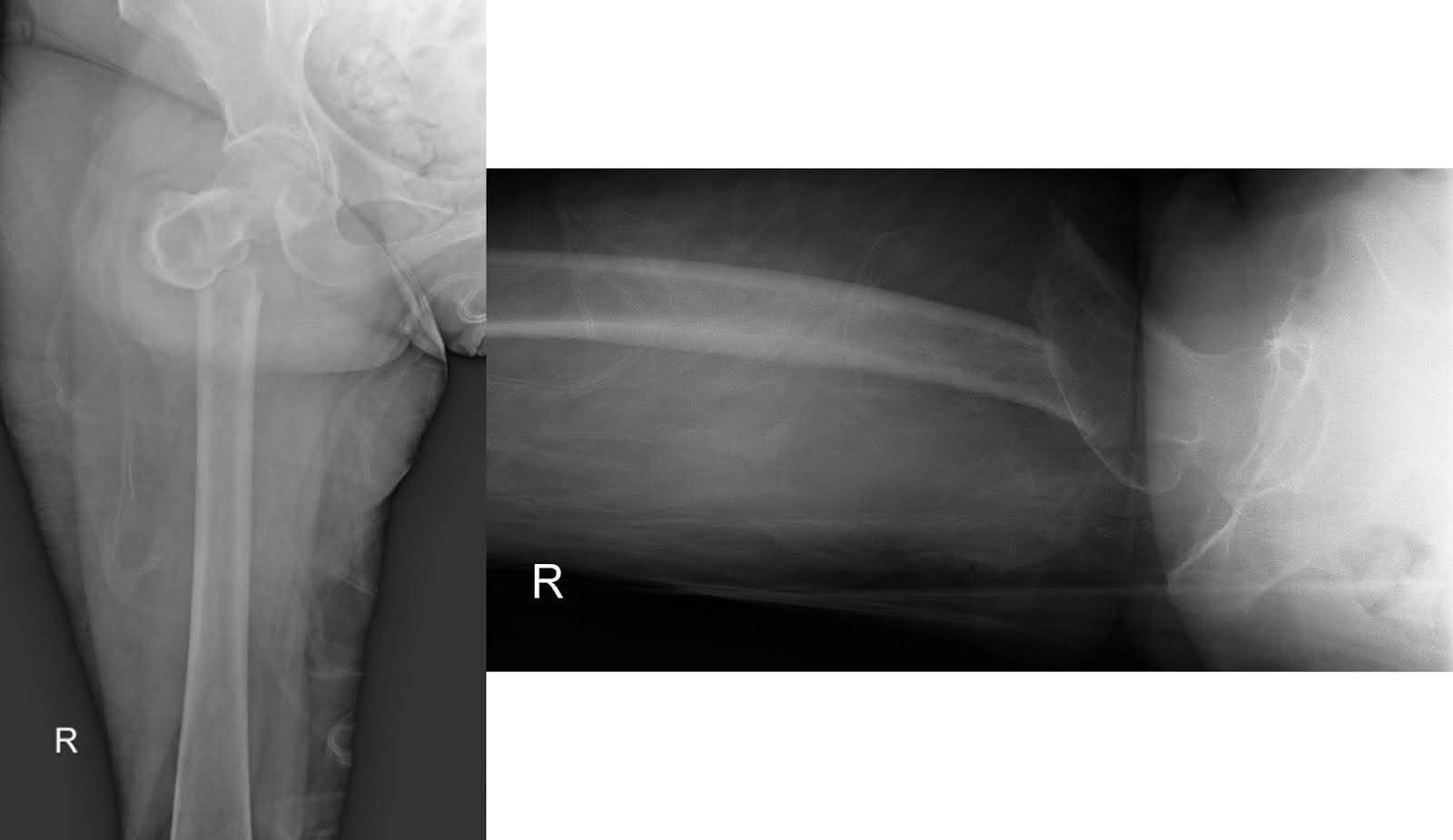
Şekil 1. AP ve sağ kalçanın lateral röntgenleri, yer değiştirilmiş subtrokanterik kırığı gösteriyor. Femur başı asetabulum içinde redaksiyonu sürdürürken, uyluk kemiğinin geri kalanı yapısal olarak sağlam kalır.
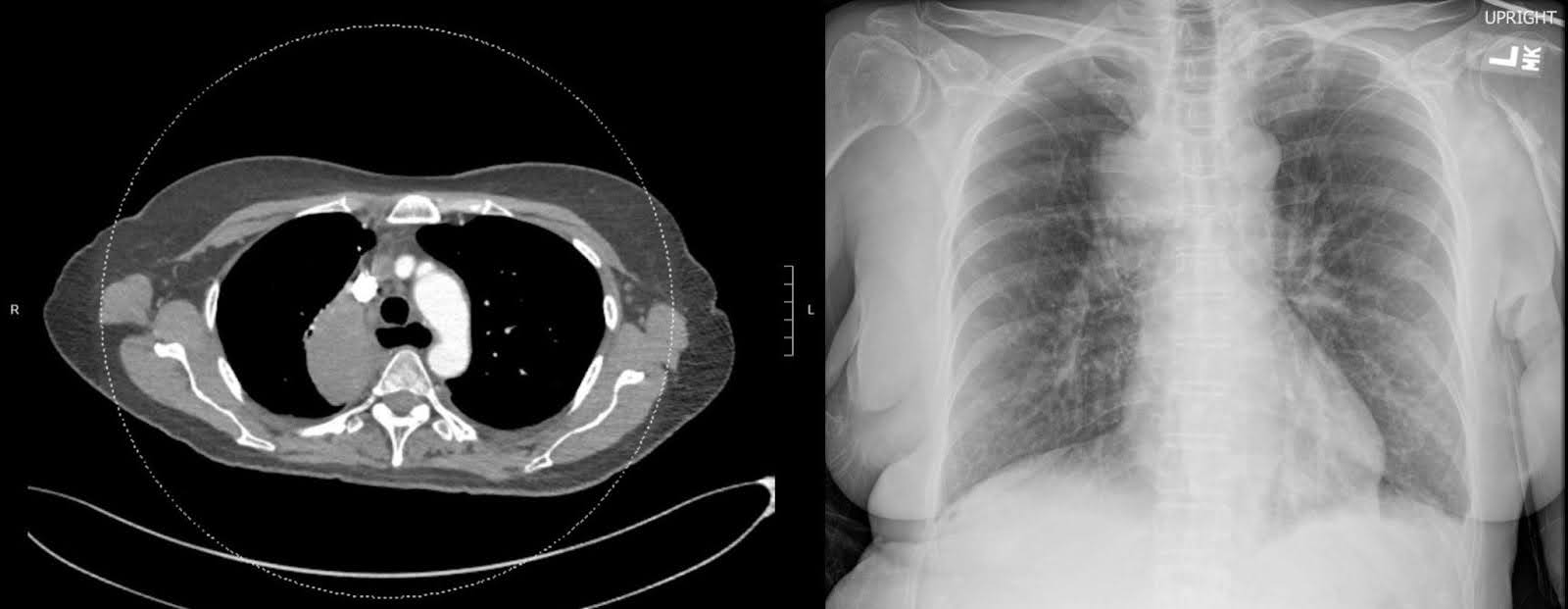
Şekil 2. Sağ üst lobun sağ paramediastinal bölgesinde bulunan heterojen olarak artıcı bir kütle kontrastlı göğüs BT'sinde tespit edildi. Bu bulgunun varlığı primer akciğer kanseri teşhisini göstermektedir.
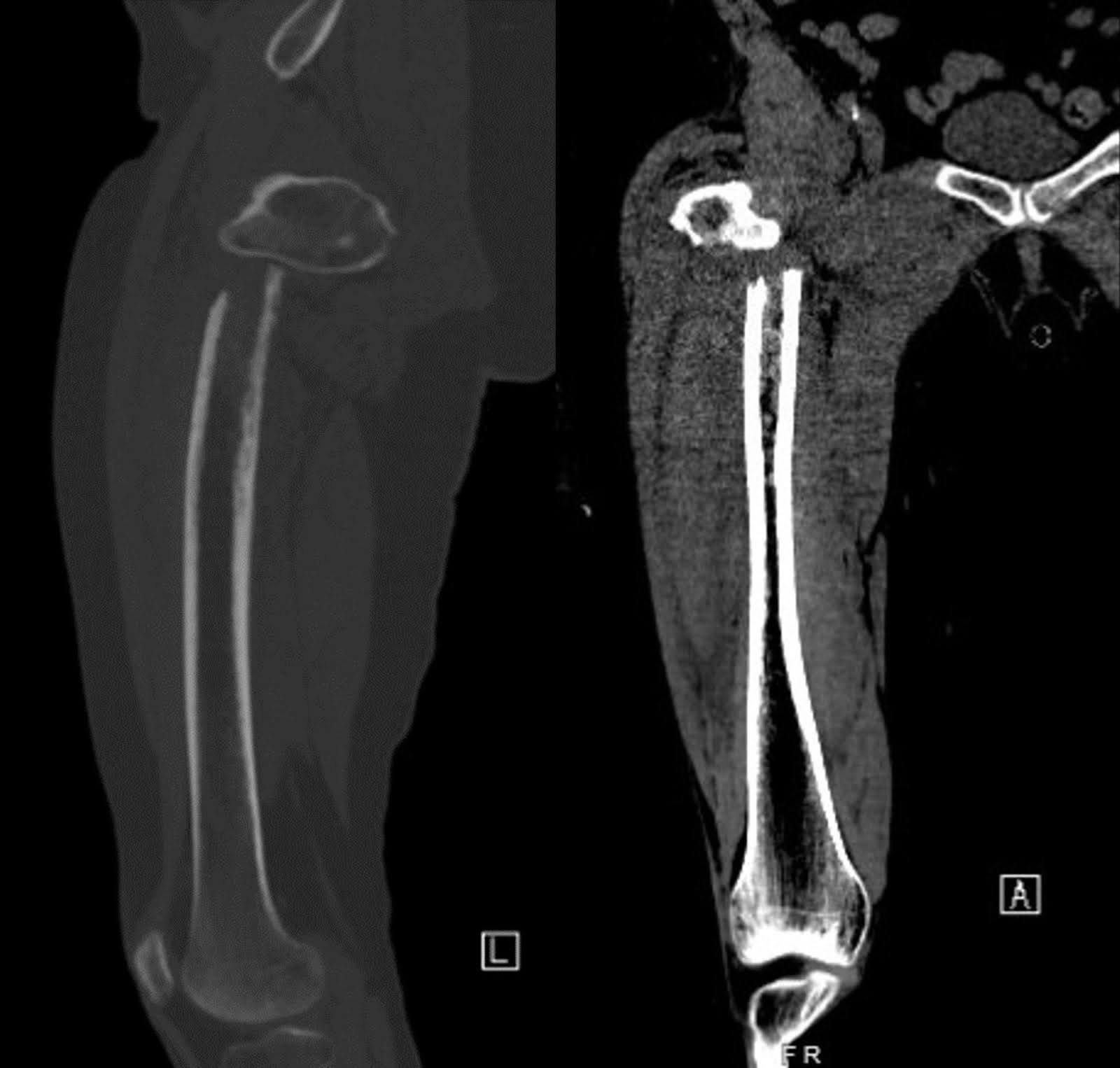 Şekil 3. Sağ femurun lateral ve AP kontrastsız BT görüntüleri, femur orta şaftında intrakortikal lusensiler göstermekte, olası patolojik kırık olabileceğini göstermektedir.
Şekil 3. Sağ femurun lateral ve AP kontrastsız BT görüntüleri, femur orta şaftında intrakortikal lusensiler göstermekte, olası patolojik kırık olabileceğini göstermektedir.
Patolojik kırıklar, travmatik kırıklardan farklı olarak, osteoporoz, kanser, enfeksiyon veya metabolik bozukluklar dahil ancak bunlarla sınırlı olmayan bir altta yatan durumun sonucu ortaya çıkar. Bu ayırt edici kırık kategorisi, kemiğin yapısal bütünlüğünü tehlikeye atan patolojik süreçlerin etkisiyle karakterize edilir.1 Patolojik kırıklar, önemli hastalıklara ve genel yaşam kalitesinde düşüşe yol açabilir.2 İskelet sistemi, akciğer ve karaciğerden sonra metastaz için üçüncü en yaygın yer olarak sıralanır.3 Tüm kemik metastazlarının yaklaşık %70'i metastatik meme ve prostat kanserlerinden kaynaklanır; akciğer, böbrek ve tiroid tümörleri ise yaygınlık açısından en yaygın nedenlerdir.4
Patolojik kırık yaşayan hastalarda kırık bölgesinde ağrı ve şişlik, yürüme zorlukları, hareket aralığının azalması, ekhimoz, lokal ödem ve belirgin uzuv kısaltması görülebilir.5 Patolojik kırıkların klinik göstergesi, genellikle minimum travma ile ortaya çıkar—sağlıklı bir kemiğin kırılması için gereken kuvvetten çok daha az kuvvetle—ortaya çıkan temel nedenlerdir.6 Patolojik kırıqlar nadir olsa da, altta yatan bir kanserin göstergesi olabilir.7 Bu, özellikle sınırlı veya eksik travma geçmişi olan durumlarda titiz bir araştırma ve tanı incelemesinin gerekliliğini vurgular.
Femoral patolojik kırık, travmatik bir femur kırığına benzer zorluklar sunar, ancak implant seçimini etkileyen ek ameliyat sonrası hususlar da getirir. Sağlıklı kemikte femur kırıklarının yönetimi gibi, kırığın azaltılması ve stabilizasyonu sağlanması da çok önemlidir. Bu sadece ağrıyı hafifletmekle kalmaz, yürüyüş için stabilite sağlar, aynı zamanda kırıkların optimal iyileşmesi için uygun bir biyomekanik ortam oluşturur.
Subtrokanterik kırıkların yönetimi, redüksiyon ve fiksasyona ulaşmada zorluklar yaratır; bu redüksiyon genellikle perkütan veya açık teknikler gerektirir.8 Cerrahi fiksasyon, iyi tolere edilen bir müdahaledir ve patolojik olmayan fiksasyonla benzer fonksiyonel sonuçlar gösterir.9 Onkolojik açıdan, kemikteki kötü huylu hücrelerin tedavisi etkili kemik iyileşmesi için çok önemlidir. Kırık sonrası tedavi rejiminde, kemoterapi ve radyasyon tedavisi bu hedefe ulaşmada kritik rol oynar. Genellikle dış ışın tedavisiyle planlanan radyasyon tedavisi, doğru planlama için tedavi öncesi BT taraması gerektirir. Ancak metal implantların varlığı ışın saçılmasına neden olabilir, görüntüleme çözünürlüğünü düşürebilir ve radyasyon tedavi planlarını etkileyebilir. Metallerin radyografik özelliklerinden arındırılmış karbon fiber implantlar, kırığın azaltılması ve iyileşme hedeflerini etkili bir şekilde yerine getirirken, radyoterapi için gerekli adjuvant tedavileri en az şekilde etkileyebilir.10
Kırık sonrası uzun kemik fiksasyonunun amacı, doğru iyileşmeyi kolaylaştırmak, stabiliteyi geri kazandırmak ve fonksiyonel iyileşmeyi teşvik etmektir. Subtrokanterik femur kırıkları için tedavi seçenekleri değerlendirilirken, fiksasyonun birincil yöntemleri tırnak veya plaka fiksasyonudur; mevcut ortopedi literatürü ise tırnak fiksasyonunu desteklemektedir.8 İmplant malzemeleri seçiminde, kırığın altta yatan etiyolojisi ve cerrahın her iki tekniği de yeterliliği dikkate alınmalıdır.
Metastatik kemik hastalığına bağlı patolojik kırıkları olan hastalarda, karbon fiber tırnaklar, radyolucency ve avantajlı mekanik özellikleri nedeniyle titanyum tırnaklara tercih edilen bir alternatif olabilir.11,12 Karbon fiber implantlar, BT'de saçılmayı önemli ölçüde azaltır ve MR'da duyarlılık artefaktını azaltır; bu da kemik iyileşmesinin daha iyi görselleştirilmesini, ameliyat sonrası yerel hastalık nyöresi veya ilerlemesini gözetimi ve radyasyon planlamasında hassasiyeti sağlar.10,13,14
Karbon fiber fiksasyonun birçok avantajı olsa da, karbon fiber ve metal fiksasyonun fonksiyonel sonuçları ve komplikasyon profilleri arasında hiçbir fark yoktur.11,12 Her iki teknik de kırık stabilizasyonu ve azaltımın sürdürülmesi hedefini düşük komplikasyon riski ile iyi belgelenmiş iyileşme ve biyouyumluluk ile gerçekleştirir. Bu nedenle, ameliyatçı cerrah karar alma sürecinde her fiksasyon yöntemi ve implant tipiyle ilgili yeterlilik ve konfor seviyesini dikkatlice değerlendirmelidir.12,15
Patolojik subtrokanterik kırık için tedavi stratejisi oluşturulurken, hem kısa hem de uzun vadeli hedeflerin dikkate alınması şarttır. Kısa vadede, fiksasyon için karbon fiber implant kullanmak, kırık kredimi sonrası kemik stabilitesini sağlamayı amaçlar. Kırık küçültme, uzuv uzunluğunu, kas gerginliğini ve normal anatomik ilişkileri geri kazandırır. Bu azalmayı sürdürmek, kemik parçalarını uygun şekilde stabilize ederek ağrıyı azaltır.16 Yük paylaşımı cihazı olarak implant, hastanın anında harekete geçmesine olanak tanıyarak venöz tromboembolizm, yatak yaraları ve hızlı kondisyon riskini azaltabilir.17
Ameliyat sonrası ara dönemde, implantın sağladığı stabilite, özellikle kanser tedavisi için adjuvan tedavi ile birleştiğinde, kırığın iyileşmesini teşvik etmede kritik bir rol oynar.18 Karbon fiber implantı tercih etmek, ameliyat sonrası radyografik hastalık izlemesini kolaylaştırmakla kalmaz, aynı zamanda radyasyon tedavisi planlamasının hassasiyetini de artırır. Bu stratejik seçim, genel tedavi yaklaşımında doğruluk ve etkinliğin artmasına katkıda bulunur.19
Karbon fiber implantlar, kısa bir kalıntı kemik segmenti (5 cm) ve büyük bir çimento aralığı olan büyük segmental rezeksiyon gerektiren humeral diafizal kemik tümörleri için kontrendikasyon olabilir. Bu tür implantlar, çimento ara parçası ile kalıntı kemik arasında elastiklik uyumsuzluğu modülü bulunan intramedullar çivinin distal kısmındaki bükülme kuvvetleri nedeniyle gerilim nedeniyle başarısız olabilir. Bu tür durumlarda, titanyum intrameduller tırnaklar tercih edilen bir tercih olarak ortaya çıkar ve bu özel bağlamda karbon fiber implantlarla ilgili zorlukları ele almak için potansiyel bir çözüm sunar.20
Cerrahlar, karbon fiber implantlara aşinalık ve konfor seviyelerini göz önünde bulundurmalı, bu implantlarla ilgili öğrenme eğrisini göz önünde bulundurmalıdır. Karbon fiber implantlar, özellikle ortopedi ve omurga onkolojisinde daha uzun ameliyat ve floroskopi süreleriyle ve kan kaybının artmasıyla ilişkilendirilmiştir.12,21 Karbon fiber implantların bu uzmanlık alanına uygunluğuna karar verirken klinik hususları ve cerrah yetkinliğini dengelemek çok önemlidir.
Ortopedide karbon fiber implantların kullanımı, birkaç kritik klinik faktörün kapsamlı bir şekilde değerlendirilmesini gerektirir. Titanyum implantlarla karşılaştırılabilir komplikasyon ve başarısızlık oranlarına rağmen, karbon fiber implantlar bükülme veya konturlama için ameliyat içi esnekliğe sahip değildir. Cerrahlar, en iyi uyumu sağlamak için titiz bir ameliyat öncesi planlama yapmalıdır.22 Karbon lifin radyolüsensisi ameliyat sonrası görüntüleme çalışmaları için avantajlı olsa da, implant pozisyonunun ameliyat sırasında doğrulanması zorluklar yaratabilir. Buna karşılık, metalik implantlar ameliyat sırasında esneklikten yoksun olsa da, radyasyon planlaması haritalamasını sıklıkla bozur ve doğru doz hesaplama ile teslimatı engeller.23,24 Ayrıca, hastalığın ekleme de yayıldığı ve eklem değişimi gerektiren durumlarda, karbon fiber implantlar en uygun seçenek olmayabilir. Bu nedenle, karbon fiber implantların kullanılması kararı, belirli klinik bağlamlarda faydalarının ve sınırlamalarının incelikli bir değerlendirmesini içerir.
Lezyonun ameliyat fiksasyonu için sağ femurun intramedullar çubukları ve metastatik kemik hastalığının etiyolojisini belirlemek için açık biyopsi yapıldı. Görüntüleme çalışmalarına göre, bu kemiğe metastaz yapan primer akciğer kanseri olarak görülmüştür. Hasta, bir fasulye torbasının yardımıyla lateral dekubitus'a yerleştirildi. Tüm kemik çıkıntıları yeterince dolgunlaştırılmıştı. Subaxillary roll yerleştirildi ve sol peroneal sinirin boşaltılması gerçekleştirildi.
Proksimal uylukta lateral kesi yapıldı ve ardından kırığın ortaya çıkması için subvastus yaklaşımı uygulandı. Kırık noktası tespit edildikten sonra bir Cobra retraktoru, maruziyeti kolaylaştırdı. Kalıcı ve dondurulmuş patoloji örnekleri curettes kullanılarak alındı. Donmuş patoloji, metastatik akciğer adenokarsinomunu doğruladı. Tümör lezyonun hem kemik içinde hem de dışında agresif debridmenti yapıldı. Cerrahi alanın peroksit çözeltisiyle bol miktarda sulanması gerçekleştirildi.
Yeni eldivenler ve yeni aletler kullanılarak, proksimal uyluk kemiğine erişim sağlamak için ilk bölgeye yakın bir kesi yapıldı. Gluteus medius'un fasyası, büyük tüberozitenin ucunu belirlemek için uzunlamasına kesilmiştir. 3,2 mm'lik bir kılavuz tel, başlangıç noktasını işaret ederek, hem anteroposterior (AP) hem de yan görüşlerde mükemmel bir konum sağlardı. Femurun nötr konumda tutulması, bir Shantz iğnesi sayesinde kolaylaştırıldı; bu da iç dönmeye ve proksimal femoral parçanın adduksiyonuna yardımcı oldu.
Önemli şekilde eğilmiş parça, uzanmasını sağlamak için ek konumlandırmadan geçti. Kırıkın anatomik olarak kredilmesi için proksimal femur ve femoral şaftta iki Shantz piniyle desteklenen parmak küçültme aracı kullanıldı. Kırık küçüldükten sonra, açılan reamer proksimal femurda yörünge açıldı. Top uçlu bir kılavuz teli ilerleterek küçültmeyi sürdürdük ve telin distal femurda mükemmel konumunu doğruladık. 11 mm çapında 360 mm karbon fiber bir çivi ölçüldü. Sırayla 12,5 mm boyutuna kadar kazdık ve bir tüp değiştirici kullanarak top uçlu kılavuz telini çıkarıp pürüzsüz olanı taktık. Karbon fiber femur çivi, geleneksel şekilde düzgün telin üzerine yerleştirilirdi; nişan kolu öne yerleştirilirken, nişan kolu dışa doğru döndürülürken çivi ilerlerken. Çubuk, son konumuna getirilir ve çubuğun üst kısmı proksimal femur tarafından kaplanır.
Yumuşak dokuları manipüle ederek, biyopsideki kesiyi kullanarak üçlü trocharı nişan koluna soktuk. Sonra kalça vidası için femur boynun yörüngesini belirlemek için femoral kılavuz teli üzerinden yerleştirdik. Floroskopide doğru pozisyon kesinleşti. 95 mm uzunluğa kadar ream yapıldı. Kalça vida için alet zorluk olmadan sabitlendi; önce yol açıldı, ardından vida femoral boyunda işaretli yörünge boyunca yerleştirildi ve ardından ayar vidayla sabitlendi.
Sağ kalça ve dizin mükemmel AP noktası korunarak, çivinin distal kısmı 40 ve 40,5 mm uzunluğunda iki 5,0 mm titanyum vida ile sabitlenmiştir (Şekil 4). Son görüntüler, çatlakın başarılı şekilde azaltılmasını ve optimal donanım konumlanmasını doğruladı (Şekil 5). Bol miktarda sulama yapıldı, ardından katman katman kapatma yapıldı. Dava sırasında herhangi bir komplikasyon yaşanmadı. Vaka süresi 121 dakika olup, tahmini kan kaybı 250 mL idi.
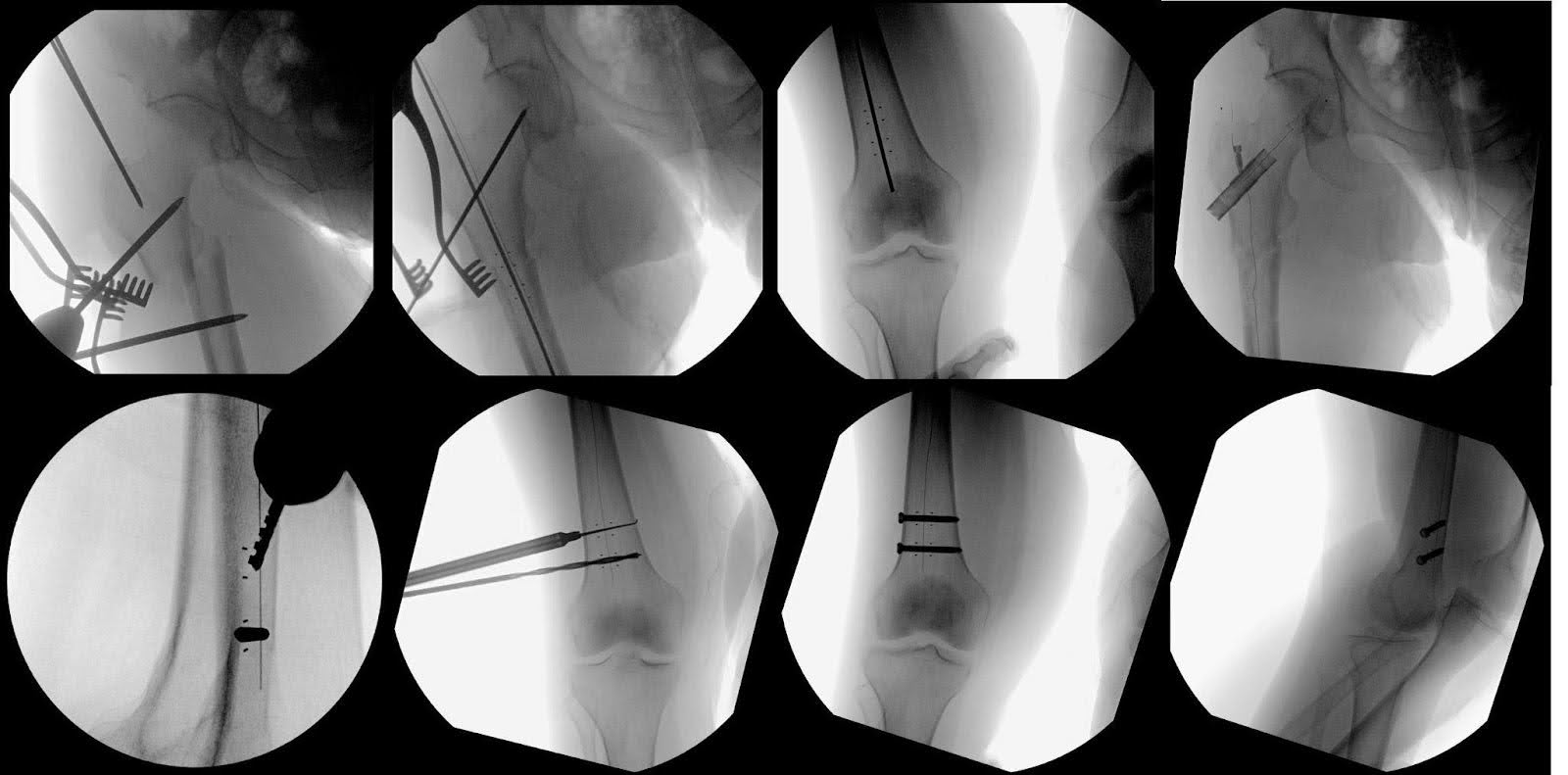
Şekil 4. Femur kırığının tedavisinde kullanılan farklı cerrahi adımları göstermek için floroskopi görüntüleme kullanıldı. Bu, başlangıç noktasının gösterilmesini ve kırığın Shantz pinleriyle azaltılmasını da içeriyordu. Ek görüntüleme ile karbon fiber çivi, karbon fiber kalça vida ve çivin stabilitesini sağlamak için kullanılan iki titanyum kilitli vida gösterildi. Radyo-opak işaretleyiciler, hem AP hem de yan görüşlerden gözlemlenebilen bu açıklıkların görselleştirilmesine yardımcı oldu. Bu giriş deliklerinin kılavuzlarının, titanyum çivileri için floroskopide genellikle görülen standart dairesel kılavuzlardan farklı olması dikkat çekicidir.
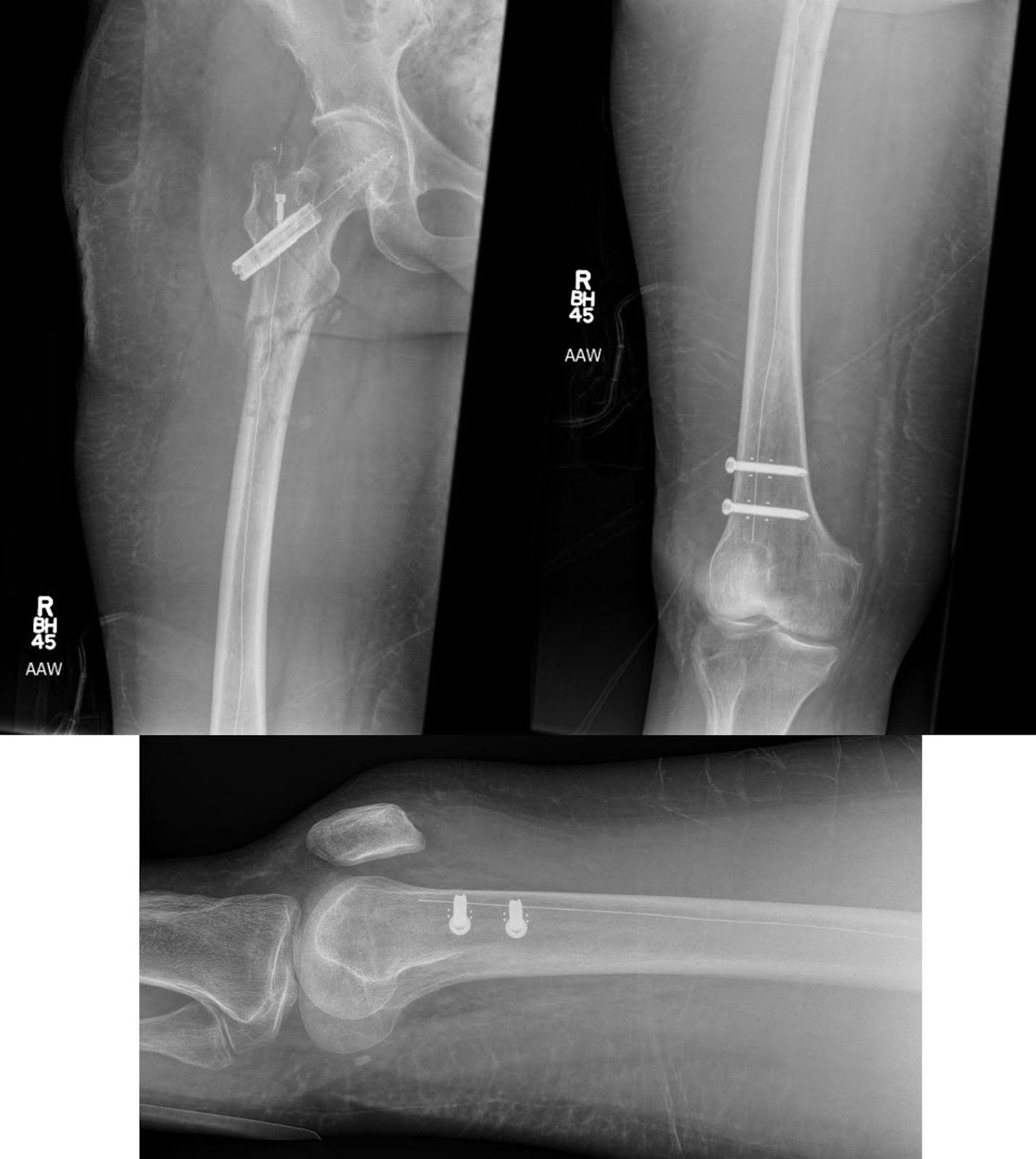
Şekil 5.Sağ femurun patolojik subtrokanterik kırığı için AP remürünü ve karbon fiber intrameduller çubuk fiksasyonundan sonra dizin lateral röntgeni, donanım komplikasyonu belirtisi olmadan hizalanmanın iyileşmesini göstermektedir. Alt bacakta ek şüpheli litik lezyon bulunmamaktadır ve yeni kırıklara dair bir belirti yoktur.
Ameliyat fiksasyonuna ek olarak sağ proksimal femurun açık biyopsisi yapıldı ve tozlu pembe-kırmızı yumuşak doku parçalarından oluşan 5.5x5.5x2.5 cm ölçümlüğünde bir örnek, burs eğitimi almış kemik ve yumuşak doku patoloğu tarafından histopatolojik değerlendirme için gönderildi. PD-L1 için bir immünbotain örneği temsil eden bir doku bloğunda yapıldı ve puanlama için >100 tümör hücresi ortaya çıktı. PD-L1, tümör hücrelerinin %>95'inde güçlü yoğunlukta membrana boyama gösterdi (tümör oranı puanı veya TPS, >95%).25 İmmünohistokimya, tümör hücrelerinin TTF-1 ve Napsin-A için pozitif, p40 için negatif olduğunu gösterdi. Bu bulgulara dayanarak, sağ proksimal femur lezyonunun nihai patolojik tanısı akciğer primer ile uyumlu metastatik karsinomdur.26–28
Ameliyattan bir ay sonra, hasta sağ kalçaya beş fraksiyonda 20 Gy palyatif radyasyon aldı. Metastatik kemik hastalığı ortamında, radyasyon tedavisi osteoklast aktivasyonunu hafifler, tümör hücrelerini öldürür ve kemik ağrısını kemikleşme yoluyla hafifleder.29 Aynı zamanda, tıbbi onkoloji hastaya metastatik küçük hücreli olmayan akciğer kanserini tedavi etmek için kullanılan hedefli bir tedavi olan Capmatinib tedavisine başladı. İki aylık takipte, hasta yürüteç olmadan yürüyebilerek önemli bir iyileşme gösterdi. Dizleri valgus ve varus gerginliğine karşı stabil oldu, tam uzatma ve 30° fleksiyon varusuna sahipti. Kalça fleksiyonu, ekstasyon, iç rotasyon ve dış rotasyon normal sınırlar içindeydi. Capmatinib'e başladıktan altı hafta sonra hasta tedaviye iyi yanıt vermeye başladı. Göğüs BT'sinde sağ üst lobda azalmış bir kütle ve iki taraflı mediastinal ile hiler lenfadenopati azaldı. En son takibinde, işlevsel durumunda belirgin bir donanım değişikliği ve belirgin bir değişiklik olmamıştır; Kapmatinib almaya devam etmekle sık radyografik izleme altında (Şekil 7).
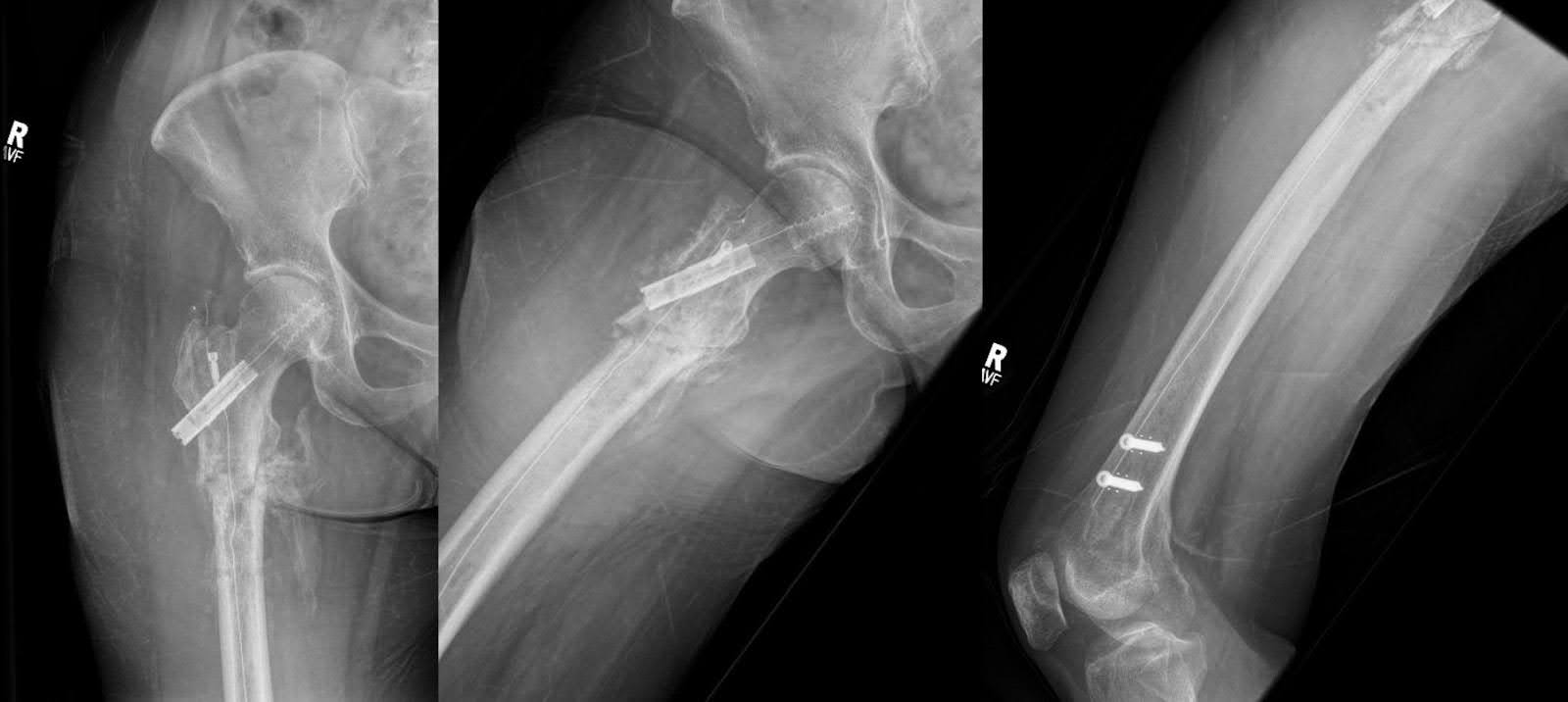
Şekil 6. Fiksasyondan iki ay sonra yapılan AP ve femurun lateral röntgenleri ile dizin lateral röntgenleri, yeni nasır oluşumu ve kemik köprüleri göstererek orijinal hizalanmayı korur. Yeni bir kırık yok, ancak sağ kalçada hafif dejeneratif değişiklikler gözlemlenmiştir.
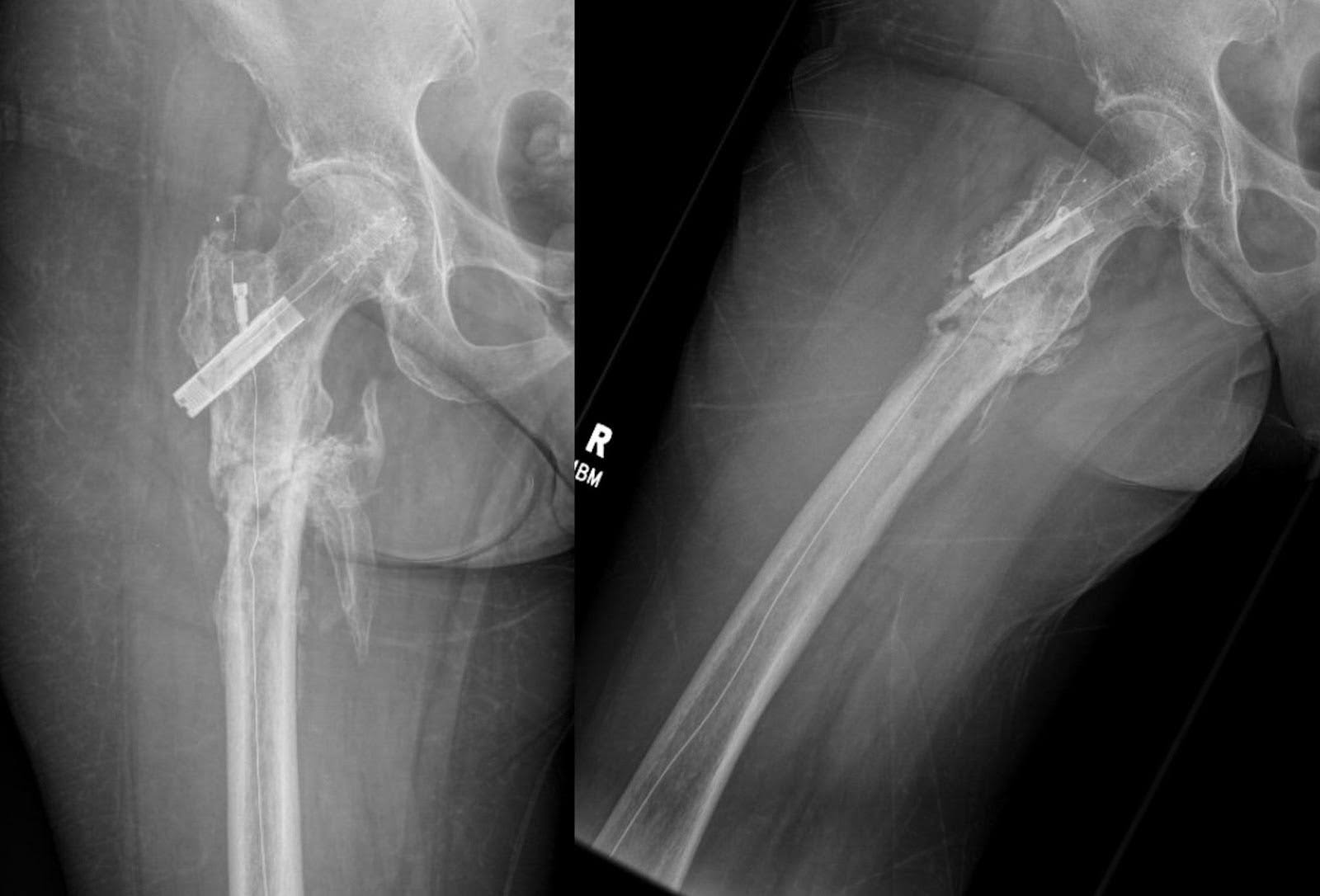
Şekil 7. Fiksasyondan altı ay sonra, AP ve lateral femur röntgenleri, kallus oluşumunun devam ettiğini ve bol kemik köprülerinin başlangıç hizalanmasını sürdürdüğünü gösterir. Kırık, heterotopik kemik oluşumunun yanı sıra eksik iyileşme belirtileri gösterir. Belirgin donanım komplikasyonları veya yeni kırığa dair belirti yoktur. Ayrıca, benzer dejeneratif değişiklikler sağ kalçada da devam eder.
Metastaz, kanserle ilişkili morbidite ve ölümde önemli bir rol oynar.30 Akciğer kanseri, sırasıyla erkeklerde ve kadınlarda en yaygın ikinci karsinom olup, beyin, kemikler ve adrenal bezlerde metastaz tercih eder.31,32 Metastatik kemik hastalığı sadece hastalara sakat edici ağrı verdirmekle kalmaz, aynı zamanda önemli bir maddi yük de getirir. Amerika Birleşik Devletleri'nde bu hastalıkla mücadele eden 250.000 hasta tahmini, yıllık sağlık maliyeti 12 milyar dolar anlamına geliyor.33,34 Tedavilerdeki ilerlemeler, kanser sağlıklarını artırırken, metastatik kemik hastalığı vakalarının artmasına yol açmıştır. Bu durumdan kaynaklanan patolojik kırıqlar, kemiğin yapısal bütünlüğünü tehlikeye atan boyutlara ulaşan çok sayıda lezyondan kaynaklanır ve sonunda çatlaklarla sonuçlanır.35 Uzun vadeli hasta hayatta kalma ve yaşam kalitesini artırmak için, hastalık yönetiminde uygun tedavi yöntemlerinin stratejik olarak önceliklendirilmesi çok önemlidir.36
Bu hastada femur kırığından önce onkolojik bir teşhis bulunmadığı için, kırık öncesi risk altındaki kemik lezyonlarını tespit etmeye yardımcı olabilecek temel noktaların vurgulanması önemlidir. Hasta, kırıktan önce kalçada birkaç ay süren ağrı bildirdi; bu ağrı genellikle herhangi bir visseral karsinomun ilk klinik bulgusu olabilir. Dikkatli öykü alınması ve açıklanamayan ağrı ortaya koyan fiziksel muayene bulguları, özellikle fonksiyonel ağrı araştırılmalıdır. En uygun değerlendirme yöntemi, etkilenen ekstremitedeki tüm kemiğin sade radyografi yapmaktır; böylece yönlendirilmiş ağrının maskeleme klinik faktörü olmadığından emin olur.
Kırık uygun şekilde tedavi edildikten ve hasta ameliyat sonrası hemen geçtikten sonra, dikkat altta yatan hastalığın ele alınmasına yönelmelidir; bu da tıbbi ve radyasyon onkolojisini içeren çok disiplinli bir yaklaşım gerektirir. Tıbbi onkoloji, hem birincil kanser hem de metastatik lezyonlar için sistematik tedavi sağlar. Radyasyon onkolojisi, subakut postoperatif dönemde yerel tedavide kritik bir amaca hizmet eder; yayılmış kanser hücrelerini agresif şekilde hedefleyerek temel kemik iyileşme sürecini kolaylaştırır. Vaka serileri, medullar tırnak stabilizasyonundan sonra hastalık ilerleme oranının daha düşük olduğunu bildirse de, hasta hayatta kaldıkça donanım arızası riski artar.37,38 Karbon fiber implantlar, gelişmiş görüntüleme teknikleriyle kullanıldığında hastalık izleme ve kemik iyileşmesini iyileştirebilir.12 Hasta tarafından bildirilen sonuçlar ve karbon fiber implantların titanyum karşısında maliyet etkinliğini inceleyen çalışmalar, klinik benimsemeyi artırabilir.
Karbon fiber implant dışında özel bir ekipman kullanılmadı.
Yazar, CarboFix Orthopaedics Ltd. için ücretli konuşmacı ve danışmandır.
Bu video makalesinde bahsedilen hasta, çekimlere bilinçli onay vermiş ve bilgi ile görüntülerin çevrimiçi yayınlanacağının farkındadır.
Animasyon ise yayın sonrası 10/03/2025 tarihinde eklendi. Makale içeriğinde herhangi bir değişiklik yapılmadı.
References
- Haase SC. Patolojik kırıkların tedavisi. El Kliniği. 2013; 29(4):579-584. doi:10.1016/j.hcl.2013.08.010.
- Coleman RE. Metastatik kemik hastalığının klinik özellikleri ve iskelet morbiditesi riski. Klinik Kanser Arş. 2006; 12(20 sayfa 2):6243S-6249S. doi:10.1158/1078-0432.CCR-06-0931.
- Hage WD, Aboulafia AJ, Aboulafia DM. Metastatik kemik hastalığının insidansı, yeri ve tanısal değerlendirmesi. Orto Klinik Kuzey. 2000; 31(4):515-528, vii. doi:10.1016/s0030-5898(05)70171-1.
- Metastatik kemik hastalığı ortamında primer malign tümörlerin prevalansı, patolojik kırık oranları ve mortalite. Kemik Jt Açık. 2023; 4(6):424-431. doi:10.1302/2633-1462.46.BJO-2023-0042. R1 olarak adlandırılır.
- Johnson SK, Knobf MT. Yaklaşan veya gerçek patolojik kırıkları olan kanser hastaları için cerrahi müdahaleler. Orthop Hemşireliği. 2008; 27(3):160-171; Bilgi Yarışması 172-173. doi:10.1097/01.NOR.0000320543.90115.d5.
- De Mattos CBR, Binitie O, Dormans JP. Çocuklarda patolojik kırıklar. Kemik Eklem Arş. 2012; 1(10):272-280. doi:10.1302/2046-3758.110.2000120.
- Kim LD, Bueno FT, Yonamine ES, Próspero JD de, Pozzan G. Tümörlerin ilk belirtisi olarak kemik metastazı: primer tümörün oluşturulmasında bir immünohistokimya çalışmasının rolü. Rev Sütyen Ortop (Sao Paulo). 2018; 53(4):467-471. doi:10.1016/j.rboe.2018.05.015.
- Yoon RS, Donegan DJ, Liporace FA. Subtrokanterik femur kırıklarının azaltılması: ipuçları ve püf noktaları, yapılması ve yapılmaması gerekenler. J Orthop Travması. 2015; 29 Ek 4:S28-33. doi:10.1097/BOT.00000000000000287.
- Weiss RJ, Ekström W, Hansen BH, et al. 194 hastada patolojik subtrokanterik kırıklar: patolojik ve patolojik olmayan kırıkların cerrahi tedavisi sonrası sonuçların karşılaştırılması. J Cerrahi Oncol. 2013; 107(5):498-504. doi:10.1002/jso.23277.
- Depauw N, Pursley J, Lozano-Calderon SA, Patel CG. Proton ve foton tedavisi için karbon fiber ve titanyum cerrahi implantların değerlendirilmesi. Radiat Oncol. 2023; 13(3):256-262. doi:10.1016/j.prro.2023.01.009.
- Lozano-Calderon SA, Rijs Z, Groot OQ, et al. Onkolojik endikasyonlar için karbon fiber çivilerle tedavi edilen uzun kemiklerin sonuçları: uluslararası çok kurumlu çalışma. J Acad Ortopedi Cerrahisi. 2024; 32(3):E134-E145. doi:10.5435/JAAOS-D-22-01159.
- Yeung CM, Bhashyam AR, Groot OQ, et al. Ortopedik onkolojide karbon fiber ve titanyum intramedüller çivilerin karşılaştırılması. Kemik Jt Açık. 2022; 3(8):648-655. doi:10.1302/2633-1462.38.BJO-2022-0092. R1 olarak adlandırılır.
- Ernstberger T, Heidrich G, Bruening T, Krefft S, Buchhorn G, Klinger HM. MRG artefaktında intervertebral spacer materyallerinin gözlemciler arası doğrulanmış alaka düzeyi. Avrupa Omurga J. 2007; 16(2):179-185. doi:10.1007/s00586-006-0064-5.
- Alvarez-Breckenridge C, de Almeida R, Haider A, et al. Omurga tümörlerinin tedavisi için karbon fiber takviyeli polietereterketon omurga implantları: algılanan avantajlar ve sınırlamalar. Nöroomurga. 2023; 20(1):317-326. doi:10.14245/ns.2244920.460.
- Clunk MJ, Gonzalez MR, Denwood HM ve diğerleri. Karbon fibere bir PEEK: ortopedik onkoloji için yüksek performanslı kompozit polimerik implantlar için pratik bir kılavuz. J Orthop. 2023;45:13-18. doi:10.1016/j.jor.2023.09.011.
- Manglani HH, Marco RA, Picciolo A, Healey JH. Kanser hastalarında ortopedik aciller. Semin Oncol. 2000; 27(3):299-310.
- Booth K, Rivet J, Flici R, et al. Progresif mobilite protokolü, travma yoğun bakım hastalarında venöz tromboemboli oranını azaltır: bir kalite iyileştirme projesi. J Travma Hemşireliği. 2016; 23(5):284-289. doi:10.1097/JTN.00000000000000234.
- Colyer RA. Patolojik neoplastik kırıkların cerrahi stabilizasyonu. Curr Probl Kanseri. 1986; 10(3):117-168. doi:10.1016/s0147-0272(86)80005-8.
- Xin-ye N, Xiao-bin T, Chang-ran G, Da C. Radyoterapide karbon fiber implantların beklentisi. J Uygulama Klinik Tıp Fizik 2012; 13(4):3821. doi:10.1120/jacmp.v13i4.3821.
- Bhashyam AR, Yeung C, Sodhi A, et al. Humerus kemik tümörleri için titanyum ve karbon fiber takviyeli intramedüller çivileme. J Omuz Dirsek Cerrahisi. 2023; 32(11):2286-2295. doi:10.1016/j.jse.2023.04.023.
- Cofano F, Di Perna G, Monticelli M, et al. Spinal metastazlarda fiksasyon için karbon fiber takviyeli ve titanyum implantlar: yeni "karbon stratejisinin" güvenliği ve etkinliği hakkında karşılaştırmalı bir klinik çalışma. J Clin Nörobilim. 2020;75:106-111. doi:10.1016/j.jocn.2020.03.013.
- Yeung CM, Bhashyam AR, Patel SS, Ortiz-Cruz E, Lozano-Calderón SA. Ortopedik onkolojide karbon fiber implantlar. J Clin Med. 2022; 11(17). doi:10.3390/jcm11174959.
- Tedesco G, Gasbarrini A, Bandiera S, Ghermandi R, Boriani S. Kompozit PEEK / karbon fiber implantlar, omurga tümörlerinin tedavisinde radyoterapinin etkinliğini artırabilir. J Omurga Cerrahisi. 2017; 3(3):323-329. doi:10.21037/jss.2017.06.20.
- Nevelsky A, Borzov E, Daniel S, Bar-Deroma R. Karbon fiber-PEEK vidalarının radyoterapi doz dağılımı üzerindeki pertürbasyon etkileri. J Appl Clin Med Phys. 2017; 18(2):62-68. doi:10.1002/acm2.12046.
- Keppens C, Dequeker EM, Pauwels P, Ryska A, 't Hart N, von der Thüsen JH. Küçük hücreli dışı akciğer kanserinde PD-L1 immünohistokimyası: boyama uyumu ve yorumundaki farklılıkların çözülmesi. Virchows Kemeri 2021; 478(5):827-839. doi:10.1007/s00428-020-02976-5.
- Pulmoner adenokarsinomlarda Yatabe Y, Mitsudomi T, Takahashi T. TTF-1 ekspresyonu. J Cerrahi Pathol. 2002; 26(6):767-773. doi:10.1097/00000478-200206000-00010.
- Zhang P, Han YP, Huang L, Li Q, Ma DL. Primer akciğer adenokarsinomunun tanımlanmasında napsin A ve tiroid transkripsiyon faktör-1'in değeri. Oncol Lett. 2010; 1(5):899-903. doi:10.3892/ol_00000160.
- Affandi KA, Tizen NMS, Mustangin M, Zin RRMRM. p40 immünohistokimyası, primer akciğer skuamöz hücreli karsinomunda mükemmel bir belirteçtir. J Pathol Transl Med. 2018; 52(5):283-289. doi:10.4132/jptm.2018.08.14.
- De Felice F, Piccioli A, Musio D, Tombolini V. Kemik metastazı tedavisinde radyasyon tedavisinin rolü. Oncotarget. 2017; 8(15):25691-25699. doi:10.18632/oncotarget.14823.
- Nooh A, Goulding K, Isler MH, et al. Metastatik uzun kemik hastalığı cerrahisi sonrası ağrı ve fonksiyonel sonuçta erken iyileşme, ancak yaşam kalitesinde iyileşme. Klinik Orthop Relat Res. 2018; 476(3):535-545. doi:10.1007/s11999.00000000000000065.
- Siegel RL, Miller KD, Wagle NS, Jemal A. Kanser istatistikleri, 2023. CA Kanser J Clin. 2023; 73(1):17-48. doi:10.3322/caac.21763.
- Popper HH. Akciğer kanserinin ilerlemesi ve metastazı. Kanser Metastazı Rev. 2016; 35(1):75-91. doi:10.1007/s10555-016-9618-0.
- Guy GP, Ekwueme DU, Yabroff KR, et al. Amerika Birleşik Devletleri'ndeki yetişkinler arasında kanserden kurtulmanın ekonomik yükü. J Klinik Oncol. 2013; 31(30):3749-3757. doi:10.1200/JCO.2013.49.1241.
- Li S, Peng Y, Weinhandl ED, et al. ABD yetişkin popülasyonunda yaygın metastatik kemik hastalığı vakalarının tahmini sayısı. Klinik Epidemiol. 2012;4:87-93. doi:10.2147/CLEP. S28339 (İngilizce).
- Boş AT, Lerman DM, Patel NM, Rapp TB. Metastatik kemik hastalığında profilaktik girişim patolojik kırıkların tedavisinden daha uygun maliyetli midir? Klinik Orthop Relat Res. 2016; 474(7):1563-1570. doi:10.1007/s11999-016-4739-x.
- Gutowski CJ, Zmistowski B, Fabbri N, Boland PJ, Healey JH. Böbrek ve akciğer kanserli hastalarda biyolojik ajanların kullanımı femoral metastazların cerrahi yönetimimizi etkilemeli midir? Klinik Orthop Relat Res. 2019; 477(4):707-714. doi:10.1097/CORR.00000000000000434.
- Miller BJ, Soni EEC, Gibbs CP, Scarborough MT. Uzun kemik metastazları için intramedüller çiviler: neden başarısız oluyorlar? Ortopedi. 2011; 34(4). doi:10.3928/01477447-20110228-12.
- Arpornsuksant P, Morris CD, Forsberg JA, Levin AS. İntramedüller tırnak stabilizasyonu sonrası lokal metastatik lezyon progresyonu ile hangi faktörler ilişkilidir? Klinik Orthop Relat Res. 2022; 480(5):932-945. doi:10.1097/CORR.0000000000002104.
Cite this article
Rizk PA, Wasnski JO, Lozano-Calderon SA. Patolojik subtrokanterik kırığın fiksasyonu için karbon fiber implant. J Med İçgörü. 2024; 2024(443). doi:10.24296/jomi/443.



