Implant en fibre de carbone pour la fixation d’une fracture sous-trochantérienne pathologique
Massachusetts General Hospital
Main Text
Table of Contents
Nous présentons ici un patient souffrant d’une fracture pathologique du fémur soustrochantérique secondaire à un adénocarcinome pulmonaire primaire non diagnostiqué. La fracture, survenue dans le contexte d’une douleur atraumatique persistante aux cuisses et aux genoux, a conduit à une identification rapide de sa nature pathologique au service des urgences. Le plan de traitement comprenait une réduction ouverte et une fixation interne utilisant un clou en fibre de carbone, en tenant compte du besoin immédiat de stabilisation et des facteurs oncologiques sous-jacents.
L’objectif principal était d’atteindre la fixation des fractures, traditionnellement réalisée avec des dispositifs intramédullaires. Cependant, la décision d’utiliser un clou en fibre de carbone a été prise en raison de la nature pathologique de la fracture et du besoin ultérieur d’une intervention oncologique post-chirurgicale. La radiolucidité unique de la fibre de carbone aide à la planification des radiations postopératoires, assurant une visualisation optimale et une précision dans le ciblage des lésions osseuses. Cette approche contribue à la réduction des fractures tout en minimisant les interférences avec la radiothérapie.
La procédure chirurgicale a consisté à un enchevêtrement intramédullaire avec un clou en fibre de carbone, permettant une réduction réussie des fractures et un positionnement optimal du matériel. L’évaluation histopathologique a confirmé l’adénocarcinome pulmonaire métastatique. Après l’opération, le patient a reçu une radiothérapie palliative et une thérapie ciblée, montrant une amélioration substantielle lors du suivi de deux mois (Figure 6).
L’affaire met en lumière l’utilisation stratégique des implants en fibre de carbone dans la gestion des fractures pathologiques, offrant des avantages en imagerie postopératoire, en suivi des maladies et en planification précise de la radiothérapie. Cette approche multidisciplinaire souligne l’importance de prendre en compte les nuances de sélection de l’implant, en particulier dans les maladies osseuses métastatiques, afin d’optimiser les résultats.
Implants en fibre de carbone ; fracture pathologique ; maladie osseuse métastatique.
Un patient s’est présenté avec une fracture pathologique du fémur sous-trochantéric du côté droit, survenant dans le contexte d’un adénocarcinome pulmonaire primaire initialement non diagnostiqué. Ses antécédents médicaux comprenaient des douleurs persistantes non traumatiques aux cuisses et aux genoux, qui s’aggravaient progressivement, culminant avec une augmentation soudaine de la douleur, une faiblesse des jambes, puis une chute subséquente après que sa jambe ait cédé dans les escaliers. Lors de sa présentation aux urgences, la nature pathologique de la fracture a été rapidement identifiée. Après une évaluation oncologique, le plan de traitement comprenait une réduction ouverte et une fixation interne, optant pour un ongle en fibre de carbone en raison du besoin immédiat de stabilisation de la fracture et des considérations oncologiques sous-jacentes.
Dans ce cas, l’objectif principal était d’atteindre la fixation de la fracture, une tâche traditionnellement accomplie avec un dispositif intramédullaire. Cependant, compte tenu de la nature pathologique de la fracture et du besoin d’intervention oncologique post-opératoire, il a été décidé d’utiliser un clou en fibre de carbone. Les fractures pathologiques, fréquentes dans les conditions métastatiques, nécessitent souvent une radiothérapie postopératoire pour traiter les cellules cancéreuses résiduelles et faciliter la guérison des os natifs. La mise en œuvre de la planification des traitements par radiothérapie, incluant la simulation par tomodensitomètre, est grandement facilitée par des implants en fibre de carbone, améliorant la visualisation et la précision dans le ciblage de la lésion osseuse. Cette approche vise à atteindre la réduction des fractures tout en minimisant les interférences posées par les implants métalliques traditionnels lors de la planification des radiations.
Une femme blanche gériatrique a été trouvée avec une fracture pathologique sous-trochantérique. Incidemment, lors d’un examen complémentaire, il a été constaté que le patient présentait un carcinome pulmonaire primaire. L’utilisation d’un clou en fibre de carbone lors de la réduction ouverte et de la fixation interne a non seulement stabilisé la fracture, mais aussi optimisé la précision dans la planification des radiations postopératoires.
Le patient a nié tout coup sur la tête ou perte de conscience et n’a montré aucun signe de délire ou de confusion. L’examen physique du membre inférieur droit a été limité en raison de la douleur. Sa jambe droite était visiblement raccourcie. L’examen a révélé une douleur et une force limitée dans l’extenseur hallucis long (EHL), le fléchisseur hallucis long (FHL), le tibial antérieur (TA) et le gastrocnémium (GS). Les pouls distals, y compris le dorsal pedis (DP) et le tibial postérieur (PT), étaient intacts, et le pied droit montrait une chaleur et une perfusion adéquate. L’évaluation ultérieure des lésions des tissus mous a révélé des perturbations du nerf péronier superficiel (SPN), du nerf péronier profond (DPN), du nerf tibial (TN), du nerf saphène et du nerf sural.
L’imagerie radiographique de la hanche droite et du fémur lors de sa première présentation après la chute a révélé une fracture subtrochantérienne déplacée avec déplacement médial du fragment distal. La tête fémorale restait bien ancrée dans l’acétabulum, et le reste du fémur était intact (Figure 1). Un rétrécissement dégénératif de l’espace articulaire avec des ostéophytes marginaux était évident. Un scanner par tomodensitométrie (CT) amélioré par contraste a montré une grande masse du lobe supérieur droit englobant la bronche principale droite, entraînant une atélectasie complète du lobe supérieur droit (Figure 2). La messe était suspecte de malignité. De multiples ganglions lymphatiques médiastinaux et bilatéraux hilaires élargis sont préoccupants pour une maladie métastatique. Un scanner non amélioré du fémur droit a révélé des lucences intracorticales non spécifiques de la diaphylesse fémorale au bord inférieur de la fracture. Cette découverte a soulevé des inquiétudes concernant des lésions perméatives sous-jacentes et une fracture pathologique (Figure 3). Bien que l’imagerie par résonance magnétique (IRM) de suivi ait pu aider à déterminer la présence de lésions osseuses sous-jacentes, l’évaluation en milieu aigu est limitée par l’œdème et les hémorragies, ce qui a conduit à la décision de ne pas se faire examiner de l’enquête.
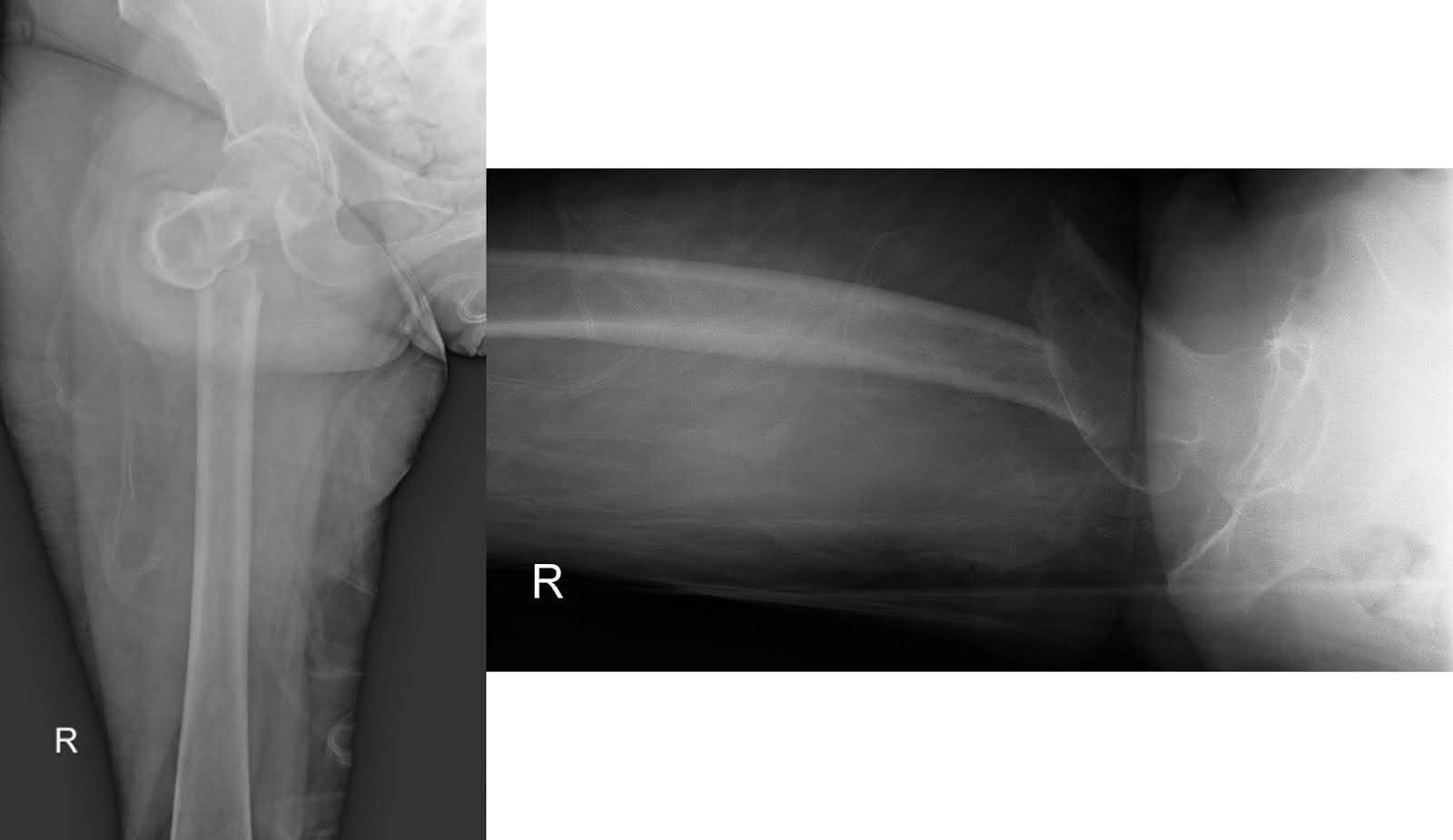
Figure 1. Radiographies AP et latérales de la hanche droite illustrant une fracture subtrochantérienne déplacée. La tête fémorale maintient une réduction à l’intérieur de l’acétabulum, tandis que le reste du fémur reste structurellement intact.
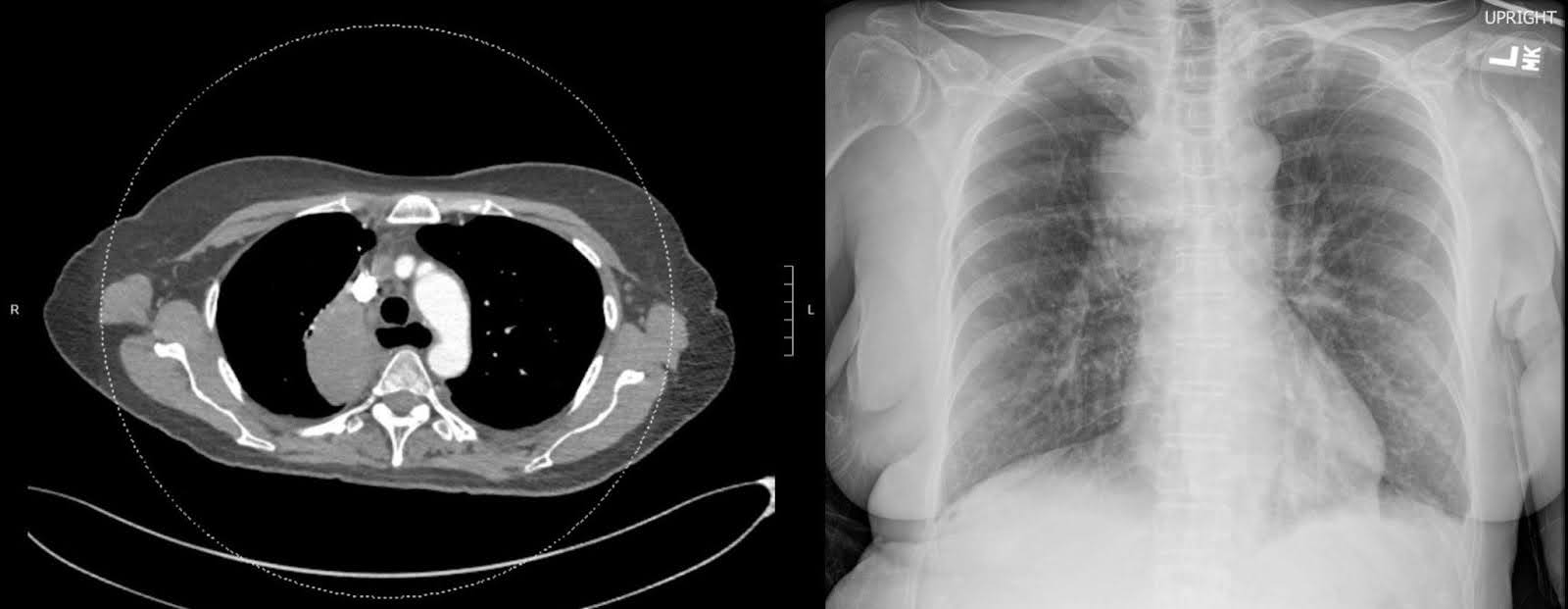
Figure 2. Une masse hétérogène à amplification, située dans la région paramédiastinale droite du lobe supérieur droit, a été découverte lors d’un scanner thoracique avec contraste. La présence de cette découverte suggère un diagnostic de cancer du poumon primaire.
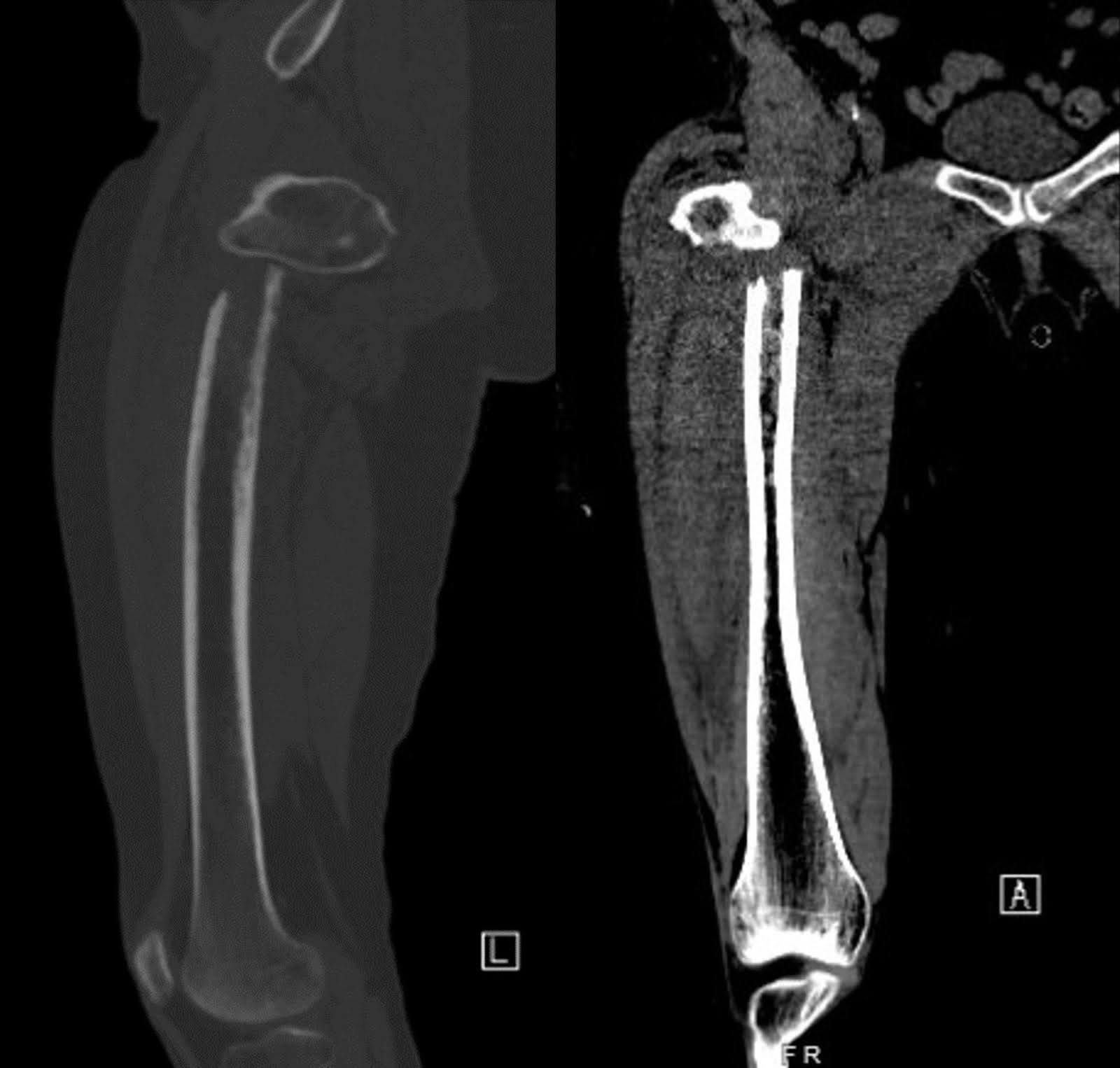 Figure 3. Les images CT latérales et AP non contrastées du fémur droit montrent des lucences intracorticales dans la diaphyse médiane du fémoral, suggérant une fracture pathologique potentielle.
Figure 3. Les images CT latérales et AP non contrastées du fémur droit montrent des lucences intracorticales dans la diaphyse médiane du fémoral, suggérant une fracture pathologique potentielle.
Les fractures pathologiques, distinctes des fractures traumatiques, apparaissent à la suite d’une affection sous-jacente, incluant mais sans s’y limiter l’ostéoporose, le cancer, une infection ou des troubles métaboliques. Cette catégorie distinctive de fractures se caractérise par l’influence de processus pathologiques qui compromettent l’intégrité structurelle de l’os.1 Les fractures pathologiques peuvent entraîner une morbidité importante et une baisse globale de la qualité de vie.2 Le système squelettique est le troisième site le plus fréquent pour les métastases, après le poumon et le foie.3 Environ 70 % de toutes les métastases osseuses surviennent dues à des cancers métastatiques du sein et de la prostate, les tumeurs du poumon, des reins et de la thyroïde étant les causes suivantes les plus courantes en termes de prévalence.4
Les patients présentant des fractures pathologiques peuvent présenter de la douleur et un gonflement au site de la fracture, ainsi que des difficultés à marcher, une réduction de l’amplitude de mouvement, des ecchymoses, un œdème local et un raccourcissement des extrémités visible.5 Un indicateur clinique des fractures pathologiques réside dans leur cause sous-jacente, souvent avec un traumatisme minimal — une force nettement inférieure à celle nécessaire pour fracturer un os sain.6 Bien que rares, les fractures pathologiques peuvent être le signe apparent d’une malignité sous-jacente.7 Cela souligne la nécessité d’une enquête méticuleuse et d’un examen diagnostique, en particulier dans les cas où il existe des antécédents de traumatismes limités ou absents.
Une fracture pathologique fémorale présente des défis similaires à une fracture traumatique du fémur tout en introduisant des considérations postopératoires supplémentaires qui influencent le choix de l’implant. Comme pour la prise en charge des fractures du fémur dans un os sain, il est crucial d’atteindre la réduction et la stabilisation des fractures. Cela soulage non seulement la douleur et assure la stabilité pour la marche, mais crée aussi un environnement biomécanique propice à une guérison optimale des fractures.
La prise en charge des fractures sous-trochantériques présente des défis pour obtenir la réduction et la fixation, la réduction nécessitant souvent des techniques percutanées ou ouvertes.8 La fixation chirurgicale, une intervention bien tolérée, démontre des résultats fonctionnels comparables à la fixation non pathologique.9 D’un point de vue oncologique, le traitement des cellules malignes de l’os est essentiel pour une guérison osseuse efficace. Dans le traitement post-fracture, la chimiothérapie et la radiothérapie jouent un rôle crucial dans l’atteinte de cet objectif. La radiothérapie, généralement planifiée avec une thérapie par faisceau externe, nécessite un scanner CT avant traitement pour une planification précise. Cependant, la présence d’implants métalliques peut provoquer une diffusion du faisceau, réduisant la résolution d’imagerie et impactant les plans de radiothérapie. Les implants en fibre de carbone, dépourvus des propriétés radiographiques des métaux, peuvent efficacement atteindre les objectifs de réduction et de guérison des fractures tout en affectant minimement les thérapies adjuvantes essentielles à la radiothérapie.10
Le but de la fixation de l’os long après une fracture est de faciliter une guérison correcte, de restaurer la stabilité et de favoriser la récupération fonctionnelle. Lors de l’examen des options de traitement pour les fractures du fémur sous-trochantérique, les principales modalités de fixation incluent la fixation de l’ongle ou de la plaque, la littérature orthopédique actuelle favorisant la fixation de l’ongle.8 Dans le choix des matériaux d’implant, il est impératif de prendre en compte l’étiologie sous-jacente de la fracture et la maîtrise du chirurgien des deux techniques.
Pour les patients atteints de fractures pathologiques secondaires à une maladie osseuse métastatique, les ongles en fibre de carbone peuvent être une alternative préférable aux clous en titane, en raison de leur radiolucidité et de leurs propriétés mécaniques favorables.11,12 Les implants en fibre de carbone réduisent significativement la dispersion lors des scanners et réduisent les artefacts de susceptibilité lors de l’IRM, ce qui permet une meilleure visualisation de la cicatrisation osseuse, une surveillance postopératoire de la récidive ou progression locale de la maladie, et une planification précise des radiations.10, 13, 14
Bien qu’il existe plusieurs avantages à la fixation en fibre de carbone, il n’y a aucune différence dans les résultats fonctionnels ni les profils de complexité de la fixation en fibre de carbone et en métal.11,12 Les deux techniques atteignent l’objectif de stabilisation des fractures et de maintien de la réduction avec un faible risque de complication et une guérison bien documentée ainsi qu’une biocompatibilité. Par conséquent, le chirurgien opérateur doit évaluer soigneusement sa compétence et son niveau de confort avec chaque méthode de fixation et type d’implant dans le processus décisionnel.12,15
Lors de l’élaboration de la stratégie de traitement d’une fracture soustrochantérienne pathologique, il est impératif de prendre en compte à la fois les objectifs à court et à long terme. À court terme, l’utilisation d’un implant en fibre de carbone pour la fixation vise à établir la stabilité osseuse après la réduction des fractures. La réduction des fractures restaure la longueur des membres, la tension musculaire et les relations anatomiques normales. Maintenir cette réduction diminue la douleur en stabilisant correctement les fragments osseux.16 En tant que dispositif de partage de charge, l’implant peut permettre au patient de se mobiliser immédiatement, réduisant ainsi le risque de thromboembolie veineuse, d’escarres de lit et de déconditionnement rapide.17
Pendant la période intermédiaire postopératoire, la stabilité offerte par l’implant joue un rôle crucial dans la promotion de la cicatrisation des fractures, notamment lorsqu’elle est combinée à une thérapie adjuvante pour le traitement du cancer.18 Opter pour un implant en fibre de carbone simplifie non seulement la surveillance radiographique postopératoire des maladies, mais améliore également la précision de la planification de la radiothérapie. Ce choix stratégique contribue à une meilleure précision et efficacité de l’approche thérapeutique globale.19
Les implants en fibre de carbone peuvent être contre-indiqués pour les tumeurs osseuses diaphysaires humérales nécessitant une grande résection segmentaire avec un segment osseux résiduel court (5 cm) et un espaceur en ciment important. De tels implants peuvent céder par tension en raison des forces de flexion sur la partie distale de l’ongle intramédullaire, où il existe un décalage de module d’élasticité entre l’espaceur en ciment et l’os résiduel. Dans de tels scénarios, les ongles intramédullaires en titane apparaissent comme un choix préférable, offrant une solution potentielle pour relever les défis liés aux implants en fibre de carbone dans ce contexte spécifique.20
Les chirurgiens doivent prendre en compte leur familiarité et leur confort avec les implants en fibre de carbone, compte tenu de la courbe d’apprentissage associée à ces implants. Les implants en fibre de carbone ont été associés à des délais opératoires et fluoroscopiques plus longs, ainsi qu’à une augmentation des pertes de sang, notamment en oncologie orthopédique et de la colonne vertébrale.12,21 Il est essentiel de concilier les considérations cliniques et la compétence du chirurgien lorsqu’on décide de l’adéquation des implants en fibre de carbone dans ce domaine spécialisé.
L’utilisation d’implants en fibre de carbone en orthopédie nécessite une prise en compte approfondie de plusieurs facteurs cliniques essentiels. Malgré des complications et des taux d’échec comparables aux implants en titane, les implants en fibre de carbone manquent de flexibilité intraopératoire pour la flexion ou le contouring. Les chirurgiens doivent s’engager dans une planification préopératoire méticuleuse afin d’assurer un ajustement optimal.22 Bien que la radiolucidité de la fibre de carbone soit avantageuse pour les examens d’imagerie postopératoire, confirmer la position de l’implant pendant l’opération peut poser des défis. Au contraire, les implants métalliques, bien que dépourvus de flexibilité intraopératoire, perturbent souvent la cartographie de la planification des radiations et entravent un calcul et une délivrance précis des doses.23,24 De plus, dans les situations où la maladie s’étend à l’articulation et nécessite un remplacement articulaire, les implants en fibre de carbone peuvent ne pas être l’option la plus adaptée. Par conséquent, la décision d’utiliser des implants en fibre de carbone implique une évaluation nuancée de leurs avantages et de leurs limites dans des contextes cliniques spécifiques.
Un bâton intramédullaire du fémur droit a été réalisé pour la fixation opératoire de la lésion en plus d’une biopsie ouverte afin de déterminer l’étiologie de la maladie osseuse métastatique. Selon les études d’imagerie, il s’agissait d’un cancer du poumon primaire avec métastase osseuse. Le patient a été placé dans un décubitus latéral avec l’aide d’un pouf. Toutes les proéminences osseuses étaient suffisamment rembourrées. La pose d’un roulis sous-axilaire et le déchargement du nerf péronique gauche ont eu lieu.
Une incision latérale a été réalisée sur la cuisse proximale, puis une approche sous-vastus a été réalisée pour exposer le site de la fracture. Un rétracteur Cobra facilitait l’exposition après identification du site de fracture. Des échantillons de pathologie permanente et congelée ont été prélevés à l’aide de curettes. La pathologie gelée a confirmé un adénocarcinome pulmonaire métastatique. Un débridement agressif de la lésion tumorale, à l’intérieur comme à l’extérieur de l’os, a été pratiqué. Une irrigation abondante du champ chirurgical avec une solution de peroxyde a été pratiquée.
À l’aide de gants neufs et d’un nouvel ensemble d’instruments, une incision ultérieure proche du site initial a été réalisée pour accéder au fémur proximal. Le fascia du fessier moyen a été incisé longitudinalement pour identifier la pointe de la plus grande tubérosité. Un fil guide de 3,2 mm marquait le point de départ, assurant une excellente position à la fois en vue antéropostérieure (AP) et latérale. Le maintien du fémur en position neutre était facilité par une épingle de Shandz, facilitant la rotation interne et l’adduction du fragment fémoral proximal.
Le fragment fortement fléchi a subi un positionnement supplémentaire pour assurer son extension. Un outil de réduction des doigts, soutenu par deux goupilles Shantz dans le fémur proximal et la diaphyse fémorale, a été utilisé pour obtenir une réduction anatomique de la fracture. Une fois la fracture réduite, l’aléneur d’ouverture a été utilisé pour ouvrir la trajectoire du fémur proximal. En avançant un fil guide à pointe en boule, nous avons maintenu la réduction et confirmé l’excellente position du fil dans le fémur distal. Un clou en fibre de carbone de 360 mm de diamètre de 11 mm a été mesuré. Nous avons alété séquentiellement jusqu’à une taille de 12,5 mm, puis inséré en douceur à l’aide d’un échangeur de tubes pour retirer le fil guide de la pointe à bille et insérer le fil lisse. Le clou fémoral en fibre de carbone était inséré sur le fil lisse de manière traditionnelle, le bras de visée étant positionné à l’avant, en tournant le bras de visée vers l’extérieur au fur et à mesure que l’ongle avançait. La tige est tapotée jusqu’à sa position finale jusqu’à ce que la partie supérieure de la tige soit recouverte par le fémur proximal.
Manipulant les tissus mous, nous avons utilisé l’incision de la biopsie pour insérer le triple trochar à travers le bras viseur. Nous avons ensuite inséré à travers le fil guide fémoral la trajectoire dans le cou fémoral pour la vis de la hanche. Sous fluoroscopie, la position correcte a été confirmée. Un alamage à une longueur de 95 mm a été réalisé. L’instrument de la vis de hanche était fixé sans difficulté, d’abord en tapotant le chemin puis en insérant la vis en suivant la trajectoire marquée dans le cou fémoral, avant de la fixer avec la vis de réglage.
En maintenant une AP parfaite de la hanche droite et du genou, la partie distale du clou était fixée avec deux vis en titane de 5,0 mm mesurant 40 et 40,5 mm de long (Figure 4). Les images finales ont confirmé la réduction réussie de la fracture et le positionnement optimal du matériel (Figure 5). Une irrigation abondante a été réalisée, suivie d’une fermeture couche par couche. Il n’y a eu aucune complication pendant l’affaire. La durée du cas était de 121 minutes avec une perte de sang estimée à 250 mL.
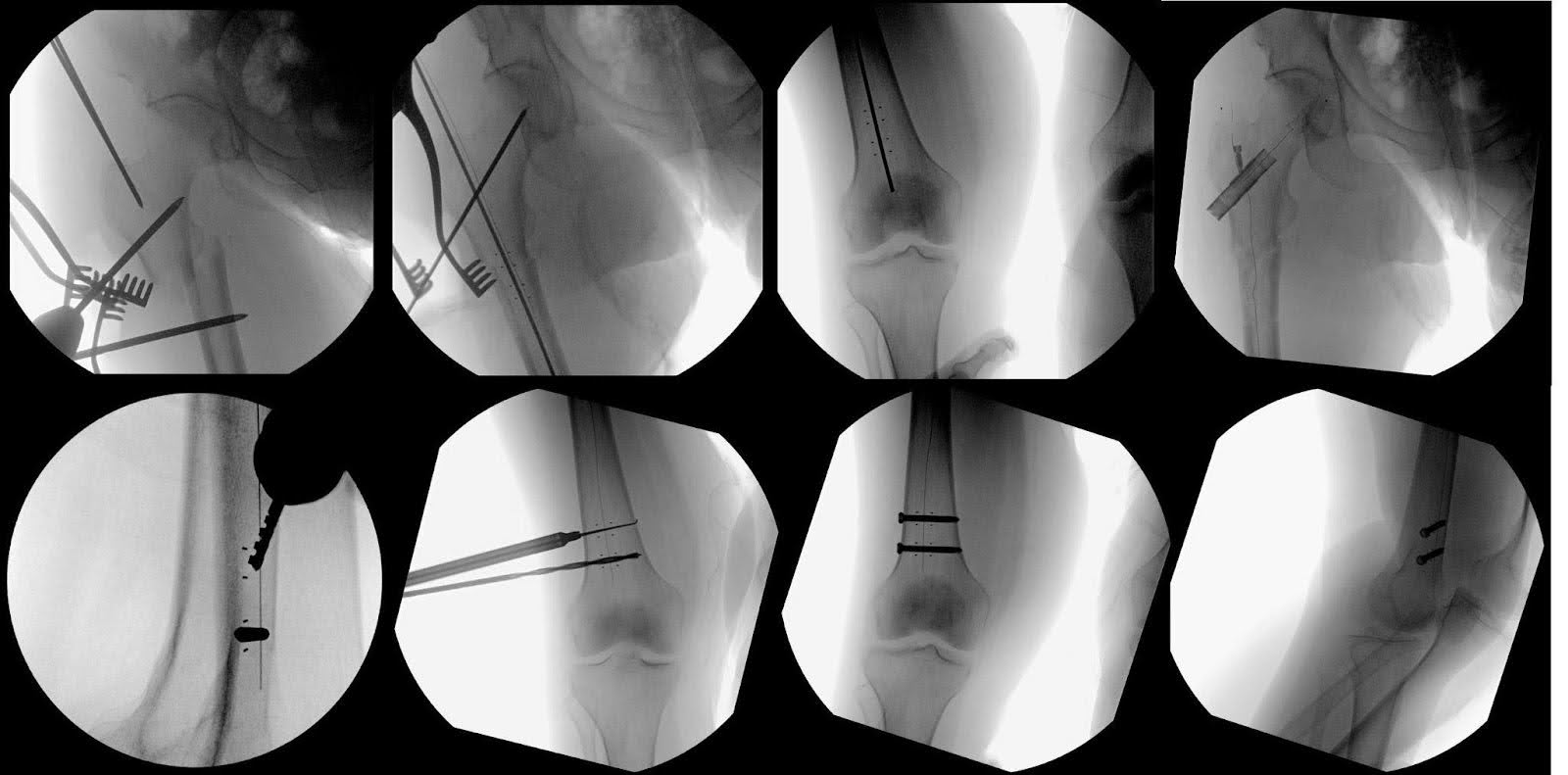
Figure 4. L’imagerie par fluoroscopie a été utilisée pour démontrer les différentes étapes chirurgicales impliquées dans le traitement de la fracture du fémur. Cela incluait la représentation du point de départ et de la réduction de la fracture à l’aide de goupilles de Shandz. Des images supplémentaires ont été utilisées pour montrer le clou en fibre de carbone, la vis de hanche en fibre de carbone et deux vis d’enclenchement en titane servant à assurer la stabilité du clou. Des marqueurs radio-opaques aidaient à visualiser ces ouvertures, observables à la fois depuis les vues AP et latérales. Il est à noter que les guides pour ces trous d’entrée diffèrent des guides circulaires standard généralement visibles en fluoroscopie pour les clous en titane.
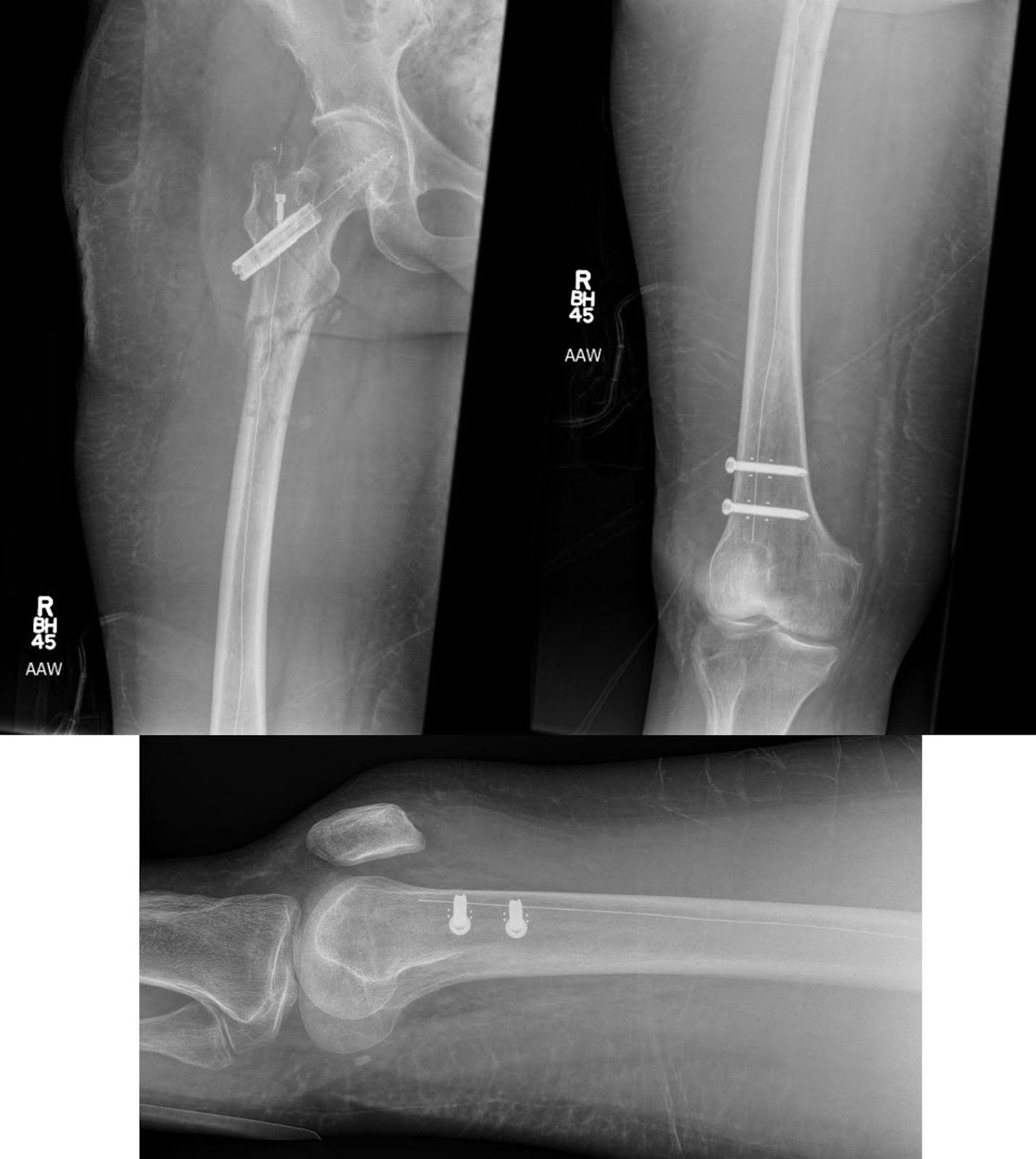
Figure 5. Une radiographie AP du fémur et une radiographie latérale du genou après fixation par tige intramédullaire en fibre de carbone pour une fracture pathologique soustrochantérienne du fémur droit montrent une amélioration de l’alignement sans signe de complications matérielles. Le bas de la jambe ne présente aucune lésion lytique suspecte supplémentaire, et il n’y a aucune indication de nouvelles fractures.
Une biopsie ouverte du fémur proximal droit a été réalisée en plus de la fixation opératoire, et un échantillon de 5,5x5,5x2,5 cm, composé de fragments de tissu mou rosé-rouge poussiéreux, a été envoyé pour évaluation histopathologique par un pathologiste osseux et des tissus mous formé en fellowship. Une immunocoloration pour-L1 a été réalisée sur un bloc tissulaire représentatif et a révélé >100 cellules tumorales disponibles pour le score. -L1 a montré une coloration membraneuse d’intensité forte dans >95 % des cellules tumorales (score de proportion tumorale, ou TPS, >95 %).25 L’immunohistochimie a montré des cellules tumorales positives pour TTF-1 et Napsin-A et négatives pour p40. Compte tenu de ces constatations, le diagnostic pathologique final de la lésion proximale du fémur droit est un carcinome métastatique compatible avec un carcinome primaire pulmonaire.26–28
Un mois après l’opération, le patient a reçu 20 Gy de radiothérapie palliative répartie en cinq fractions à la hanche droite. Dans le contexte des maladies osseuses métastatiques, la radiothérapie atténue l’activation des ostéoclastes, tue les cellules tumorales et soulage la douleur osseuse en produisant une ossification.29 Parallèlement, l’oncologie médicale a commencé le traitement du Capmatinib, une thérapie ciblée utilisée pour traiter le cancer du poumon non à petites cellules métastatique. Au suivi des deux mois, le patient a montré une amélioration substantielle, pouvant marcher sans déambulateur. Ses genoux étaient stables face aux contraintes de valgus et de varus à pleine extension et 30° de flexion. La flexion de la hanche, l’extension, la rotation interne et la rotation externe étaient dans les limites normales. Six semaines après le début du Capmatinib, le patient répondait bien au traitement. Un scanner thoracique a montré une diminution de la masse dans le lobe supérieur droit et une diminution de la lymphadénopathie médiastinale et hilaire bilatérale. Lors de son dernier suivi, son état fonctionnel n’a montré aucun changement significatif ni modifications matérielles discernables, et elle continue de recevoir du Capmatinib, subissant une surveillance radiographique fréquente (Figure 7).
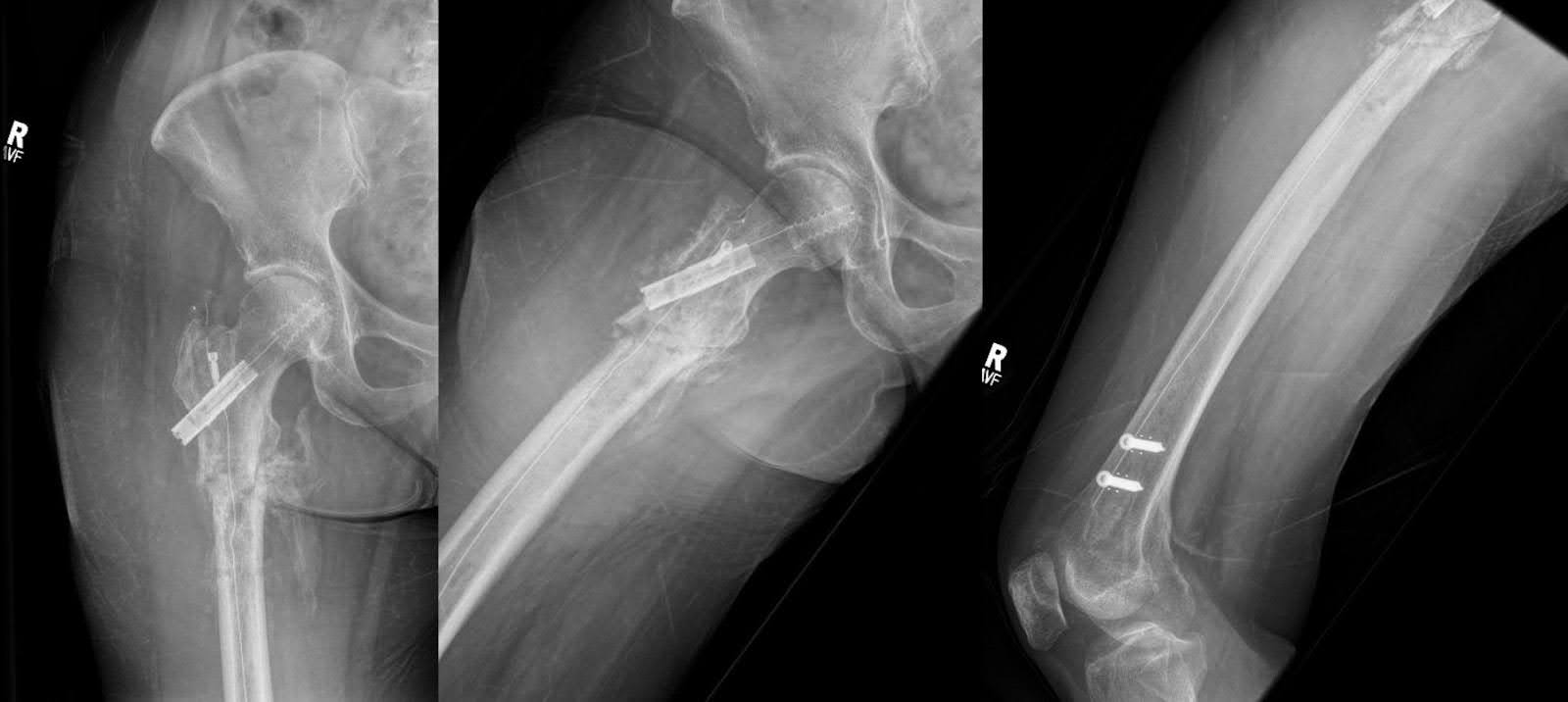
Figure 6. Les radiographies AP et latérales du fémur ainsi qu’une radiographie latérale du genou, deux mois après la fixation, montrent la formation d’un nouveau callosité et un pont osseux, conservant l’alignement initial. Aucune nouvelle fracture n’est présente, mais de légères modifications dégénératives ont été observées à la hanche droite.
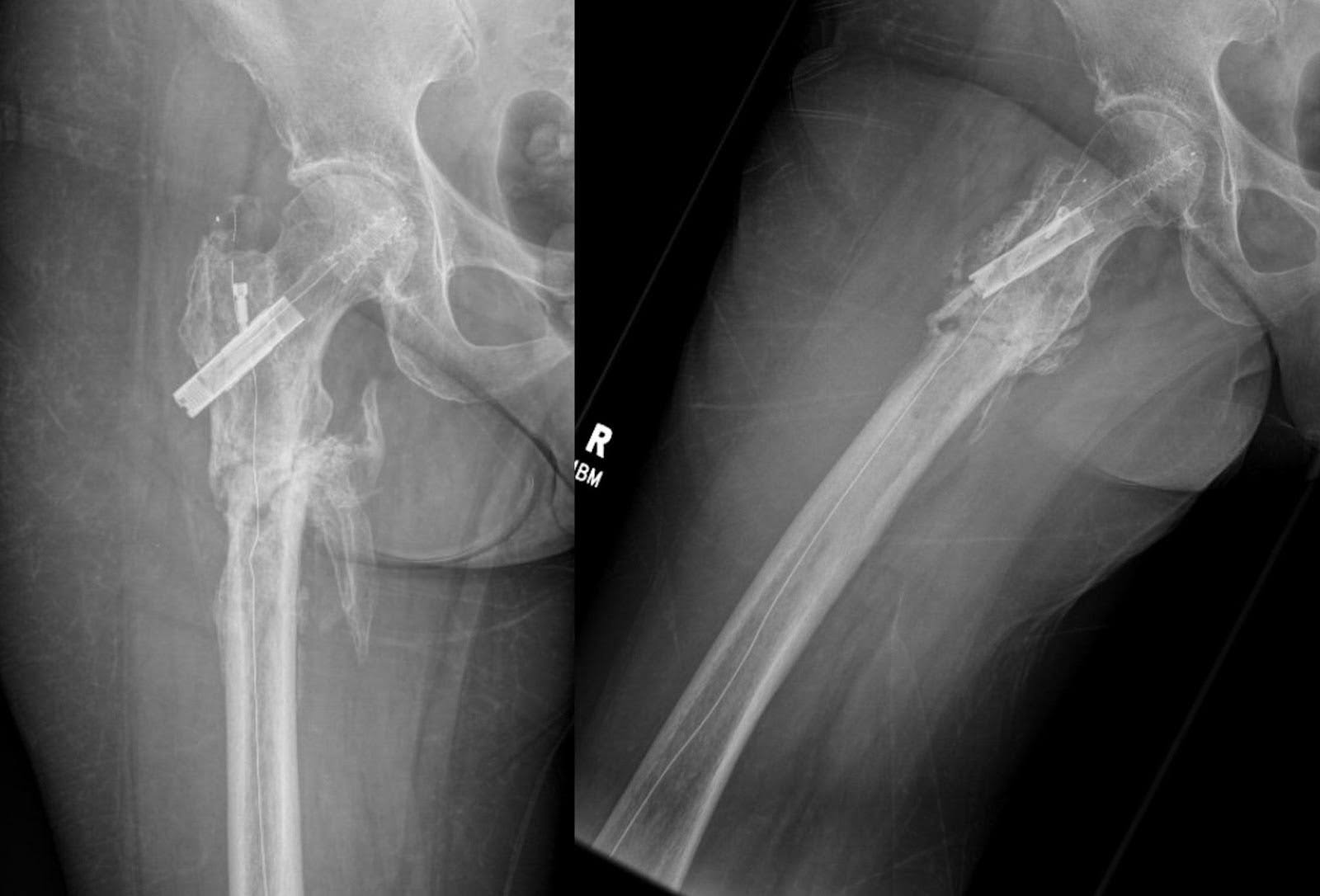
Figure 7. Six mois après la fixation, les radiographies de la parachromatique et du fémur latéral révèlent une formation continue de callosités et un important pontage osseux, maintenant l’alignement initial. La fracture présente des signes de guérison incomplète, parallèlement à la présence d’une formation osseuse hétérotopique. Il n’y a aucune complication matérielle discernable ni signe de nouvelles fractures. De plus, des modifications dégénératives analogues persistent à la hanche droite.
La métastase joue un rôle important dans la morbidité et la mortalité associées au cancer.30 Le cancer du poumon, le deuxième carcinome le plus fréquent chez les hommes et les femmes, présente une préférence pour les métastases dans le cerveau, les os et les glandes surrénales.31,32 La maladie osseuse métastatique inflige non seulement des douleurs invalidantes aux patients, mais impose également un fardeau financier important. L’estimation actuelle de 250 000 patients aux États-Unis confrontés à cette affection se traduit par un coût annuel des soins de santé de 12 milliards de dollars.33,34 Les progrès dans les traitements, tout en améliorant les taux de survie au cancer, ont conduit à une incidence plus élevée de la maladie osseuse métastatique. Les fractures pathologiques résultant de cette affection proviennent de nombreuses lésions atteignant une taille qui met en péril l’intégrité structurelle de l’os, aboutissant finalement à des fractures.35 Pour améliorer la survie à long terme et la qualité de vie des patients, il est crucial de prioriser stratégiquement les modalités de traitement appropriées dans la gestion de la maladie.36
Comme ce patient n’avait pas de diagnostic oncologique avant la fracture du fémur, il est important de souligner les points clés qui peuvent aider à identifier les lésions osseuses à risque avant la fracture. Le patient a signalé plusieurs mois de douleur à la hanche avant la fracture, ce qui peut souvent être la première découverte clinique d’un carcinome viscéral. Une analyse d’anamnésie avisée et des résultats d’examen physique révélant une douleur sans explication, en particulier la douleur fonctionnelle, doivent être étudiés. La méthode d’évaluation la plus appropriée consiste à réaliser des radiographies simples de l’os entier de l’extrémité affectée, afin de s’assurer que la douleur référée ne masque pas un facteur clinique masquant.
Après que la fracture a été traitée de manière appropriée et que le patient a survécu à la phase immédiatement postopératoire, l’attention doit se tourner vers la prise en charge de la maladie sous-jacente, nécessitant une approche multidisciplinaire impliquant l’oncologie médicale et radio-oncologie. L’oncologie médicale assure un traitement systémique à la fois du cancer primaire et de ses lésions métastatiques. L’oncologie radiothérapeutique joue un rôle crucial dans le traitement local pendant la période postopératoire subaiguë, ciblant agressivement les cellules cancéreuses disséminées pour faciliter le processus essentiel de guérison osseuse. Bien que les séries de cas rapportent un taux de progression de la maladie plus faible après la stabilisation de l’ongle médullaire, le risque de défaillance matérielle augmente avec la survie du patient.Les implants en fibre de carbone peuvent améliorer la surveillance des maladies et la guérison osseuse lorsqu’ils sont utilisés avec des techniques d’imagerie avancées.12 Des études portant sur les résultats rapportés par les patients et la rentabilité des implants en fibre de carbone par rapport au titane pourraient favoriser l’adoption clinique.
Aucun équipement spécial n’est utilisé au-delà de l’implant en fibre de carbone.
L’auteur correspondant est conférencier et consultant rémunéré pour CarboFix Orthopaedics Ltd.
Le patient mentionné dans cet article vidéo a donné son consentement éclairé pour être filmé et est conscient que les informations et images seront publiées en ligne.
Animation ajoutée après la publication le 03/10/2025. Aucun changement n’a été apporté au contenu de l’article.
References
- Haase SC. Traitement des fractures pathologiques. Clin. de la main. 2013; 29(4):579-584. doi :10.1016/j.hcl.2013.08.010.
- Coleman RE. Caractéristiques cliniques de la maladie osseuse métastatique et risque de morbidité squelettique. Clin Cancer Res. 2006 ; 12(20 Pt 2) :6243S-6249S. doi :10.1158/1078-0432.CCR-06-0931.
- Hage WD, Aboulafia AJ, Aboulafia DM. Incidence, localisation et évaluation diagnostique de la maladie osseuse métastatique. Orthop Clin North Am. 2000; 31(4) :515-528, vii. doi :10.1016/s0030-5898(05)70171-1.
- Christ AB, Piple AS, Gettleman BS, et al. Prévalence des tumeurs malignes primitives, taux de fractures pathologiques et mortalité dans le cadre d’une maladie osseuse métastatique. Os Jt Ouvert. 2023; 4(6):424-431. doi :10.1302/2633-1462.46.BJO-2023-0042. R1.
- Johnson, SK, Knobf, MT. Interventions chirurgicales pour les patients atteints de cancer présentant des fractures pathologiques imminentes ou réelles. Orthop Nurs. 2008; 27(3):160-171; Quiz 172-173. doi :10.1097/01.NOR.0000320543.90115.d5.
- De Mattos CBR, Binitie O, Dormans JP. Fractures pathologiques chez l’enfant. Bone Joint Res. 2012 ; 1(10):272-280. doi :10.1302/2046-3758.110.2000120.
- Kim LD, Bueno FT, Yonamine ES, Próspero JD de, Pozzan G. Métastases osseuses comme premier symptôme des tumeurs : rôle d’une étude d’immunohistochimie dans l’établissement d’une tumeur primaire. Révérend Bras Ortop (São Paulo). 2018; 53(4):467-471. doi :10.1016/j.rboe.2018.05.015.
- Réduire les fractures du fémur sous-trochantériennes : trucs et astuces, choses à faire et à ne pas faire. J Traumatisme orthop. 2015; 29 Suppl 4 :S28-33. doi :10.1097/BOT.000000000000287.
- Weiss RJ, Ekström W, Hansen BH, et al. Fractures sous-trochantériennes pathologiques chez 194 patients : une comparaison des résultats après traitement chirurgical des fractures pathologiques et non pathologiques. J Surg Oncol. 2013; 107(5):498-504. doi :10.1002/jso.23277.
- Depauw N, Pursley J, Lozano-Calderon SA, Patel CG. Évaluation d’implants chirurgicaux en fibre de carbone et en titane pour la protonthérapie et la photonthérapie. Pratique Radiat Oncol. 2023 ; 13(3):256-262. doi :10.1016/j.prro.2023.01.009.
- Lozano-Calderon SA, Rijs Z, Groot OQ, et al. Résultats des os longs traités avec des ongles en fibre de carbone pour des indications oncologiques : étude multi-institutionnelle internationale. J Am Acad Orthop Surg. 2024; 32(3) :e134 et e145. doi :10.5435/JAAOS-D-22-01159.
- Yeung CM, Bhashyam AR, Groot OQ, et al. Comparaison des ongles intramédullaires en fibre de carbone et en titane en oncologie orthopédique. Os Jt Ouvert. 2022; 3(8):648-655. doi :10.1302/2633-1462.38.BJO-2022-0092. R1.
- Ernstberger T, Heidrich G, Bruening T, Krefft S, Buchhorn G, Klinger HM. La pertinence validée par interobservateur des matériaux de l’espaceur intervertébral dans l’artéfact IRM. Eur Spine J. 2007 ; 16(2):179-185. doi :10.1007/s00586-006-0064-5.
- Alvarez-Breckenridge C, de Almeida R, Haider A, et al. Implants rachidiens en polyétheréthercétone renforcés de fibres de carbone pour le traitement des tumeurs de la colonne vertébrale : avantages et limites perçus. Neurospine. 2023; 20(1):317-326. doi :10.14245/ns.2244920.460.
- Clunk MJ, Gonzalez MR, Denwood HM, et al. Un PEEK dans la fibre de carbone : un guide pratique pour les implants polymères composites haute performance pour l’oncologie orthopédique. J Orthop. 2023;45:13-18. doi :10.1016/j.jor.2023.09.011.
- Manglani HH, Marco RA, Picciolo A, Healey JH. Urgences orthopédiques chez les patients atteints de cancer. Semin Oncol. 2000 ; 27(3) :299 à 310.
- Booth K, Rivet J, Flici R, et al. Un protocole de mobilité progressive réduit le taux de thromboembolie veineuse chez les patients en soins intensifs traumatiques : un projet d’amélioration de la qualité. J Trauma Nurs. 2016; 23(5):284-289. doi :10.1097/JTN.000000000000234.
- Colyer RA. Stabilisation chirurgicale des fractures néoplasiques pathologiques. Curr Probl Cancer. 1986 ; 10(3):117-168. doi :10.1016/s0147-0272(86)80005-8.
- Xin-ye N, Xiao-bin T, Chang-ran G, Da C. La perspective des implants en fibre de carbone en radiothérapie. J Appl Clin Med Phys. 2012 ; 13(4):3821. doi :10.1120/jacmp.v13i4.3821.
- Bhashyam AR, Yeung C, Sodhi A, et al. Clouage intramédullaire renforcé de titane ou de fibre de carbone pour les tumeurs osseuses humérales. J épaule coude Surg. 2023; 32(11):2286-2295. doi :10.1016/j.jse.2023.04.023.
- Cofano F, Di Perna G, Monticelli M, et al. Implants renforcés de fibre de carbone vs implants en titane pour la fixation dans les métastases vertébrales : une étude clinique comparative sur l’innocuité et l’efficacité de la nouvelle « stratégie carbone ». J Clin Neurosci. 2020;75:106-111. doi :10.1016/j.jocn.2020.03.013.
- Yeung CM, Bhashyam AR, Patel SS, Ortiz-Cruz E, Lozano-Calderón SA. Implants en fibre de carbone en oncologie orthopédique. J Clin Med. 2022 ; 11(17). doi :10.3390/jcm11174959.
- Tedesco G, Gasbarrini A, Bandiera S, Ghermandi R, Boriani S. Les implants composites PEEK/fibre de carbone peuvent augmenter l’efficacité de la radiothérapie dans la gestion des tumeurs de la colonne vertébrale. J Spine Surg. 2017; 3(3):323-329. doi :10.21037/jss.2017.06.20.
- Nevelsky A, Borzov E, Daniel S, Bar-Deroma R. Effets de perturbation des vis en fibre de carbone-PEEK sur la distribution de la dose de radiothérapie. J Appl Clin Med Phys. 2017; 18(2):62-68. doi :10.1002/acm2.12046.
- Keppens C, Dequeker EM, Pauwels P, Ryska A, 't Hart N, von der Thüsen JH. Immunohistochimie-L1 dans le cancer du poumon non à petites cellules : démêler les différences de concordance et d’interprétation de la coloration. Virchows Arch. 2021 ; 478(5):827-839. doi :10.1007/s00428-020-02976-5.
- Yatabe Y, Mitsudomi T, Takahashi T. TTF-1 expression dans les adénocarcinomes pulmonaires. Am J Surg Pathol. 2002; 26(6):767-773. doi :10.1097/00000478-200206000-00010.
- Zhang P, Han YP, Huang L, Li Q, Ma DL. Valeur de la napsine A et du facteur de transcription thyroïdien-1 dans l’identification de l’adénocarcinome pulmonaire primitif. Oncol Lett. 2010 ; 1(5):899-903. doi :10.3892/ol_00000160.
- L’immunohistochimie d’Affandi KA, de Tizen NMS, de Mustangin M, de Zin RRMRM. L’immunohistochimie p40 est un excellent marqueur du carcinome épidermoïde primitif du poumon. J Pathol Transl Med. 2018; 52(5):283-289. doi :10.4132/jptm.2018.08.14.
- De Felice F, Piccioli A, Musio D, Tombolini V. Le rôle de la radiothérapie dans la gestion des métastases osseuses. Oncotarget. 2017 ; 8(15):25691-25699. doi :10.18632/oncotarget.14823.
- Nooh A, Goulding K, Isler MH, et al. Amélioration précoce de la douleur et de l’état de résultat fonctionnel, mais pas de la qualité de vie après la chirurgie pour une maladie métastatique des os longs. Clin Orthop Relat Res. 2018 ; 476(3):535-545. doi :10.1007/s11999.00000000000065.
- Siegel RL, Miller KD, Wagle NS, Jemal A. Statistiques sur le cancer, 2023. CA Cancer J Clin. 2023; 73(1):17-48. doi :10.3322/caac.21763.
- Popper HH. Progression et métastases du cancer du poumon. Métastases cancéreuses Rev. 2016 ; 35(1):75-91. doi :10.1007/s10555-016-9618-0.
- Guy GP, Ekwueme DU, Yabroff KR, et al. Fardeau économique de la survie au cancer chez les adultes aux États-Unis. J Clin Oncol. 2013; 31(30):3749-3757. doi :10.1200/JCO.2013.49.1241.
- Li S, Peng Y, Weinhandl ED, et al. Nombre estimé de cas prévalents de maladie osseuse métastatique dans la population adulte américaine. Clin Epidemiol. 2012;4:87-93. doi :10.2147/CLEP. Réf. S28339.
- Blank AT, Lerman DM, Patel NM, Rapp TB. L’intervention prophylactique est-elle plus rentable que le traitement des fractures pathologiques dans les maladies osseuses métastatiques ? Clin Orthop Relat Res. 2016 ; 474(7):1563-1570. doi :10.1007/s11999-016-4739-x.
- Gutowski CJ, Zmistowski B, Fabbri N, Boland PJ, Healey JH. L’utilisation d’agents biologiques chez les patients atteints d’un cancer du rein et du poumon devrait-elle affecter notre prise en charge chirurgicale des métastases fémorales ? Clin Orthop Relat Res. 2019 ; 477(4):707-714. doi :10.1097/CORR.000000000000434.
- Miller BJ, Soni EEC, Gibbs CP, Scarborough MT. Ongles intramédullaires pour les métastases osseuses longues : pourquoi échouent-ils ? Orthopédie. 2011; 34(4). doi :10.3928/01477447-20110228-12.
- Arpornsuksant P, Morris CD, Forsberg JA, Levin AS. Quels sont les facteurs associés à la progression d’une lésion métastatique locale après stabilisation intramédullaire de l’ongle ? Clin Orthop Relat Res. 2022; 480(5):932-945. doi :10.1097/CORR.000000000002104.
Cite this article
Rizk PA, Werenski JO, Lozano-Calderon SA. Implant en fibre de carbone pour la fixation d’une fracture sous-trochantérienne pathologique. J Med Insight. 2024; 2024(443). doi :10.24296/jomi/443.



