Implante de fibra de carbono para la fijación de una fractura subtrocantérea patológica
Massachusetts General Hospital
Main Text
Table of Contents
Presentamos a un paciente con una fractura patológica subtrocantérica del fémur secundaria a un adenocarcinoma pulmonar primario no diagnosticado. La fractura, que se produjo en el contexto de un dolor persistente no traumático en muslos y rodillas, provocó una rápida identificación de su naturaleza patológica en el Departamento de Urgencias. El plan de tratamiento consistía en reducción abierta y fijación interna utilizando un clavo de fibra de carbono, teniendo en cuenta la necesidad inmediata de estabilización y los factores oncológicos subyacentes.
El objetivo principal era lograr la fijación de fracturas, tradicionalmente realizada con dispositivos intramedulares. Sin embargo, la decisión de emplear un clavo de fibra de carbono se tomó debido a la naturaleza patológica de la fractura y a la posterior necesidad de intervención oncológica postquirúrgica. La radiolucidez única de la fibra de carbono ayuda en la planificación de la radiación postoperatoria, asegurando una visualización óptima y precisión en el objetivo de lesiones óseas. Este enfoque contribuye a la reducción de fracturas minimizando la interferencia con la radioterapia.
El procedimiento quirúrgico consistió en el clavado intramedular con una uña de fibra de carbono, logrando una reducción exitosa de fracturas y una posición óptima del hardware. La evaluación histopatológica confirmó adenocarcinoma pulmonar metastásico. Tras la operación, el paciente recibió radioterapia paliativa y terapia dirigida, mostrando una mejora sustancial en el seguimiento de dos meses (Figura 6).
El caso destaca el uso estratégico de implantes de fibra de carbono en el manejo de fracturas patológicas, ofreciendo ventajas en la imagen postoperatoria, el monitoreo de enfermedades y la precisión en la planificación de la radioterapia. El enfoque multidisciplinar subraya la importancia de considerar las sutilezas de selección del implante, especialmente en la enfermedad ósea metastásica, para optimizar los resultados.
Implantes de fibra de carbono; fractura patológica; Enfermedad ósea metastásica.
Un paciente se presentó con una fractura patológica del fémur subtrocantérico en el lado derecho, que se manifestó en el contexto de un adenocarcinoma pulmonar primario inicialmente no diagnosticado. Su historial médico incluía dolor persistente no traumático en muslos y rodillas, que fue empeorando progresivamente, culminando en un aumento repentino del dolor, debilidad en las piernas y una caída posterior tras ceder la pierna en las escaleras. Al presentarla en el Departamento de Urgencias, se identificó rápidamente la naturaleza patológica de la fractura. Tras una evaluación oncológica, el plan de tratamiento implicó una reducción abierta y fijación interna, optando por una uña de fibra de carbono debido a la necesidad inmediata de estabilización de fracturas y las consideraciones oncológicas subyacentes.
En este caso, el enfoque principal era lograr la fijación de fracturas, una tarea tradicionalmente realizada con un dispositivo intramedular. Sin embargo, teniendo en cuenta la naturaleza patológica de la fractura y la posterior necesidad de intervención oncológica tras la cirugía, se decidió utilizar un clavo de fibra de carbono. Las fracturas patológicas, comunes en condiciones metastásicas, a menudo requieren radiación postoperatoria para tratar las células cancerosas residuales y facilitar la cicatrización ósea nativa. La implementación de la planificación de tratamientos con radiación, que incluye la simulación de TC, se ve notablemente facilitada por implantes de fibra de carbono, mejorando la visualización y precisión para atacar la lesión ósea. Este enfoque busca alcanzar el objetivo de reducción de fracturas minimizando la interferencia que suponen los implantes metálicos tradicionales durante la planificación de la radiación.
Se encontró una fractura patológica subtrocantérica en una mujer blanca geriátrica. Por cierto, tras un análisis más profundo, se encontró que el paciente tenía un carcinoma pulmonar primario. El uso de un clavo de fibra de carbono durante la reducción abierta y la fijación interna no solo estabilizó la fractura, sino que también optimizó la precisión en la planificación de la radiación postoperatoria.
El paciente negó cualquier golpe en la cabeza o pérdida de conciencia y no mostró signos de delirio ni confusión. El examen físico de la extremidad inferior derecha fue limitado debido al dolor. Su pierna derecha estaba visiblemente acortada. El examen reveló dolor y resistencia limitada en el extensor hallucis longus (EHL), flexor hallucis longus (FHL), tibial anterior (TA) y gastrocnemio (GS). Los pulsos distales, incluyendo dorsal pedis (DP) y tibial posterior (PT), estaban intactos, y el pie derecho mostraba calidez y una perfusión adecuada. La evaluación posterior de la lesión de tejidos blandos reveló alteraciones en el nervio peroneo superficial (SPN), nervio peroneo profundo (DPN), nervio tibial (TN), nervio safeno y nervio sural.
Las radiografías de la cadera y fémur derecho en su presentación inicial tras la caída revelaron una fractura subtrocantérica desplazada con desplazamiento medial del fragmento distal. La cabeza femoral permaneció bien asentada en el acetábulo y el resto del fémur permaneció intacto (Figura 1). Se observó un estrechamiento degenerativo del espacio articular con osteófitos marginales. Una tomografía computarizada (TC) con contraste del tórax mostró una gran masa en el lóbulo superior derecho que envuelve el bronquio principal derecho, lo que resultó en atelectasia completa del lóbulo superior derecho (Figura 2). La misa sospechaba malignidad. La proliferación de ganglios linfáticos mediastínicos y bilaterales hilares preocupa para la enfermedad metastásica. Una tomografía computarizada no mejorada del fémur derecho reveló lucencias intracorticales inespecíficas del diáfise medio femoral en el margen inferior de la fractura. Este hallazgo suscitó preocupación por lesiones permeativas subyacentes y una fractura patológica (Figura 3). Aunque la resonancia magnética (RM) de seguimiento pudo haber ayudado a determinar la presencia de lesiones óseas subyacentes, la evaluación en el entorno agudo está limitada por edema y hemorragia, lo que llevó a la decisión de no realizar este examen.
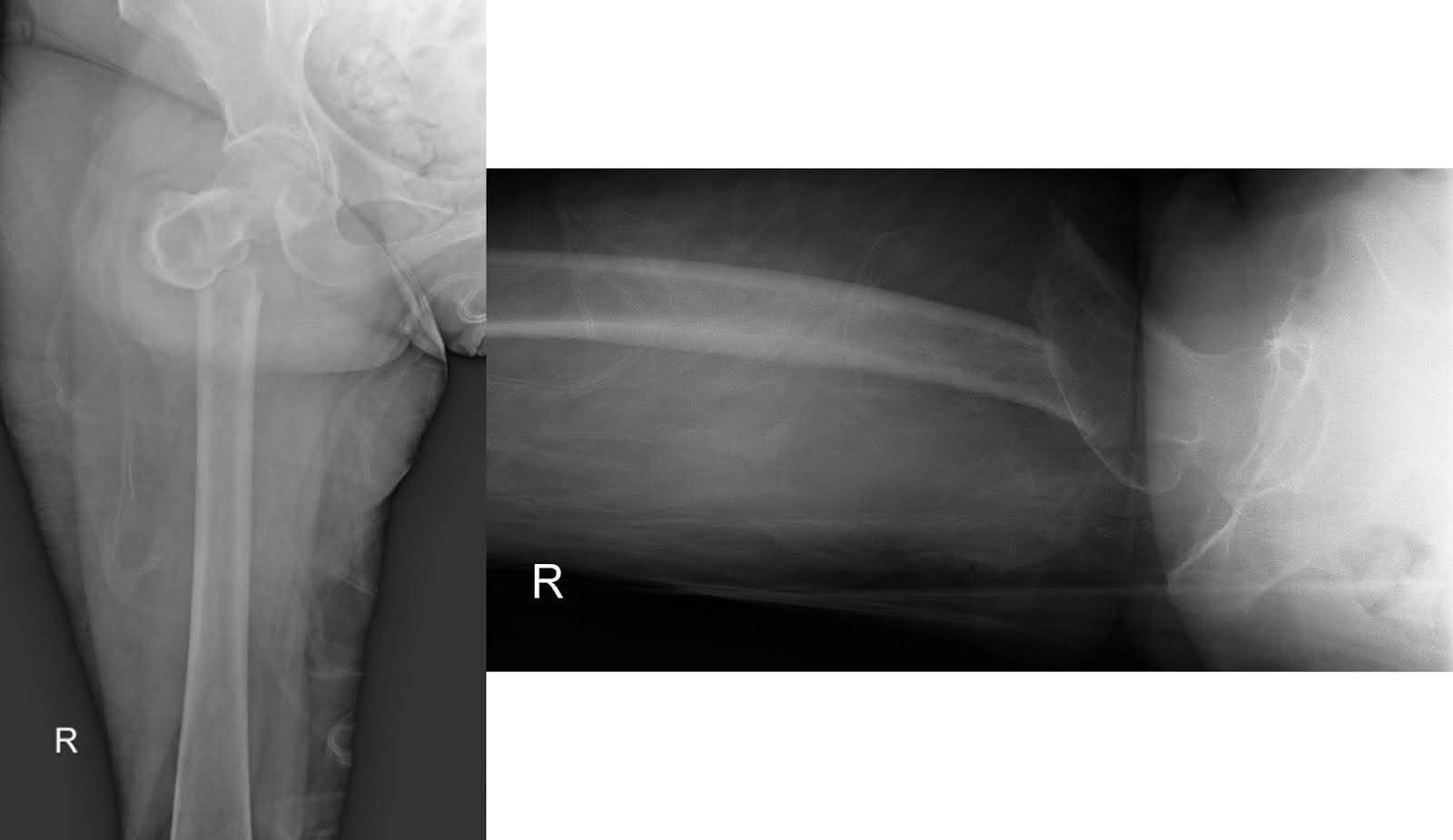
Figura 1. Radiografías AP y laterales de la cadera derecha que ilustran una fractura subtrocantérica desplazada. La cabeza femoral mantiene la reducción dentro del acetábulo, mientras que el resto del fémur permanece estructuralmente intacto.
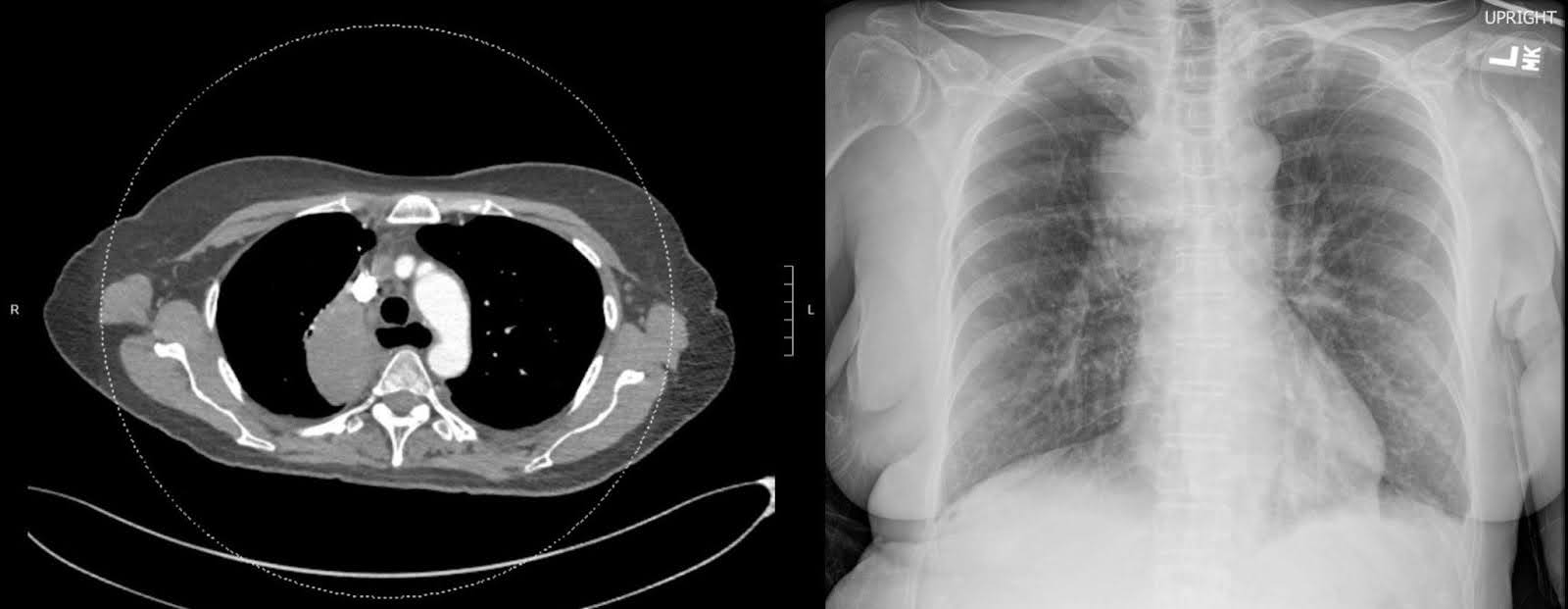
Figura 2.Durante una TC de tórax con contraste se encontró una masa de mejora heterogénea, situada en la región paramediastinal derecha del lóbulo superior derecho. La presencia de este hallazgo sugiere un diagnóstico de cáncer de pulmón primario.
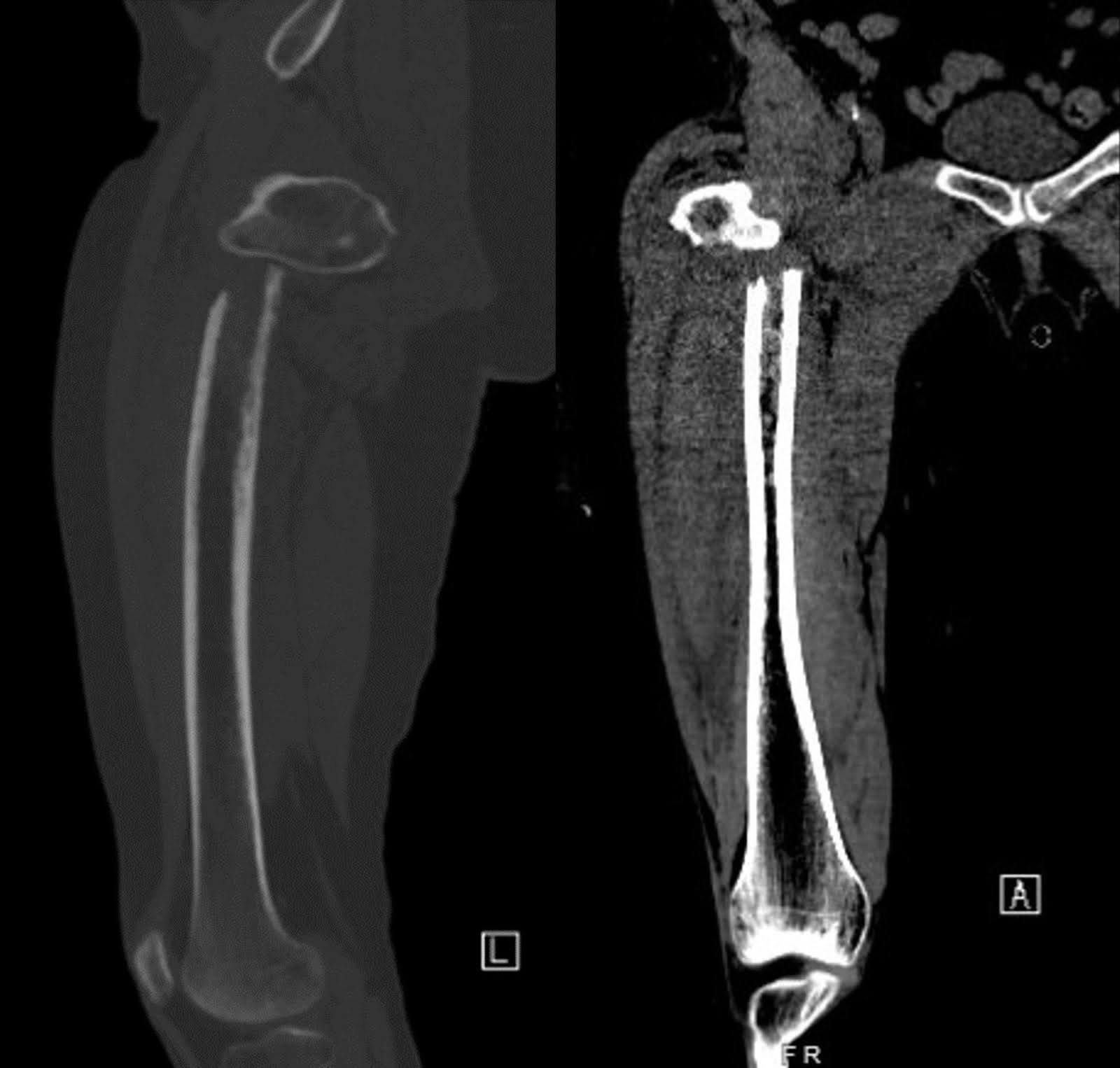 Figura 3. Las imágenes de TC lateral y AP sin contraste del fémur derecho muestran lucencias intracorticales en el centro del fémur del tronco, lo que sugiere una posible fractura patológica.
Figura 3. Las imágenes de TC lateral y AP sin contraste del fémur derecho muestran lucencias intracorticales en el centro del fémur del tronco, lo que sugiere una posible fractura patológica.
Las fracturas patológicas, distintas de las traumáticas, surgen como resultado de una condición subyacente, incluyendo, pero no limitándose a, osteoporosis, cáncer, infecciones o trastornos metabólicos. Esta categoría distintiva de fracturas se caracteriza por la influencia de procesos patológicos que comprometen la integridad estructural del hueso.1 Las fracturas patológicas pueden provocar morbilidad significativa y un deterioro general de la calidad de vida.2 El sistema esquelético ocupa el tercer lugar más común para las metástasis, después del pulmón y el hígado.3 Alrededor del 70% de todas las metástasis óseas se producen debido a cánceres metastásicos de mama y próstata, siendo los tumores de pulmón, riñón y tiroides las siguientes causas más comunes en términos de prevalencia.4
Los pacientes que sufren fracturas patológicas pueden mostrar dolor e inflamación en el lugar de la fractura, además de dificultad para caminar, reducción del rango de movimiento, equimosis, edema local y un acortamiento notable de las extremidades.5 Un indicador clínico de fracturas patológicas radica en su causa subyacente, que a menudo presenta un trauma mínimo—es decir, considerablemente menos fuerza de la necesaria para fracturar un hueso sano.6 Aunque poco frecuentes, las fracturas patológicas pueden ser el signo presente de una malignidad subyacente.7 Esto subraya la necesidad de una investigación meticulosa y un escrutinio diagnóstico, especialmente en casos donde existe antecedentes de trauma limitado o ausente.
Una fractura patológica femoral presenta desafíos similares a una fractura traumática del fémur, pero introduce consideraciones postoperatorias adicionales que afectan la selección del implante. Al igual que en el manejo de fracturas de fémur en hueso sano, es fundamental lograr la reducción y estabilización de las fracturas. Esto no solo alivia el dolor y proporciona estabilidad para la marcha, sino que también establece un entorno biomecánico propicio para una cicatrización óptima de fracturas.
El manejo de fracturas subtrocantéricas presenta desafíos para lograr la reducción y la fijación, siendo esta reducción que a menudo requiere técnicas percutáneas o abiertas.8 La fijación quirúrgica, una intervención bien tolerada, demuestra resultados funcionales comparables a la fijación no patológica.9 Desde una perspectiva oncológica, tratar las células malignas del hueso es fundamental para una cicatrización ósea eficaz. En el régimen de tratamiento posterior a la fractura, la quimioterapia y la radioterapia desempeñan un papel crucial para lograr este objetivo. La radioterapia, normalmente planificada con terapia de haz externo, requiere una tomografía computarizada previa al tratamiento para una planificación precisa. Sin embargo, la presencia de implantes metálicos puede causar dispersión del haz, reduciendo la resolución de imagen y afectando a los planes de radioterapia. Los implantes de fibra de carbono, carentes de las propiedades radiográficas de los metales, pueden cumplir eficazmente los objetivos de reducción y cicatrización de fracturas, al tiempo que afectan mínimamente a las terapias adyuvantes esenciales para la radioterapia.10
El propósito de la fijación del hueso largo tras una fractura es facilitar una cicatrización adecuada, restaurar la estabilidad y promover la recuperación funcional. Al considerar opciones de tratamiento para fracturas subtrocantéricas del fémur, las principales modalidades de fijación incluyen la fijación de uñas o placas, siendo la literatura ortopédica actual la que favorece la fijación de uñas.8 En la selección de materiales para implantes, es imprescindible tener en cuenta la etiología subyacente de la fractura y la competencia del cirujano con ambas técnicas.
Para pacientes con fracturas patológicas secundarias a enfermedad ósea metastásica, las uñas de fibra de carbono pueden ser una alternativa preferible a las de titanio, debido a su radiolucidez y sus favorables propiedades mecánicas.11,12 Los implantes de fibra de carbono disminuyen significativamente la dispersión en la TC y disminuyen el artefacto de susceptibilidad en la resonancia magnética, lo que permite una mejor visualización de la cicatrización ósea, la vigilancia postoperatoria de la recurrencia o progresión local de la enfermedad y la precisión en la planificación de la radiación.10, 13, 14
Aunque existen varias ventajas en la fijación de fibra de carbono, no hay diferencias en los resultados funcionales ni en los perfiles de complicaciones de la fijación de fibra de carbono y metal.11,12 Ambas técnicas logran el objetivo de estabilizar fracturas y mantener la reducción con bajo riesgo de complicaciones y una cicatrización y biocompatibilidad bien documentadas. Por lo tanto, el cirujano quirúrgico debe valorar cuidadosamente su nivel de competencia y comodidad con cada método de fijación y tipo de implante en el proceso de toma de decisiones.12,15
Al formular la estrategia de tratamiento para una fractura subtrocantérica patológica, es imprescindible tener en cuenta tanto los objetivos a corto como a largo plazo. A corto plazo, utilizar un implante de fibra de carbono para la fijación busca establecer estabilidad ósea tras la reducción de fracturas. La reducción de fracturas restaura la longitud de las extremidades, la tensión muscular y las relaciones anatómicas normales. Mantener esta reducción disminuye el dolor al estabilizar adecuadamente los fragmentos óseos.16 Como dispositivo de compartición de carga, el implante puede permitir que el paciente se movilice de inmediato, reduciendo el riesgo de tromboembolismo venoso, úlceras de depresión y desacondicionamiento rápido.17
En el periodo intermedio postoperatorio, la estabilidad que proporciona el implante juega un papel crucial en la promoción de la cicatrización de fracturas, especialmente cuando se combina con terapia adyuvante para el tratamiento del cáncer.18 Optar por un implante de fibra de carbono no solo simplifica la monitorización radiográfica postoperatoria de la enfermedad, sino que también mejora la precisión en la planificación de la radioterapia. Esta elección estratégica contribuye a una mayor precisión y eficacia en el enfoque general del tratamiento.19
Los implantes de fibra de carbono pueden estar contraindicados para tumores óseos diáfisarios humérales que requieren una gran resección segmentaria con un segmento óseo residual corto (5 cm) y un separador de cemento considerable. Estos implantes pueden fallar por tensión debido a fuerzas de flexión en la parte distal de la uña intramedular, donde existe un desajuste de módulo de elasticidad entre el separador de cemento y el hueso residual. En estos escenarios, las uñas intramedulares de titanio emergen como una opción preferible, ofreciendo una posible solución para abordar los desafíos asociados con los implantes de fibra de carbono en este contexto específico.20
Los cirujanos deben tener en cuenta su familiaridad y comodidad con los implantes de fibra de carbono, teniendo en cuenta la curva de aprendizaje asociada a estos implantes. Los implantes de fibra de carbono se han relacionado con tiempos más largos de cirugía y fluoroscopia, así como con un aumento de la pérdida de sangre, especialmente en oncología ortopédica y de columna.12,21 Equilibrar consideraciones clínicas y la competencia del cirujano es esencial a la hora de decidir la idoneidad de los implantes de fibra de carbono en este campo especializado.
El uso de implantes de fibra de carbono en ortopedia requiere una consideración exhaustiva de varios factores clínicos clave. A pesar de las tasas de complicaciones y fallos comparables a los implantes de titanio, los implantes de fibra de carbono carecen de flexibilidad intraoperatoria para doblarse o contornear. Los cirujanos deben realizar una planificación preoperatoria meticulosa para asegurar un ajuste óptimo.22 Aunque la radiolucidez de la fibra de carbono es ventajosa para estudios de imagen postoperatorios, confirmar la posición del implante durante la operación puede presentar desafíos. Por el contrario, los implantes metálicos, aunque carentes de flexibilidad intraoperatoria, a menudo interrumpen el mapeo de la planificación de la radiación y dificultan el cálculo y la administración precisos de la dosis.23,24 Además, en situaciones donde la enfermedad se extiende a la articulación y requiere reemplazo articular, los implantes de fibra de carbono pueden no ser la opción más adecuada. Por lo tanto, la decisión de emplear implantes de fibra de carbono implica una evaluación matizada de sus beneficios y limitaciones en contextos clínicos específicos.
Se realizó una varilla intramedular del fémur derecho para la fijación operativa de la lesión, además de una biopsia abierta para determinar la etiología de la enfermedad ósea metastásica. Según los estudios de imagen, esto parecía ser un cáncer de pulmón primario con metástasis en el hueso. El paciente fue colocado en un decúbito lateral con la ayuda de un puff. Todas las prominencias óseas estaban adecuadamente acolchadas. Se realizó la colocación de una rotación subaxilar y la descarga del nervio peroneo izquierdo.
Se realizó una incisión lateral en el muslo proximal y posteriormente se realizó un enfoque subvasto para exponer el lugar de la fractura. Un separador Cobra facilitó la exposición tras la identificación del lugar de la fractura. Se obtuvieron muestras de patología permanente y congelada utilizando curettes. La patología congelada confirmó adenocarcinoma pulmonar metastásico. Se realizó un desbridamiento agresivo de la lesión tumoral, tanto dentro como fuera del hueso. Se realizó una abundante irrigación del campo quirúrgico con solución de peróxido.
Utilizando guantes nuevos y un nuevo conjunto de instrumentos, se realizó una incisión posterior próxima al lugar inicial para acceder al fémur proximal. La fascia del glúteo medio fue incisa longitudinalmente para identificar la punta de la mayor tuberosidad. Un alambre guía de 3,2 mm marcaba el punto de partida, asegurando una excelente posición tanto en la vista anteroposterior (AP) como lateral. El mantenimiento del fémur en posición neutral se facilitaba mediante un pasador de Shantz, que facilitaba la rotación interna y la aducción del fragmento femoral proximal.
El fragmento significativamente flexionado fue colocado adicionalmente para asegurar la extensión. Se utilizó una herramienta de reducción de dedos, sostenida por dos pinos Shantz en el fémur proximal y en el eje femoral, para lograr la reducción anatómica de la fractura. Con la fractura reducida, se utilizó el escariador de apertura para abrir la trayectoria en el fémur proximal. Avanzando un alambre guía con punta de bola, mantuvimos la reducción y confirmamos la excelente posición del alambre en el fémur distal. Se midió un clavo de fibra de carbono de 360 mm con un diámetro de 11 mm. Escariamos secuencialmente hasta el tamaño de 12,5 mm e insertamos suavemente usando un intercambiador de tubos para quitar el cable guía de la punta de la bola e insertar el liso. El clavo femoral de fibra de carbono se insertaba sobre el alambre liso de la manera tradicional, con el brazo de puntería situado hacia adelante, girando el brazo hacia fuera a medida que avanzaba el clavo. La varilla se golpea hasta su posición final hasta que la parte superior de la barra queda cubierta por el fémur proximal.
Manipulando los tejidos blandos, utilizamos la incisión de la biopsia para insertar el triple trochar a través del brazo de apuntación. Luego insertamos a través del alambre guía femoral la trayectoria en el cuello femoral para el tornillo de la cadera. Con fluoroscopia se confirmó la posición correcta. Se logró un escariado a una longitud de 95 mm. El instrumento para el tornillo de cadera se aseguraba sin dificultad, inicialmente golpeando el camino y luego insertando el tornillo siguiendo la trayectoria marcada en el cuello femoral, y después asegurándolo con el tornillo de ajuste.
Manteniendo una penetración perfecta de la cadera y rodilla derechas, la parte distal del clavo se aseguraba con dos tornillos de titanio de 5,0 mm de 40 y 40,5 mm de longitud (Figura 4). Las imágenes finales confirmaron la reducción exitosa de la fractura y la posición óptima del hardware (Figura 5). Se realizó un riego abundante, seguido de cierre capa por capa. No hubo complicaciones durante el caso. La duración del caso fue de 121 minutos con una pérdida de sangre estimada de 250 mL.
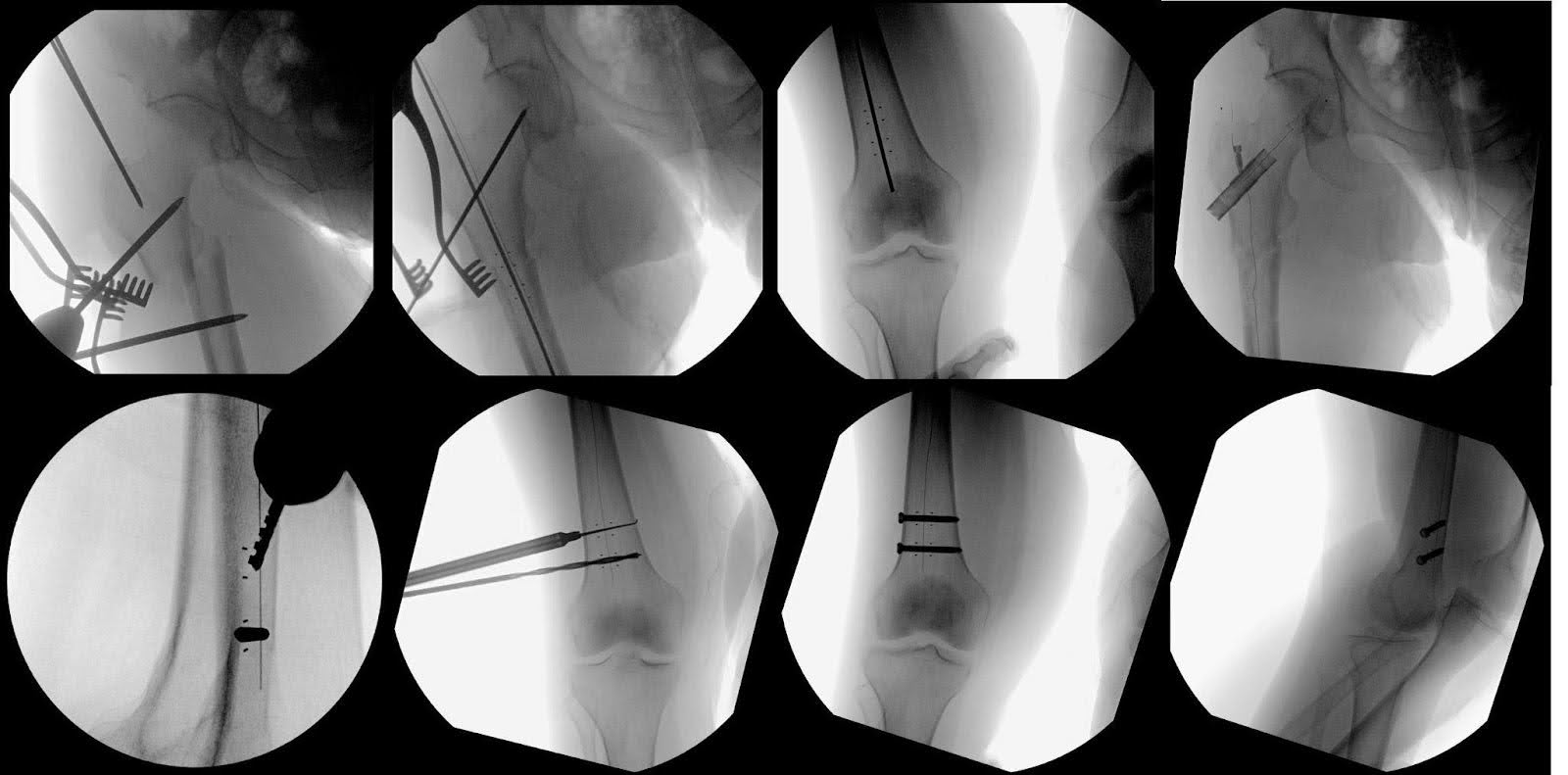
Figura 4. Se utilizó la fluoroscopia para demostrar los diferentes pasos quirúrgicos implicados en el tratamiento de la fractura del fémur. Esto incluyó mostrar el punto de inicio y la reducción de la fractura usando pasadores de Shandz. Se utilizaron imágenes adicionales para mostrar el clavo de fibra de carbono, el tornillo de la cadera de fibra de carbono y dos tornillos de enclavamiento de titanio que se empleaban para asegurar la estabilidad del clavo. Marcadores radioopacos ayudaron a visualizar estas aperturas, observables tanto desde la vista AP como lateral. Cabe destacar que las guías para estos orificios de entrada difieren de las circulares estándar que se ven típicamente en fluoroscopía para clavos de titanio.
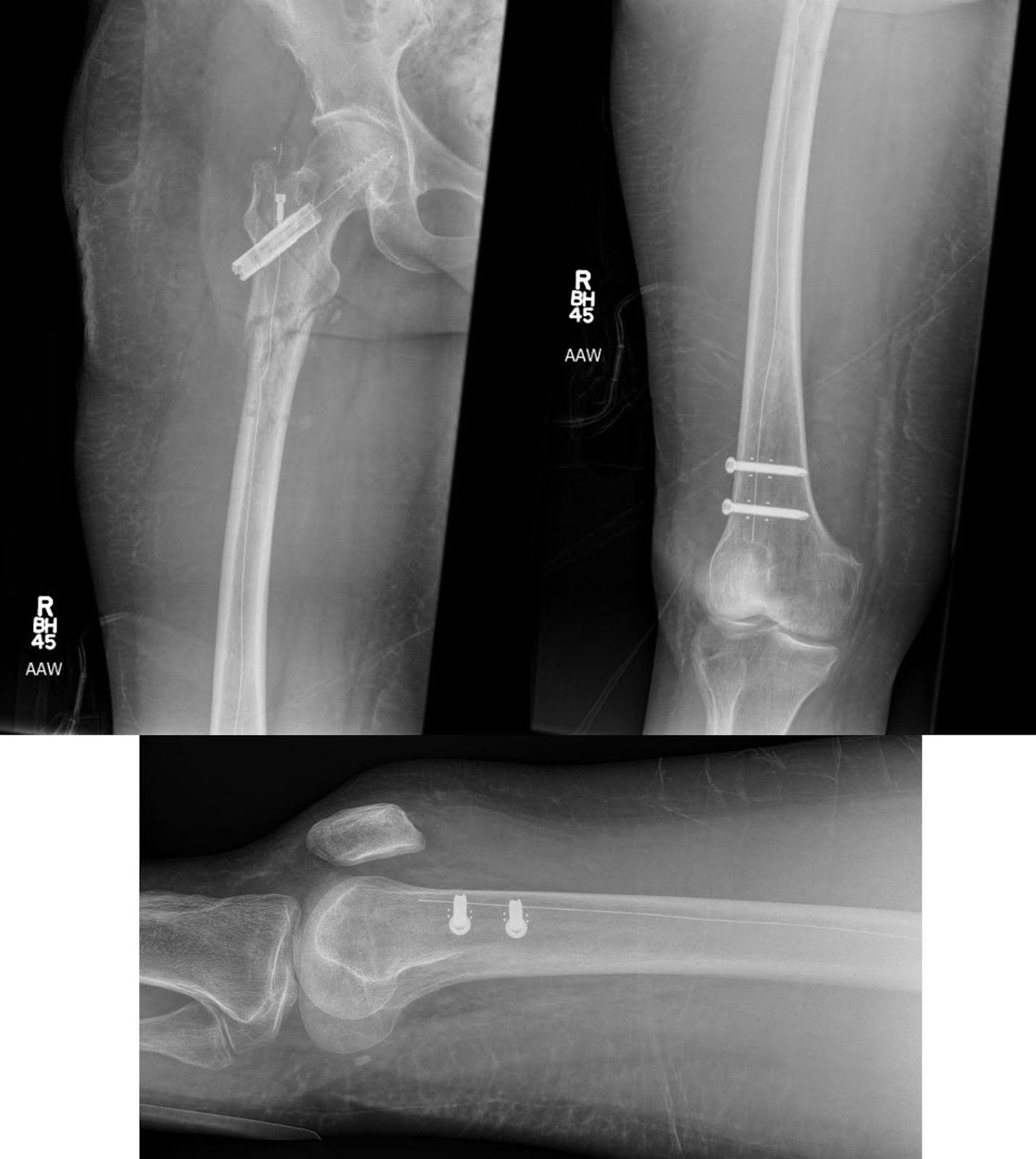
Figura 5. Una radiografía AP del fémur y una radiografía lateral de la rodilla tras la fijación de la varilla intramedular de fibra de carbono para una fractura patológica subtrocantérica del fémur derecho muestran una mejor alineación sin signos de complicaciones del hardware. La parte inferior de la pierna no presenta lesiones líticas sospechosas adicionales y no hay indicios de nuevas fracturas.
Se realizó una biopsia abierta del fémur proximal derecho además de la fijación operativa, y se envió una muestra de 5,5x5,5x2,5 cm, compuesta por fragmentos de tejido blando rosado-rojo polvoriento, para evaluación histopatológica por un patólogo de huesos y tejidos blandos con formación en fellowship. Se realizó una inmunotinción para PD-L1 sobre un bloque tisular representativo y reveló >100 células tumorales disponibles para la puntuación. PD-L1 mostró tinción membranosa de fuerte intensidad en el >95% de las células tumorales (puntuación de proporción tumoral, o TPS, >95%).25 Inmunohistoquímica mostró células tumorales positivas para TTF-1 y Napsin-A y negativas para p40. Dadas estas conclusiones, el diagnóstico patológico final de la lesión del fémur proximal derecho es carcinoma metastásico compatible con carcinoma primario pulmonar.26–28
Un mes después de la cirugía, el paciente recibió 20 Gy de radiación paliativa en cinco fracciones en la cadera derecha. En el contexto de la enfermedad ósea metastásica, la radioterapia mitiga la activación de los osteoclastos, mata las células tumorales y alivia el dolor óseo al producir osificación.29 Simultáneamente, oncología médica inició la administración de Capmatinib, una terapia dirigida utilizada para tratar el cáncer de pulmón no de células pequeñas metastásico. En la revisión de los dos meses, el paciente mostró una mejora sustancial, pudiendo caminar sin andador. Sus rodillas estaban estables bajo tensión de valgo y varo en plena extensión y 30° de flexión. La flexión, extensión, rotación interna y rotación externa de la cadera estuvieron dentro de los límites normales. Seis semanas después de comenzar con Capmatinib, el paciente respondía bien al tratamiento. Una tomografía computarizada del tórax mostró una disminución de la masa en el lóbulo superior derecho y una disminución de la linfadenopatía mediastínica y hilar bilateral. En su revisión más reciente, su estado funcional no ha mostrado cambios significativos ni cambios visibles en el hardware, y continúa recibiendo Capmatinib, sometiéndose a monitorización radiográfica frecuente (Figura 7).
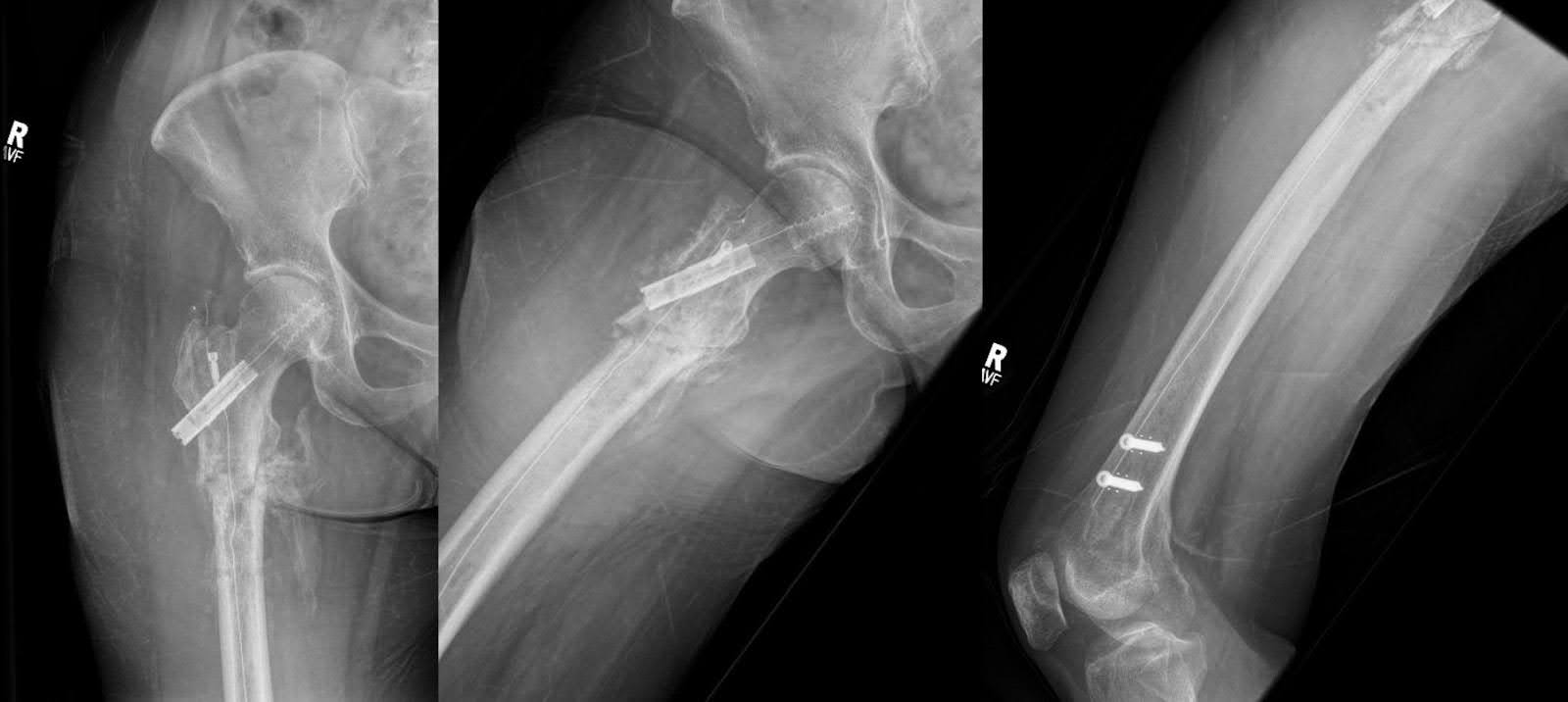
Figura 6. Las radiografías AP y laterales del fémur y una radiografía lateral de la rodilla, dos meses después de la fijación, muestran la formación de nuevos callos y puentes óseos, manteniendo la alineación original. No hay fracturas nuevas, pero se observan cambios degenerativos leves en la cadera derecha.
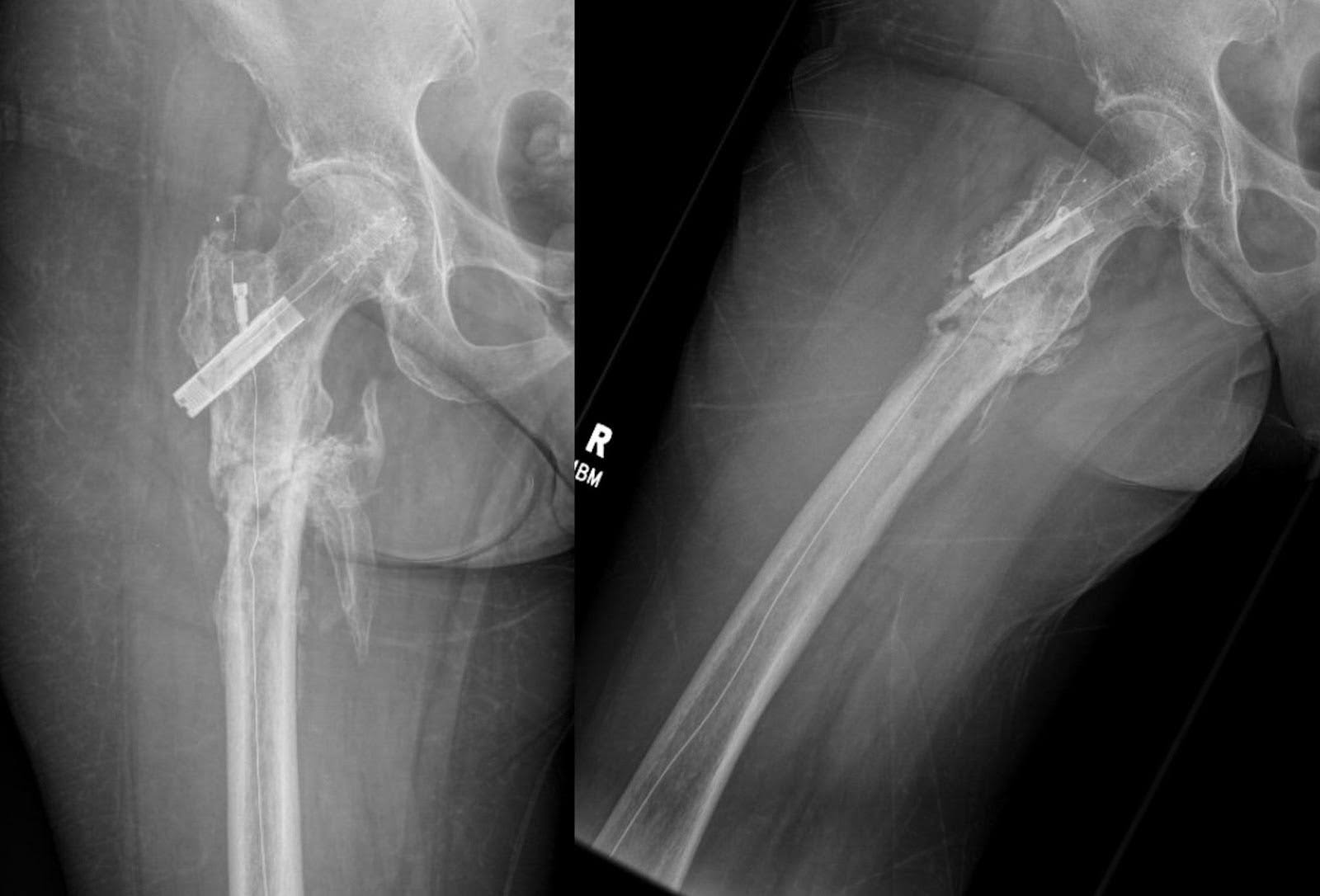
Figura 7. Seis meses después de la fijación, las radiografías de la AP y del fémur lateral revelan formación continua de callos y abundante puente óseo, manteniendo la alineación inicial. La fractura muestra signos de cicatrización incompleta junto con la presencia de formación ósea heterotópica. No hay complicaciones hardware discernibles ni indicios de fracturas nuevas. Además, persisten cambios degenerativos análogos en la cadera derecha.
La metástasis desempeña un papel significativo en la morbilidad y mortalidad asociadas al cáncer.30 El cáncer de pulmón, el segundo carcinoma más común en hombres y mujeres respectivamente, muestra preferencia por la metástasis en el cerebro, huesos y glándulas suprarrenales.La enfermedad ósea metastásica no solo inflige un dolor incapacitante a los pacientes, sino que también supone una carga financiera considerable. La estimación actual de 250.000 pacientes en Estados Unidos que lidian con esta enfermedad se traduce en un coste anual de atención sanitaria de 12.000 millones de dólares.33,34 Los avances en los tratamientos, aunque han mejorado las tasas de supervivencia al cáncer, han llevado a una mayor incidencia de enfermedad ósea metastásica. Las fracturas patológicas derivadas de esta condición se originan por numerosas lesiones que alcanzan un tamaño que pone en peligro la integridad estructural del hueso, culminando finalmente en fracturas.35 Para mejorar la supervivencia y calidad de vida a largo plazo del paciente, es fundamental priorizar estratégicamente las modalidades de tratamiento adecuadas en el manejo de la enfermedad.36
Como este paciente no tenía diagnóstico oncológico antes de la fractura del fémur, es importante destacar los puntos clave que pueden ayudar a identificar lesiones óseas de riesgo antes de la fractura. El paciente informó de varios meses de dolor en la cadera antes de la fractura, lo que a menudo puede ser el primer hallazgo clínico de cualquier carcinoma visceral. Se deben investigar resultados de historia clínica y exámenes físicos que revelen dolor sin explicación, especialmente el dolor funcional. El método más adecuado de evaluación es mediante radiografías simples de todo el hueso de la extremidad afectada, para asegurar que el dolor referido no sea un factor clínico que enmascara.
Una vez tratada adecuadamente la fractura y el paciente ha superado la fase inmediata postoperatoria, la atención debe centrarse en abordar la enfermedad subyacente, lo que requiere un enfoque multidisciplinar que incluya oncología médica y radioterápica. La oncología médica proporciona tratamiento sistémico tanto para el cáncer primario como para sus lesiones metastásicas. La oncología radioterápica cumple un papel fundamental en el tratamiento local durante el periodo subagudo postoperatorio, dirigiéndose agresivamente a las células cancerosas diseminadas para facilitar el proceso esencial de curación ósea. Aunque las series de casos informan de una menor tasa de progresión de la enfermedad tras la estabilización de las uñas medulares, el riesgo de fallo del hardware aumenta con la supervivencia del paciente.37,38 Los implantes de fibra de carbono pueden mejorar el monitoreo de enfermedades y la curación ósea cuando se utilizan con técnicas avanzadas de imagen.12 Estudios que investiguen los resultados reportados por los pacientes y la rentabilidad de los implantes de fibra de carbono frente al titanio pueden potenciar la adopción clínica.
No se utiliza equipo especial más allá del implante de fibra de carbono.
El autor correspondiente es ponente remunerado y consultor para CarboFix Orthopaedics Ltd.
El paciente al que se refiere en este vídeo ha dado su consentimiento informado para ser grabado y es consciente de que la información y las imágenes se publicarán en línea.
Animación añadida tras la publicación el 03/10/2025. No se hicieron cambios en el contenido del artículo.
References
- Haase SC. Tratamiento de las fracturas patológicas. Mano Clin. 2013; 29(4):579-584. doi:10.1016/j.hcl.2013.08.010.
- Coleman RE. Características clínicas de la enfermedad ósea metastásica y riesgo de morbilidad esquelética. Clin Cáncer Res. 2006; 12(20 Pt 2):6243s-6249s. doi:10.1158/1078-0432.CCR-06-0931.
- Hage WD, Aboulafia AJ, Aboulafia DM. Incidencia, localización y evaluación diagnóstica de la enfermedad ósea metastásica. Orthop Clin América del Norte. 2000; 31(4):515-528, vii. doi:10.1016/s0030-5898(05)70171-1.
- Christ AB, Piple AS, Gettleman BS, et al. Prevalencia de tumores malignos primarios, tasas de fractura patológica y mortalidad en el contexto de la enfermedad ósea metastásica. Hueso Jt abierto. 2023; 4(6):424-431. doi:10.1302/2633-1462.46.BJO-2023-0042. R1.
- Johnson SK, Knobf MT. Intervenciones quirúrgicas para pacientes con cáncer con fracturas patológicas inminentes o reales. Enfermería ortopédica. 2008; 27(3):160-171; Cuestionario 172-173. doi:10.1097/01.NOR.0000320543.90115.d5.
- De Mattos CBR, Binitie O, Dormans JP. Fracturas patológicas en niños. Res. de la Articulación Ósea 2012; 1(10):272-280. doi:10.1302/2046-3758.110.2000120.
- Kim LD, Bueno FT, Yonamine ES, Próspero JD de, Pozzan G. Metástasis ósea como primer síntoma de tumores: papel de un estudio de inmunohistoquímica en el establecimiento de un tumor primario. Rev Bras Ortop (São Paulo). 2018; 53(4):467-471. doi:10.1016/j.rboe.2018.05.015.
- Yoon RS, Donegan DJ, Liporace FA. Reducción de las fracturas de fémur subtrocantéreo: consejos y trucos, qué hacer y qué no hacer. J Traumatismo ortopédico. 2015; 29 Supl. 4:S28-33. doi:10.1097/BOT.00000000000000287.
- Weiss RJ, Ekström W, Hansen BH, et al. Fracturas subtrocantéreas patológicas en 194 pacientes: una comparación de los resultados después del tratamiento quirúrgico de fracturas patológicas y no patológicas. J Surg Oncol. 2013; 107(5):498-504. doi:10.1002/jso.23277.
- Depauw N, Pursley J, Lozano-Calderón SA, Patel CG. Evaluación de implantes quirúrgicos de fibra de carbono y titanio para terapia de protones y fotones. Pract Radiat Oncol. 2023; 13(3):256-262. doi:10.1016/j.prro.2023.01.009.
- Lozano-Calderón SA, Rijs Z, Groot OQ, et al. Resultados de huesos largos tratados con clavos de fibra de carbono para indicaciones oncológicas: estudio internacional multiinstitucional. J am Acad Orthop Surg. 2024; 32(3):E134-E145. doi:10.5435/JAAOS-D-22-01159.
- Yeung CM, Bhashyam AR, Groot OQ, et al. Comparación de clavos intramedulares de fibra de carbono y titanio en oncología ortopédica. Hueso Jt abierto. 2022; 3(8):648-655. doi:10.1302/2633-1462.38.BJO-2022-0092. R1.
- Ernstberger T, Heidrich G, Bruening T, Krefft S, Buchhorn G, Klinger HM. La relevancia validada por el interobservador de los materiales espaciadores intervertebrales en la artefacto de la resonancia magnética. Eur Spine J. 2007; 16(2):179-185. doi:10.1007/s00586-006-0064-5.
- Alvarez-Breckenridge C, de Almeida R, Haider A, et al. Implantes espinales de polieteretercetona reforzados con fibra de carbono para el tratamiento de tumores espinales: ventajas y limitaciones percibidas. Neurocolumna vertebral. 2023; 20(1):317-326. doi:10.14245/ns.2244920.460.
- Clunk MJ, Gonzalez MR, Denwood HM, et al. Un PEEK en fibra de carbono: una guía práctica para implantes poliméricos compuestos de alto rendimiento para oncología ortopédica. 2023;45:13-18. doi:10.1016/j.jor.2023.09.011.
- Manglani HH, Marco RA, Picciolo A, Healey JH. Urgencias ortopédicas en pacientes oncológicos. Semin Oncol. 2000; 27(3):299-310.
- Booth K, Rivet J, Flici R, et al. El protocolo de movilidad progresiva reduce la tasa de tromboembolismo venoso en pacientes de cuidados intensivos con traumatismos: un proyecto de mejora de la calidad. J Enfermería de Trauma. 2016; 23(5):284-289. doi:10.1097/JTN.000000000000000234.
- Colyer RA. Estabilización quirúrgica de fracturas neoplásicas patológicas. Curr Probl Cáncer. 1986; 10(3):117-168. doi:10.1016/s0147-0272(86)80005-8.
- Xin-ye N, Xiao-bin T, Chang-ran G, Da C. La perspectiva de los implantes de fibra de carbono en radioterapia. J Appl Clin Med Phys. 2012; 13(4):3821. doi:10.1120/jacmp.v13i4.3821.
- Bhashyam AR, Yeung C, Sodhi A, et al. Clavo intramedular reforzado con titanio frente a fibra de carbono para tumores óseos humerales. J Cirugía de hombro y codo. 2023; 32(11):2286-2295. doi:10.1016/j.jse.2023.04.023.
- Cofano F, Di Perna G, Monticelli M, et al. Implantes reforzados con fibra de carbono frente a implantes de titanio para la fijación en metástasis espinales: un estudio clínico comparativo sobre la seguridad y la eficacia de la nueva "estrategia de carbono". J Clin Neurosci. 2020;75:106-111. doi:10.1016/j.jocn.2020.03.013.
- Yeung CM, Bhashyam AR, Patel SS, Ortiz-Cruz E, Lozano-Calderón SA. Implantes de fibra de carbono en oncología ortopédica. J Clin Med. 2022; 11(17). doi:10.3390/jcm11174959.
- Tedesco G, Gasbarrini A, Bandiera S, Ghermandi R, Boriani S. Los implantes compuestos de PEEK/fibra de carbono pueden aumentar la eficacia de la radioterapia en el tratamiento de los tumores de la columna vertebral. J Cirugía de columna. 2017; 3(3):323-329. doi:10.21037/jss.2017.06.20.
- Nevelsky A, Borzov E, Daniel S, Bar-Deroma R. Efectos de perturbación de los tornillos de fibra de carbono-PEEK en la distribución de dosis de radioterapia. J Appl Clin Med Phys. 2017; 18(2):62-68. doi:10.1002/acm2.12046.
- Keppens C, Dequeker EM, Pauwels P, Ryska A, 't Hart N, von der Thüsen JH. Inmunohistoquímica de PD-L1 en el cáncer de pulmón de células no pequeñas: desentrañando las diferencias en la concordancia de la tinción y la interpretación. Virchows Arch. 2021; 478(5):827-839. doi:10.1007/s00428-020-02976-5.
- Yatabe Y, Mitsudomi T, Takahashi T. TTF-1 en adenocarcinomas pulmonares. Am J Surg Pathol. 2002; 26(6):767-773. doi:10.1097/00000478-200206000-00010.
- Zhang P, Han YP, Huang L, Li Q, Ma DL. Valor de la napsina A y del factor de transcripción-1 de la tiroides en la identificación del adenocarcinoma primario de pulmón. Oncol Lett. 2010; 1(5):899-903. doi:10.3892/ol_00000160.
- La inmunohistoquímica p40 es un excelente marcador en el carcinoma primario de pulmón de células escamosas. J Pathol Transl Med. 2018; 52(5):283-289. doi:10.4132/jptm.2018.08.14.
- De Felice F, Piccioli A, Musio D, Tombolini V. La función de la radioterapia en el tratamiento de las metástasis óseas. Oncotarget. 2017; 8(15):25691-25699. doi:10.18632/oncotarget.14823.
- Nooh A, Goulding K, Isler MH, et al. Mejoría temprana del dolor y del resultado funcional, pero no de la calidad de vida después de la cirugía para la enfermedad metastásica de los huesos largos. Clin Orthop Relat Res. 2018; 476(3):535-545. doi:10.1007/s11999.000000000000000065.
- Siegel RL, Miller KD, Wagle NS, Jemal A. Estadísticas de cáncer, 2023. CA Cáncer J Clin. 2023; 73(1):17-48. doi:10.3322/caac.21763.
- Popper HH. Progresión y metástasis del cáncer de pulmón. Metástasis del Cáncer Rev. 2016; 35(1):75-91. doi:10.1007/s10555-016-9618-0.
- Guy GP, Ekwueme DU, Yabroff KR, et al. Carga económica de la supervivencia al cáncer entre los adultos en los Estados Unidos. J Clin Oncol. 2013; 31(30):3749-3757. doi:10.1200/JCO.2013.49.1241.
- Li S, Peng Y, Weinhandl ED, et al. Número estimado de casos prevalentes de enfermedad ósea metastásica en la población adulta de EE. UU. Clin Epidemiol. 2012;4:87-93. doi:10.2147/CLEP. S28339.
- Blank AT, Lerman DM, Patel NM, Rapp TB. ¿La intervención profiláctica es más costo-efectiva que el tratamiento de las fracturas patológicas en la enfermedad ósea metastásica? Clin Orthop Relat Res. 2016; 474(7):1563-1570. doi:10.1007/s11999-016-4739-x.
- Gutowski CJ, Zmistowski B, Fabbri N, Boland PJ, Healey JH. ¿El uso de agentes biológicos en pacientes con cáncer renal y de pulmón debe afectar nuestro manejo quirúrgico de las metástasis femorales? Clin Orthop Relat Res. 2019; 477(4):707-714. doi:10.1097/CORR.00000000000000434.
- Miller BJ, Soni EEC, Gibbs CP, Scarborough MT. Clavos intramedulares para metástasis de huesos largos: ¿por qué fallan? Ortopedia. 2011; 34(4). doi:10.3928/01477447-20110228-12.
- Arpornsuksant P, Morris CD, Forsberg JA, Levin AS. ¿Qué factores se asocian con la progresión de la lesión metastásica local después de la estabilización ungueal intramedular? Clin Orthop Relat Res. 2022; 480(5):932-945. doi:10.1097/CORR.00000000000002104.
Cite this article
Rizk PA, Werenski JO, Lozano-Calderón SA. Implante de fibra de carbono para la fijación de una fractura subtrocantérea patológica. J Med Insight. 2024; 2024(443). doi:10.24296/jomi/443.



