Kohlefaserimplantat zur Fixierung einer pathologischen subtrochantären Fraktur
Massachusetts General Hospital
Main Text
Table of Contents
Hier präsentieren wir einen Patienten mit einem pathologischen subtrochanteren Oberschenkelbruch, der sekundär zu einem nicht diagnostizierten primären Lungenadenokarzinom führt. Der Bruch, der im Zusammenhang mit anhaltenden atraumatischen Oberschenkel- und Knieschmerzen auftrat, führte zu einer schnellen Identifizierung seiner pathologischen Natur in der Notaufnahme. Der Behandlungsplan umfasste offene Reduktion und interne Fixierung mit einem Kohlefasernagel, wobei der unmittelbare Bedarf an Stabilisierung und zugrunde liegenden onkologischen Faktoren berücksichtigt wurde.
Der Hauptfokus lag auf der Bruchfixierung, die traditionell mit intramedullären Geräten erreicht wurde. Die Entscheidung zur Verwendung eines Kohlefasernagels wurde jedoch aufgrund der pathologischen Natur des Bruchs und des anschließenden Notwendigen einer onkologischen Behandlung nach der Operation getroffen. Die einzigartige Radioluzenz von Kohlefaser unterstützt die postoperative Strahlenplanung und gewährleistet eine optimale Visualisierung und Präzision bei der Bekämpfung von Knochenläsionen. Dieser Ansatz trägt zur Frakturreduktion bei und minimiert gleichzeitig Störungen durch die Strahlentherapie.
Der chirurgische Eingriff beinhaltete das intramedulläre Staben mit einem Kohlefasernagel, wodurch eine erfolgreiche Frakturreduktion und eine optimale Befestigung der Hardware erreicht wurde. Die histopathologische Untersuchung bestätigte ein metastasiertes Lungenadenokarzinom. Postoperativ erhielt der Patient eine palliative Bestrahlung und gezielte Therapie, was eine deutliche Verbesserung bei der Nachbeobachtung nach zwei Monaten zeigte (Abbildung 6).
Der Fall hebt den strategischen Einsatz von Kohlefaserimplantaten zur Behandlung pathologischer Brüche hervor und bietet Vorteile bei der postoperativen Bildgebung, Krankheitsüberwachung und Präzision bei der Planung der Strahlentherapie. Der multidisziplinäre Ansatz unterstreicht die Bedeutung, Nuancen der Implantatauswahl, insbesondere bei metastasierender Knochenerkrankung, zu berücksichtigen, um die Ergebnisse zu optimieren.
Kohlefaserimplantate; pathologischer Bruch; Metastasierte Knochenerkrankung.
Ein Patient präsentierte sich mit einem pathologischen subtrochanteren Oberschenkelbruch auf der rechten Seite, der im Zusammenhang mit einem zunächst nicht diagnostizierten primären Lungenadenokarzinom auftrat. Ihre Krankengeschichte umfasste anhaltende atraumatische Oberschenkel- und Knieschmerzen, die sich zunehmend verschlimmerten, gipfelnd in plötzlicher Zunahme der Schmerzen, Beinschwäche und einem anschließenden Sturz, nachdem ihr Bein auf der Treppe nachgegeben hatte. Bei der Vorstellung in der Notaufnahme wurde die pathologische Natur des Bruchs umgehend festgestellt. Nach einer onkologischen Begutachtung beinhaltete der Behandlungsplan eine offene Reduktion und eine innere Fixierung, wobei aufgrund des unmittelbaren Bedarfs an einer Frakturstabilisierung und den zugrunde liegenden onkologischen Überlegungen ein Kohlenfasernagel eingesetzt wurde.
In diesem Fall lag der Hauptfokus auf der Bruchfixation, einer Aufgabe, die traditionell mit einem Intramedullärgerät durchgeführt wird. Angesichts der pathologischen Natur des Bruchs und des anschließenden Notwendigen einer onkologischen Behandlung nach der Operation wurde jedoch entschieden, einen Kohlefasernagel zu verwenden. Pathologische Brüche, die bei metastasierenden Erkrankungen häufig auftreten, erfordern oft eine postoperative Bestrahlung, um Restkrebszellen zu behandeln und die Heilung des nativen Knochens zu erleichtern. Die Umsetzung der Strahlenbehandlungsplanung, einschließlich CT-Simulationsplanung, wird durch Kohlefaserimplantate erheblich unterstützt, was die Visualisierung und Präzision bei der Gezieltung der Knochenläsion verbessert. Dieser Ansatz zielt darauf ab, das Ziel der Bruchreduktion zu erreichen und gleichzeitig die durch herkömmliche Metallimplantate während der Strahlenplanung verursachten Störungen zu minimieren.
Bei einer geriatrischen weißen Frau wurde eine subtrochanterische pathologische Fraktur festgestellt. Übrigens wurde bei weiterer Untersuchung festgestellt, dass der Patient ein primäres Lungenkarzinom hatte. Der Einsatz eines Kohlefasernagels während der offenen Reduktion und inneren Fixierung stabilisierte nicht nur den Bruch, sondern optimierte auch die Präzision bei der postoperativen Strahlenplanung.
Der Patient bestritt einen Kopfstoß oder Bewusstseinsverlust und zeigte keine Anzeichen von Delirium oder Verwirrung. Die körperliche Untersuchung der rechten unteren Extremität war aufgrund von Schmerzen begrenzt. Ihr rechtes Bein war deutlich verkürzt. Die Untersuchung zeigte Schmerzen und eingeschränkte Kraft im Extensor hallucis longus (EHL), Flexor hallucis longus (FHL), Tibialis anterior (TA) und Gastrocnemius (GS). Distale Pulse, einschließlich dorsalis pedis (DP) und posterioor tibial (PT), waren intakt, und der rechte Fuß zeigte Wärme und ausreichende Durchblutung. Die anschließende Untersuchung der Weichteilverletzung ergab Störungen im oberflächlichen Peroneusnerv (SPN), tiefem Peroneusnerv (DPN), Tibianerv (TN), Saphenusnerv und Suralnerv.
Röntgenaufnahmen der rechten Hüfte und des Oberschenkelknochens bei ihrer ersten Präsentation nach dem Sturz zeigten einen verschobenen subtrochanteren Bruch mit medialer Verschiebung des distalen Fragments. Der Oberschenkelkopf blieb gut im Acetabulum sitzen, und der Rest des Oberschenkelknochens war intakt (Abbildung 1). Degenerative Verengung des Gelenkraums bei marginalen Osteophyten war erkennbar. Eine kontrastverstärkte Computertomographie (CT) des Brustkorbs zeigte eine große Masse des rechten oberen Lappen, die den rechten Hauptbronchus umschloss, was zu einer vollständigen rechten Oberlappenatelectase führte (Abbildung 2). Die Masse war verdächtig wegen einer bösartigen Erkrankung. Mehrere vergrößerte mediastinale und beidseitige hilare Lymphknoten sind für metastasierte Erkrankungen besorgniserregend. Eine nicht-verstärkte CT-Untersuchung des rechten Oberschenkelknochens zeigte unspezifische intrakortikale Lucenzen des femoralen Mittelschafts am unteren Rand des Bruchs. Dieses Ergebnis warf Bedenken hinsichtlich darunterliegender permeativer Läsionen und eines pathologischen Bruchs auf (Abbildung 3). Obwohl die nachfolgende Magnetresonanztomographie (MRT) möglicherweise geholfen hat, das Vorhandensein der zugrundeliegenden knochenartigen Läsionen festzustellen, ist die Beurteilung im akuten Zustand durch Ödem und Blutungen eingeschränkt, was die Entscheidung veranlasst, auf diese Untersuchung zu verzichten.
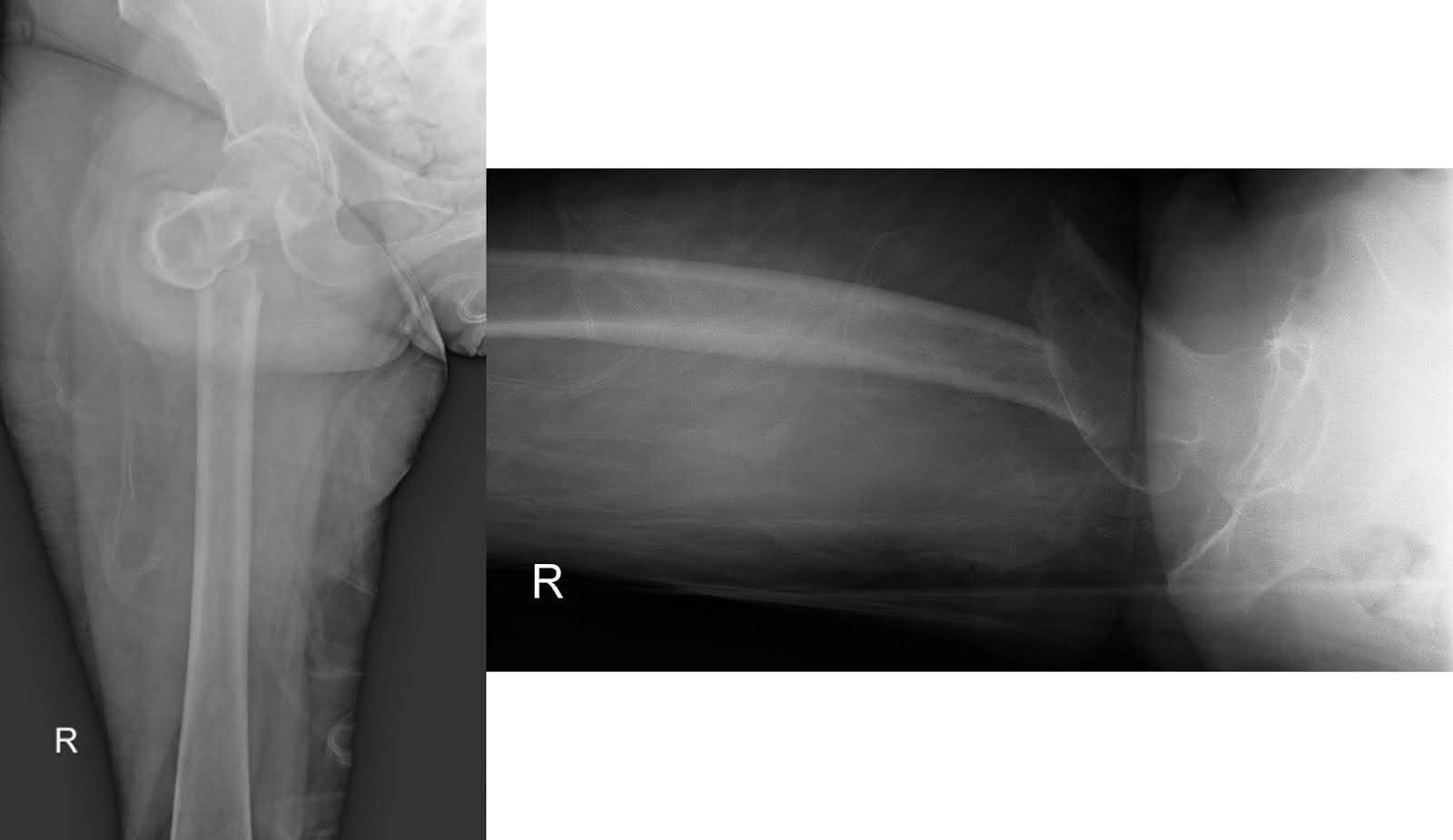
Abbildung 1. AP und laterale Röntgenaufnahmen der rechten Hüfte, die einen verschobenen subtrochanteren Bruch zeigen. Der Oberschenkelkopf erhält die Reduktion im Acetabulum, während der Rest des Oberschenkelknochens strukturell intakt bleibt.
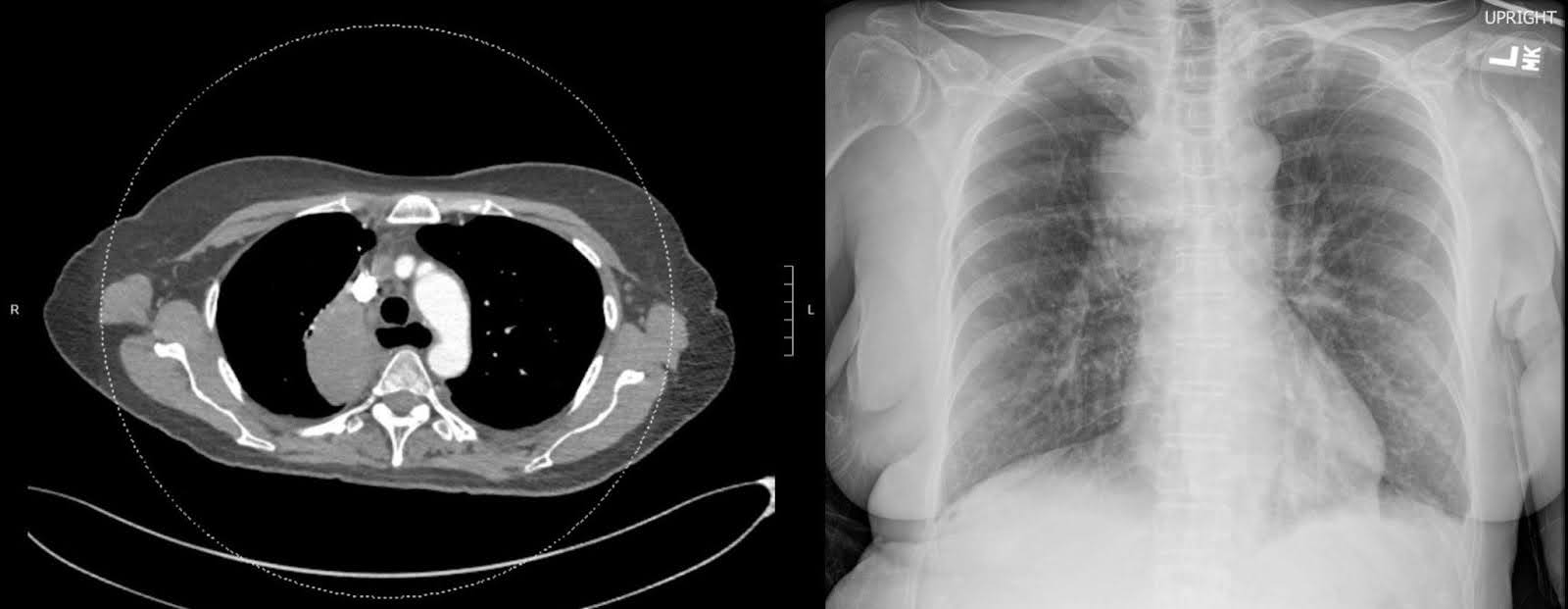
Abbildung 2. Eine heterogen aufblühende Masse, die sich im rechten paramediastinalen Bereich des rechten oberen Lappens befindet, wurde bei einer CT des Thorax mit Kontrast gefunden. Das Vorhandensein dieses Befunds deutet auf die Diagnose eines primären Lungenkrebses hin.
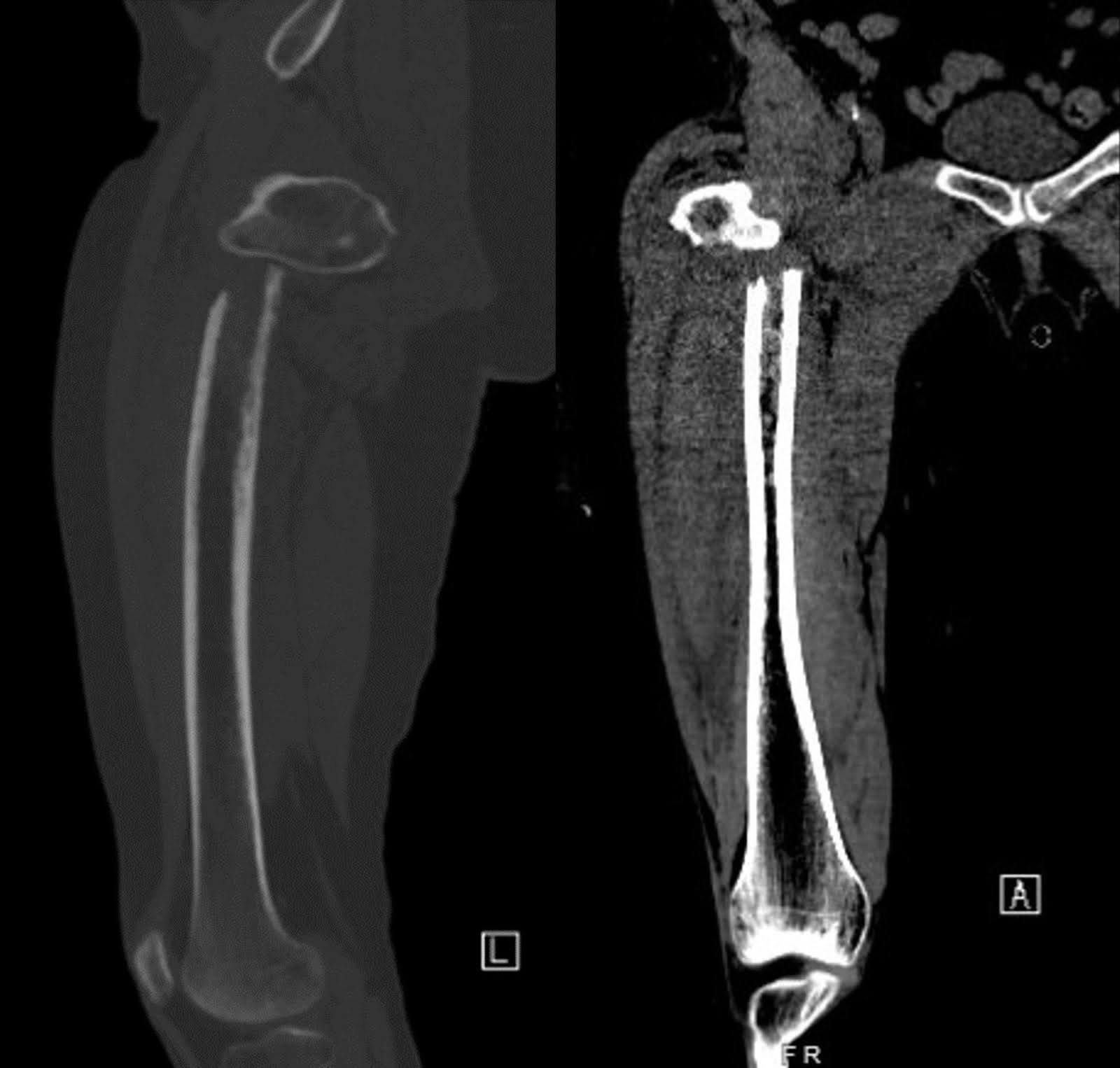 Abbildung 3. Seitliche und AP-nicht-kontrastierte CT-Aufnahmen des rechten Oberschenkelknochens zeigen intrakortikale Lukenzen im Oberschenkelmittelschaft, was auf einen möglichen pathologischen Bruch hindeutet.
Abbildung 3. Seitliche und AP-nicht-kontrastierte CT-Aufnahmen des rechten Oberschenkelknochens zeigen intrakortikale Lukenzen im Oberschenkelmittelschaft, was auf einen möglichen pathologischen Bruch hindeutet.
Pathologische Brüche, die sich von traumatischen Frakturen unterscheiden, treten als Folge einer zugrunde liegenden Erkrankung auf, darunter, aber nicht beschränkt auf, Osteoporose, Krebs, Infektionen oder Stoffwechselstörungen. Diese charakteristische Kategorie von Brüchen ist durch den Einfluss pathologischer Prozesse gekennzeichnet, die die strukturelle Integrität des Knochens beeinträchtigen.1 Pathologische Frakturen können zu erheblicher Morbidität und einem Rückgang der allgemeinen Lebensqualität führen.2 Das Skelettsystem ist nach Lunge und Leber der dritthäufigste Ort für Metastasen.3 Etwa 70 % aller Knochenmetastasen entstehen durch metastasierende Brust- und Prostatakrebs, wobei Lungen-, Nieren- und Schilddrüsentumoren die nächsthäufigsten Ursachen in Bezug auf die Prävalenz sind.4
Patienten mit pathologischen Brüchen können Schmerzen und Schwellungen an der Bruchstelle zeigen, ebenso wie Schwierigkeiten beim Gehen, eingeschränkter Beweglichkeit, Ekkymose, lokales Ödem und sichtbare Verkürzung der Extremitäten.5 Ein klinisches Zeichen für pathologische Brüche liegt in ihrer zugrunde liegenden Ursache, die oft mit minimalem Trauma auftreten – deutlich weniger Kraft als nötig, um einen gesunden Knochen zu brechen.6 Obwohl selten, können pathologische Brüche das Zeichen einer zugrunde liegenden Malignität sein.7 Dies unterstreicht die Notwendigkeit sorgfältiger Untersuchungen und diagnostischer Prüfungen, insbesondere in Fällen mit einer Vorgeschichte begrenzter oder fehlender Traumata.
Ein femoralpathologischer Bruch stellt ähnliche Herausforderungen mit sich wie ein traumatischer Femurbruch, bringt jedoch zusätzliche postoperative Überlegungen mit sich, die die Implantatauswahl beeinflussen. Ähnlich wie bei der Behandlung von Oberschenkelbrüchen in gesunden Knochen ist es entscheidend, eine Frakturreduktion und -stabilisierung zu erreichen. Dies lindert nicht nur Schmerzen und sorgt für Stabilität beim Gang, sondern schafft auch ein biomechanisches Umfeld, das eine optimale Frakturheilung fördert.
Das Management subtrochanterer Frakturen stellt Herausforderungen bei der Reduktion und Fixierung dar, wobei die Reduktion oft perkutane oder offene Techniken erfordert.8 Chirurgische Fixation, eine gut tolerierte Intervention, zeigt vergleichbare funktionelle Ergebnisse wie nicht-pathologische Fixation.9 Aus onkologischer Sicht ist die Behandlung der bösartigen Zellen im Knochen entscheidend für eine wirksame Knochenheilung. Im Behandlungsprogramm nach der Fraktur spielen Chemotherapie und Strahlentherapie eine entscheidende Rolle bei der Erreichung dieses Ziels. Die Strahlentherapie, die typischerweise mit externer Strahltherapie geplant wird, erfordert eine CT-Untersuchung vor der Behandlung für eine genaue Planung. Das Vorhandensein von Metallimplantaten kann jedoch zu Strahlstreuung führen, was die Bildauflösung verringert und die Strahlentherapiepläne beeinträchtigt. Kohlefaserimplantate, denen die radiographischen Eigenschaften von Metallen fehlen, können die Ziele der Frakturenreduktion und -heilung effektiv erfüllen und dabei die für die Strahlentherapie unerlässlichen Adjuvanstherapien minimal beeinträchtigen.10
Der Zweck der Langknochenfixierung nach einem Bruch ist es, eine ordnungsgemäße Heilung zu ermöglichen, die Stabilität wiederherzustellen und die funktionelle Genesung zu fördern. Bei der Erwägung von Behandlungsmöglichkeiten für subtrochantere Femurfrakturen gehören die primären Fixierungsmethoden die Fixierung von Nägeln oder Platten, wobei die aktuelle orthopädische Literatur die Nagelfixierung bevorzugt.8 Bei der Auswahl der Implantatmaterialien ist es unerlässlich, die zugrundeliegende Ätiologie des Bruchs und die Fertigkeit des Chirurgen mit beiden Techniken zu berücksichtigen.
Für Patienten mit pathologischen Brüchen infolge metastasierter Knochenerkrankung können Kohlenstofffasernägel aufgrund ihrer Radioluzenz und günstigen mechanischen Eigenschaften eine bevorzugte Alternative zu Titannägeln sein.11,12 Kohlefaserimplantate verringern die Streuung im CT signifikant und verringern die Anfälligkeitsartefakte im MRT, was eine bessere Visualisierung der Knochenheilung, eine postoperative Überwachung des lokalen Rückfalls oder Fortschreitens der Krankheit sowie eine präzisere Strahlenplanung ermöglicht.10,13,14
Obwohl es mehrere Vorteile der Kohlefaserfixierung gibt, gibt es keine Unterschiede in den funktionalen Ergebnissen und Komplikationsprofilen der Carbonfaser- und Metallfixierung.11,12 Beide Techniken erreichen das Ziel der Frakturstabilisierung und Aufrechterhaltung der Reduktion mit geringem Komplikationsrisiko sowie gut dokumentierter Heilung und Biokompatibilität. Daher sollte der operierende Chirurg seine Kompetenz und sein Wohlbefinden bei jeder Fixationsmethode und jedem Implantattyp im Entscheidungsprozess sorgfältig abwägen.12,15
Bei der Formulierung der Behandlungsstrategie für einen pathologischen subtrochanteren Bruch ist es unerlässlich, sowohl kurz- als auch langfristige Ziele zu berücksichtigen. Kurzfristig zielt die Verwendung eines Kohlefaserimplantats zur Fixierung darauf ab, die Knochenstabilität nach der Bruchreduktion herzustellen. Die Frakturreduktion stellt die Gliedmaßenlänge, die Muskelspannung und die normale anatomische Beziehungen wieder her. Das Aufrechterhalten dieser Reduktion verringert den Schmerz, indem Knochenfragmente angemessen stabilisiert werden.16 Als Lastverteilungsgerät kann das Implantat dem Patienten ermöglichen, sich sofort zu mobilisieren, wodurch das Risiko von venöser Thromboembolie, Bettgeschwüren und schneller Dekonditionierung reduziert wird.17
In der zwischenliegenden postoperativen Phase spielt die durch das Implantat geschaffene Stabilität eine entscheidende Rolle bei der Förderung der Bruchheilung, insbesondere in Kombination mit einer Adjuvanstherapie zur Krebsbehandlung.18 Die Wahl eines Carbonfaserimplantats vereinfacht nicht nur die postoperative radiographische Erkrankungsüberwachung, sondern erhöht auch die Präzision der Planung der Strahlentherapie. Diese strategische Entscheidung trägt zu einer verbesserten Genauigkeit und Wirksamkeit im gesamten Behandlungsansatz bei.19
Kohlenstofffaserimplantate können kontraindiziert für humerale diaphysäre Knochentumoren sein, die eine große segmentale Resektion mit einem kurzen Restknochensegment (5 cm) und einem erheblichen Zementabstand erfordern. Solche Implantate können durch Spannung aufgrund von Biegekräften am distalen Teil des intramedullären Nagels versagen, wo zwischen dem Zementabstandshalter und dem Restknochen ein Elastizitätsmodul besteht. In solchen Szenarien erweisen sich Titan-Intramedullärnägel als bevorzugte Wahl und bieten eine potenzielle Lösung zur Bewältigung der Herausforderungen mit Kohlefaserimplantaten in diesem speziellen Kontext.20
Chirurgen müssen ihre Vertrautheit und ihr Wohlbefinden mit Kohlefaserimplantaten berücksichtigen, angesichts der Lernkurve, die mit diesen Implantaten verbunden ist. Kohlefaserimplantate werden mit längeren operativen und fluoroskopischen Zeiten sowie mit erhöhtem Blutverlust in Verbindung gebracht, insbesondere in der orthopädischen und wirbelsäulenonkologi.12,21 Die Abwägung klinischer Überlegungen und der Kompetenz des Chirurgen ist entscheidend, um die Eignung von Kohlefaserimplantaten in diesem spezialisierten Bereich zu bestimmen.
Der Einsatz von Kohlefaserimplantaten in der Orthopädie erfordert eine gründliche Abwägung mehrerer entscheidender klinischer Faktoren. Trotz vergleichbarer Komplikationen und Ausfallraten wie Titanimplantate fehlt Carbonfaser-Implantaten die intraoperative Flexibilität für Biegen oder Konturierung. Chirurgen müssen eine sorgfältige präoperative Planung durchführen, um eine optimale Passform sicherzustellen.22 Während die Radioluzenz von Kohlefaser für postoperative Bildaufnahmen vorteilhaft ist, kann die intraoperative Bestätigung der Implantatposition Herausforderungen darstellen. Im Gegensatz dazu stören metallische Implantate, obwohl sie keine intraoperative Flexibilität besitzen, oft die Strahlenplanung, und erschweren eine genaue Dosisberechnung und -abgabe.23,24 Darüber hinaus sind Kohlefaserimplantate in Situationen, in denen sich die Krankheit auf das Gelenk ausbreitet und einen Gelenkersatz notwendig macht, möglicherweise nicht die geeignetste Option. Daher erfordert die Entscheidung, Carbonfaser-Implantate zu verwenden, eine differenzierte Einschätzung ihrer Vorteile und Einschränkungen in spezifischen klinischen Kontexten.
Eine intramedulläre Rodierung des rechten Oberschenkelknochens wurde zur operativen Fixierung der Läsion durchgeführt, zusätzlich zu einer offenen Biopsie zur Bestimmung der Ätiologie der metastasierenden Knochenerkrankung. Bildgebende Untersuchungen zufolge handelte es sich um einen primären Lungenkrebs mit Metastasen auf den Knochen. Der Patient wurde mit Hilfe eines Sitzsacks in einen lateralen Dekubitus gelegt. Alle knochigen Vorsprünge waren ausreichend gepolstert. Die Platzierung einer subaxillären Rolle und das Abladen des linken Peroneusnervs erfolgten.
Es wurde ein seitlicher Schnitt am proximalen Oberschenkel gemacht, und anschließend wurde ein Subvastus-Ansatz durchgeführt, um die Bruchstelle freizulegen. Ein Kobra-Retraktor ermöglichte die Exposition nach der Identifikation der Bruchstelle. Permanente und eingefrorene Pathologieproben wurden mit Curetten entnommen. Die eingefrorene Pathologie bestätigte metastasiertes Lungenadenokarzinom. Es wurde eine aggressive Debridement der Tumorläsion sowohl innerhalb als auch außerhalb des Knochens durchgeführt. Es wurde umfangreiche Bewässerung des Operationsfeldes mit Peroxidlösung durchgeführt.
Mit frischen Handschuhen und einem neuen Set von Instrumenten wurde ein anschließender Schnitt näher an der ursprünglichen Stelle gemacht, um Zugang zum proximalen Oberschenkelknochen zu erhalten. Die Faszie des Gluteus medius wurde längs eingeschnitten, um die Spitze der großen Tuberosität zu identifizieren. Ein 3,2-mm-Führungsdraht markierte den Ausgangspunkt und sicherte eine ausgezeichnete Position sowohl in der anteroposterioren (AP) als auch in der seitlichen Ansicht. Das Halten des Oberschenkelknochens in neutraler Position wurde durch einen Shantz-Pin erleichtert, der die Innenrotation und Adduktion des proximalen Femoralfragments unterstützte.
Das stark gebogene Fragment wurde zusätzlich positioniert, um eine Ausstreckung zu gewährleisten. Ein Fingerreduktionswerkzeug, gestützt von zwei Shantz-Pins im proximalen Oberschenkelknochen und am Oberschenkelschaft, wurde verwendet, um eine anatomische Reduktion des Bruchs zu erreichen. Mit reduzierter Fraktur wurde der Opening Reamer verwendet, um die Bahn im proximalen Oberschenkelknochen zu öffnen. Indem wir einen kugelspitzigen Führungsdraht vorrückten, hielten wir die Reduktion fort und bestätigten die ausgezeichnete Position des Drahtes im distalen Oberschenkelknochen. Ein 360-mm-Kohlefasernagel mit einem Durchmesser von 11 mm wurde gemessen. Wir haben nacheinander auf Größe 12,5 mm geschnitten und mit einem Röhrenaustauscher sanft den Kugelspitzen-Führungsdraht entfernt und den glatten Draht eingesetzt. Der Femurnagel aus Kohlefaser wurde traditionell über den glatten Draht eingeführt, wobei der Zielarm nach vorne positioniert war und der Zielarm beim Vorschieben des Nagels außen rotierte. Der Stab wird auf seine endgültige Position getippt, bis der obere Teil des Stabs vom proximalen Oberschenkelknochen bedeckt ist.
Wir manipulierten das Weichgewebe und nutzten den Schnitt von der Biopsie, um den Dreifach-Trochar durch den Zielarm einzuführen. Dann führten wir durch den Oberschenkeldraht die Bahn im Oberschenkelhals für die Hüftschraube ein. Bei der Fluoroskopie wurde die richtige Position bestätigt. Eine Länge von 95 mm wurde erreicht. Das Instrument für die Hüftschraube wurde ohne Schwierigkeiten befestigt, zunächst wurde der Weg angeklopft, dann die Schraube entlang der markierten Bahn im Oberschenkelhals eingesetzt und anschließend mit der Einstellschraube gesichert.
Mit perfekter AP der rechten Hüfte und des Knies wurde der distale Teil des Nagels mit zwei 5,0-mm-Titanschrauben von 40 bzw. 40,5 mm Länge gesichert (Abbildung 4). Endgültige Bilder bestätigten eine erfolgreiche Reduktion des Bruchs und die optimale Positionierung der Hardware (Abbildung 5). Es wurde umfangreiche Bewässerung durchgeführt, gefolgt von Schicht-für-Schicht-Schließung. Während des Falls gab es keine Komplikationen. Die Behandlungsdauer betrug 121 Minuten mit einem geschätzten Blutverlust von 250 ml.
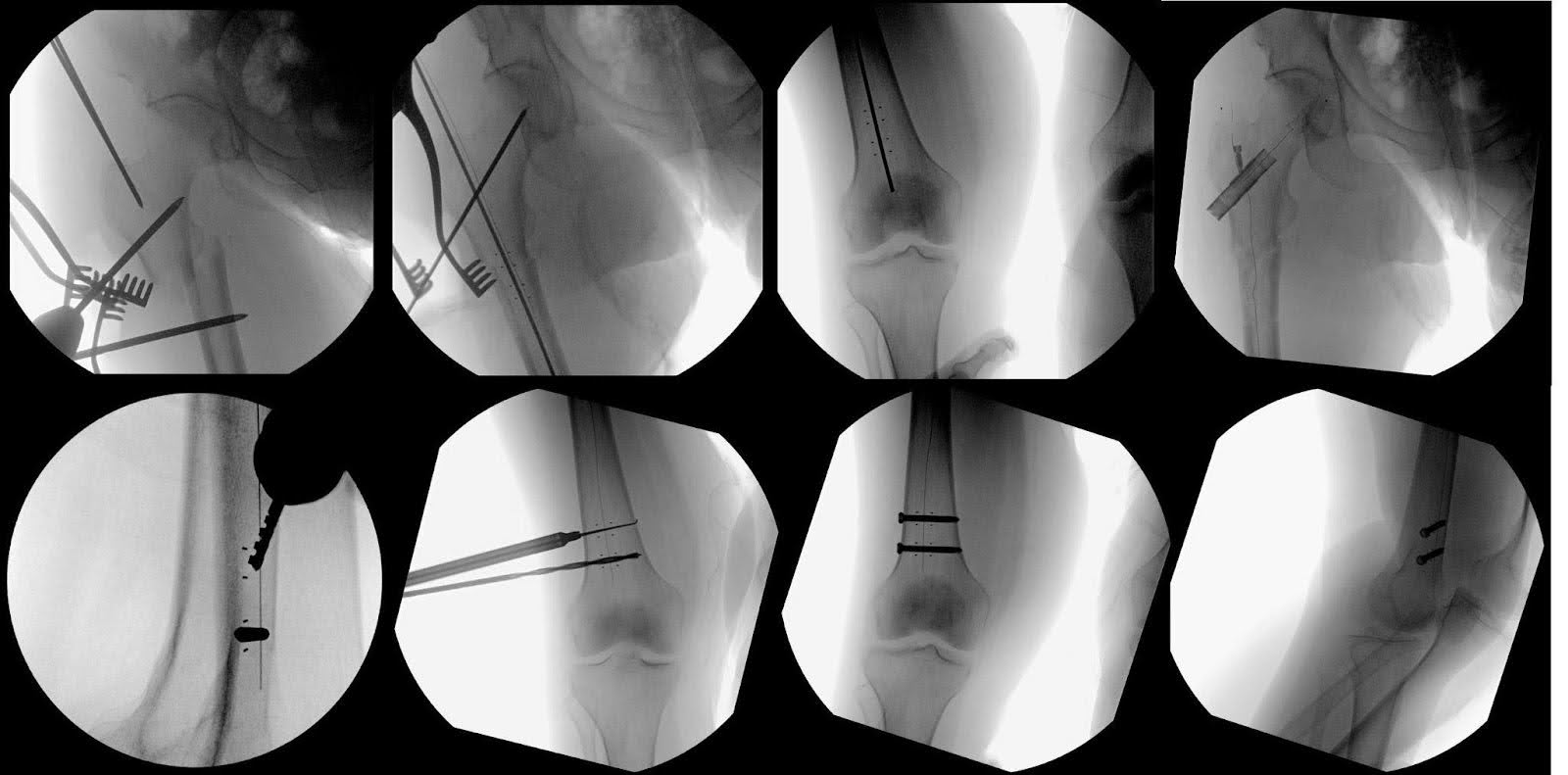
Abbildung 4. Die Fluoroskopie-Bildgebung wurde verwendet, um die verschiedenen chirurgischen Schritte bei der Behandlung des Oberschenkelbruchs zu demonstrieren. Dazu gehörte die Darstellung des Ausgangspunkts und der Reduktion des Bruchs mit Shantz-Pins. Zusätzliche Bilder wurden verwendet, um den Kohlefasernagel, die Hüftschraube aus Carbonfaser und zwei Titan-Schrauben zu zeigen, die die Stabilität des Nagels gewährleisten sollten. Radio-undurchsichtige Marker halfen dabei, diese Öffnungen sichtbar zu machen, die sowohl von AP- als auch von Seitenansichten aus beobachtbar waren. Bemerkenswert ist, dass die Führungen für diese Eintrittslöcher von den üblichen runden Führungen abweichen, die typischerweise bei der Fluoroskopie von Titannägeln sichtbar sind.
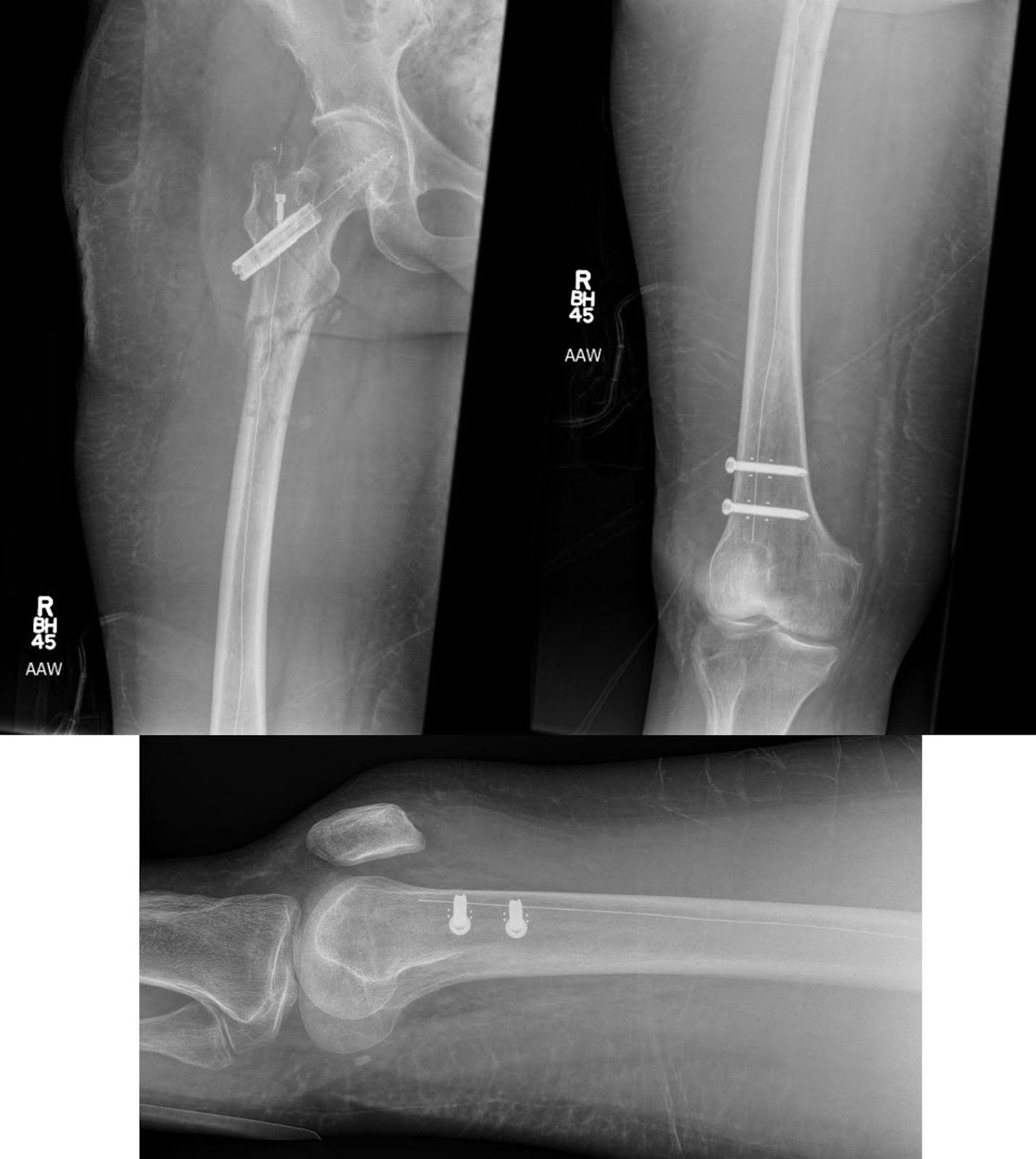
Abbildung 5. Ein AP-Röntgenbild des Oberschenkelknochens und ein laterales Röntgenbild des Knies nach der intramedullären Stabfixation der Kohlenstofffaser bei einer pathologischen subtrochanteren Fraktur des rechten Oberschenkelknochens zeigen eine verbesserte Ausrichtung ohne Anzeichen von Hardwarekomplikationen. Das Unterschenkel zeigt keine weiteren verdächtigen lytischen Läsionen, und es gibt keine Hinweise auf neue Brüche.
Zusätzlich zur operativen Fixierung wurde eine offene Biopsie des rechten proximalen Oberschenkelknochens durchgeführt, und eine 5,5x5,5x2,5 cm große Probe, bestehend aus staubigen rosa-roten Weichteilfragmenten, wurde zur histopathologischen Begutachtung durch einen Facharzt ausgebildeten Knochen- und Weichteilpathologen geschickt. Eine Immunfärbung für PD-L1 wurde auf einem repräsentativen Gewebeblock durchgeführt und zeigte >100 Tumorzellen zur Punktung. PD-L1 zeigte eine membranöse Färbung starker Intensität in >95 % der Tumorzellen (Tumoranteilswert, oder TPS, >95 %).25 Immunhistochemie zeigte Tumorzellen, die positiv auf TTF-1 und Napsin-A sowie negativ auf p40 waren. Angesichts dieser Befunde lautet die endgültige pathologische Diagnose der rechten proximalen Oberschenkelschnittläsion ein metastasiertes Karzinom, das mit dem primären Lungenkarzinom übereinstimmt.26–28
Einen Monat nach der Operation erhielt der Patient 20 Gy palliative Bestrahlung in fünf Fraktionen an der rechten Hüfte. Im Zusammenhang mit metastasierter Knochenerkrankung mildert die Strahlentherapie die Osteoklastenaktivierung, tötet Tumorzellen ab und lindert Knochenschmerzen durch die Entstehung einer Ossifikation.29 Gleichzeitig begann die medizinische Onkologie mit Capmatinib, einer gezielten Therapie zur Behandlung metastasierter nicht-kleinzelliger Lungenkrebs. Bei der zweimonatigen Nachsorge zeigte der Patient eine deutliche Verbesserung und konnte sich ohne Rollator bewegen. Ihre Knie waren stabil gegenüber Valgus- und Varus-Belastung bei vollständiger Dehnung und 30° Beugung. Hüftbeugung, Dehnung, Innenrotation und Außenrotation lagen innerhalb der normalen Grenzen. Sechs Wochen nach Beginn von Capmatinib sprach der Patient gut auf die Behandlung an. Ein CT des Thorax zeigte eine verringerte Masse im rechten oberen Lappen und eine verringerte bilaterale mediastinale und hilare lymphadenopathie. Bei ihrer jüngsten Nachuntersuchung zeigte ihr Funktionszustand keine signifikanten Veränderungen ohne erkennbare Hardwareänderungen, und sie erhält weiterhin Capmatinib, das sich häufig röntgentechnisch überwacht (Abbildung 7).
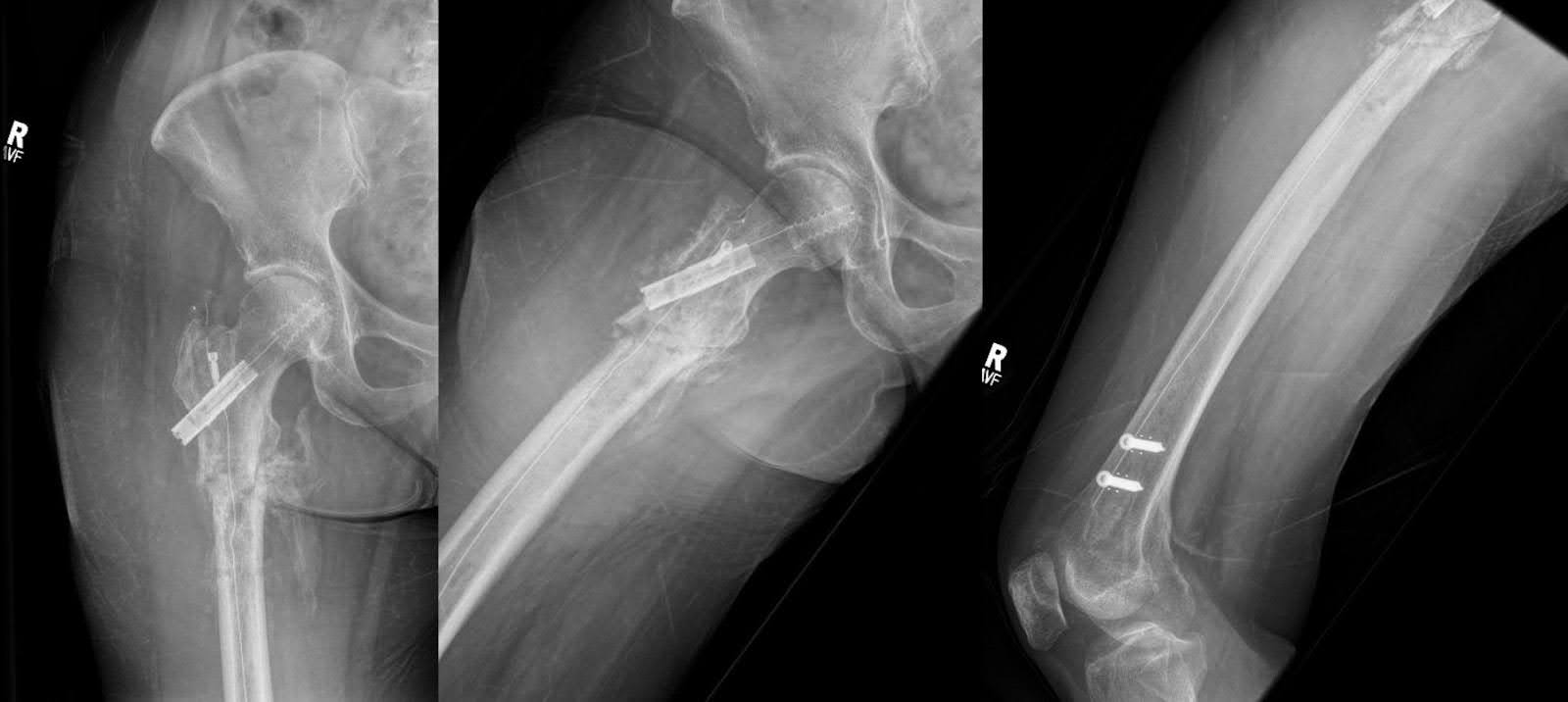
Abbildung 6. AP- und laterale Röntgenaufnahmen des Oberschenkelknochens sowie ein laterales Röntgenbild des Knies zwei Monate nach der Fixierung zeigen eine neue Schwielbildung und Knochenbrückenbildung, wobei die ursprüngliche Ausrichtung erhalten bleibt. Es sind keine neuen Brüche vorhanden, aber leichte degenerative Veränderungen wurden in der rechten Hüfte beobachtet.
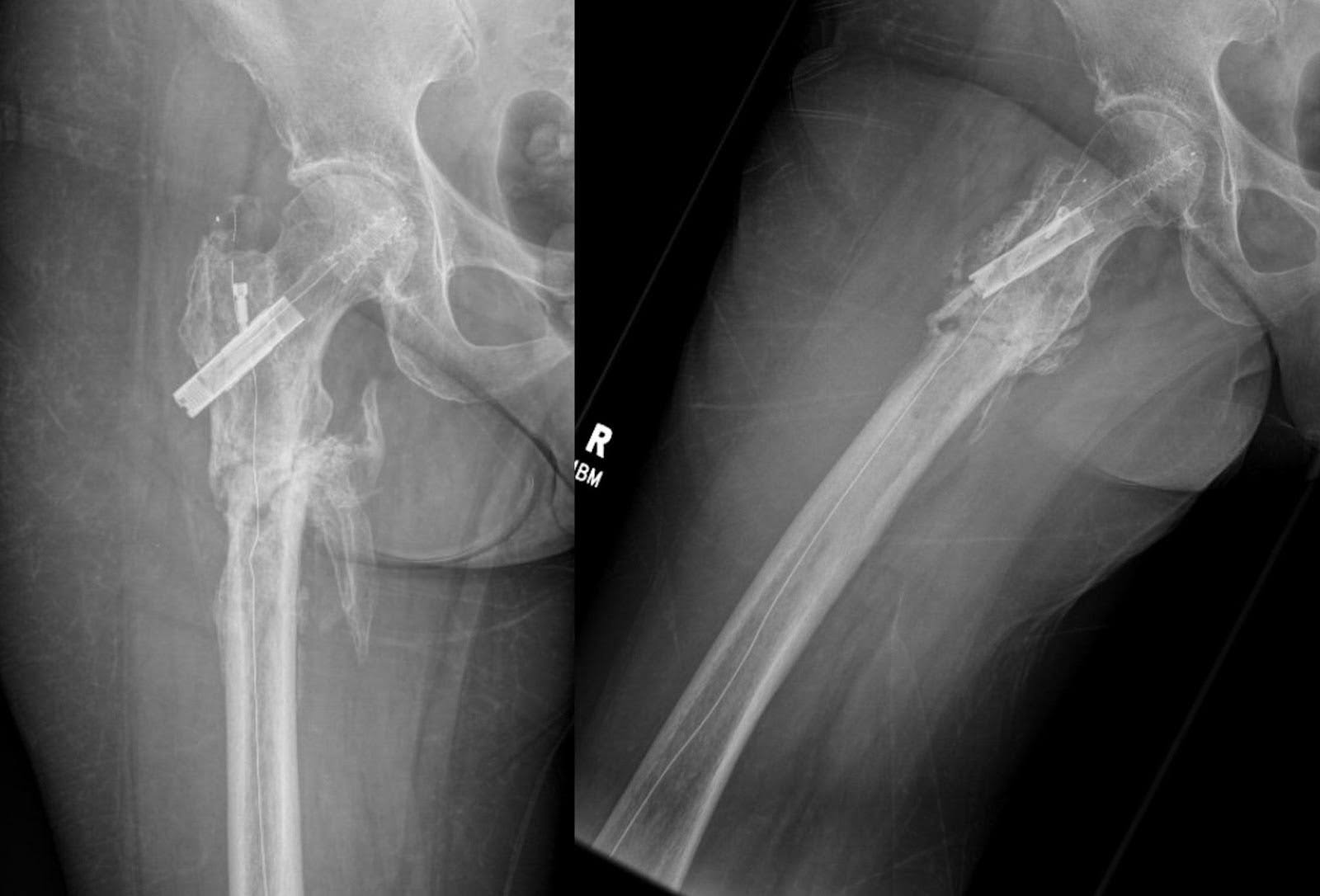
Abbildung 7. Sechs Monate nach der Fixierung zeigen AP- und laterale Oberschenkel-Röntgenaufnahmen eine fortgesetzte Kallusbildung und umfangreiche Knochenbrückenbildung, wodurch die anfängliche Ausrichtung erhalten bleibt. Der Bruch zeigt Anzeichen unvollständiger Heilung sowie heterotopische Knochenbildung. Es gibt keine erkennbaren Hardwarekomplikationen oder Anzeichen neuer Brüche. Darüber hinaus bestehen analoge degenerative Veränderungen in der rechten Hüfte fort.
Metastasen spielen eine bedeutende Rolle bei der Morbidität und Sterblichkeit, die mit Krebs verbunden sind.30 Lungenkrebs, das zweithäufigste Karzinom bei Männern bzw. Frauen, zeigt eine Präferenz für Metastasen im Gehirn, in den Knochen und den Nebennieren.31,32 Metastasierte Knochenerkrankungen verursachen nicht nur lähmende Schmerzen bei Patienten, sondern verursachen auch eine erhebliche finanzielle Belastung. Die aktuelle Schätzung von 250.000 Patienten in den Vereinigten Staaten, die mit dieser Erkrankung zu kämpfen haben, entspricht jährlichen Gesundheitskosten von 12 Milliarden US-Dollar.33,34 Fortschritte in den Behandlungen, die die Überlebensraten bei Krebs verbesserten, haben folglich zu einer höheren Inzidenz metastasierender Knochenerkrankungen geführt. Pathologische Brüche, die durch diese Erkrankung entstehen, resultieren aus zahlreichen Läsionen, die eine Größe erreichen, die die strukturelle Integrität des Knochens gefährden und letztlich in Brüchen gipfeln.35 Um das langfristige Überleben und die Lebensqualität der Patienten zu verbessern, ist es entscheidend, geeignete Behandlungsmethoden im Krankheitsmanagement strategisch zu priorisieren.36
Da dieser Patient vor dem Oberschenkelbruch keine onkologische Diagnose hatte, ist es wichtig, die wichtigsten Punkte hervorzuheben, die helfen, gefährdete Knochenläsionen vor dem Bruch zu erkennen. Der Patient berichtete von mehreren Monaten Schmerzen in der Hüfte vor dem Bruch, was oft der erste klinische Befund eines viszeralen Karzinoms sein kann. Kluge Anamnese und körperliche Untersuchungen, die keine Erklärung für Schmerzen zeigen, insbesondere funktionelle Schmerzen, sollten untersucht werden. Die geeignetste Untersuchungsmethode sind einfache Röntgenaufnahmen des gesamten Knochens in der betroffenen Extremität, um sicherzustellen, dass der gezeigte Schmerz kein klinischer Faktor ist.
Nachdem der Bruch angemessen behandelt wurde und der Patient die unmittelbare postoperative Phase überstanden hat, muss sich die Aufmerksamkeit auf die zugrunde liegende Erkrankung richten, was einen multidisziplinären Ansatz mit medizinischer und strahlentherapeutischer Onkologie erforderlich macht. Die medizinische Onkologie bietet systemische Behandlung sowohl für den primären Krebs als auch für seine metastasierten Läsionen. Die Strahlenonkologie erfüllt eine entscheidende Funktion in der lokalen Behandlung innerhalb der subakuten postoperativen Phase, indem sie gezielt disseminierte Krebszellen gezielt anspricht, um den wesentlichen Knochenheilungsprozess zu erleichtern. Obwohl Fallserien eine geringere Krankheitsprogression nach der Stabilisierung der Medullärnnägel melden, steigt das Risiko eines Hardwareversagens mit dem Überleben des Patienten.37,38 Kohlefaserimplantate können die Krankheitsüberwachung und Knochenheilung verbessern, wenn sie mit fortschrittlichen Bildgebungstechniken verwendet werden.12 Studien, die patientenberichtete Ergebnisse und Kostenwirksamkeit von Kohlefaserimplantaten im Vergleich zu Titan untersuchen, könnten die klinische Akzeptanz verbessern.
Es wird keine spezielle Ausrüstung über das Kohlefaserimplantat hinaus verwendet.
Der korrespondierende Autor ist bezahlter Redner und Berater für CarboFix Orthopaedics Ltd.
Der in diesem Videoartikel erwähnte Patient hat seine informierte Zustimmung zur Aufnahme gegeben und weiß, dass Informationen und Bilder online veröffentlicht werden.
Animation wurde nach der Veröffentlichung am 03.10.2025 hinzugefügt. Am Artikelinhalt wurden keine Änderungen vorgenommen.
References
- Haase SC. Behandlung von pathologischen Frakturen. Hand Clin. 2013; 29(4):579-584. doi:10.1016/j.hcl.2013.08.010.
- Coleman RE. Klinische Merkmale der metastasierten Knochenerkrankung und Risiko einer Skelettmorbidität. Clin Cancer Res. 2006; 12(20 Teil 2):6243s-6249s. doi:10.1158/1078-0432.CCR-06-0931.
- Hage WD, Aboulafia AJ, Aboulafia DM. Inzidenz, Lokalisation und diagnostische Bewertung der metastasierten Knochenerkrankung. Orthop Clin North Am. 2000; 31(4):515-528, vii. doi:10.1016/s0030-5898(05)70171-1.
- Christ AB, Piple AS, Gettleman BS et al. Prävalenz primärer maligner Tumoren, Raten pathologischer Frakturen und Mortalität im Rahmen metastasierender Knochenerkrankungen. Knochen Jt Offen. 2023; 4(6):424-431. doi:10.1302/2633-1462.46.BJO-2023-0042. R1.
- Johnson SK, Knobf MT. Chirurgische Eingriffe bei Krebspatienten mit drohenden oder tatsächlichen pathologischen Frakturen. Orthop-Krankenschwestern. 2008; 27(3):160-171; Quiz 172-173. doi:10.1097/01.NOR.0000320543.90115.d5.
- De Mattos CBR, Binitie O, Dormans JP. Pathologische Frakturen bei Kindern. Knochengelenk Res. 2012; 1(10):272-280. doi:10.1302/2046-3758.110.2000120.
- Kim LD, Bueno FT, Yonamine ES, Próspero JD de, Pozzan G. Knochenmetastasen als erstes Symptom von Tumoren: Rolle einer immunhistochemischen Studie bei der Etablierung des Primärtumors. Pfarrer Bras Ortop (São Paulo). 2018; 53(4):467-471. doi:10.1016/j.rboe.2018.05.015.
- Yoon RS, Donegan DJ, Liporace FA. Reduzierung von subtrochantären Femurfrakturen: Tipps und Tricks, Do's und Don'ts. J Orthop-Trauma. 2015; 29 Suppl 4:S28-33. doi:10.1097/BOT.0000000000000287.
- Weiss RJ, Ekström W, Hansen BH et al. Pathologische subtrochantäre Frakturen bei 194 Patienten: ein Vergleich des Ergebnisses nach chirurgischer Behandlung pathologischer und nicht-pathologischer Frakturen. J Surg Oncol. 2013; 107(5):498-504. doi:10.1002/jso.23277.
- Depauw N, Pursley J, Lozano-Calderon SA, Patel CG. Evaluierung von chirurgischen Implantaten aus Kohlefaser und Titan für die Protonen- und Photonentherapie. Prakt Radiat Oncol. 2023; 13(3):256-262. doi:10.1016/j.prro.2023.01.009.
- Lozano-Calderon SA, Rijs Z, Groot OQ, et al. Ergebnisse von langen Knochen, die mit Kohlefasernägeln für onkologische Indikationen behandelt wurden: internationale multiinstitutionelle Studie. J Am Acad Orthop Surg. 2024; 32(3):e134-e145. doi:10.5435/JAAOS-D-22-01159.
- Yeung CM, Bhashyam AR, Groot OQ, et al. Vergleich von Marknägeln aus Kohlefaser und Titan in der orthopädischen Onkologie. Knochen Jt Offen. 2022; 3(8):648-655. doi:10.1302/2633-1462.38.BJO-2022-0092. R1.
- Ernstberger T, Heidrich G, Brüning T, Krefft S, Buchhorn G, Klinger HM. Die interobserver-validierte Relevanz von intervertebralen Spacermaterialien bei der MRT-Artefaktierung. Eur Spine J. 2007; 16(2):179-185. doi:10.1007/s00586-006-0064-5.
- Alvarez-Breckenridge C, de Almeida R, Haider A, et al. Kohlefaserverstärkte Polyetheretherketon-Wirbelsäulenimplantate zur Behandlung von Wirbelsäulentumoren: wahrgenommene Vorteile und Einschränkungen. Neurospine. 2023; 20(1):317-326. doi:10.14245/ns.2244920.460.
- Clunk MJ, Gonzalez MR, Denwood HM, et al. Ein PEEK aus Kohlefaser: ein praktischer Leitfaden für Hochleistungs-Komposit-Polymerimplantate für die orthopädische Onkologie. J Orthop. 2023;45:13-18. doi:10.1016/j.jor.2023.09.011.
- Manglani HH, Marco RA, Picciolo A, Healey JH. Orthopädische Notfälle bei Krebspatienten. Semin Oncol. 2000; 27(3):299-310.
- Booth K, Rivet J, Flici R, et al. Progressives Mobilitätsprotokoll reduziert die Rate venöser Thromboembolien bei Trauma-Intensivpatienten: ein Projekt zur Qualitätsverbesserung. J Trauma-Krankenschwestern. 2016; 23(5):284-289. doi:10.1097/JTN.0000000000000234.
- Colyer RA. Chirurgische Stabilisierung pathologischer neoplastischer Frakturen. Curr Probl Krebs. 1986; 10(3):117-168. doi:10.1016/s0147-0272(86)80005-8.
- Xin-ye N, Xiao-bin T, Chang-ran G, Da C. Die Aussicht auf Kohlefaserimplantate in der Strahlentherapie. J Appl Clin Med Phys. 2012; 13(4):3821. doi:10.1120/jacmp.v13i4.3821.
- Bhashyam AR, Yeung C, Sodhi A, et al. Titan- vs. kohlenstofffaserverstärkte intramedulläre Nagelung bei Humerusknochentumoren. J Schulter Ellenbogen Chirurgie 2023; 32(11):2286-2295. doi:10.1016/j.jse.2023.04.023.
- Cofano F, Di Perna G, Monticelli M, et al. Kohlefaserverstärkte vs. Titanimplantate zur Fixierung bei Wirbelsäulenmetastasen: eine vergleichende klinische Studie zur Sicherheit und Wirksamkeit der neuen "Carbon-Strategie". J Clin Neurosci. 2020;75:106-111. doi:10.1016/j.jocn.2020.03.013.
- Yeung CM, Bhashyam AR, Patel SS, Ortiz-Cruz E, Lozano-Calderón SA. Kohlefaserimplantate in der orthopädischen Onkologie. J Clin Med. 2022; 11(17). doi:10.3390/jcm11174959.
- Tedesco G, Gasbarrini A, Bandiera S, Ghermandi R, Boriani S. Komposit-PEEK/Kohlefaser-Implantate können die Wirksamkeit der Strahlentherapie bei der Behandlung von Wirbelsäulentumoren erhöhen. J Wirbelsäule Chirurgie. 2017; 3(3):323-329. doi:10.21037/jss.2017.06.20.
- Nevelsky A, Borzov E, Daniel S, Bar-Deroma R. Störungseffekte der Kohlefaser-PEEK-Schrauben auf die Dosisverteilung der Strahlentherapie. J Appl Clin Med Phys. 2017; 18(2):62-68. doi:10.1002/acm2.12046.
- Keppens C, Dequeker EM, Pauwels P, Ryska A, 't Hart N, von der Thüsen JH. PD-L1-Immunhistochemie bei nicht-kleinzelligem Lungenkrebs: Unterschiede in der Färbekonkordanz und -interpretation aufklären. Virchows Arch. 2021; 478(5):827-839. doi:10.1007/s00428-020-02976-5.
- Yatabe Y, Mitsudomi T, Takahashi T. TTF-1-Expression bei pulmonalen Adenokarzinomen. Am J Surg Pathol. 2002; 26(6):767-773. doi:10.1097/00000478-200206000-00010.
- Zhang P, Han YP, Huang L, Li Q, Ma DL. Wert von Napsin A und Schilddrüsentranskriptionsfaktor-1 bei der Identifizierung des primären Lungenadenokarzinoms. Oncol Lett. 2010; 1(5):899-903. doi:10.3892/ol_00000160.
- Affandi KA, Tizen NMS, Mustangin M, Zin RRMRM. Die Immunhistochemie von p40 ist ein ausgezeichneter Marker für das primäre Plattenepithelkarzinom der Lunge. J Pathol Transl Med. 2018; 52(5):283-289. doi:10.4132/jptm.2018.08.14.
- De Felice F, Piccioli A, Musio D, Tombolini V. Die Rolle der Strahlentherapie bei der Behandlung von Knochenmetastasen. Oncotarget. 2017; 8(15):25691-25699. doi:10.18632/oncotarget.14823.
- Nooh A, Goulding K, Isler MH et al. Frühe Verbesserung der Schmerzen und des funktionellen Ergebnisses, aber nicht der Lebensqualität nach der Operation bei metastasierender Erkrankung der langen Knochen. Clin Orthop Relat Res. 2018; 476(3):535-545. doi:10.1007/s11999.000000000000065.
- Siegel RL, Miller KD, Wagle NS, Jemal A. Krebsstatistik, 2023. CA Krebs J Clin. 2023; 73(1):17-48. doi:10.3322/caac.21763.
- Popper HH. Fortschreiten und Metastasierung von Lungenkrebs. Krebsmetastasierung Rev. 2016; 35(1):75-91. doi:10.1007/s10555-016-9618-0.
- Guy GP, Ekwueme DU, Yabroff KR et al. Wirtschaftliche Belastung durch Krebsüberleben bei Erwachsenen in den Vereinigten Staaten. J Clin Oncol. 2013; 31(30):3749-3757. doi:10.1200/JCO.2013.49.1241.
- Li S, Peng Y, Weinhandl ED, et al. Geschätzte Anzahl der prävalenten Fälle von metastasierender Knochenerkrankung in der erwachsenen US-Bevölkerung. Clin Epidemiol. 2012;4:87-93. doi:10.2147/CLEP. Nr. S28339.
- Blank AT, Lerman DM, Patel NM, Rapp TB. Ist ein prophylaktischer Eingriff kostengünstiger als die Behandlung von pathologischen Frakturen bei metastasierten Knochenerkrankungen? Clin Orthop Relat Res. 2016; 474(7):1563-1570. doi:10.1007/s11999-016-4739-x.
- Gutowski CJ, Zmistowski B, Fabbri N, Boland PJ, Healey JH. Sollte die Verwendung von biologischen Wirkstoffen bei Patienten mit Nieren- und Lungenkrebs unsere chirurgische Behandlung von Femurmetastasen beeinflussen? Clin Orthop Relat Res. 2019; 477(4):707-714. doi:10.1097/CORR.000000000000434.
- Miller BJ, Soni EEC, Gibbs CP, Scarborough MT. Marknägel bei Metastasen langer Knochen: Warum versagen sie? Orthopädie. 2011; 34(4). doi:10.3928/01477447-20110228-12.
- Arpornsuksant P, Morris CD, Forsberg JA, Levin AS. Welche Faktoren sind mit dem Fortschreiten der lokalen metastasierten Läsion nach intramedullärer Nagelstabilisierung verbunden? Clin Orthop Relat res. 2022; 480(5):932-945. doi:10.1097/CORR.000000000002104.
Cite this article
Rizk PA, Werenski JO, Lozano-Calderon SA. Kohlefaserimplantat zur Fixierung einer pathologischen subtrochantären Fraktur. J Med Insight. 2024; 2024(443). doi:10.24296/jomi/443.



