El uso de clavos fotodinámicos para el refuerzo óseo en combinación con la artroplastia total compleja de cadera en el contexto de la osteítis por radiación
Main Text
Table of Contents
Presentamos un caso de linfoma difuso de células B grandes (DLBCL) con afectación esquelética en un varón geriátrico. Inicialmente presentando dolor en la cadera izquierda, el paciente fue diagnosticado de DLBCL que afectaba el acetábulo izquierdo. El tratamiento posterior con radioterapia sistémica y radioterapia dio lugar a osteítis por radiación, osteoartritis y colapso acetabular, que requirió intervención quirúrgica.
El plan de tratamiento incluyó artroplastia total de cadera (THA) con clavos intramedulares fotodinámicos (PDN) para la estabilización pélvica, aumentada con aumentos de tantalio para mejorar el soporte. Las PDN proporcionaron estabilidad estructural al tiempo que minimizaron la interferencia con futuras intervenciones oncológicas. El procedimiento quirúrgico consistió en la inserción meticulosa de PDNs y la colocación de aumentos de tantalio, logrando una estabilidad y alineación óptimas del componente acetabular.
Este caso subraya el uso estratégico de las PDN y los aumentos de tantalio para el tratamiento de defectos acetabulares importantes en pacientes con patologías complejas que requieren THA para la estabilización pélvica. Estas técnicas proporcionan ventajas en el seguimiento radiográfico posoperatorio de la enfermedad y precisión en la planificación de la radioterapia. El enfoque multidisciplinario enfatiza la importancia de seleccionar cuidadosamente los implantes apropiados para optimizar los resultados en oncología ortopédica.
Estabilización pélvica; uñas fotodinámicas; osteítis por radiación; Artroplastia total compleja de cadera.
El tratamiento del linfoma difuso de células B grandes (DLBCL) con compromiso esquelético exige un enfoque matizado, que tenga en cuenta la interacción de la progresión de la enfermedad, la ubicación de la lesión, las características del paciente y las opciones de tratamiento. Si bien el paradigma de tratamiento ha evolucionado hacia el tratamiento no quirúrgico, que abarca la quimioterapia sistémica avanzada y la radioterapia, los posibles efectos secundarios de estas terapias ameritan una consideración cuidadosa, en particular si se considera una mejor supervivencia del paciente. Los pacientes con lesiones acetabulares y/o osteoítis por radiación presentan desafíos únicos, ya que los pacientes mayores y comórbidos con integridad ósea comprometida pueden no ser adecuados para la ATC aislada. Por lo tanto, son muy deseables estrategias menos invasivas que ofrezcan estabilidad estructural y restauración de la biomecánica, como la colocación percutánea de clavos intramedulares fotodinámicos para la estabilización pélvica de forma aislada o antes de ATC compleja. La estabilización con balones fotodinámicos no excluye la artroplastia o reconstrucción futura.
Un varón blanco geriátrico presentó una queja de dolor de cadera, que, tras la biopsia, reveló DLBCL del acetábulo izquierdo. Se sometió a terapia sistémica y radioterapia para el linfoma, mostrando una respuesta favorable. Sin embargo, las imágenes posteriores indicaron una pérdida de la integridad acetabular y una migración superior de la cabeza femoral dentro de la columna anterior, atribuida a la osteítis inducida por la radiación. Después de completar la terapia sistémica y la radioterapia, se planificó la cirugía para tratar la osteítis por radiación y la discrepancia resultante en la longitud de las piernas. Se utilizó la aplicación percutánea de PDN para aumentar la estabilidad de la THA, incorporando aumentos de tantalio para mejorar el soporte.
El examen musculoesquelético de las extremidades inferiores seis meses antes de la intervención quirúrgica reveló una marcha normal pero ligeramente antálgica, especialmente a largas distancias. Después de caminar alrededor de 100 a 150 yardas, el paciente experimentó dolor bilateral en la cadera, que fue más severo en la cadera izquierda. La palpación no reveló edema ni sensibilidad. El rango de movimiento se restringió en ambas caderas con una disminución de la rotación interna de la cadera izquierda, que midió aproximadamente de 10 a 15 grados, mientras que la rotación externa se mantuvo a 45 grados bilateralmente. No hubo restricciones en la flexión de la cadera, la flexión y extensión de la rodilla o la flexión y extensión del tobillo. Desde el punto de vista neurológico, el paciente mostró una fuerza muscular y una sensibilidad normales en los miotomas y dermatomas L1-S2, respectivamente, sin que se observaran déficits. El entumecimiento en la planta de los pies se atribuyó al efecto de la quimioterapia (por ejemplo, ciclofosfamida, doxorrubicina, prednisona, rituximab y vincristina). El examen vascular reveló pulsos palpables de dorsal del pie y tibial posterior, mientras que la integridad de la piel estaba intacta en todas las extremidades inferiores.
En el examen posterior tres meses antes de la cirugía, se observaron reducciones notables en la flexión, rotación interna, rotación externa y abducción en la cadera izquierda. Además, el acortamiento significativo de las extremidades se atribuyó a la migración craneal de la cabeza femoral.
En el momento de la presentación, las imágenes radiográficas de la pelvis demostraron pérdida del espacio articular de la cadera izquierda, osteofitos, quistes subcondrales y migración proximal del fémur con cambios en la articulación sacroilíaca. Erosión superior leve del acetábulo acompañada de esclerosis atribuida a linfoma. También se presentaron cambios degenerativos en la articulación sacroilíaca y la sínfisis púbica. Además, la fijación transpedicular en la unión lumbosacra con marcadores de injerto intersomática derivados de la cirugía de fusión lumbar realizada ocho años antes por la enfermedad degenerativa del disco lumbar.
Las radiografías posteriores, realizadas tres meses antes de la cirugía, no revelaron cambios sustanciales en la apariencia de lesiones escleróticas y líticas mixtas en la hemipelvis izquierda, de acuerdo con el linfoma tratado. Se acompañó de remodelación acetabular y migración craneal del fémur proximal, con cambios degenerativos en la articulación de la cadera izquierda (Figura 1). Los hallazgos de la tomografía computarizada (TC) se alinearon con los de la radiografía, confirmando la patología observada (Figura 2).
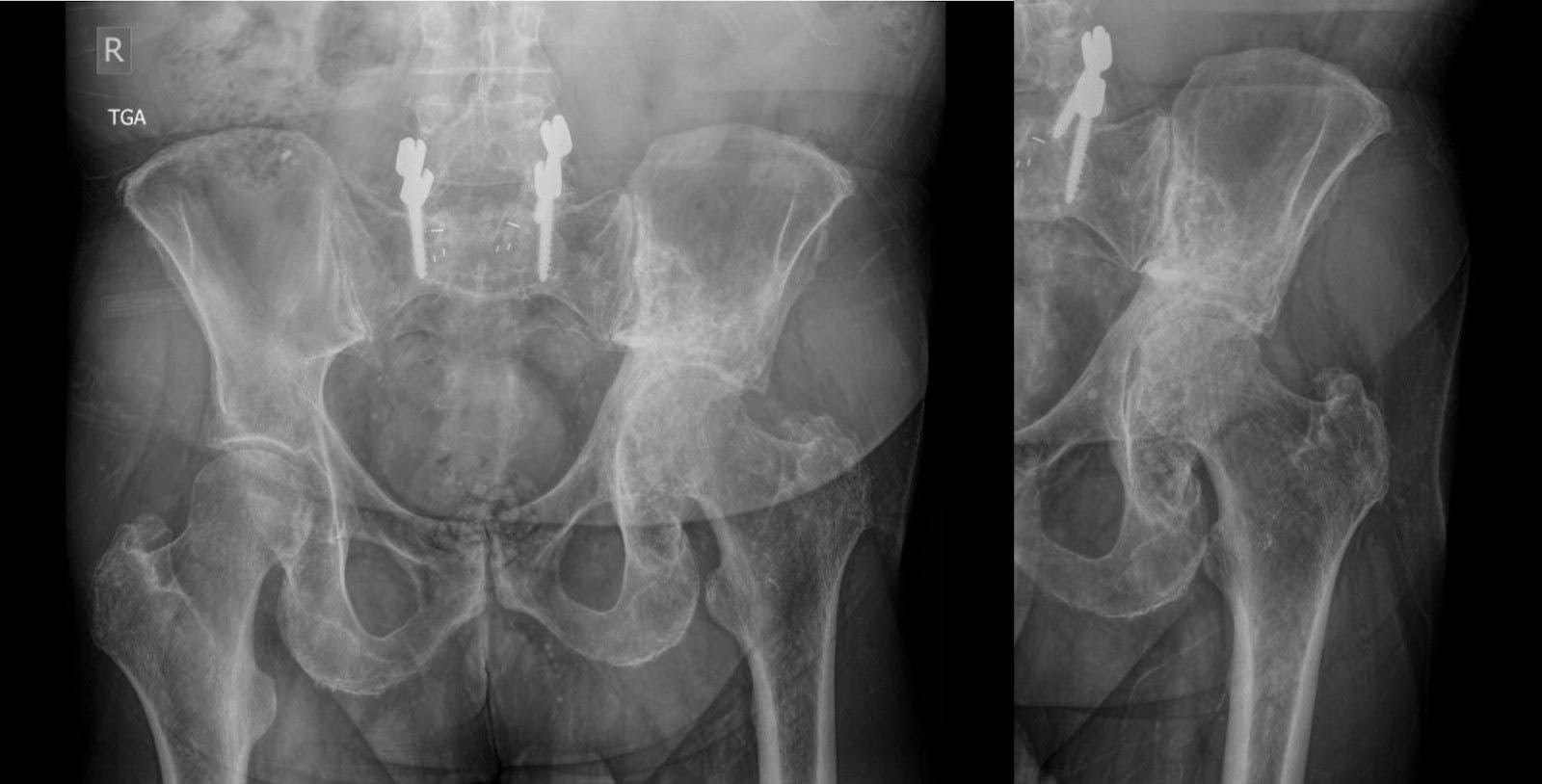
Figura 1. Radiografías anteroposteriores (AP) de la pelvis tres meses antes de la cirugía. Lesión esclerótica principalmente de la hemipelvis izquierda, compatible con linfoma tratado. Cambios estructurales del acetábulo con remodelación y migración superior del fémur proximal.
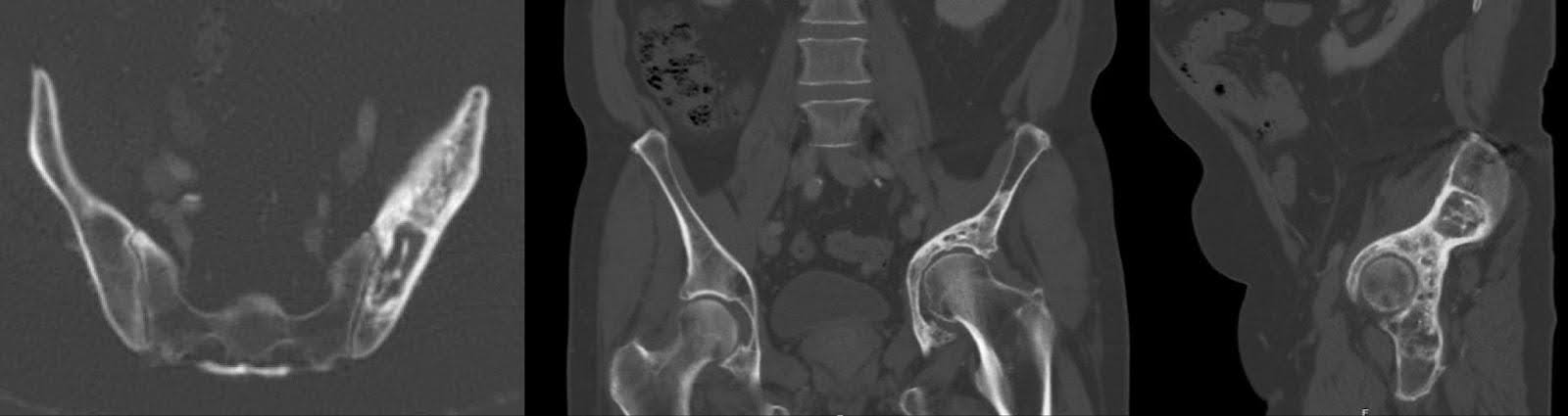
Figura 2. Proyecciones axial, coronal y sagital de la TC de la pelvis tres meses antes de la cirugía. Lesión mixta esclerótica/lítica del acetábulo que vuelve a demostrar el linfoma tratado. Colapso del techo acetabular y migración del fémur proximal hacia la zona supraacetabular con protrusión.
El DLBCL es el subtipo más prevalente de linfoma no Hodgkin y constituye aproximadamente el 30-40% de todos los casos. 1 El diagnóstico suele ocurrir entre la quinta y la sexta décadas de la vida. Su etiología es multifactorial y puede implicar predisposiciones genéticas, desregulación inmunitaria, así como exposiciones virales, ambientales y ocupacionales. 2,3 Se caracteriza por la proliferación de células linfopoyéticas, que a menudo se originan en el hueso, y tiene el potencial de causar la destrucción localizada de la arquitectura ósea, predisponiendo en última instancia a un individuo a fracturas patológicas. 4 Clínicamente, el DLBCL puede presentarse con dolor esquelético secundario a la destrucción ósea y desestabilización. Este dolor puede irradiarse, particularmente cuando hay afectación de componentes de tejidos blandos localizados, como nervios, músculos o vasos, dependiendo de la ubicación de la lesión. Los síntomas sistémicos, como la fiebre, los sudores nocturnos y la pérdida de peso, también pueden formar parte de la constelación de síntomas. 2,4,5 Las imágenes a menudo revelan una destrucción ósea radiolúcida con afectación de los tejidos blandos, evidente en la película simple. La resonancia magnética nuclear (RMN) suele mostrar una hipointensidad relativa en las secuencias T1 del canal medular, lo que indica un reemplazo de médula ósea. Además, las secuencias T2 suelen mostrar hiperintensidad tanto en la extensión intramedular como en la extramedular. 6 Aproximadamente cuatro años antes de la cirugía de estabilización pélvica, la resonancia magnética de la paciente reveló una lesión T1 hipointensa y T2 hiperintensa en el acetábulo izquierdo y hueso innominado, compatible con un proceso patológico en estas áreas (Figura 3). Las masas prominentes de tejidos blandos que se observan con frecuencia en la presentación de DLBCL pueden progresar sin intervención sistémica. Las modalidades de tratamiento estándar para el DLBCL incluyen quimioterapia y radioterapia localizada. 7 La DLBCL tiene un pronóstico de moderado a favorable, con tasas de supervivencia a 5 años que oscilan entre el 60 y el 70 % después del tratamiento de primera línea. 1
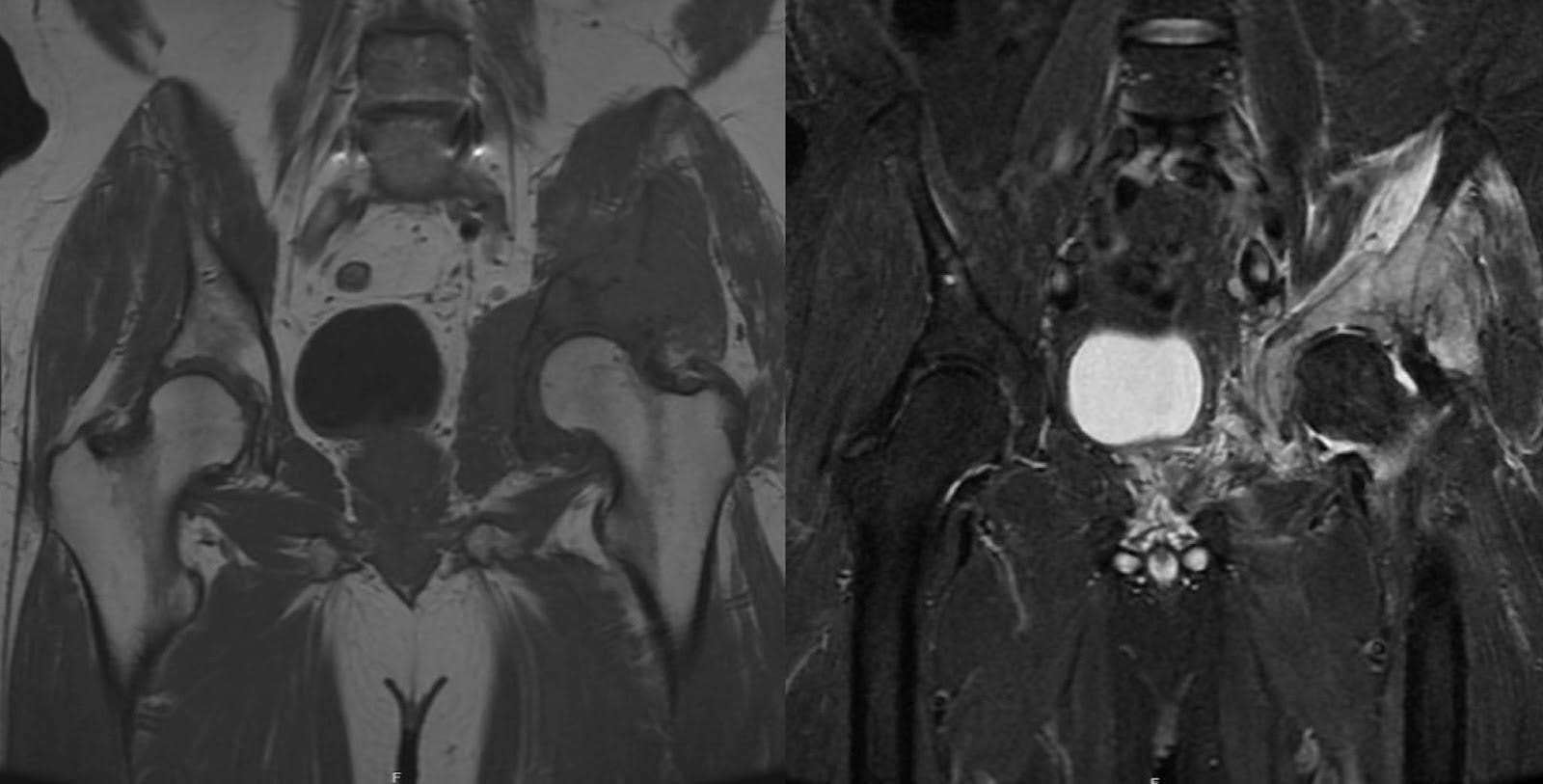
Figura 3. Resonancia magnética preoperatoria, tomada aproximadamente cuatro años antes de la cirugía de estabilización pélvica. La resonancia magnética mostró una lesión T1 hipointensa y T2 hiperintensa en acetábulo izquierdo y hueso innominado, sugestiva de un proceso patológico.
Aunque el linfoma generalmente responde a la radioterapia, los efectos a largo plazo en los huesos, conocidos como osteítis por radiación, aún no se comprenden completamente. La osteítis por radiación puede manifestarse como osteopenia, alteración de la arquitectura trabecular e irregularidades corticales, lo que hace que el hueso sea susceptible a fracturas y remodelaciones anormales. Estas alteraciones predisponen al hueso afectado a fracturas y procesos de remodelación aberrantes. Este riesgo se intensifica en los huesos largos y en las regiones que soportan peso, como el acetábulo, lo que puede culminar en una osteoartritis progresiva. 8,9 Además, la radiación que involucra a las células condrales contribuye sustancialmente a estas alteraciones degenerativas. 10
La THA sigue siendo una intervención quirúrgica ampliamente utilizada y fiable para la osteoartritis, que abarca un espectro de complejidades que van desde la osteoartritis degenerativa primaria hasta los casos de deformidades pélvicas y defectos debidos a enfermedades previas u otras patologías. De 11 a 13 años Los avances en metalurgia y ciencia de los materiales han mejorado la durabilidad del THA desde su adopción generalizada. Los aumentos, una técnica utilizada para tratar los defectos pélvicos, facilitan el relleno de defectos óseos mediante la integración de la cubierta hemisférica del componente acetabular con una cara metálica trabecular, lo que promueve el crecimiento biológico y la fijación con tornillos. 14,15 Los métodos de aumento, incluidos el cemento y los balones fotodinámicos, ofrecen soporte estructural, que es particularmente crucial para los pacientes oncológicos. Los balones fotodinámicos insertados percutáneamente proporcionan estabilidad a la copa acetabular, complementando la función de los aumentos. Esta combinación se vuelve cada vez más significativa a medida que mejora la terapia dirigida al carcinoma y aumenta la esperanza de vida, logrando el alivio del dolor y rectificando los defectos acetabulares, como se evidencia al abordar la discrepancia en la longitud de las piernas en casos específicos. 16,17
Existen múltiples opciones de tratamiento para la osteoartritis de cadera, que van desde inyecciones de esteroides hasta intervenciones quirúrgicas. 18 Sin embargo, en los casos caracterizados por patologías multifocales, como la osteítis por radiación y la migración superior de la cabeza femoral, la reconstrucción articular surge como la opción de tratamiento óptima. La hemiartroplastia no es una opción adecuada debido a que el acetábulo no es hemisférico y está erosionado. Aunque la THA in situ es una opción, puede empeorar la discrepancia en la longitud de la extremidad y alterar la biomecánica, lo que aumenta el riesgo de inestabilidad y luxación. 19 La reconstrucción con un componente acetabular jumbo puede abordar la alteración del espacio articular y el gran defecto, pero requiere un escariado acetabular prolongado, lo que resulta en una posible pérdida ósea. 20
Por el contrario, el uso de un componente acetabular de tamaño estándar con aumentos ofrece preservación ósea, aunque la fijación con tornillos puede verse obstaculizada por la osteítis por radiación. Superar este desafío requiere una atención meticulosa para lograr una profundidad de tornillo adecuada. Otras estrategias reconstructivas se basan en grandes construcciones de tribridas personalizadas o construcciones complejas de jaulas de copas. Estas opciones son efectivas, pero tienen un riesgo significativo de infección e inestabilidad. 21,22 Las construcciones de jaula de copa también son una opción para la reconstrucción acetabular grande, pero conllevan el riesgo de inestabilidad e infección. 23 Estos grandes constructos pueden aumentar la morbilidad intraoperatoria y complicar el seguimiento radiográfico de la enfermedad después de la cirugía. De 24 a 26 años El uso de PDN como aumentos es una alternativa mínimamente invasiva que puede proporcionar fijación conectada a un puntal endosteal que se extiende por la columna pélvica, restaurando efectivamente el centro de rotación. 27
En los casos de linfoma pélvico, la arquitectura ósea puede colapsar durante el tiempo que tardan la radiación y la quimioterapia en hacer efecto, especialmente en las articulaciones que soportan peso. A medida que se ejerce presión sobre el acetábulo estructuralmente debilitado, la cabeza femoral puede migrar proximalmente hacia arriba, causando discrepancia en la longitud de la extremidad y un rango de movimiento restringido. Las terapias sistémicas, sin embargo, permiten la curación ósea con tratamiento de la enfermedad y consolidación ósea. La osteítis por radiación, combinada con un rango de movimiento limitado, puede acelerar el desgaste acetabular, lo que provoca dolor. La prioridad de la THA es el alivio del dolor, seguido de la corrección de la discrepancia en la longitud de la extremidad. Este enfoque puede reforzarse aún más mediante la estabilización de la PDN del acetábulo, mejorando así los resultados del tratamiento y mejorando la calidad de vida del paciente.
Las PDN ofrecen una solución versátil para la reconstrucción acetabular, ya que sirven como estabilizadores primarios de las columnas pélvicas y facilitan la fijación segura de los implantes en los procedimientos reconstructivos. Su excepcional resistencia a las fuerzas de compresión, torsión y tracción y la facilidad de administración a través de un catéter flexible permiten una restauración anatómica precisa de la columna acetabular. Con la inserción y el curado flexibles de la PDN después del relleno volumétrico, hay múltiples puntos de contacto dentro del hueso, lo que mejora la estabilidad general y reduce el riesgo de falla mecánica debido a la concentración de tensión dentro del implante. 28 Además, su radiolucidez permite obtener imágenes claras sin interferencia de artefactos metálicos durante el monitoreo radiográfico de enfermedades. Los PDN permiten la fijación de tornillos dentro del material curado, lo que facilita la integración perfecta con las construcciones endoprotésicas al tiempo que preserva el potencial de osteointegración local. 16 Su resistencia longitudinal superior y estabilidad rotacional eliminan la necesidad de estabilización adicional del tornillo y distribuyen eficazmente la resistencia mecánica en todo el implante. Además, las características mecánicas de las PDN son más cercanas al hueso en comparación con el metal y, por lo tanto, tienen un menor riesgo de protección contra la tensión, lo que conduce a una construcción mejor integrada dentro del hueso. 28 A pesar de estas ventajas, el encapsulamiento de PDN dentro de un catéter de balón de polietileno puede restringir el crecimiento óseo. Sin embargo, la ausencia de cemento o sustratos similares puede promover una mayor osteointegración en comparación con las construcciones convencionales. 16
Este complejo reemplazo de cadera implicó la reconstrucción de la articulación, el refuerzo de la pelvis con PDN y la neurolización del nervio ciático. El procedimiento se realizó bajo anestesia general y el paciente fue clasificado como Sociedad Americana de Anestesiólogos (ASA) Estado Físico III.
Inicialmente, el paciente se colocó boca abajo, con botas de compresión aplicadas bilateralmente. Todas las prominencias óseas estaban debidamente acolchadas para su protección. La fijación segura se garantizó con rollos de pecho en una mesa Jackson plana. Se administraron antibióticos profilácticos preoperatorios (2 g de Ancef), con posterior redosis cada cuatro horas durante todo el procedimiento.
Se realizó cuidadosamente una pequeña incisión transversal en la columna ilíaca posterior inferior derecha, seguida de la colocación de un rastreador de navegación y la adquisición de un giro intraoperatorio del brazo en O. Utilizando la guía de navegación junto con la fluoroscopia, se realizaron incisiones adicionales en la espina ilíaca posterior inferior izquierda y en la prominencia isquiática. Posteriormente, se avanzó meticulosamente una broca de 3,2 mm para delinear las trayectorias de los globos. Empleando un punzón recto, aseguramos un posicionamiento preciso sobre el punto de entrada mientras la broca de 3,2 mm servía como guía. Tras la confirmación de la colocación óptima del alambre en el área supraacetabular y la columna posterior mediante imágenes fluoroscópicas en varias vistas, incluida la ilíaca oblicua, la pelvis anteroposterior, la entrada y el obturador oblicuo, la broca se cambió por una guía de 2 mm. Después de esto, el escariado de la trayectoria de ambos globos se llevó a cabo con cuidadosa atención al detalle.
El desbridamiento planteó desafíos considerables debido a la esclerosis y a la rápida progresión de la osteítis posterior a la radiación del paciente. Se dimensionaron dos balones: uno de 22 mm x 140 mm para el área supraacetabular y otro de 22 mm x 120 mm para la columna posterior. Se procedió a la inserción del balón, seguido del inflado con polímero, asegurando un llenado óptimo de las trayectorias y las regiones defectuosas óseas. El curado del polímero se llevó a cabo sin complicaciones (Figura 4). Posteriormente, se extirpó el sistema de colocación de ambos globos, con un riego exhaustivo de ambos sitios. El cierre implicó sutura por capas, utilizando 0 polidioxanona (PDS) para las capas profundas y 2-0 PDS para las capas superficiales. El cierre de la piel se logró utilizando 3-0 Monocryl, Dermabond, Telfa y Tegaderms para un tratamiento óptimo de las heridas.
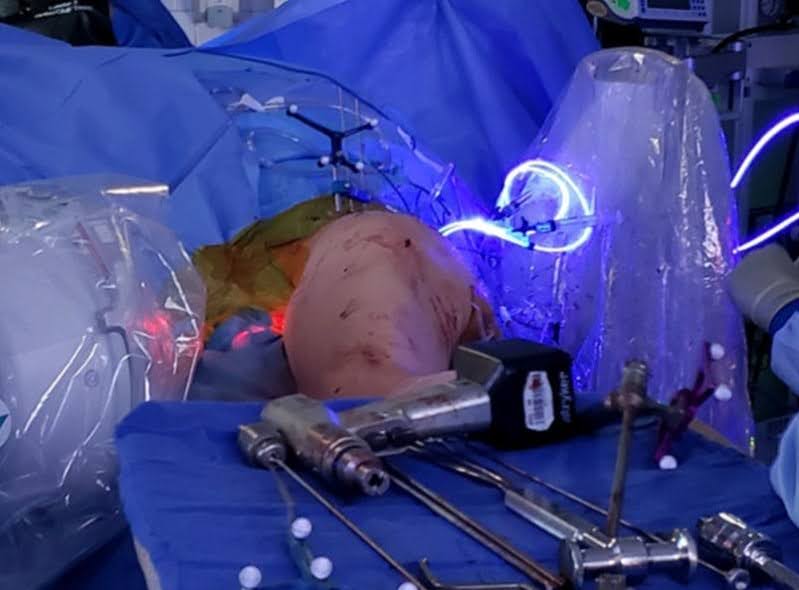
Figura 4. Proceso de curado. Recocido ligero de PDN con fluoroscopia para controlar el inflado del implante. (Reutilizado con permiso de Fourman MS, Ramsey DC, Newman ET, Raskin KA, Tobert DG, Lozano-Calderon S. Cómo lo hago: estabilización percutánea de lesiones metastásicas sacras y periacetabulares sintomáticas con uñas fotodinámicas. J Surg Oncol. 2021; 124(7):1192-1199. doi:10.1002/jso.26617.).
En este punto, el paciente fue trasladado a la posición de decúbito lateral utilizando un agarre de cadera en la misma mesa plana de Jackson. Se realizó una incisión longitudinal tras el abordaje posterolateral de cadera izquierda con 10 cuchillas, y posteriormente se realizó disección de los tejidos subcutáneos mediante electrocauterización. La fascia se incisó longitudinalmente y el glúteo mayor se dividió, con el desprendimiento del 50% superior del cabestrillo y los rotadores externos como una sola unidad con la cápsula. Dado el sobrecrecimiento significativo de la pelvis, se realizó un corte in situ después de colocar dos retractores Cobra, seguido de la identificación de la porción intramedular del hueso mediante un buscador de canales.
Se realizó el brochado secuencial del fémur hasta el tallo tamaño 6. Esto dio como resultado una excelente restauración de la anteversión y una sensación satisfactoria del canal, sin ninguna movilización perceptible de la prueba en la rotación interna y externa. El broche se dejó in situ para minimizar el sangrado.
La columna posterior quedó completamente expuesta y se identificó el nervio ciático para la neurólisis desde la escotadura ciática hasta el muslo proximal, anticipando el alargamiento esperado durante la reconstrucción. Tras la extracción de la cabeza, se logró una visualización completa del acetábulo, incluido su centro superior de migración. Se utilizaron escariadores secuenciales, escariados en el punto más bajo del acetábulo con el ligamento transverso sirviendo de referencia anatómica para la determinación de la anteversión y la abducción. El escariado secuencial comenzó a los 44 mm para realinear medialmente el acetábulo nativo, progresando hasta el tamaño de 54 mm. Un aumento de 15 mm de espesor se fijó mediante tres tornillos de 6,5 mm de 30, 45 y 40 mm de longitud, logrando una excelente fijación.
La superficie acetabular se preparó hasta lograr el sangrado óseo. Posteriormente, el acetábulo se llenó con 30 cc de injerto óseo esponjoso cortical. A continuación, se insertó una copa de revisión de 56 orificios múltiples y se aseguró con ocho tornillos de 6,5 mm de longitud que varían de 15 a 50 mm de diámetro. Se determinó que la compatibilidad de una copa de doble movilidad con una doble movilidad de -4 y un vástago de 28/52 mm era adecuada para corregir la discrepancia en la longitud de la extremidad. Los componentes finales se insertaron sin problemas y sin dificultad, y las radiografías intraoperatorias confirmaron la correcta colocación del implante. Se realizó un riego copioso y no se utilizaron desagües. Se logró una hemostasia satisfactoria y la reparación de los rotadores externos y la cápsula se realizó mediante túneles óseos y puntos de sutura Ethibond #5. El cierre del intervalo entre los rotadores externos y el glúteo menor se logró con puntos interrumpidos #1 PDS. Posteriormente, se utilizó el PDS #1 para las capas fasciales profundas. La capa subcutánea profunda se cerró con 0 puntos interrumpidos de PDS, y la capa superficial con 2-0 puntos interrumpidos de PDS. El cierre cutáneo se completó con 3-0 Monocryl y Dermabond, seguido de la aplicación de un apósito estéril con Telfa y Tegaderm. El paciente salió de la anestesia sin complicaciones, manteniendo la integridad neurovascular y la restauración de la longitud de la extremidad inferior izquierda. El paciente presentaba una contractura en flexión de cadera que requirió fisioterapia; Sin embargo, una pequeña liberación de la cápsula anterior resultó insuficiente dada la gravedad de la contractura. La duración del caso fue de 386 minutos, con una pérdida de sangre estimada de 400 mL. El paciente permanece vivo 18 meses después de la operación, con seguimientos formales a las dos semanas, seis semanas, tres meses, cuatro meses, seis meses y nueve meses. En el último seguimiento, informó de una mejora en el control del dolor, recuperó la deambulación, paseó a su perro a diario y completó más de 30 sesiones de fisioterapia.
Presentamos el caso de un varón geriátrico con DLBCL acetabular izquierdo. El paciente respondió favorablemente a la quimioterapia y a la radioterapia; sin embargo, el seguimiento posterior reveló un colapso persistente del acetábulo y una migración superior de la cabeza femoral. Estos cambios se atribuyeron a la osteítis por radiación después del tratamiento y al colapso de la enfermedad antes del efecto completo del tratamiento. Para abordar la discrepancia en la longitud de la pierna, las interrupciones biomecánicas y el dolor resultantes, el paciente se sometió a una estabilización percutánea con PDN para mejorar la calidad de la fijación de un THA complejo realizado utilizando aumentos de tantalio.
Seis meses después de la cirugía, el paciente demostró un rango completo de movimiento en la cadera izquierda, aunque informó dolor localizado durante la rotación interna. La flexión y extensión de la cadera estaban dentro de los límites normales. Clínicamente, el paciente exhibía una longitud de pierna casi adecuada, pero mostraba una marcha antálgica con una longitud de zancada izquierda reducida en comparación con la derecha. A pesar de participar en más de 30 sesiones de fisioterapia, el paciente experimentó fatiga y dolor moderados durante la deambulación, necesitando descansos frecuentes después de caminar distancias moderadas. El dolor en la ingle izquierda y en el lateral de la cadera sigue aumentando durante los períodos de actividad traslacional y prolongados. Las radiografías de la articulación de la cadera y la pelvis revelaron un THA izquierdo bien alineado con aumentos de tantalio en posiciones óptimas, sin signos de aflojamiento (Figura 5).
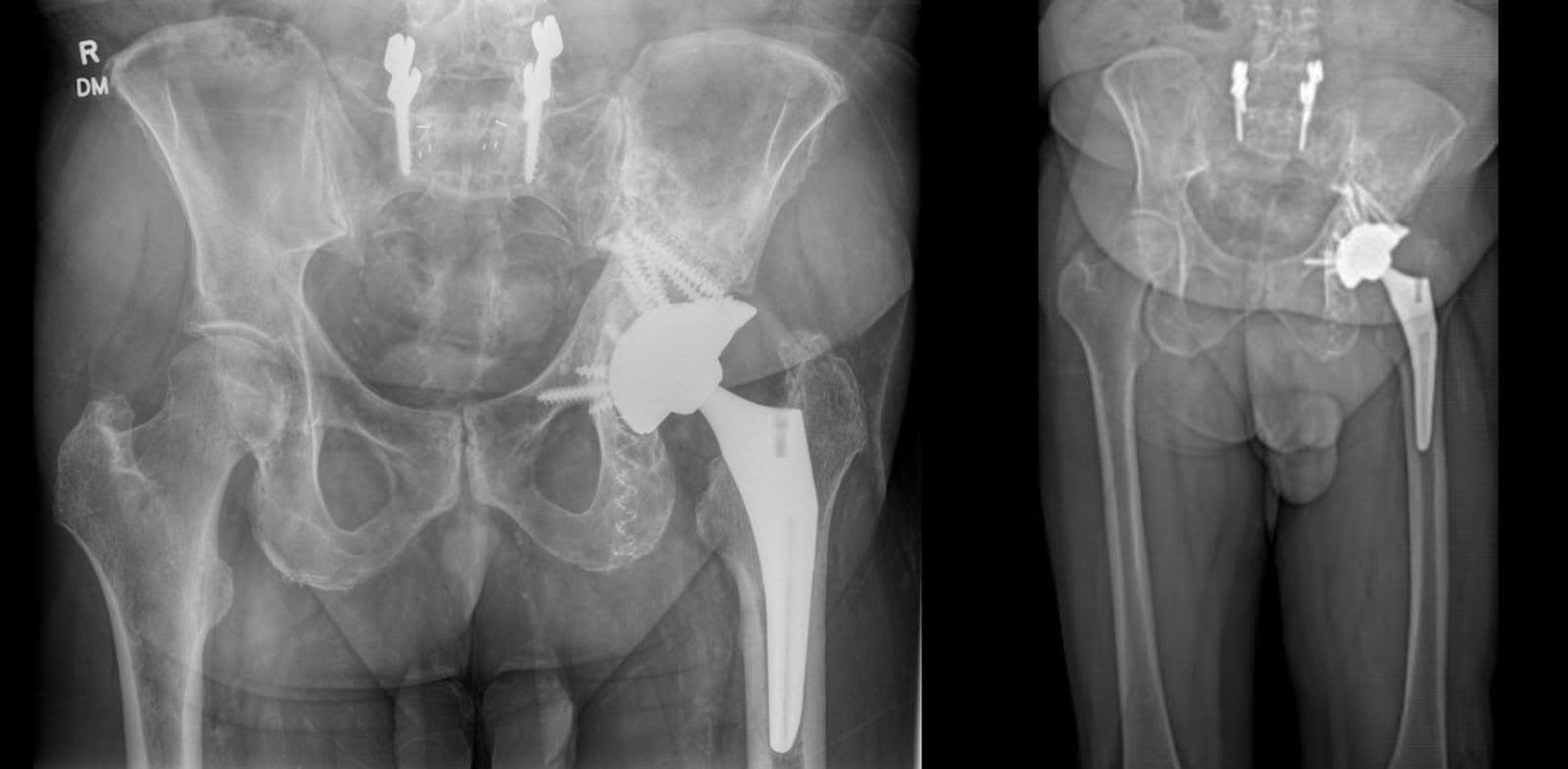
Figura 5. AP Radiografía de la pelvis seis meses después de la cirugía. Alineación estable tras artroplastia total de cadera izquierda con aumento acetabular, junto a fijación del hueso isquiático e ilíaco izquierdo mediante clavos fotodinámicos. No hay evidencia de fractura periprotésica.
El linfoma con compromiso esquelético impone un desafío multifacético a los cirujanos ortopédicos, ya que amplía sus responsabilidades más allá del tratamiento del tumor primario para abordar los efectos tardíos de la quimioterapia sistémica o la radioterapia. Esta enfermedad requiere un enfoque integral y multidisciplinario que integre la experiencia de cirujanos ortopédicos, oncólogos médicos y oncólogos radioterápicos. Un elemento central de este enfoque es la utilización de marcadores inmunohistoquímicos bien establecidos, como la expresión de CD20, que no solo ayudan a diagnosticar el DLBCL, sino que también informan la selección de regímenes de tratamiento adecuados, a saber, el protocolo de quimioterapia R-CHOP ampliamente empleado. 29 Si bien estos tratamientos son cruciales para el control de enfermedades, pueden afectar significativamente la estructura y función ósea. La radioterapia, por ejemplo, puede reducir el tamaño de las lesiones al matar directamente las células del linfoma o alterar su material genético. Sin embargo, también puede alterar la estructura primaria del colágeno óseo, degradar el cartílago e inducir osteítis por radiación. 9,30 En consecuencia, el debilitamiento o la pérdida del stock óseo puede predisponer a los pacientes a la artrosis posterior, que a menudo requiere la reconstrucción articular mediante artroplastia.
La THA es una cirugía eficaz y bien tolerada para el tratamiento de la artrosis. Sin embargo, puede ser un desafío técnico cuando hay defectos acetabulares. Existen varias técnicas para reconstruir los defectos acetabulares, cada una con sus propias ventajas y desventajas. 31 Por lo tanto, no existe una única opción óptima para tratar los defectos acetabulares, especialmente en pacientes oncológicos. Se publican varias técnicas, incluidas las construcciones de jaulas de copa, los implantes personalizados y las aplicaciones de aumento. 21,23,32 Una técnica prometedora para reconstruir defectos acetabulares consiste en utilizar PDN para reconstruir la arquitectura acetabular y utilizarla como andamio para fijar internamente el componente acetabular.
Los avances futuros en la THA y la reconstrucción acetabular ofrecen perspectivas prometedoras con la aparición de nuevas tecnologías que abordan los defectos óseos en los componentes acetabulares. La evolución de los implantes personalizados que utilizan la tecnología de impresión 3D representa una vía importante para mejorar la eficiencia y la conveniencia de la artroplastia de revisión total de cadera. Además, la utilización de sustitutos óseos en la THA es cada vez más viable a medida que avanzan los avances en los materiales de sustitutos óseos.33 Además, la amalgama de malla metálica con injerto óseo por impactación se ha delineado como un enfoque alternativo, mostrando resultados prometedores con un seguimiento a medio y largo plazo. 34
El equipo especializado requerido para el procedimiento incluye balones fotodinámicos y el monómero que lo acompaña para la inyección. Además, una unidad de fuente de luz es esencial para el proceso de curado de la PDN. Una mesa radiolúcida es indispensable para la inserción de PDN, especialmente porque la utilización de la pelvis requiere una visualización radiográfica, facilitada por la fluoroscopia o la tomografía computarizada intraoperatoria para la navegación. La preferencia del autor se inclina hacia la navegación por TC intraoperatoria debido a su capacidad para mejorar la precisión de la perforación, especialmente en los casos en que el stock óseo comprometido perjudica la retroalimentación táctil.
El autor correspondiente (SALC) recibe apoyo de investigación y se desempeña como orador y consultor remunerado por IlluminOss Medical Inc.
El paciente al que se refiere este artículo en vídeo ha dado su consentimiento informado para ser filmado y es consciente de que la información y las imágenes se publicarán en línea.
References
- Li S, Young KH, Medeiros LJ. Linfoma difuso de células B grandes. Patología. 2018; 50(1):74-87. doi:10.1016/j.pathol.2017.09.006.
- Sehn LH, Salles G. Linfoma difuso de células B grandes. N Engl J Med. 2021; 384(9):842-858. doi:10.1056/NEJMra2027612.
- Cerhan JR, Kricker A, Paltiel O, et al. Antecedentes médicos, estilo de vida, antecedentes familiares y factores de riesgo ocupacionales para el linfoma difuso de células B grandes: el proyecto de subtipos de linfoma no Hodgkin InterLymph. J Natl Cancer Inst Monogr. 2014; 2014(48):15-25. doi:10.1093/jncimonographs/lgu010.
- Yohannan B, Ríos A. Linfoma primario difuso de células B grandes del hueso. J Hematol. 2023; 12(2):75-81. doi:10.14740/jh1087.
- Baar J, Burkes RL, Gospodarowicz M. Linfoma óseo no Hodgkin primario. Semin Oncol. 1999; 26(3):270-275.
- Shah HJ, Keraliya AR, Jagannathan JP, Tirumani SH, Lele VR, DiPiro PJ. Linfoma difuso de células B grandes en la era de la oncología de precisión: cómo son útiles las imágenes. J Radiol. Coreano 2017; 18(1):54-70. doi:10.3348/kjr.2017.18.1.54.
- Susanibar-Adaniya S, Barta SK. Actualización de 2021 sobre el linfoma difuso de células B grandes: una revisión de los datos actuales y las posibles aplicaciones sobre la estratificación y el tratamiento del riesgo. Am J Hematol. 2021; 96(5):617-629. doi:10.1002/ajh.26151.
- Fu AL, Greven KM, Maruyama Y. Osteítis por radiación y fracturas por insuficiencia después de la irradiación pélvica para neoplasias malignas ginecológicas. Am J Clin Oncol. 1994; 17(3):248-254. doi:10.1097/00000421-199406000-00015.
- Willey JS, Lloyd SAJ, Nelson GA, Bateman TA. Radiación ionizante y pérdida ósea: exploración espacial y aplicaciones de terapia clínica. Clin Rev Bone Miner Metab. 2011; 9(1):54-62. doi:10.1007/s12018-011-9092-8.
- Margulies BS, Horton JA, Wang Y, Damron TA, Allen MJ. Efectos de la radioterapia en los condrocitos in vitro. Calcif Tissue Int. 2006; 78(5):302-313. doi:10.1007/s00223-005-0135-3.
- Ferguson RJ, Palmer AJ, Taylor A, Porter ML, Malchau H, Glyn-Jones S. Reemplazo de cadera. Lanceta. 2018; 392(10158):1662-1671. doi:10.1016/S0140-6736(18)31777-X.
- Stiehl JB, Saluja R, Diener T. Reconstrucción de defectos importantes de la columna y discontinuidad pélvica en la artroplastia total de cadera de revisión. J Artroplastia. 2000; 15(7):849-857. doi:10.1054/arth.2000.9320.
- Caminante RH. Reconstrucción pélvica/artroplastia total de cadera por insuficiencia acetabular metastásica. Clin Orthop Relat Res. 1993;( 294):170-175.
- Melnic CM, Salimy MS, Hosseinzadeh S, et al. Aumentos del metal trabecular en la pérdida ósea acetabular asociada a la malignidad grave. Cadera Int. 2023; 33(4):678-684. doi:10.1177/11207000221110787.
- Karuppal R. Fijación biológica de la artroplastia total de cadera: hechos y factores. J Ortope. 2016; 13(3):190-192. doi:10.1016/j.jor.2016.06.002.
- Heng M, Fourman MS, Mitrevski A, Berner E, Lozano-Calderón SA. Aumento de la pérdida ósea acetabular patológica con clavos fotodinámicos para apoyar la artroplastia total primaria de cadera. Arthroplast hoy. 2022;18:1-6. doi:10.1016/j.artd.2022.08.022.
- Fourman MS, Ramsey DC, Newman ET, Raskin KA, Tobert DG, Lozano-Calderón S. Cómo lo hago: estabilización percutánea de lesiones metastásicas sacras y periacetabulares sintomáticas con uñas fotodinámicas. J Surg Oncol. 2021; 124(7):1192-1199. doi:10.1002/jso.26617.
- Katz JN, Arant KR, Loeser RF. Diagnóstico y tratamiento de la osteoartritis de cadera y rodilla: una revisión. JAMA. 2021; 325(6):568-578. doi:10.1001/jama.2020.22171.
- D'Angelo F, Murena L, Zatti G, Cherubino P. La artroplastia total de cadera inestable. Indian J Orthop. 2008; 42(3):252-259. doi:10.4103/0019-5413.39667.
- McKenna DP, Price A, McAleese T, Dahly D, McKenna P, Cleary M. Tendencias del tamaño de la copa acetabular en la artroplastia total de cadera. Mundo J Ortopédico. 2024; 15(1):39-44. doi:10.5312/wjo.v15.i1.39.
- Sershon RA, McDonald JF, Nagda S, Hamilton WG, Engh CA. Copas de tribrida personalizadas: 20 años de experiencia. J Artroplastia. 2021; 36(9):3264-3268. doi:10.1016/j.arth.2021.05.005.
- Meding JB, Meding LK. Implantes acetabulares triflange personalizados: seguimiento medio a 10 años. J Artroplastia. 2023; 38(7S): S201-S205. doi:10.1016/j.arth.2023.03.035.
- Wang CX, Huang Z da, Wu BJ, Li WB, Fang XY, Zhang WM. Solución de jaula de copa para defectos acetabulares masivos: una revisión sistemática y metanálisis. Cirugía ortopédica. 2020; 12(3):701-707. doi:10.1111/os.12710.
- Marco RA, Sheth DS, Boland PJ, Wunder JS, Siegel JA, Healey JH. Resultado funcional y oncológico de la reconstrucción acetabular para el tratamiento de la enfermedad metastásica. J Bone Joint Surg Am. 2000; 82(5):642-651. doi:10.2106/00004623-200005000-00005.
- Wunder JS, Ferguson PC, Griffin AM, Pressman A, Bell RS. Metástasis acetabulares: planificación de la reconstrucción y revisión de los resultados. Clin Orthop Relat Res. 2003;( 415 Supl):S187-97. doi:10.1097/01.blo.0000092978.12414.1d.
- Allan DG, Bell RS, Davis A, Langer F. Reconstrucción acetabular compleja para tumores metastásicos. J Artroplastia. 1995; 10(3):301-306. doi:10.1016/s0883-5403(05)80178-0.
- Su Y, Lin Y, Yang R, et al. Aprendiendo del muestreo de espacio de cabeza: un reactor versátil de alto rendimiento para la generación de vapor fotoquímico. Química Anal. 2022; 94(46):16265-16273. doi:10.1021/acs.analchem.2c04401.
- Gausepohl T, Pennig D, Heck S, Gick S, Vegt PA, Block JE. Manejo eficaz de las fracturas óseas con el Sistema de Estabilización Ósea Fotodinámica Illuminoss: experiencia clínica inicial del Registro de la Unión Europea. Orthop Rev (Pavía). 2017; 9(1):6988. doi:10.4081/or.2017.6988.
- Choi CH, Park YH, Lim JH, et al. Implicación pronóstica de la evaluación inmunohistoquímica semicuantitativa de la expresión de CD20 en el linfoma difuso de células B grandes. J Pathol Transl Med. 2016; 50(2):96-103. doi:10.4132/jptm.2016.01.12.
- Donaubauer AJ, Deloch L, Becker I, Fietkau R, Frey B, Gaipl US. Influencia de la radiación sobre el hueso y las células óseas: efectos diferenciales sobre osteoclastos y osteoblastos. Int J Mol Sci. 2020; 21(17). doi:10.3390/ijms21176377.
- Petrie J, Sassoon A, Haidukewych GJ. Discontinuidad pélvica: soluciones actuales. Articulación ósea J. 2013; 95-B(11 Supl A):109-113. doi:10.1302/0301-620X.95B11.32764.
- Ying J, Cheng L, Li J, et al. Tratamiento del defecto óseo acetabular en la revisión de la artroplastia total de cadera mediante aumento acetabular de tantalio impreso en 3D. Cirugía ortopédica. 2023; 15(5):1264-1271. doi:10.1111/os.13691.
- Romagnoli M, Casali M, Zaffagnini M, et al. Fosfato tricálcico como sustituto óseo para tratar defectos óseos acetabulares masivos en la cirugía de revisión de cadera: una revisión sistemática y experiencia clínica inicial con 11 casos. J Clin Med. 2023; 12(5). doi:10.3390/jcm12051820.
- Yang C, Zhu K, Dai H, Zhang X, Wang Q, Wang Q. Seguimiento a mediano y largo plazo del defecto óseo acetabular grave después de la revisión de la artroplastia total de cadera mediante injerto óseo por impactación y malla metálica. Cirugía ortopédica. 2023; 15(3):750-757. doi:10.1111/os.13651.
Cite this article
Werenski JO, Rizk PA, Lozano-Calderón SA. El uso de clavos fotodinámicos para el refuerzo óseo en combinación con la artroplastia total compleja de cadera en el contexto de la osteítis por radiación. J Med Insight. 2025; 2025(441). doi:10.24296/jomi/441.



