Timectomía robótica para la miastenia gravis
Main Text
Table of Contents
La miastenia gravis es una enfermedad autoinmune que afecta la transmisión de acetilcolina involucrada en la contracción del músculo esquelético. El abordaje de los pacientes miasténicos es complejo ya que el tratamiento óptimo implica una técnica multidisciplinar de terapias médicas y quirúrgicas combinadas. La terapia médica con acetilcolinesterasas e inmunomoduladores puede aliviar los síntomas y eliminar la sensación de fatiga y debilidad. La timectomía quirúrgica puede ayudar a reducir los síntomas, prevenir la recurrencia y reducir los requisitos diarios de medicación. La timectomía se realizaba tradicionalmente mediante un abordaje transesternal, pero las técnicas mínimamente invasivas y robóticas se han vuelto cada vez más comunes. Aquí, presentamos nuestro enfoque para la timectomía total robótica a través de un enfoque del lado izquierdo.
La miastenia gravis es una enfermedad autoinmune que afecta a los receptores nicotínicos postsinápticos de acetilcolina que controlan la función voluntaria del músculo esquelético. Esto suele estar mediado por anticuerpos anti-receptor de acetilcolina (anti-AChR). El inicio y la magnitud de la enfermedad pueden variar significativamente, pero por lo general implican cierto grado de debilidad progresiva de los ojos, las extremidades o los músculos orofaríngeos o respiratorios. 1 Junto con la terapia médica, la cirugía se ha convertido en el estándar de atención, ya que los pacientes posteriores a la timectomía tienen más probabilidades de tener una mejoría y/o resolución de los síntomas con menos dependencia de la terapia médica. 2, 3
La paciente es una mujer de 23 años a la que se le diagnosticó miastenia gravis generalizada anti-AChR positiva hace varios años. Su principal queja era fatiga, debilidad facial y visión doble. Se mantuvo con prednisona y piridostigmina diarias, pero los síntomas empeoraron progresivamente. Ahora ha requerido dosis crecientes de corticosteroides e infusiones de inmunoglobulina intravenosa para controlar los síntomas. Por lo demás, está sana sin antecedentes médicos o quirúrgicos pertinentes. No tiene antecedentes familiares de miastenia gravis u otra enfermedad autoinmune.
El examen físico reveló una mujer joven de aspecto saludable con signos vitales normales. No tiene déficits sensoriales, los reflejos tendinosos son normales y no hay debilidad por esfuerzo en las extremidades superiores o inferiores. Tiene ptosis leve que se produce cuando mantiene la mirada hacia arriba durante aproximadamente un minuto.
El paciente se sometió a una tomografía computarizada transversal de tórax que mostró hiperplasia tímica sin timoma dominante. No hubo linfadenopatía asociada ni invasión a las estructuras circundantes. En la Figura 1 se muestra una imagen representativa.
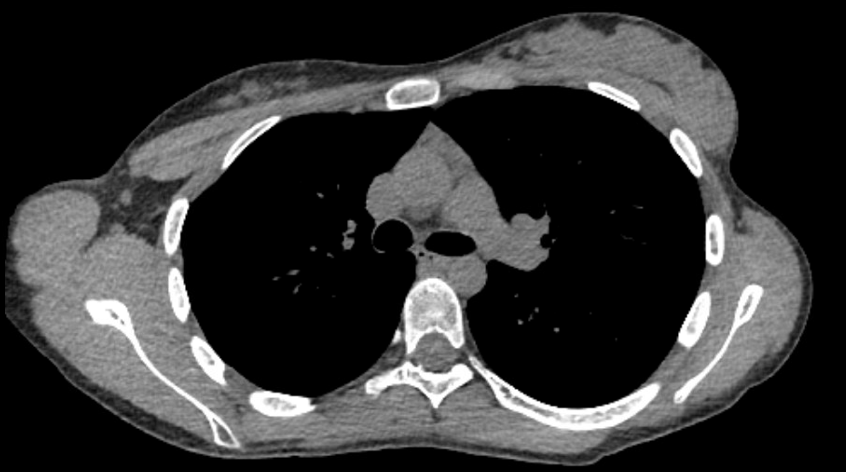 Figura 1. Corte transversal representativo de la tomografía computarizada axial que muestra hiperplasia tímica sin timoma dominante.
Figura 1. Corte transversal representativo de la tomografía computarizada axial que muestra hiperplasia tímica sin timoma dominante.
El tratamiento de la miastenia gravis suele ser multidisciplinario y requiere la cooperación entre neurólogos y cirujanos torácicos. Después del diagnóstico, los pacientes generalmente se someten a alguna combinación de terapia médica que incluye acetilcolinesterasas como piridostigmina, muscarínicos como propantelina e inmunomoduladores como corticosteroides, metotrexato o ciclofosfamida. La infusión de inmunoglobulina intravenosa (IVIG) puede ser necesaria para la enfermedad refractaria. 1
Una vez controlados con un régimen estable, la mayoría de los pacientes son remitidos a timectomía quirúrgica, que se ha demostrado que reduce la dependencia de las terapias médicas y disminuye los síntomas informados.
Nuestro video muestra una timectomía total robótica a través de un enfoque de tórax izquierdo. Utilizando técnicas toracoscópicas o robóticas, las timectomías mínimamente invasivas se realizan cada vez más utilizando abordajes subxifoides, izquierdo, derecho o bilateral. En raras ocasiones, puede ser necesario un abordaje transesternal para tumores grandes o aquellos con un componente invasivo. 4-6
Nuestro paciente había controlado previamente la miastenia que ahora ha requerido terapias médicas graduales. Se pensó que la timectomía podría permitirle dejar de tomar su medicación actual sin recurrencia de los síntomas.
Los pacientes con miastenia gravis deben optimizarse antes de someterse a una timectomía quirúrgica. Después de la cirugía, los pacientes no optimizados pueden experimentar una "crisis miasténica", que se presenta con debilidad profunda, insuficiencia respiratoria e incapacidad para dejar de usar el ventilador. Para evitar esto, planificamos nuestra intervención una semana después de su última infusión de IVIG y también le administramos esteroides intraoperatorios de dosis de estrés. Además, se utilizaron técnicas de anestesia especializadas que incluyen evitar la paralítica y la anestesia intravenosa total para evitar posibles complicaciones miasténicas postoperatorias.
Aquí presentamos una timectomía total robótica mediante abordaje torácico del lado izquierdo. Este procedimiento implica la extirpación de la totalidad del timo y la grasa pericárdica asociada. Los bordes de esta resección incluyen los nervios frénicos izquierdo y derecho lateralmente, el esternón anteriormente, el pericardio posteriormente, el diafragma inferior y los cuernos superiores del timo superior. Todo el tejido graso dentro de estos límites se reseca teniendo cuidado de no dañar las estructuras cercanas importantes, incluida la vena innominada, el corazón, la aorta y los nervios frénicos bilaterales.
El paciente se coloca en decúbito supino con una protuberancia debajo del lado operatorio. Esto permite una exposición completa del pecho izquierdo mientras se deja caer el hombro fuera del campo para evitar colisiones robóticas. La entrada se realiza en el tórax en la línea axilar anterior en el 4º espacio intercostal con un trócar robótico de 8 mm. Luego, se colocan dos trócares robóticos de 8 mm bajo visualización directa, uno en la línea medioclavicular en el pliegue inframamario y otro en la línea axilar posterior en el 3er espacio intercostal. Por último, un puerto auxiliar de 12 mm se triangula entre los dos puertos inferiores en el 5º o 6º espacio intercostal. Una vez colocados todos los puertos de trabajo, el robot se acopla. La cámara se coloca en el puerto robótico central entre los dos puertos de trabajo. Si bien hay muchas opciones disponibles, nuestros instrumentos de elección incluyen una pinza Cadiere en la mano izquierda y una pinza bipolar larga en la mano derecha.
La disección se inicia lo más abajo posible, justo medial al nervio frénico. El tejido graso del mediastino se moviliza fuera del diafragma y el pericardio subyacentes de manera caudal a cefálica. Usando una combinación de disección contundente y electrocauterizada, la movilización continúa medial y superiormente hasta que se encuentra la vena innominada. Esta área se aborda con meticulosa precaución y cualquier vena de drenaje al innominado se controla con cauterización o clips quirúrgicos. Los cuernos superiores derecho e izquierdo del timo se retraen hacia abajo y se diseccionan libremente. Por último, la disección se lleva al tórax derecho. La pleura mediastínica derecha se puede abrir para permitir la identificación del nervio frénico derecho.
Una vez que el timo y la grasa mediastínica están completamente movilizados, la muestra se extrae utilizando una bolsa de recuperación del puerto asistente. Se utiliza un solo drenaje Blake para el drenaje torácico y se coloca a través de una de las incisiones del puerto robótico. El robot se desacopla y el resto de los puertos se retiran y cierran con suturas subcuticulares.
En el postoperatorio, se monitorizó el drenaje pleural y dentro de los límites normales. El drenaje de Blake se retiró a la mañana siguiente y el paciente fue dado de alta el primer día postoperatorio. La patología final fue compatible con hiperplasia tímica. En el seguimiento de 9 meses, el paciente está mayormente libre de síntomas, excepto por diplopía leve que solo se presenta con fatiga extrema. Fue destetada a dosis bajas de prednisona y ya no requiere infusiones de IVIG.
- Constantine Poulos, MD: redacción, revisión y edición
- Tong-Yan Chen, MD: producción, redacción, revisión y edición de video
- Lana Schumacher, MD: producción, redacción, revisión y edición de video
Todos los autores declararon que no hay conflictos de intereses.
El paciente al que se hace referencia en este artículo de video ha dado su consentimiento informado para ser filmado y es consciente de que la información y las imágenes se publicarán en línea.
Animación añadida después de la publicación el 10/03/2025. No se realizaron cambios en el contenido del artículo.
References
- Vincent A, Palace J, Hilton-Jones D. Miastenia gravis. Lanceta. 2001; 357(9274):2122-2128. doi:10.1016/S0140-6736(00)05186-2.
- Gronseth GS, Barohn R, Narayanaswami P. Aviso de práctica: timectomía para la miastenia gravis (Actualización de parámetros de práctica): informe del subcomité de desarrollo, difusión e implementación de guías de la Academia Estadounidense de Neurología. Neurología. 2020; 94(16):705-709. doi:10.1212/WNL.00000000000009294.
- Wolfe GI, Kaminski HJ, Aban IB, et al. Ensayo aleatorizado de timectomía en miastenia gravis. N Engl J Med. 2016; 375(6):511-522. doi:10.1056/NEJMoa1602489.
- Marulli G, Comacchio GM, Rea F. Timectomía robótica. J Vis Surg. 2017;3:68. doi:10.21037/jovs.2017.05.01.
- Wei B, Cerfolio R. Timectomía robótica. J Vis Surg. 2016;2:136. doi:10.21037/jovs.2016.07.17.
- Holleran TJ, Napolitano MA, Crowder HR, Sparks AD, Antevil JL, Trachiotis GD. Resultados clínicos y enfoque técnico de la timectomía en la administración de salud de veteranos. Ann Thorac Surg. 2022; 113(5):1648-1655. doi:10.1016/j.athoracsur.2021.05.020.
Cite this article
Poulos CM, Chen TY, Schumacher L. Timectomía robótica para la miastenia gravis. J Med Insight. 2024; 2024(426). doi:10.24296/jomi/426.



