Robotergestützte Thymektomie bei Myasthenia gravis
Main Text
Table of Contents
Myasthenia gravis ist eine Autoimmunerkrankung, die die Übertragung von Acetylcholin beeinträchtigt und an der Kontraktion der Skelettmuskulatur beteiligt ist. Die Herangehensweise an myasthenische Patienten ist komplex, da eine optimale Behandlung eine multidisziplinäre Technik aus kombinierten medizinischen und chirurgischen Therapien erfordert. Eine medikamentöse Therapie mit Acetylcholinesterasen und Immunmodulatoren kann zur Linderung der Symptome führen und Müdigkeits- und Schwächegefühle beseitigen. Die chirurgische Thymektomie kann helfen, indem sie die Symptome reduziert, ein Wiederauftreten verhindert und den täglichen Medikamentenbedarf reduziert. Die Thymektomie wurde traditionell über einen transsternalen Zugang durchgeführt, aber minimalinvasive und robotergestützte Techniken werden immer häufiger. Hier stellen wir unseren Ansatz für die robotergestützte Totalthymektomie durch einen linksseitigen Zugang vor.
Myasthenia gravis ist eine Autoimmunerkrankung, die die postsynaptischen nikotinischen Acetylcholinrezeptoren betrifft, die die willkürliche Funktion der Skelettmuskulatur steuern. Dies wird häufig durch Anti-Acetylcholinrezeptor-Antikörper (Anti-AChR) vermittelt. Der Beginn und das Ausmaß der Erkrankung können erheblich variieren, gehen aber in der Regel mit einem gewissen Grad an fortschreitender Schwäche der Augen, Extremitäten oder der oropharyngealen/Atemmuskulatur einher. 1 In Verbindung mit der medikamentösen Therapie ist die Operation zum Standard geworden, da Patienten nach einer Thymektomie mit größerer Wahrscheinlichkeit eine Verbesserung und/oder ein Abklingen der Symptome haben und weniger auf eine medikamentöse Therapie angewiesen sind. 2, 3
Bei der Patientin handelt es sich um eine 23-jährige Frau, bei der vor einigen Jahren eine anti-AChR-positive generalisierte Myasthenia gravis diagnostiziert wurde. Ihre Hauptbeschwerden waren Müdigkeit, Gesichtsschwäche und Doppelbilder. Sie wurde täglich mit Prednison und Pyridostigmin behandelt, hatte aber zunehmend eine Verschlechterung der Symptome. Sie benötigt nun eskalierende Dosen von Kortikosteroiden und intravenöse Immunglobulin-Infusionen zur Symptomkontrolle. Ansonsten ist sie gesund und hat keine einschlägige medizinische oder chirurgische Vorgeschichte. Sie hat keine familiäre Vorgeschichte von Myasthenia gravis oder anderen Autoimmunerkrankungen.
Die körperliche Untersuchung ergab eine gesund aussehende junge Frau mit normalen Vitalfunktionen. Sie hat keine sensorischen Defizite, die Sehnenreflexe sind normal und es gibt keine Belastungsschwäche der oberen oder unteren Extremitäten. Sie hat eine leichte Ptosis, die hervorgerufen wird, wenn sie den Blick etwa eine Minute lang nach oben richtet.
Die Patientin unterzog sich einer Querschnitts-Computertomographie des Brustkorbs, die eine Thymushyperplasie ohne dominantes Thymom zeigte. Es gab keine assoziierte Lymphadenopathie oder Invasion in umliegende Strukturen. Ein repräsentatives Bild ist in Abbildung 1 dargestellt.
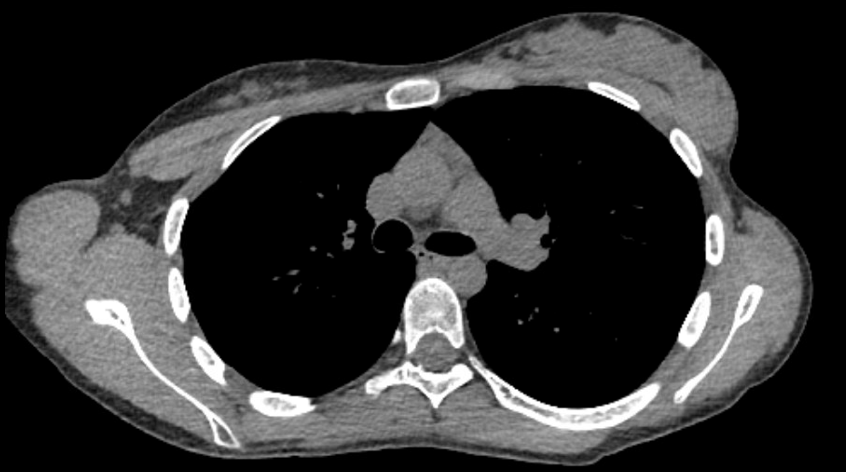 Abbildung 1. Repräsentativer Querschnitt einer axialen Computertomographie mit Thymushyperplasie ohne dominantes Thymom.
Abbildung 1. Repräsentativer Querschnitt einer axialen Computertomographie mit Thymushyperplasie ohne dominantes Thymom.
Die Behandlung von Myasthenia gravis ist in der Regel multidisziplinär und erfordert die Zusammenarbeit zwischen Neurologen und Thoraxchirurgen. Nach der Diagnose unterziehen sich die Patienten in der Regel einer Kombination aus medikamentösen Therapien, einschließlich Acetylcholinesterasen wie Pyridostigmin, Muskarinika wie Propanthelin und Immunmodulatoren wie Kortikosteroiden, Methotrexat oder Cyclophosphamid. Bei refraktärer Erkrankung kann eine Infusion von intravenösem Immunglobulin (IVIG) erforderlich sein. 1
Nach der Kontrolle über ein stabiles Schema werden die meisten Patienten zur chirurgischen Thymektomie überwiesen, die nachweislich die Abhängigkeit von medizinischen Therapien verringert und die berichteten Symptome verringert.
Unser Video zeigt eine robotergestützte Totalthymektomie über einen Zugang zur linken Brust. Minimalinvasive Thymektomien werden zunehmend mit subxiphoiden, linken, rechten oder bilateralen Zugängen durchgeführt, entweder mit thorakoskopischen oder robotergestützten Techniken. In seltenen Fällen kann ein transsternaler Zugang bei großen Tumoren oder Tumoren mit einer invasiven Komponente erforderlich sein. 4-6
Unser Patient hatte zuvor eine Myasthenie unter Kontrolle gebracht, die nun eskalierende medizinische Therapien erforderte. Es wurde angenommen, dass die Thymektomie es ihr ermöglichen könnte, sich von ihrer aktuellen Medikation zu entwöhnen, ohne dass die Symptome erneut auftreten.
Myasthenia gravis-Patienten müssen vor einer chirurgischen Thymektomie optimiert werden. Nach der Operation kann es bei nicht optimierten Patienten zu einer "myasthenischen Krise" kommen, die sich in einer tiefgreifenden Schwäche, Atemversagen und der Unfähigkeit, sich vom Beatmungsgerät zu entwöhnen, äußert. Um dies zu vermeiden, planten wir unseren Eingriff eine Woche nach ihrer letzten IVIG-Infusion und verabreichten ihnen zusätzlich intraoperative Stressdosis-Steroide. Darüber hinaus wurden spezielle Anästhesietechniken eingesetzt, einschließlich der Vermeidung von Lähmungen und der intravenösen Vollanästhesie, um mögliche postoperative myasthenische Komplikationen zu vermeiden.
Hier stellen wir eine robotergestützte Totalthymektomie über einen linksseitigen Thoraxzugang vor. Bei diesem Verfahren wird der gesamte Thymus und das damit verbundene Perikardfett entfernt. Die Grenzen für diese Resektion umfassen den linken und rechten Nervus phrenicus lateral, das Brustbein anterior, das Perikard posterior, das Zwerchfell inferior und die oberen Hörner des Thymus superior. Das gesamte Fettgewebe innerhalb dieser Grenzen wird reseziert, wobei darauf geachtet wird, dass die wichtigen nahe gelegenen Strukturen wie die Vene innominat, das Herz, die Aorta und die beidseitigen Nervus phrenicus nicht verletzt werden.
Der Patient wird in Rückenlage mit einer Beule unter der Operationsseite gelagert. Dies ermöglicht die vollständige Freilegung der linken Brust, während die Schulter aus dem Feld fallen gelassen wird, um Roboterkollisionen zu vermeiden. Der Eintritt in den Brustkorb an der vorderen Achsellinie im 4. Interkostalraum erfolgt mit einem 8-mm-Robotertrokar. Zwei 8-mm-Robotertrokare werden dann unter direkter Visualisierung platziert – einer in der Mittelklavikularlinie in der Unterbrustfalte und ein weiterer in der hinteren Achsellinie im 3. Interkostalraum. Schließlich wird ein 12-mm-Assistentenanschluss zwischen den beiden unteren Anschlüssen im 5. oder 6. Interkostalraum trianguliert. Sind alle Arbeitsanschlüsse platziert, wird der Roboter angedockt. Die Kamera befindet sich in der mittleren Roboteröffnung zwischen den beiden Arbeitsanschlüssen. Es gibt zwar viele Optionen, aber zu unseren Instrumenten der Wahl gehören ein Cadière-Greifer in der linken Hand und ein langer bipolarer Greifer in der rechten Hand.
Die Dissektion wird so inferior wie möglich direkt medial des Nervus phrenicus begonnen. Das Fettgewebe des Mediastinums wird von kaudal zu kopfförmig vom darunter liegenden Zwerchfell und Perikard mobilisiert. Mit einer Kombination aus stumpfer und elektrokauterischer Dissektion wird die Mobilisation medial und superior fortgesetzt, bis die Vena innominatis erreicht wird. Dieser Bereich wird mit äußerster Vorsicht angegangen und eventuell ableitende Venen zum Innominat werden mit Kauterisation oder chirurgischen Clips kontrolliert. Das rechte und linke obere Horn des Thymus werden nach unten zurückgezogen und frei präpariert. Zuletzt wird die Dissektion in die rechte Brust getragen. Das rechte mediastinale Pleura kann geöffnet werden, um die Identifizierung des rechten Nervus phrenicus zu ermöglichen.
Sobald der Thymus und das Mediastinalfett vollständig mobilisiert sind, wird die Probe mit Hilfe eines Entnahmebeutels aus dem Hilfsport entnommen. Eine einzelne Blake-Drainage wird für die Thoraxdrainage verwendet und durch einen der Roboterschnitte platziert. Der Roboter wird abgedockt, und die restlichen Ports werden entfernt und mit subkutikulären Nähten verschlossen.
Postoperativ wurde die Pleuradrainage überwacht und bewegte sich innerhalb normaler Grenzen. Die Blake-Drainage wurde am nächsten Morgen entfernt und der Patient am ersten postoperativen Tag entlassen. Die endgültige Pathologie stimmte mit der Thymushyperplasie überein. Nach 9 Monaten Nachbeobachtung ist der Patient weitgehend symptomfrei, mit Ausnahme einer leichten Diplopie, die nur mit extremer Müdigkeit einhergeht. Sie wurde von niedrig dosiertem Prednison entwöhnt und benötigt keine IVIG-Infusionen mehr.
- Constantine Poulos, MD: Schreiben, Überprüfen und Bearbeiten
- Tong-Yan Chen, MD: Videoproduktion, Schreiben, Überprüfen und Bearbeiten
- Lana Schumacher, MD: Videoproduktion, Schreiben, Überprüfen und Bearbeiten
Alle Autoren erklärten, dass es keine Interessenkonflikte gibt.
Der Patient, auf den sich dieser Videoartikel bezieht, hat seine Einverständniserklärung gegeben, gefilmt zu werden, und ist sich bewusst, dass Informationen und Bilder online veröffentlicht werden.
Animation nach der Veröffentlichung am 10.03.2025 hinzugefügt. Es wurden keine Änderungen am Inhalt des Artikels vorgenommen.
References
- Vincent A., Palast J., Hilton-Jones D. Myasthenia gravis. Lanzette. 2001; 357(9274):2122-2128. doi:10.1016/S0140-6736(00)05186-2.
- Gronseth GS, Barohn R, Narayanaswami P. Praxisberatung: Thymektomie bei Myasthenia gravis (Aktualisierung der Praxisparameter): Bericht des Unterausschusses für die Entwicklung, Verbreitung und Umsetzung von Leitlinien der American Academy of Neurology. Neurologie. 2020; 94(16):705-709. doi:10.1212/WNL.000000000009294.
- Wolfe GI, Kaminski HJ, Aban IB, et al. Randomisierte Studie zur Thymektomie bei Myasthenia gravis. N Engl J Med. 2016; 375(6):511-522. doi:10.1056/NEJMoa1602489.
- Marulli G, Comacchio GM, Rea F. Robotergestützte Thymektomie. J Vis Surg. 2017;3:68. doi:10.21037/jovs.2017.05.01.
- Wei B, Cerfolio R. Robotergestützte Thymektomie. J Vis Surg. 2016;2:136. doi:10.21037/jovs.2016.07.17.
- Holleran TJ, Napolitano MA, Crowder HR, Sparks AD, Antevil JL, Trachiotis GD. Klinische Ergebnisse und technischer Ansatz der Thymektomie in der Gesundheitsverwaltung von Veteranen. Ann Thorac Chirurgie. 2022; 113(5):1648-1655. doi:10.1016/j.athoracsur.2021.05.020.
Cite this article
Poulos CM, Chen TY, Schumacher L. Robotergestützte Thymektomie bei Myasthenia gravis. J Med Insight. 2024; 2024(426). doi:10.24296/jomi/426.



