Inserção de um cateter PleurX do lado direito para paliação de um derrame pleural maligno
Main Text
Table of Contents
O caso a seguir descreve uma mulher de 91 anos sem história médica pregressa significativa que se apresentou ao médico de cuidados primários com vários meses de tosse e dispneia progressiva. Após investigação apropriada, descobriu-se que ela tinha um adenocarcinoma de pulmão em estágio IVa com derrame pleural maligno associado que contribuiu para seus sintomas. Existem várias opções terapêuticas para o tratamento de um derrame pleural maligno. Um cateter pleural tunelizado de demora (cateter PleurX) é uma maneira confiável de tratar um derrame pleural crônico. O dispositivo é mais comumente usado para tratar derrames pleurais malignos, mas a mesma técnica também pode ser aplicada a uma variedade de indicações benignas e não infecciosas. Os cateteres PleurX podem ser inseridos em um ambulatório, sala de radiologia intervencionista, ambiente de internação ou sala de cirurgia sob anestesia local ou geral. Uma vez instalados, eles são projetados para serem tratados em ambiente ambulatorial pelos cuidadores do paciente ou pelo próprio paciente e servem para paliar os sintomas respiratórios de um grande derrame sem a necessidade de toracocenteses repetidas. Eles podem permanecer no local por vários meses, e a remoção em ambiente ambulatorial com anestésico local é trivial. Após a colocação do cateter PleurX, a paciente relatou melhora sintomática em sua dispneia e iniciou o uso de mobocertinibe com dose reduzida sob a orientação de oncologia torácica.
PleurX, cateter pleural de demora, derrame pleural crônico, derrame crônico, derrame pleural maligno, derrame maligno.
A paciente é uma mulher de 91 anos com poucos outros problemas médicos que se apresentou ao seu médico de cuidados primários com queixa de vários meses de tosse e dispneia progressiva. Antes disso, ela vivia de forma independente, com o mínimo de assistência de seus filhos. Mais recentemente, ela se sentiu cansada e teve dificuldade em cuidar de si mesma. Seu exame físico foi notável pela ausência de murmúrios vesiculares do lado direito. A radiografia de tórax demonstrou opacificação completa do hemitórax direito. A tomografia computadorizada e a PET subsequente mostraram uma grande massa no hilo central direito, que era intensamente ávida por FDG e que obstruía o brônquio principal direito, resultando em atelectasia quase completa do pulmão direito. O restante do hemitórax direito era ocupado por líquido de baixa densidade, e havia evidência de espessamento pleural e adenopatia mediastinal. Foi realizada toracocentese e removido 1,5 L de líquido cor de palha, com alguma melhora dos sintomas do paciente. A citologia do líquido pleural demonstrou células malignas com imuno-histoquímica compatível com adenocarcinoma de origem pulmonar. Foi feito o diagnóstico de adenocarcinoma de pulmão estágio IVa. Ela foi encaminhada para oncologia para discutir opções de tratamento sistêmico e para cirurgia torácica para paliação durável do derrame pleural.
Um derrame pleural maligno é uma característica de muitas apresentações avançadas de câncer. Os cânceres de pulmão, mama e mesotélio primário são os mais propensos a causar derrame pleural maligno, mas qualquer malignidade tem o potencial. 1–3 No estado normal, o espaço pleural contém ~0,26 mL/kg de líquido por quilograma de massa corporal em um estado constante de produção e absorção. 3 Um derrame maligno representa a desregulação de um ou ambos os processos, geralmente pela produção de fluido a partir de implantes tumorais na pleura ou de canais linfáticos absortivos obstrutivos do tumor. 1,3
Os pacientes apresentam dispneia secundária à atelectasia compressiva do pulmão afetado. 1,4,5 Dor torácica pleurítica às vezes está presente e pode indicar invasão mais profunda da parede torácica de implantes pleurais metastáticos. 4 Derrames malignos raramente são infectados antes da instrumentação.
O diagnóstico é feito combinando o achado de um grande derrame na imagem com um diagnóstico conhecido de câncer avançado. 3,4 O fluido deve ser exsudativo com base em estudos químicos, mas esses testes são inúteis. A citologia fluídica que demonstra células malignas é patognomônica para o diagnóstico, mas a citologia fluídica negativa não a descarta. 3,4 Se houver ambiguidade sobre o diagnóstico, como freqüentemente acontece com o mesotelioma primário, uma toracoscopia diagnóstica com biópsias pleurais deve ser realizada. 1
Um derrame maligno é um sinal de câncer avançado e geralmente pressagia um prognóstico desfavorável. 3,5 O tratamento se concentra no início da terapia sistêmica para controle da doença e paliação dos sintomas relacionados ao líquido pleural. Intervenções que minimizem hospitalizações e interrupções da terapia sistêmica são favorecidas em relação a procedimentos mais complexos e mórbidos. 3,5
No estágio inicial da doença, é possível evacuar completamente um derrame maligno e expandir o pulmão afetado. Se a taxa de produção de líquido pleural não for excessiva, um procedimento ablativo pleural, como pleurodese química ou mecânica, pode fornecer paliação durável. 1,4 A maioria dos pacientes se apresenta no momento em que o aprisionamento do pulmão pelo tumor e o alto volume de líquido pleural impedem essa abordagem. 1 A drenagem do fluido resulta em um pneumotórax-ex-vácuo, caracterizado por ar no hemitórax acoplado a um pulmão não expandido. O fluido se reacumula rapidamente dentro deste espaço. 2 A maioria dos pacientes experimentará alguma melhora nos sintomas após a drenagem do fluido, apesar da expansão pulmonar incompleta, mas o efeito é transitório. 2 Esses pacientes podem optar por repetir as toracocenteses, mas isso tende a ser logisticamente complicado e proporcionar pouco alívio dos sintomas. 3 O risco cumulativo de toracocentese também cresce linearmente a cada tentativa subsequente.
A colocação de um cateter pleural tunelizado de demora oferece alívio duradouro dos sintomas sem a necessidade de procedimentos repetidos. 1–3,6 Os cateteres podem ser colocados no consultório, à beira do leito em ambiente de internação, em uma sala intervencionista sob orientação de imagem ou na sala de cirurgia com ou sem adição de toracoscopia. 1 Uma vez colocado, o cateter pode ser drenado de acordo com o uso de garrafas a vácuo pré-fabricadas. A assistência de enfermagem geralmente é necessária no início, mas os pacientes ou familiares frequentemente assumem a responsabilidade pela drenagem. O processo de drenagem inclui a preparação estéril do cateter, conexão ao frasco de vácuo, drenagem por um período de vários minutos, desconexão do cateter e reajuste do local do cateter. 5,7 O volume e a frequência da drenagem são diferentes dependendo das circunstâncias do paciente. Na ausência de outras informações, uma recomendação de drenagem de até 1L três vezes por semana servirá ao paciente médio.
As vantagens de um cateter pleural de demora incluem alívio duradouro dos sintomas e promoção da autonomia do paciente. 1,3,5 As desvantagens incluem o desconforto associado à colocação do cateter, desconforto associado à drenagem (geralmente uma dor aguda e pleurítica que ocorre tardiamente no processo de drenagem e indica um colapso do espaço pleural) e complicações associadas ao próprio cateter. 8 As complicações incluem deslocamento do cateter (raro após as primeiras semanas), oclusão do cateter (recuperável pela administração de fibrinolíticos transcateter) e infecção do cateter ou do espaço pleural. A infecção é incomum, mas o risco aumenta quanto mais tempo o cateter permanece. 6,8 As infecções superficiais são tratadas com antibióticos e remoção do cateter, com planos de substituição em um novo local da pele em um futuro próximo. 8 As infecções do espaço pleural são mais desafiadoras: muitas vezes é necessário remover o cateter, colocar um novo tubo temporário para evacuação completa do espaço pleural, fibrinólise intrapleural e antibióticos intravenosos. 8 Deve decorrer um tempo considerável antes que a substituição do cateter seja considerada.
No vídeo em anexo, a colocação de um cateter PleurX está sendo realizada na sala de cirurgia para demonstrar a configuração e a técnica mais ideais. O kit PleurX é independente e inclui:
- Cortinas estéreis,
- Preparação da pele.
- Anestésico local, seringas e agulhas.
- Um cateter de inserção, fio-guia, trocarte dilatador e bainha de separação.
- O tubo PleurX e um dispositivo de tunelamento.
- Uma tampa para o tubo ou, alternativamente, um conector para prendê-lo ao sistema de drenagem torácica.
- Sutura e curativos.
- Não estão incluídos os aventais e luvas estéreis e os frascos de vácuo para drenagem.
A posição lateral parcial é confortável para pacientes que conseguem deitar e permite o uso de sedação consciente. Alternativamente, os pacientes podem sentar-se na beira da cama e inclinar-se sobre uma mesa, como fariam para a colocação do cateter peridural. A exposição do arco costal e da parede torácica lateral é importante. A pele é preparada e coberta de forma estéril. Os pontos de entrada e saída ideais para o tubo são selecionados. As principais considerações incluem a facilidade de acesso e gerenciamento do tubo pelo paciente, bem como a colocação do tubo em uma posição dependente para maximizar a drenagem. A pele é marcada nos locais de saída da pele e entrada pleural. O local de saída da pele é tipicamente ao longo da margem costal, enquanto o local de entrada pleural é mais posterior. Uma distância de 10 ou mais centímetros entre os dois locais garante um túnel subcutâneo que mitiga o risco de infecção do espaço pleural; A distância excessiva torna o processo de tunelamento desafiador.
O anestésico local é administrado em uma pápula subcutânea em ambos os locais. Um bloqueio do nervo intercostal é realizado no local de entrada pleural posterior. Isso é realizado administrando anestésico local ao redor do periósteo da costela sobre a qual o cateter será colocado, entrando no espaço pleural acima dessa costela, retirando o líquido pleural e, em seguida, retirando a agulha enquanto injeta uma quantidade generosa de anestésico local. Se nenhum líquido pleural for aspirado neste local, um novo local deve ser selecionado. A ultrassonografia pode ser útil para orientar esta etapa.
Incisões cutâneas de um centímetro são feitas em ambos os locais. O tunelizador é usado para passar o cateter entre o local de saída da pele anterior e o local de entrada do espaço pleural posterior. Na extremidade distal do tubo há um manguito projetado para fixar o tubo ao túnel subcutâneo, provocando uma reação fibroinflamatória. O manguito é idealmente deixado apenas profundamente na incisão anterior da saída da pele, facilitando a remoção futura sob anestesia local.
O espaço pleural é acessado através do local posterior usando a bainha de inserção. Uma vez aspirado o líquido pleural, a agulha é removida e um fio-guia é colocado através da bainha. A bainha é removida. Um dilatador é inserido sobre o fio-guia até as costelas. Isso é seguido em série por uma bainha separável. Com a bainha separável no lugar, o fio e a parte interna da bainha são removidos e o cateter PleurX é alimentado através do canal. A bainha pode ser quebrada à medida que o cateter avança para o espaço pleural. A aplicação de sucção no cateter com drenagem resultante do líquido pleural confirma a colocação adequada.
A pele no local de entrada pleural posterior é fechada de forma subcutânea. O cateter pode ser suturado à pele para segurança adicional, mas nossa preferência é usar os curativos estéreis incluídos para esse fim, para evitar o problema de uma sutura externa esquecida.
O tubo pode ser tampado para uso posterior ou conectado a um sistema de drenagem autônomo para evacuação completa do espaço pleural durante um período de tempo. Normalmente, restringimos a drenagem de fluido a não mais que 1,5 L de cada vez para evitar a complicação rara, mas potencialmente fatal, do edema pulmonar de reexpansão.
A colocação de um cateter PleurX é bem tolerada pelos pacientes e resulta em melhora imediata naqueles para os quais a doença pleural é um contribuinte significativo para a dispneia. A melhora marginal ou ausente dos sintomas pode indicar drenagem incompleta, mas é mais provável que fale da natureza polifatorial da dispneia como um sintoma. As complicações da colocação incluem falha no acesso ao espaço pleural, colocação subdiafragmática do cateter (particularmente em um paciente com ascite), sangramento e danos às estruturas subjacentes. O sangramento pode ser causado por lesão na vasculatura intercostal, entrada no parênquima pulmonar ou ruptura das aderências pleurais. Raramente, a embolização ou a exploração cirúrgica são necessárias.
Nosso paciente tolerou bem o procedimento e a operação ocorreu sem complicações. Ela relatou melhora sintomática de sua dispneia dentro de 1 semana após a colocação do cateter PleurX. Seu cateter foi drenado por meio de uma visita à enfermagem em sua casa por cerca de 125 a 250 mL de líquido pleural duas vezes por semana durante as primeiras semanas após a colocação. Posteriormente, o débito de drenagem começou a diminuir, até que o débito foi de 0 mL cerca de 2,5 meses após a colocação do cateter PleurX. Cerca de 4 meses após a colocação, o paciente foi posteriormente internado no hospital por anormalidades eletrolíticas, náuseas, vômitos, diarreia e má ingestão de PO relacionados à terapia sistêmica com mobocertinibe que havia sido iniciada pela oncologia torácica. Como a saída do cateter foi mínima, ele foi removido à beira do leito durante a internação.
As tomografias computadorizadas do paciente antes e após a colocação do cateter PleurX podem ser vistas nas Figuras 1 e 2.
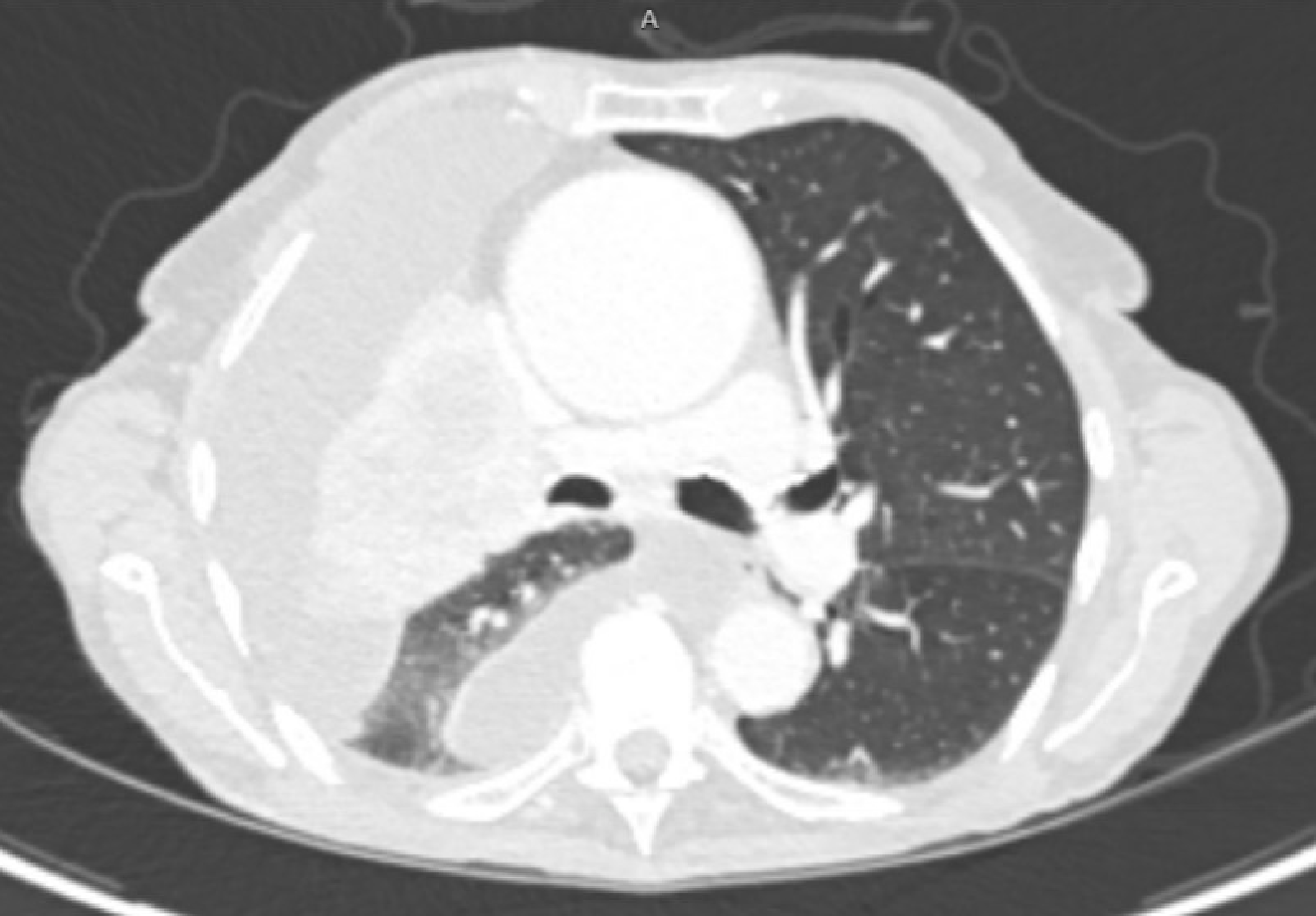
Figura 1. A tomografia computadorizada do paciente antes da colocação do cateter PleurX.
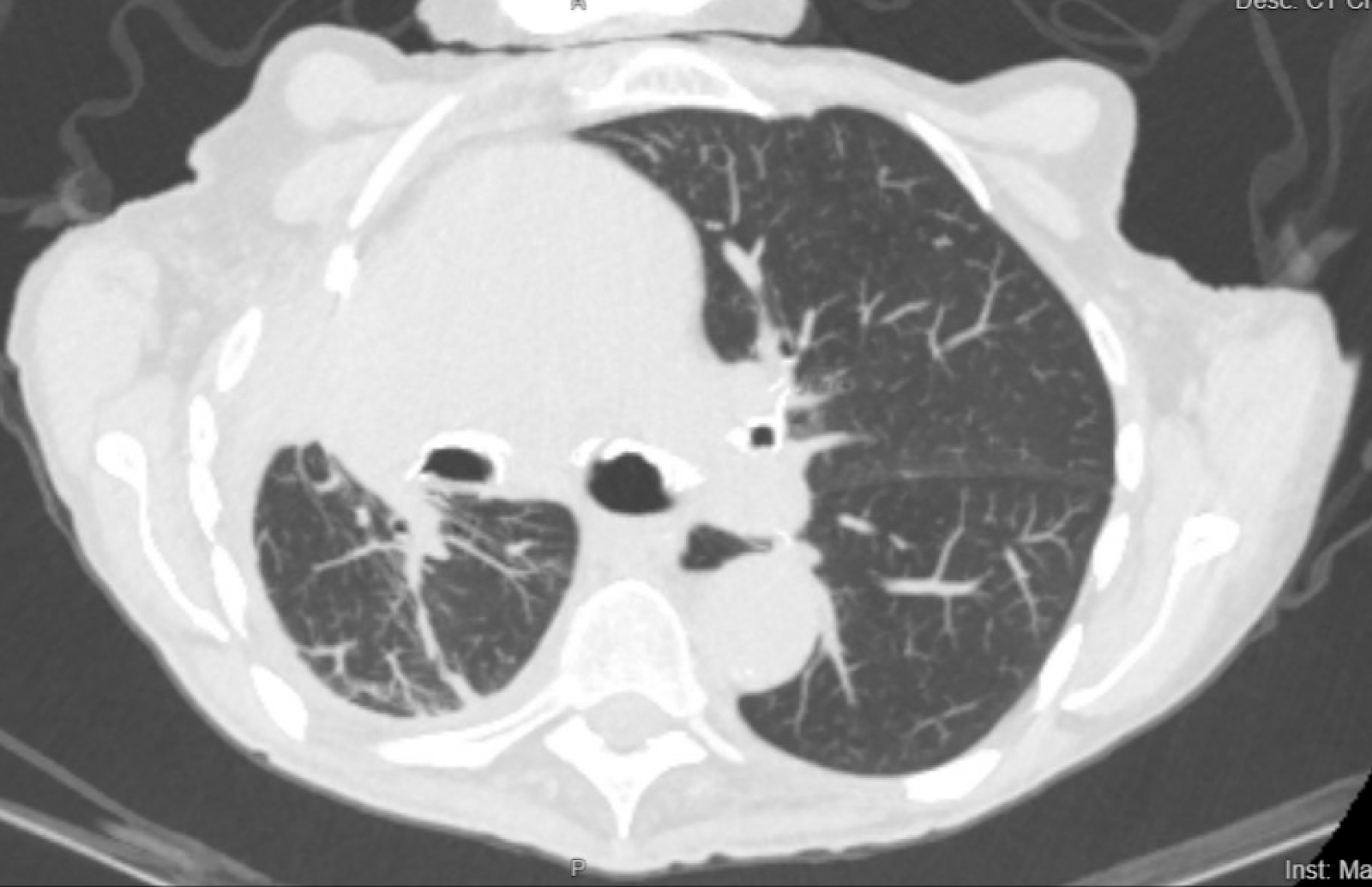
Figura 2. A tomografia computadorizada do paciente 4 meses após a colocação do cateter PleurX.
O paciente referido neste artigo em vídeo deu seu consentimento informado para ser filmado e está ciente de que informações e imagens serão publicadas online.
References
-
Gonnelli F, Hassan W, Bonifazi M, et al. Derrame pleural maligno: compreensão atual e abordagem terapêutica. Respir Res. 19 de janeiro de 2024; 25(1):47. DOI:10.1186/S12931-024-02684-7.
-
Hofmann HS, Scheule AM, Markowiak T, Ried M. O tratamento do derrame pleural maligno com cateteres pleurais permanentes. Dtsch arztebl int. 5 de setembro de 2022; 119(35-36):595-600. DOI:10.3238/arztebl.m2022.0229.
-
Skok K, Hladnik G, Grm A, Crnjac A. Derrame pleural maligno e seu manejo atual: uma revisão. Medicina (Kaunas). 15 de agosto de 2019; 55(8):490. DOI:10.3390/medicina55080490.
-
Ferreiro L, Suárez-Antelo J, Álvarez-Dobaño JM, Toubes ME, Riveiro V, Valdés L. Derrame Pleural Maligno: Diagnóstico e Tratamento. Pode respirar J. 23 de setembro de 2020;2020:2950751. DOI:10.1155/2020/2950751.
-
Egan AM, McPhillips D, Sarkar S, Breen DP. Derrame pleural maligno. QJM. Março de 2014; 107(3):179-84. DOI:10.1093/qjmed/hct245.
-
Wang S, Zhang R, Wan C, et al. Incidência de complicações do cateter pleural de demora para derrame pleural: uma meta-análise. Clin Transl Sci. Janeiro de 2023; 16(1):104-117. DOI:10.1111/CTS.13430.
-
Addala DN, Kanellakis NI, Bedawi EO, Dong T, Rahman NM. Derrame pleural maligno: atualizações no diagnóstico, manejo e desafios atuais. Oncol frontal. 17 de novembro de 2022;12:1053574. DOI:10.3389/fonc.2022.1053574.
-
Chalhoub M, Saqib A, Castellano M. Cateteres pleurais de demora: complicações e estratégias de manejo. J Thorac dis. Julho de 2018; 10(7):4659-4666. DOI:10.21037/jtd.2018.04.160.
Cite this article
Chung AS, Auchincloss HG. Inserção de um cateter PleurX do lado direito para paliação de um derrame pleural maligno. J Med Insight. 2024; 2024(419). DOI:10.24296/jomi/419.


