Insertion d’un cathéter PleurX du côté droit pour pallier un épanchement pleural malin
Main Text
Table of Contents
Le cas suivant décrit une femme de 91 ans sans antécédents médicaux importants qui s’est présentée à son médecin de soins primaires avec une toux et une dyspnée progressive pendant plusieurs mois. Après un examen approprié, elle présentait un adénocarcinome pulmonaire de stade IVa associé à un épanchement pleural malin qui a contribué à ses symptômes. Il existe plusieurs options thérapeutiques pour traiter un épanchement pleural malin. Un cathéter pleural tunnelisé à demeure (cathéter PleurX) est un moyen fiable de gérer un épanchement pleural chronique. Le dispositif est le plus souvent utilisé pour gérer les épanchements pleuraux malins, mais la même technique peut également être appliquée pour une gamme d’indications bénignes et non infectieuses. Les cathéters PleurX peuvent être insérés dans une clinique externe, une salle de radiologie interventionnelle, un milieu hospitalier ou une salle d’opération sous anesthésie locale ou générale. Une fois en place, ils sont conçus pour être pris en charge en consultation externe soit par les soignants du patient, soit par le patient lui-même et servent à pallier les symptômes respiratoires d’un épanchement important sans qu’il soit nécessaire de recourir à des thoracentèses répétées. Ils peuvent rester en place pendant plusieurs mois, et leur retrait en ambulatoire avec une anesthésie locale est trivial. Après la mise en place du cathéter PleurX, la patiente a signalé une amélioration symptomatique de sa dyspnée et elle a commencé à prendre du Mobocertinib à dose réduite sous la direction de l’oncologie thoracique.
PleurX, cathéter pleural à demeure, épanchement pleural chronique, épanchement chronique, épanchement pleural malin, épanchement malin.
La patiente est une femme de 91 ans avec peu d’autres problèmes médicaux qui s’est présentée à son médecin de soins primaires avec une plainte de plusieurs mois de toux et de dyspnée progressive. Avant cela, elle vivait de manière autonome avec une aide minimale de la part de ses enfants. Plus récemment, elle s’était sentie fatiguée et avait de la difficulté à prendre soin d’elle-même. Son examen physique a révélé l’absence de bruits de respiration du côté droit. La radiographie pulmonaire a montré une opacification complète de l’hémithorax droit. La tomodensitométrie et la TEP qui a suivi ont montré une grande masse dans le hile central droit, qui était intensément avide de FDG et qui a obstrué la bronche principale droite, entraînant une atélectasie presque complète du poumon droit. Le reste de l’hémithorax droit était occupé par un liquide de faible densité, et il y avait des signes d’épaississement pleural et d’adénopathie médiastinale. Une thoracentèse a été pratiquée et 1,5 L de liquide de couleur paille a été retiré, ce qui a entraîné une certaine amélioration des symptômes du patient. La cytologie du liquide pleural a mis en évidence des cellules malignes avec une immunohistochimie compatible avec un adénocarcinome d’origine pulmonaire. Un diagnostic d’adénocarcinome pulmonaire de stade IVa a été posé. Elle a été dirigée vers l’oncologie pour discuter des options de traitement systémique et vers la chirurgie thoracique pour une palliation durable de l’épanchement pleural.
Un épanchement pleural malin est une caractéristique de nombreuses présentations cancéreuses avancées. Les cancers du poumon, du sein et de la mésothélie primitive sont les plus susceptibles de provoquer un épanchement pleural malin, mais toute tumeur maligne a le potentiel. 1 à 3 À l’état normal, l’espace pleural contient ~0,26 mL/kg de liquide par kilogramme de masse corporelle dans un état constant de production et d’absorption. 3 Un épanchement malin représente une dérégulation de l’un ou des deux processus, généralement par la production de liquide à partir d’implants tumoraux sur la plèvre ou d’une tumeur obstruant les canaux lymphatiques absorbants. 1,3
Les patients présentent une dyspnée secondaire à une atélectasie compressive du poumon affecté. 1,4,5 Une douleur thoracique pleurétique est parfois présente et peut indiquer une invasion plus profonde de la paroi thoracique des implants pleuraux métastatiques. 4 Les épanchements malins s’infectent rarement avant l’instrumentation.
Le diagnostic est posé en combinant la découverte d’un épanchement important à l’imagerie avec un diagnostic connu de cancer avancé. 3,4 Le liquide devrait être exsudatif sur la base d’études chimiques, mais ces tests ne sont pas utiles par ailleurs. La cytologie liquidienne mettant en évidence la présence de cellules malignes est pathognomonique pour le diagnostic, mais la cytologie liquidienne négative ne l’exclut pas. 3,4 En cas d’ambiguïté sur le diagnostic, comme c’est souvent le cas avec le mésothéliome primitif, une thoracoscopie diagnostique avec biopsies pleurales doit être effectuée. 1
Un épanchement malin est un signe de cancer avancé et laisse généralement présager un mauvais pronostic. 3.5 Le traitement se concentre sur l’instauration d’un traitement systémique pour contrôler la maladie et pallier les symptômes liés au liquide pleural. Les interventions qui minimisent les hospitalisations et les interruptions du traitement systémique sont privilégiées par rapport aux procédures morbides plus complexes. 3,5
Au stade précoce de la maladie, il est possible d’évacuer complètement un épanchement malin et d’élargir le poumon affecté. Si le taux de production de liquide pleural n’est pas excessif, une procédure d’ablation pleurale telle qu’une pleurodèse chimique ou mécanique peut fournir une palliation durable. 1,4 La plupart des patients se présentent à des moments où le piégeage du poumon par la tumeur et le volume élevé de liquide pleural excluent cette approche. 1 Le drainage du liquide entraîne un pneumothorax-ex-vacuo, caractérisé par de l’air dans l’hémithorax couplé à un poumon non dilaté. Le fluide s’accumule rapidement dans cet espace. 2 La plupart des patients ressentiront une certaine amélioration des symptômes après le drainage du liquide malgré une expansion pulmonaire incomplète, mais l’effet est transitoire. 2 Ces patients peuvent choisir d’avoir des thoracentèses répétées, mais cela a tendance à être compliqué sur le plan logistique et à soulager mal les symptômes. 3 Le risque cumulatif de thoracentèse augmente également de manière linéaire à chaque tentative ultérieure.
La mise en place d’un cathéter pleural tunnelisé à demeure offre un soulagement durable des symptômes sans qu’il soit nécessaire de répéter les procédures. 1 à 3,6 Les cathéters peuvent être placés au cabinet, au chevet du patient en milieu hospitalier, dans une salle d’intervention sous guidage par imagerie, ou en salle d’opération avec ou sans l’ajout d’une thoracoscopie. 1 Une fois en place, le cathéter peut être vidangé selon un calendrier à l’aide de bouteilles à vide préfabriquées. L’aide infirmière est généralement nécessaire au début, mais les patients ou les membres de la famille assument souvent la responsabilité du drainage. Le processus de drainage comprend la préparation stérile du cathéter, le raccordement à la bouteille à vide, le drainage sur une période de plusieurs minutes, la déconnexion du cathéter et le redressement du site du cathéter. 5,7 Le volume et la fréquence du drainage varient en fonction de la situation du patient. En l’absence d’autres informations, une recommandation de drainage allant jusqu’à 1L trois fois par semaine servira au patient moyen.
Les avantages d’un cathéter pleural à demeure comprennent un soulagement durable des symptômes et la promotion de l’autonomie du patient. 1,3,5 Les inconvénients comprennent l’inconfort associé à la mise en place du cathéter, l’inconfort associé au drainage (généralement une douleur pleurétique aiguë survenant tard dans le processus de drainage et indiquant un affaissement de l’espace pleural) et les complications associées au cathéter lui-même. 8 Les complications comprennent le déplacement du cathéter (rare après les premières semaines), l’occlusion du cathéter (récupérable par l’administration de fibrinolytiques transcathéter) et l’infection du cathéter ou de l’espace pleural. L’infection est rare, mais le risque augmente au fur et à mesure que le cathéter reste longtemps. 6,8 Les infections superficielles sont traitées avec des antibiotiques et l’ablation du cathéter, avec des plans de remplacement à un nouveau site cutané dans un avenir proche. 8 Les infections de l’espace pleural sont plus difficiles : il est souvent nécessaire de retirer le cathéter, de placer un nouveau tube temporaire pour l’évacuation complète de l’espace pleural, une fibrinolyse intrapleurale et des antibiotiques intraveineux. 8 Un temps considérable doit s’écouler avant que le remplacement du cathéter ne soit envisagé.
Dans la vidéo ci-jointe, la mise en place d’un cathéter PleurX est effectuée dans la salle d’opération afin de démontrer le réglage et la technique les plus optimaux. Le kit PleurX est autonome et comprend :
- Champs stériles,
- Préparation de la peau.
- Anesthésique local, seringues et aiguilles.
- Un cathéter d’insertion, un fil-guide, un trocart dilatateur et une gaine détachable.
- Le tube PleurX et un dispositif à effet tunnel.
- Un capuchon pour le tube, ou bien un connecteur pour l’accrocher au système de drainage thoracique.
- Suture et pansements.
- Les blouses et les gants stériles ainsi que les bouteilles sous vide pour le drainage ne sont pas inclus.
La position latérale partielle est confortable pour les patients qui sont capables de s’allonger à plat et permet l’utilisation d’une sédation consciente. Alternativement, les patients peuvent s’asseoir au bord du lit et se pencher au-dessus d’une table comme ils le feraient pour la mise en place d’un cathéter épidural. L’exposition de l’arc costal et de la paroi thoracique latérale est importante. La peau est préparée et drapée de manière stérile. Les points d’entrée et de sortie optimaux du tube sont sélectionnés. Les principales considérations comprennent la facilité d’accès et la gestion de la sonde par le patient, ainsi que le placement de la sonde dans une position dépendante pour maximiser le drainage. La peau est marquée au niveau de la sortie de la peau et des sites d’entrée pleurale. Le site de sortie de la peau se trouve généralement le long de la marge costale, tandis que le site d’entrée pleurale est plus postérieur. Une distance de 10 centimètres ou plus entre les deux sites assure un tunnel sous-cutané qui atténue le risque d’infection de l’espace pleural ; Une distance excessive rend le processus de creusement de tunnels difficile.
L’anesthésique local est administré dans une papule sous-cutanée aux deux sites. Un bloc nerveux intercostal est réalisé au site d’entrée pleurale postérieur. Ceci est réalisé en administrant un anesthésique local autour du périoste de la côte sur laquelle le cathéter sera placé, en pénétrant dans l’espace pleural au-dessus de cette côte, en retirant le liquide pleural, puis en retirant l’aiguille tout en injectant une quantité généreuse d’anesthésique local. Si aucun liquide pleural n’est aspiré à ce site, un nouveau site doit être sélectionné. L’échographie peut être utile pour guider cette étape.
Des incisions cutanées d’un centimètre sont pratiquées aux deux endroits. Le tunnelier est utilisé pour faire passer le cathéter entre le site de sortie de la peau antérieure et le site d’entrée de l’espace pleural postérieur. À l’extrémité distale du tube se trouve un brassard conçu pour fixer le tube au tunnel sous-cutané en provoquant une réaction fibro-inflammatoire. Le brassard est idéalement laissé juste en profondeur jusqu’à l’incision de sortie antérieure de la peau, ce qui facilite le retrait futur sous anesthésie locale.
L’accès à l’espace pleural se fait par le site postérieur à l’aide de la gaine d’insertion. Une fois le liquide pleural aspiré, l’aiguille est retirée et un fil-guide est placé à travers la gaine. La gaine est retirée. Un dilatateur est inséré sur le fil-guide juste en profondeur jusqu’aux côtes. Celle-ci est suivie en série d’une gaine détachable. Une fois la gaine détachable en place, le fil et la partie intérieure de la gaine sont retirés et le cathéter PleurX est alimenté par le canal. La gaine peut être rompue à mesure que le cathéter avance dans l’espace pleural. L’application d’une aspiration sur le cathéter avec drainage du liquide pleural qui en résulte confirme un placement adéquat.
La peau au niveau du site d’entrée pleurale postérieur est fermée de manière sous-cutanée. Le cathéter peut être suturé à la peau pour plus de sécurité, mais notre préférence est d’utiliser les pansements stériles inclus à cette fin pour éviter le problème d’une suture externe oubliée.
Le tube peut être bouché pour une utilisation ultérieure ou connecté à un système de drainage autonome pour une évacuation complète de l’espace pleural sur une période de temps. Nous limitons généralement le drainage du liquide à un maximum de 1,5 L à la fois pour prévenir la complication rare mais potentiellement mortelle de l’œdème pulmonaire de réexpansion.
La mise en place d’un cathéter PleurX est bien tolérée par les patients et entraîne une amélioration immédiate chez ceux pour qui la maladie pleurale est un contributeur important à la dyspnée. Une amélioration marginale ou absente des symptômes peut indiquer un drainage incomplet, mais il est plus probable qu’elle témoigne de la nature polyfactorielle de la dyspnée en tant que symptôme. Les complications de la mise en place comprennent l’incapacité d’accéder à l’espace pleural, la mise en place sous-diaphragmatique du cathéter (en particulier chez un patient atteint d’ascite), des saignements et des lésions des structures sous-jacentes. Les saignements peuvent être causés par une lésion du système vasculaire intercostal, l’entrée dans le parenchyme pulmonaire ou une perturbation des adhérences pleurales. Rarement, une embolisation ou une exploration chirurgicale sont nécessaires.
Notre patient a bien toléré l’intervention et l’opération s’est déroulée sans complication. Elle a signalé une amélioration symptomatique de sa dyspnée dans la semaine suivant la mise en place du cathéter PleurX. Son cathéter a été drainé par les infirmières visiteuses à son domicile pour environ 125 à 250 ml de liquide pleural deux fois par semaine pendant les premières semaines après la mise en place. Par la suite, le débit de drainage a commencé à diminuer, jusqu’à ce qu’il soit de 0 mL environ 2,5 mois après la mise en place du cathéter PleurX. Environ 4 mois après la mise en place, le patient a été admis à l’hôpital pour des anomalies électrolytiques, des nausées, des vomissements, de la diarrhée et un faible apport en PO liés au traitement systémique au Mobocertinib amorcé par l’oncologie thoracique. Étant donné que le débit du cathéter avait été minime, il a été retiré au chevet du patient lors de cette admission.
Les figures 1 et 2 montrent que la tomodensitométrie du patient avant et après la mise en place du cathéter PleurX est pratiquée.
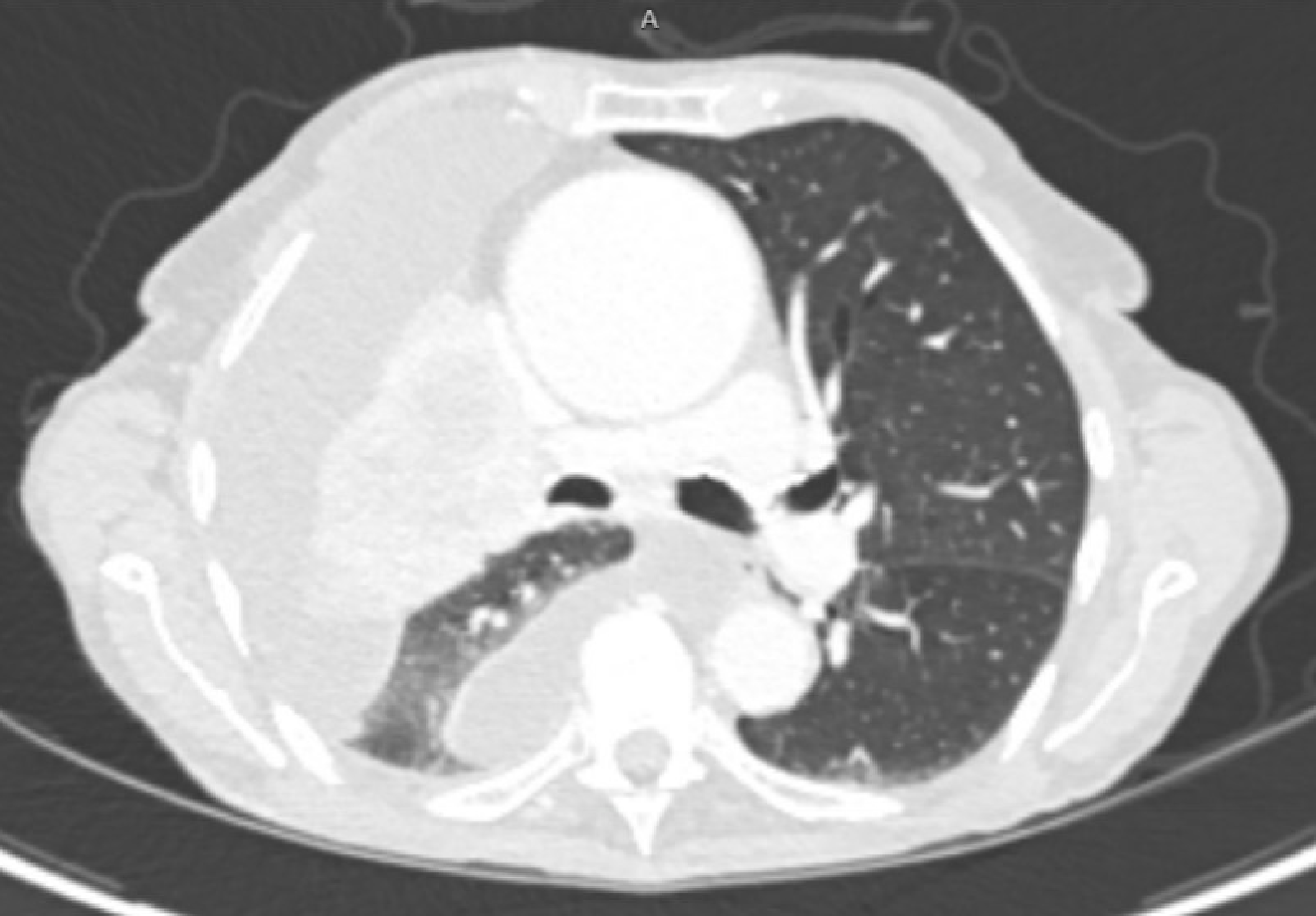
Graphique 1. La tomodensitométrie du patient avant la mise en place du cathéter PleurX.
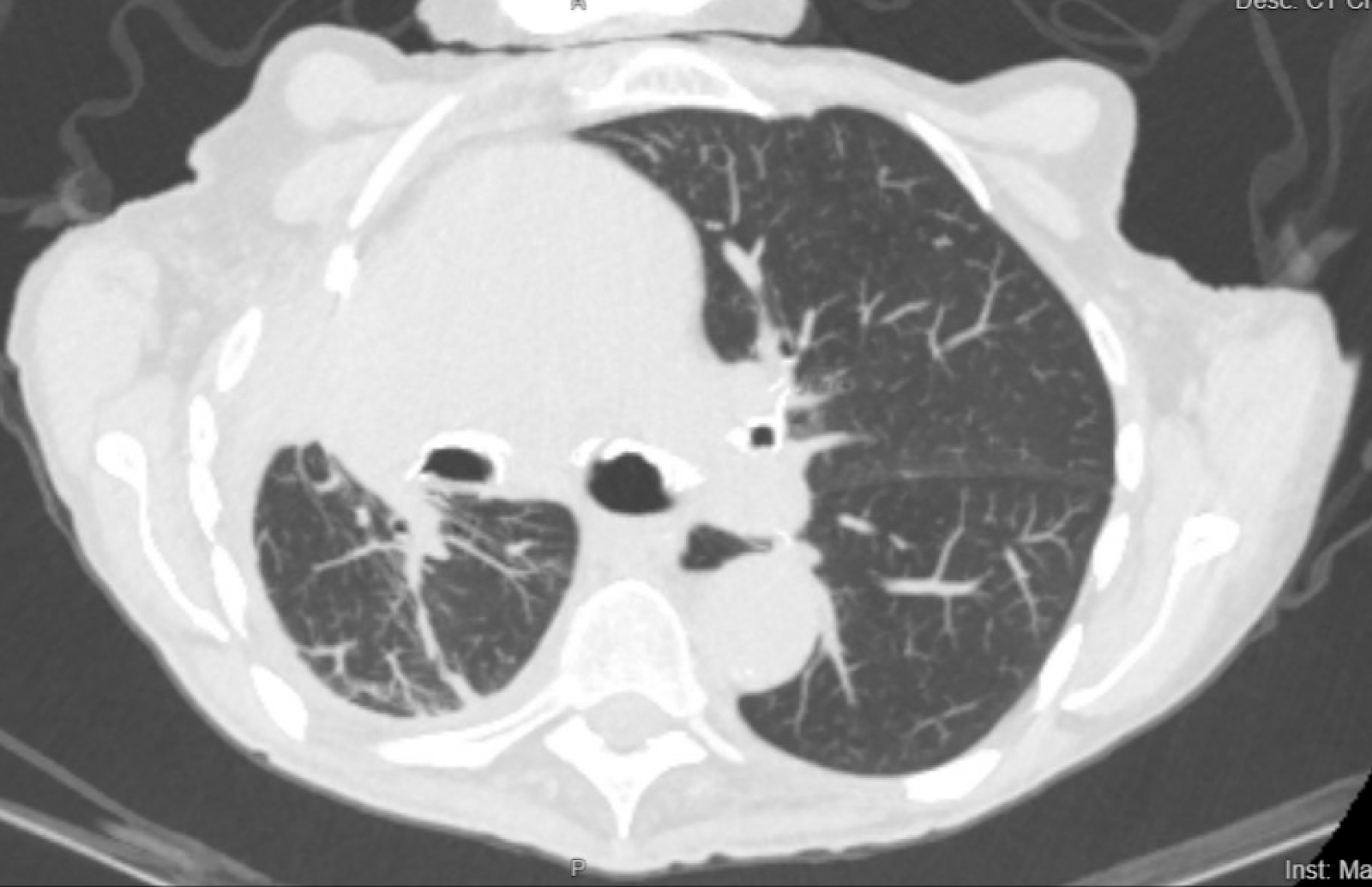
Graphique 2. La tomodensitométrie du patient 4 mois après la pose du cathéter PleurX.
Le patient visé dans cet article vidéo a donné son consentement éclairé pour être filmé et est conscient que des informations et des images seront publiées en ligne.
References
-
Gonnelli F, Hassan W, Bonifazi M, et al. Épanchement pleural malin : connaissances actuelles et approche thérapeutique. Respir Res. 19 janvier 2024 ; 25(1):47. doi :10.1186/s12931-024-02684-7.
-
Hofmann HS, Scheule AM, Markowiak T, Ried M. Le traitement de l’épanchement pleural malin avec des cathéters pleuraux à demeure permanents. Dtsch arztebl int. 5 septembre 2022 ; 119(35-36):595-600. doi :10.3238/arztebl.m2022.0229.
-
Skok K, Hladnik G, Grm A, Crnjac A. L’épanchement pleural malin et sa prise en charge actuelle : une revue. Medicina (Kaunas). 15 août 2019 ; 55(8):490. doi :10.3390/medicina55080490.
-
Ferreiro L, Suárez-Antelo J, Álvarez-Dobaño JM, Toubes ME, Riveiro V, Valdés L. Épanchement pleural malin : diagnostic et prise en charge. Can Respir J. 23 septembre 2020;2020:2950751. doi :10.1155/2020/2950751.
-
Egan AM, McPhillips D, Sarkar S, Breen DP. Épanchement pleural malin. QJM. mars 2014 ; 107(3):179-84. doi :10.1093/qjmed/hct245.
-
Wang S, Zhang R, Wan C, et al. Incidence des complications d’un cathéter pleural à demeure pour l’épanchement pleural : une méta-analyse. Clin Transl Sci. 2023 janv. 16(1):104-117. doi :10.1111/cts.13430.
-
Addala DN, Kanellakis NI, Bedawi EO, Dong T, Rahman NM. Épanchement pleural malin : mises à jour du diagnostic, de la prise en charge et des défis actuels. Oncol avant. 17 novembre 2022;12:1053574. doi :10.3389/fonc.2022.1053574.
-
Chalhoub M, Saqib A, Castellano M. Cathéters pleuraux à demeure : complications et stratégies de prise en charge. J Thorac Dis. Juillet 2018 ; 10(7):4659-4666. doi :10.21037/jtd.2018.04.160.
Cite this article
Chung AS, Auchincloss HG. Insertion d’un cathéter PleurX du côté droit pour pallier un épanchement pleural malin. J Med Insight. 2024; 2024(419). doi :10.24296/jomi/419.


