Inserción de un catéter PleurX del lado derecho para la paliación de un derrame pleural maligno
Main Text
Table of Contents
El siguiente caso describe el caso de una mujer de 91 años, sin antecedentes médicos significativos, que acudió a su médico de atención primaria con varios meses de tos y disnea progresiva. Después de un estudio adecuado, se descubrió que tenía un adenocarcinoma de pulmón en estadio IVa con un derrame pleural maligno asociado que contribuyó a sus síntomas. Existen varias opciones terapéuticas para tratar un derrame pleural maligno. Un catéter pleural tunelizado permanente (catéter PleurX) es una forma confiable de tratar un derrame pleural crónico. El dispositivo se usa con mayor frecuencia para tratar derrames pleurales malignos, pero la misma técnica también se puede aplicar para una variedad de indicaciones benignas y no infecciosas. Los catéteres PleurX se pueden insertar en una clínica ambulatoria, una sala de radiología intervencionista, un entorno hospitalario o un quirófano bajo anestesia local o general. Una vez colocados, están diseñados para ser tratados en un entorno ambulatorio, ya sea por los cuidadores del paciente o por el propio paciente, y sirven para paliar los síntomas respiratorios de un derrame grande sin necesidad de toracocentesis repetidas. Pueden permanecer en su lugar durante varios meses, y la extracción en un entorno ambulatorio con anestesia local es trivial. Tras la colocación del catéter PleurX, la paciente informó de una mejoría sintomática de su disnea y se inició el tratamiento con Mobocertinib de dosis reducida bajo la guía de oncología torácica.
PleurX, catéter pleural permanente, derrame pleural crónico, derrame crónico, derrame pleural maligno, derrame maligno.
Se trata de una mujer de 91 años, con pocos problemas médicos, que acudió a su médico de atención primaria con una queja de varios meses de tos y disnea progresiva. Antes de esto, había estado viviendo de forma independiente con una ayuda mínima de sus hijos. Más recientemente, se había sentido cansada y tenía dificultades para cuidar de sí misma. Su examen físico fue notable por la ausencia de ruidos respiratorios del lado derecho. La radiografía de tórax demostró opacificación completa del hemitórax derecho. La tomografía computarizada y la posterior tomografía por emisión de positrones mostraron una gran masa en el hilio central derecho, que estaba intensamente ávida de FDG y que obstruía el bronquio principal derecho, lo que provocaba una atelectasia casi completa del pulmón derecho. El resto del hemitórax derecho estaba ocupado por líquido de baja densidad, y había evidencia de engrosamiento pleural y adenopatía mediastínica. Se realizó toracocentesis y se extrajeron 1,5 L de líquido de color pajizo con cierta mejoría en la sintomatología del paciente. La citología del líquido pleural demostró células malignas con inmunohistoquímica compatible con adenocarcinoma de origen pulmonar. Se realizó un diagnóstico de adenocarcinoma de pulmón en estadio IVa. Fue remitida a oncología para discutir las opciones de tratamiento sistémico y a cirugía torácica para la paliación duradera del derrame pleural.
Un derrame pleural maligno es una característica de muchas presentaciones de cáncer avanzado. Los cánceres de pulmón, de mama y mesoteliales primarios son los más propensos a causar un derrame pleural maligno, pero cualquier neoplasia maligna tiene el potencial. De 1 a 3 años En el estado normal, el espacio pleural contiene ~0,26 mL/kg de líquido por kilogramo corporal de masa en un estado constante de producción y absorción. 3 Un derrame maligno representa la desregulación de uno o ambos de estos procesos, generalmente por la producción de líquido de los implantes tumorales en la pleura o de los canales linfáticos de absorción que obstruyen los tumores. 1,3
Los pacientes presentan disnea secundaria a atelectasia compresiva del pulmón afectado. 1,4,5 A veces se presenta dolor torácico pleurítico y puede indicar una invasión más profunda de la pared torácica de los implantes pleurales metastásicos. 4 Los derrames malignos rara vez se infectan antes de la instrumentación.
El diagnóstico se realiza combinando el hallazgo de un derrame grande en las imágenes con un diagnóstico conocido de cáncer avanzado. 3,4 El líquido debe ser exudativo según los estudios químicos, pero estas pruebas no son útiles. La citología de fluidos que demuestra células malignas es patognomónica para el diagnóstico, pero la citología de fluidos negativa no la excluye. 3,4 Si existe ambigüedad en el diagnóstico, como ocurre con frecuencia con el mesotelioma primario, se debe realizar una toracoscopia diagnóstica con biopsias pleurales. 1
Un derrame maligno es un signo de cáncer avanzado y, por lo general, presagia un mal pronóstico. 3,5 El tratamiento se centra en iniciar una terapia sistémica para controlar la enfermedad y paliar los síntomas relacionados con el líquido pleural. Las intervenciones que minimizan las hospitalizaciones e interrupciones de la terapia sistémica se ven favorecidas sobre los procedimientos más complicados y mórbidos. 3,5
En la etapa temprana de la enfermedad es posible evacuar completamente un derrame maligno y expandir el pulmón afectado. Si la tasa de producción de líquido pleural no es excesiva, un procedimiento de ablación pleural, como la pleurodesis química o mecánica, puede proporcionar una paliación duradera. 1,4 La mayoría de los pacientes se presentan en el momento en que el tumor atrapa el pulmón y el alto volumen de líquido pleural impide este abordaje. 1 El drenaje del líquido da lugar a un neumotórax ex vacuo, caracterizado por aire en el hemitórax junto con un pulmón no expandido. El líquido se reacumula rápidamente dentro de este espacio. 2 La mayoría de los pacientes experimentarán alguna mejoría en los síntomas después del drenaje del líquido a pesar de la expansión pulmonar incompleta, pero el efecto es transitorio. 2 Estos pacientes pueden optar por tener toracocentesis repetidas, pero esto tiende a ser logísticamente complicado y proporciona un pobre alivio de los síntomas. 3 El riesgo acumulado de toracocentesis también crece linealmente con cada intento subsiguiente.
La colocación de un catéter pleural tunelizado permanente ofrece un alivio duradero de los síntomas sin necesidad de repetir los procedimientos. 1–3,6 Los catéteres se pueden colocar en el consultorio, junto a la cama en un entorno hospitalario, en una sala de intervencionismo bajo guía por imágenes o en el quirófano con o sin la adición de toracoscopia. 1 Una vez colocado, el catéter se puede drenar de forma programada utilizando botellas de vacío prefabricadas. La asistencia de enfermería suele ser necesaria al principio, pero los pacientes o familiares suelen asumir la responsabilidad del drenaje. El proceso de drenaje incluye la preparación estéril del catéter, la conexión al frasco de vacío, el drenaje durante un período de varios minutos, la desconexión del catéter y el reajuste del sitio del catéter. 5,7 El volumen y la frecuencia del drenaje son diferentes según las circunstancias del paciente. A falta de otra información, una recomendación de drenaje de hasta 1 litro tres veces por semana servirá para el paciente promedio.
Las ventajas de un catéter pleural permanente incluyen el alivio duradero de los síntomas y el fomento de la autonomía del paciente. 1,3,5 Las desventajas incluyen la incomodidad asociada con la colocación del catéter, la incomodidad asociada con el drenaje (generalmente un dolor pleurítico agudo que ocurre tarde en el proceso de drenaje e indica un colapso del espacio pleural) y las complicaciones asociadas con el catéter en sí. 8 Las complicaciones incluyen el desplazamiento del catéter (raro después de las primeras semanas), la oclusión del catéter (salvable mediante la administración de fibrinolíticos transcatéter) y la infección del catéter o del espacio pleural. La infección es poco común, pero el riesgo aumenta cuanto más tiempo permanece el catéter. 6,8 Las infecciones superficiales se tratan con antibióticos y la extracción del catéter, con planes para el reemplazo en un nuevo sitio de piel en un futuro cercano. 8 Las infecciones del espacio pleural son más desafiantes: a menudo es necesario retirar el catéter, colocar un nuevo tubo temporal para la evacuación completa del espacio pleural, fibrinólisis intrapleural y antibióticos intravenosos. 8 Debe transcurrir un tiempo considerable antes de que se considere el reemplazo del catéter.
En el vídeo adjunto, se realiza la colocación de un catéter PleurX en el quirófano para demostrar el ajuste y la técnica más óptimos. El kit PleurX es autónomo e incluye:
- Paños estériles,
- Preparación de la piel.
- Anestésico local, jeringas y agujas.
- Un catéter de inserción, una guía, un trocar dilatador y una vaina separable.
- El tubo PleurX y un dispositivo de tunelización.
- Una tapa para el tubo, o alternativamente un conector para engancharlo al sistema de drenaje torácico.
- Suturas y apósitos.
- No se incluyen las batas y guantes estériles y las botellas de vacío para el drenaje.
La posición lateral parcial es cómoda para los pacientes que pueden acostarse y permite el uso de sedación consciente. Alternativamente, los pacientes pueden sentarse en el borde de la cama e inclinarse sobre una mesa como lo harían para la colocación del catéter epidural. Es importante la exposición del arco costal y de la pared torácica lateral. La piel se prepara y se cubre de forma estéril. Se seleccionan los puntos óptimos de entrada y salida del tubo. Las consideraciones clave incluyen la facilidad de acceso y manejo del tubo por parte del paciente, así como la colocación del tubo en una posición dependiente para maximizar el drenaje. La piel está marcada en los sitios de salida y entrada pleural de la piel. El sitio de salida de la piel suele ser a lo largo del margen costal, mientras que el sitio de entrada pleural es más posterior. Una distancia de 10 o más centímetros entre los dos sitios asegura un túnel subcutáneo que mitiga el riesgo de infección del espacio pleural; La distancia excesiva hace que el proceso de tunelización sea un desafío.
El anestésico local se administra en una roncha subcutánea en ambos sitios. Se realiza un bloqueo del nervio intercostal en el sitio de entrada pleural posterior. Esto se realiza administrando anestésico local alrededor del periostio de la costilla sobre el cual se colocará el catéter, ingresando al espacio pleural por encima de esta costilla, retirando el líquido pleural y luego retirando la aguja mientras se inyecta una cantidad generosa de anestésico local. Si no se aspira líquido pleural en este sitio, se debe seleccionar un nuevo sitio. La ecografía puede ser útil para guiar este paso.
Se realizan incisiones de un centímetro en la piel en ambos sitios. El tunelizador se utiliza para pasar el catéter entre el sitio de salida de la piel anterior y el sitio de entrada del espacio pleural posterior. En el extremo distal del tubo hay un manguito diseñado para fijar el tubo al túnel subcutáneo provocando una reacción fibroinflamatoria. Lo ideal es dejar el manguito justo a la profundidad de la incisión de salida de la piel anterior, lo que facilita su posterior extracción con anestesia local.
Se accede al espacio pleural a través del sitio posterior utilizando la vaina de inserción. Una vez que se aspira el líquido pleural, se retira la aguja y se coloca una guía a través de la vaina. Se retira la funda. Se inserta un dilatador sobre la guía justo a la profundidad de las costillas. A esto le sigue en serie una funda separable. Con la vaina separable en su lugar, se retiran el alambre y la parte interna de la vaina y el catéter PleurX se alimenta a través del canal. La vaina se puede desprender a medida que el catéter avanza hacia el espacio pleural. La aplicación de succión al catéter con el consiguiente drenaje de líquido pleural confirma la colocación adecuada.
La piel en el sitio de entrada pleural posterior se cierra de forma subcutánea. El catéter se puede suturar a la piel para mayor seguridad, pero preferimos utilizar los apósitos estériles incluidos para este propósito para evitar el problema de una sutura externa olvidada.
El tubo puede taparse para su uso posterior o conectarse a un sistema de drenaje autónomo para una evacuación completa del espacio pleural durante un período de tiempo. Por lo general, restringimos el drenaje de líquido a no más de 1,5 L a la vez para prevenir la complicación rara pero potencialmente mortal del edema pulmonar por reexpansión.
La colocación de un catéter PleurX es bien tolerada por los pacientes y da lugar a una mejoría inmediata en aquellos para los que la enfermedad pleural es un contribuyente significativo a la disnea. La mejoría marginal o ausente de los síntomas puede indicar un drenaje incompleto, pero lo más probable es que se refiera a la naturaleza polifactorial de la disnea como síntoma. Las complicaciones de la colocación incluyen falta de acceso al espacio pleural, colocación subdiafragmática del catéter (particularmente en un paciente con ascitis), sangrado y daño a las estructuras subyacentes. El sangrado puede ser causado por una lesión en la vasculatura intercostal, la entrada en el parénquima pulmonar o la interrupción de las adherencias pleurales. En raras ocasiones, se requiere embolización o exploración quirúrgica.
Nuestro paciente toleró bien el procedimiento y la operación transcurrió sin complicaciones. Informó una mejoría sintomática de su disnea dentro de 1 semana después de la colocación del catéter PleurX. Su catéter fue drenado por la enfermería visitada en su casa para recibir alrededor de 125-250 mL de líquido pleural dos veces por semana durante las primeras semanas después de la colocación. Posteriormente, la producción de drenaje comenzó a disminuir, hasta que la producción fue de 0 mL aproximadamente 2,5 meses después de la colocación del catéter PleurX. Aproximadamente 4 meses después de la colocación, el paciente ingresó en el hospital por anomalías electrolíticas, náuseas, vómitos, diarrea y mala ingesta de PO relacionada con el tratamiento sistémico con mobocertinib que se había iniciado por oncología torácica. Dado que la salida del catéter había sido mínima, se retiró a pie de cama durante ese ingreso.
Las tomografías computarizadas del paciente antes y después de la colocación del catéter PleurX se pueden ver en las Figuras 1 y 2.
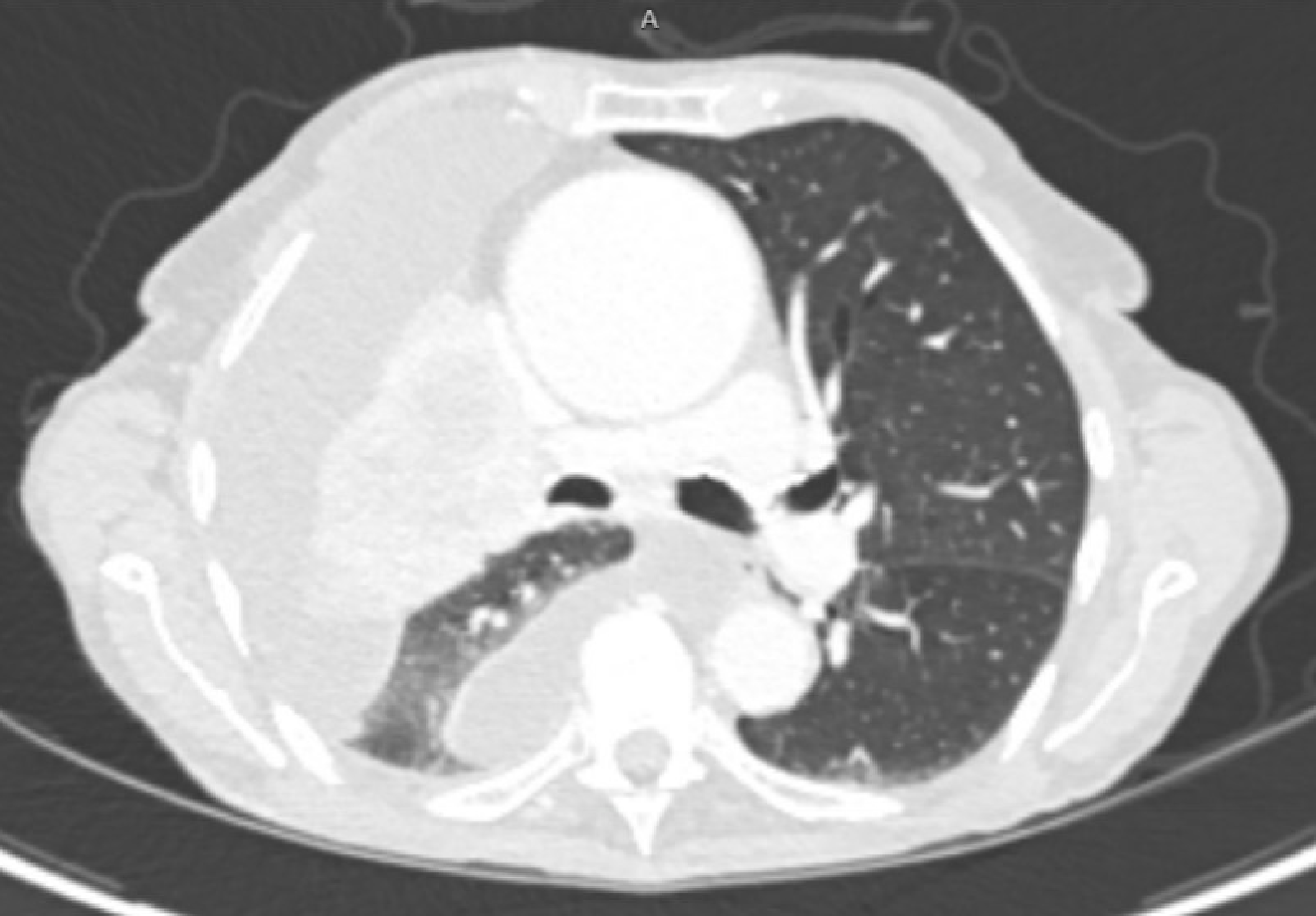
Figura 1. La tomografía computarizada del paciente antes de la colocación del catéter PleurX.
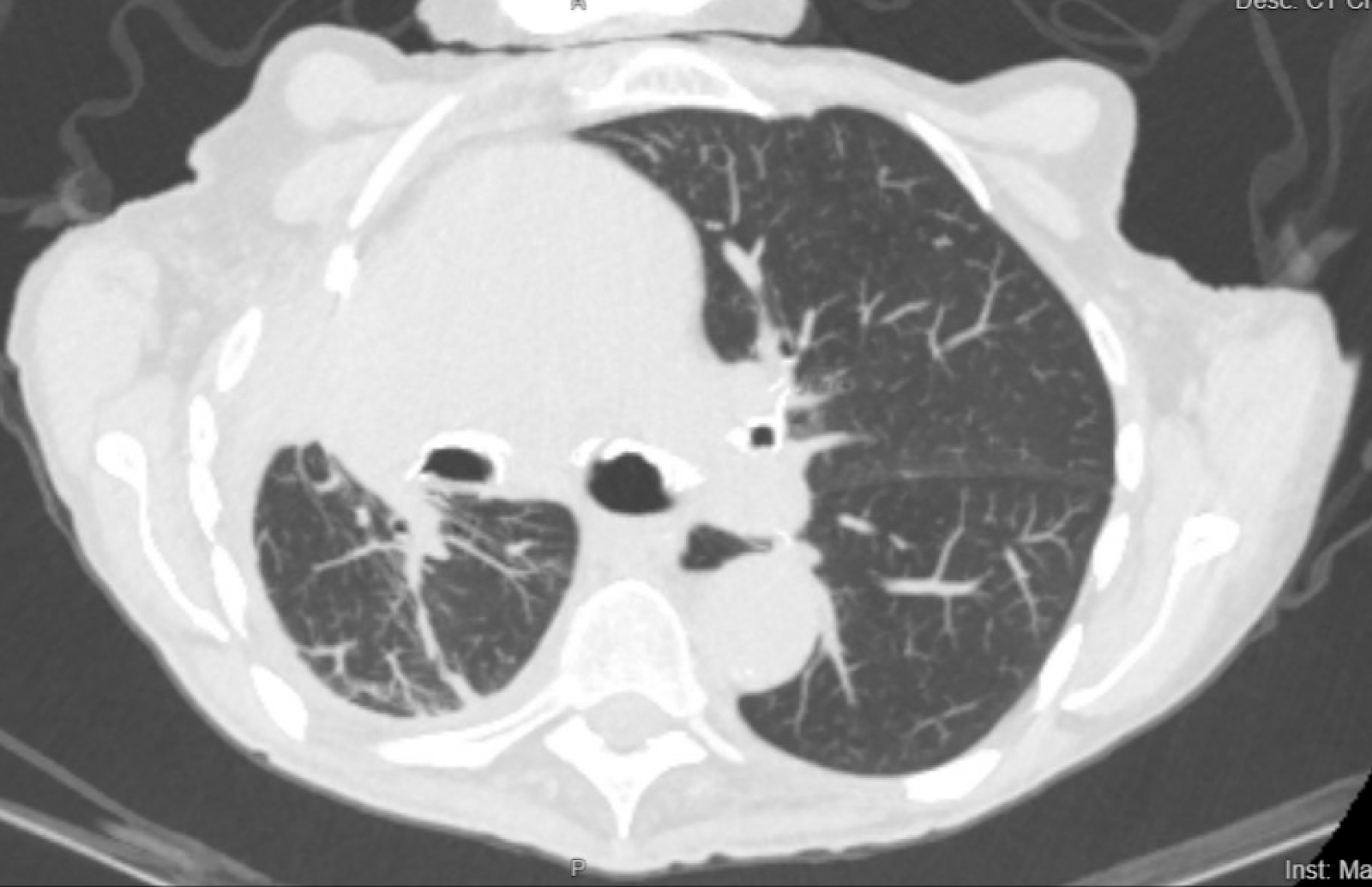
Figura 2. La tomografía computarizada del paciente 4 meses después de la colocación del catéter PleurX.
El paciente al que se refiere este videoartículo ha dado su consentimiento informado para ser filmado y es consciente de que la información y las imágenes se publicarán en línea.
References
-
Gonnelli F, Hassan W, Bonifazi M, et al. Derrame pleural maligno: comprensión actual y abordaje terapéutico. Respir Res. 19 de enero de 2024; 25(1):47. doi:10.1186/s12931-024-02684-7.
-
Hofmann HS, Scheule AM, Markowiak T, Ried M. Tratamiento del derrame pleural maligno con catéteres pleurales permanentes. Dtsch arztebl int. 5 de septiembre de 2022; 119(35-36):595-600. doi:10.3238/arztebl.m2022.0229.
-
Skok K, Hladnik G, Grm A, Crnjac A. Derrame pleural maligno y su tratamiento actual: una revisión. Medicina (Kaunas). 15 de agosto de 2019; 55(8):490. doi:10.3390/medicina55080490.
-
Ferreiro L, Suárez-Antelo J, Álvarez-Dobaño JM, Toubes ME, Riveiro V, Valdés L. Derrame pleural maligno: diagnóstico y tratamiento. Puede Respirar J. 23 de septiembre de 2020;2020:2950751. doi:10.1155/2020/2950751.
-
Egan AM, McPhillips D, Sarkar S, Breen DP. Derrame pleural maligno. QJM. Marzo de 2014; 107(3):179-84. doi:10.1093/qjmed/hct245.
-
Wang S, Zhang R, Wan C, et al. Incidencia de complicaciones del catéter pleural permanente para el derrame pleural: un metanálisis. Clin Transl Sci. Enero de 2023; 16(1):104-117. doi:10.1111/cts.13430.
-
Addala DN, Kanellakis NI, Bedawi EO, Dong T, Rahman NM. Derrame pleural maligno: actualizaciones en el diagnóstico, manejo y retos actuales. Frente Oncol. 17 de noviembre de 2022;12:1053574. doi:10.3389/fonc.2022.1053574.
-
Chalhoub M, Saqib A, Castellano M. Catéteres pleurales permanentes: complicaciones y estrategias de manejo. J Thorac Dis. julio de 2018; 10(7):4659-4666. doi:10.21037/jtd.2018.04.160.
Cite this article
Chung AS, Auchincloss HG. Inserción de un catéter PleurX del lado derecho para la paliación de un derrame pleural maligno. J Med Insight. 2024; 2024(419). doi:10.24296/jomi/419.


