Anlegen eines rechtsseitigen PleurX-Katheters zur Linderung eines bösartigen Pleuraergusses
Main Text
Table of Contents
Der folgende Fall beschreibt eine 91-jährige Frau ohne nennenswerte Vorgeschichte, die sich mit mehrmonatigem Husten und fortschreitender Dyspnoe bei ihrem Hausarzt vorstellte. Nach entsprechender Abklärung wurde bei ihr ein Lungenadenokarzinom im Stadium IVa mit einem damit verbundenen malignen Pleuraerguss festgestellt, der zu ihren Symptomen beitrug. Für die Behandlung eines bösartigen Pleuraergusses gibt es mehrere Therapiemöglichkeiten. Ein getunnelter Verweilkatheter (PleurX-Katheter) ist eine zuverlässige Methode, um einen chronischen Pleuraerguss zu behandeln. Das Gerät wird am häufigsten zur Behandlung von malignen Pleuraergüssen eingesetzt, aber die gleiche Technik kann auch bei einer Reihe von gutartigen, nicht infektiösen Indikationen angewendet werden. PleurX-Katheter können in einer Ambulanz, einer interventionellen Radiologie, einer stationären Einrichtung oder einem Operationssaal unter örtlicher Betäubung oder Vollnarkose eingeführt werden. Sobald sie an Ort und Stelle sind, sind sie so konzipiert, dass sie ambulant entweder von den Pflegekräften des Patienten oder vom Patienten selbst behandelt werden können, und dienen dazu, die Atemwegssymptome eines großen Ergusses zu lindern, ohne dass wiederholte Thorakozentesen erforderlich sind. Sie können mehrere Monate an Ort und Stelle bleiben, und die Entfernung in einer ambulanten Umgebung mit örtlicher Betäubung ist trivial. Nach der Platzierung des PleurX-Katheters berichtete die Patientin über eine symptomatische Verbesserung ihrer Dyspnoe, und sie wurde unter Anleitung der Thoraxonkologie mit dosisreduziertem Mobocertinib begonnen.
PleurX, Verweilkatheter des Pleura, chronischer Pleuraerguss, chronischer Erguss, maligner Pleuraerguss, maligner Erguss.
Bei der Patientin handelt es sich um eine 91-jährige Frau mit wenigen anderen medizinischen Problemen, die sich bei ihrem Hausarzt mit einer Beschwerde über mehrmonatigen Husten und fortschreitende Dyspnoe vorstellte. Zuvor hatte sie unabhängig gelebt und nur wenig Unterstützung von ihren Kindern erhalten. In letzter Zeit fühlte sie sich müde und hatte Schwierigkeiten, sich um sich selbst zu kümmern. Ihre körperliche Untersuchung war bemerkenswert für das Fehlen rechtsseitiger Atemgeräusche. Die Röntgenaufnahme des Brustkorbs zeigte eine vollständige Trübung des rechten Hemithorax. CT-Scans und anschließende PET zeigten eine große Masse im zentralen rechten Hilum, die stark FDG-avid war und den rechten Hauptstammbronchus verstopfte, was zu einer nahezu vollständigen Atelektase der rechten Lunge führte. Der Rest des rechten Hemithorax war mit Flüssigkeit geringer Dichte besetzt, und es gab Hinweise auf eine Pleuraverdickung und eine mediastinale Adenopathie. Es wurde eine Thorazentese durchgeführt und 1,5 l strohfarbene Flüssigkeit wurden entfernt, wobei sich die Symptome des Patienten etwas verbesserten. Die Zytologie aus der Pleuraflüssigkeit zeigte maligne Zellen mit Immunhistochemie, die mit einem Adenokarzinom Lungenursprungs übereinstimmten. Es wurde die Diagnose Lungenadenokarzinom im Stadium IVa gestellt. Sie wurde in die Onkologie überwiesen, um systemische Behandlungsmöglichkeiten zu besprechen, und in die Thoraxchirurgie zur dauerhaften Palliation des Pleuraergusses.
Ein maligner Pleuraerguss ist ein Merkmal vieler fortgeschrittener Krebserscheinungen. Lungen-, Brust- und primärer Mesothelkrebs verursachen am ehesten einen bösartigen Pleuraerguss, aber jede Malignität hat das Potenzial. 1–3 Im Normalzustand enthält der Pleuraraum ~0,26 ml/kg Flüssigkeit pro Körperkilogramm Masse in einem konstanten Produktions- und Absorptionszustand. 3 Ein bösartiger Erguss stellt eine Deregulierung eines oder beider dieser Prozesse dar, typischerweise durch Flüssigkeitsproduktion aus Tumorimplantaten auf der Pleura oder aus Tumoren, die die absorbierenden Lymphkanäle blockieren. 1,3 kg
Die Patienten stellen sich mit Dyspnoe als Folge einer kompressiven Atelektase der betroffenen Lunge vor. 1,4,5 Pleuritische Brustschmerzen treten manchmal auf und können auf eine tiefere Invasion der Brustwand bei metastasierten Pleuraimplantaten hinweisen. 4 Bösartige Ergüsse infizieren sich selten vor der Instrumentierung.
Die Diagnose wird gestellt, indem der Befund eines großen Ergusses in der Bildgebung mit einer bekannten Diagnose einer fortgeschrittenen Krebserkrankung kombiniert wird. 3,4 Die Flüssigkeit sollte auf der Grundlage chemischer Studien exsumativ sein, aber diese Tests sind ansonsten nicht hilfreich. Die Flüssigkeitszytologie, die bösartige Zellen nachweist, ist pathognomonisch für die Diagnose, aber die negative Flüssigkeitszytologie schließt sie nicht aus. 3,4 Bei Unklarheiten über die Diagnose – wie es beim primären Mesotheliom häufig der Fall ist – sollte eine diagnostische Thorakoskopie mit Pleurabiopsien durchgeführt werden. 1
Ein bösartiger Erguss ist ein Zeichen für eine fortgeschrittene Krebserkrankung und deutet in der Regel auf eine schlechte Prognose hin. 3,5 Die Behandlung konzentriert sich auf den Beginn einer systemischen Therapie zur Kontrolle der Erkrankung und zur Linderung der Symptome im Zusammenhang mit der Pleuraflüssigkeit. Interventionen, die Krankenhausaufenthalte und Unterbrechungen der systemischen Therapie minimieren, werden gegenüber komplizierteren, morbiden Verfahren bevorzugt. 3,5 kg
Im Frühstadium der Erkrankung ist es möglich, einen bösartigen Erguss vollständig zu evakuieren und die betroffene Lunge zu erweitern. Wenn die Geschwindigkeit der Produktion von Pleuraflüssigkeit nicht übermäßig hoch ist, kann ein pleuraablatives Verfahren wie chemische oder mechanische Pleurodese zu einer dauerhaften Palliation führen. 1,4 Die meisten Patienten stellen sich zu einem Zeitpunkt vor, zu dem eine Einklemmung der Lunge durch einen Tumor und das hohe Volumen an Pleuraflüssigkeit diesen Ansatz ausschließen. 1 Die Drainage der Flüssigkeit führt zu einem Pneumothorax-ex-vacuo, der durch Luft im Hemithorax in Verbindung mit einer nicht expandierten Lunge gekennzeichnet ist. In diesem Raum sammelt sich schnell wieder Flüssigkeit an. 2 Bei den meisten Patienten kommt es nach der Drainage der Flüssigkeit trotz unvollständiger Lungenexpansion zu einer gewissen Verbesserung der Symptome, aber der Effekt ist vorübergehend. 2 Diese Patienten können sich für wiederholte Thorakozentesen entscheiden, aber dies ist in der Regel logistisch kompliziert und führt zu einer schlechten Symptomlinderung. 3 Auch das kumulative Risiko einer Thorakozentese wächst linear mit jedem weiteren Versuch.
Die Platzierung eines getunnelten Verweilkatheters bietet eine dauerhafte Linderung der Symptome, ohne dass wiederholte Eingriffe erforderlich sind. 1–3,6 Die Katheter können in der Praxis, am Krankenbett in einer stationären Umgebung, in einem Interventionsraum unter Bildkontrolle oder im Operationssaal mit oder ohne Thorakoskopie platziert werden. 1 Sobald der Katheter an Ort und Stelle ist, kann er nach einem bestimmten Zeitplan mit vorgefertigten Vakuumflaschen entleert werden. In der Regel wird zunächst pflegerische Hilfe benötigt, aber häufig übernehmen Patienten oder Angehörige die Verantwortung für die Entwässerung. Der Prozess der Drainage umfasst die sterile Vorbereitung des Katheters, den Anschluss an die Vakuumflasche, die Drainage über einen Zeitraum von mehreren Minuten, das Trennen des Katheters und das erneute Anziehen der Katheterstelle. 5,7 Das Volumen und die Häufigkeit der Drainage sind je nach den Umständen des Patienten unterschiedlich. In Ermangelung anderer Informationen wird eine Empfehlung für eine Drainage von bis zu 1 l dreimal pro Woche für den durchschnittlichen Patienten ausreichen.
Zu den Vorteilen eines Pleuraverweilkatheters gehören eine dauerhafte Linderung der Symptome und die Förderung der Autonomie des Patienten. 1,3,5 Zu den Nachteilen gehören die mit der Platzierung des Katheters verbundenen Beschwerden, die mit der Drainage verbundenen Beschwerden (in der Regel ein scharfer, pleuritischer Schmerz, der erst spät im Drainageprozess auftritt und auf einen kollabierenden Pleuraraum hinweist) und Komplikationen im Zusammenhang mit dem Katheter selbst. 8 Zu den Komplikationen gehören eine Katheterdislokation (selten nach den ersten Wochen), ein Katheterverschluss (der durch Verabreichung von Transkatheterfibrinolytika gerettet werden kann) und eine Infektion des Katheters oder des Pleuraraums. Eine Infektion ist selten, aber das Risiko steigt, je länger der Katheter verbleibt. 6,8 Oberflächliche Infektionen werden mit Antibiotika behandelt und der Katheter entfernt, wobei in naher Zukunft ein Austausch an einer neuen Hautstelle geplant ist. 8 Infektionen des Pleuraraums sind eine größere Herausforderung: Oft ist es notwendig, den Katheter zu entfernen, einen neuen provisorischen Schlauch für die vollständige Evakuierung des Pleuraraums zu legen, eine intrapleurale Fibrinolyse durchzuführen und intravenöse Antibiotika zu verabreichen. 8 Es sollte eine beträchtliche Zeit vergehen, bevor ein Austausch des Katheters in Betracht gezogen wird.
Im beigefügten Video wird die Platzierung eines PleurX-Katheters im Operationssaal durchgeführt, um die optimale Einstellung und Technik zu demonstrieren. Das PleurX-Kit ist in sich geschlossen und enthält:
- Sterile Abdecktücher,
- Vorbereitung der Haut.
- Lokalanästhetikum, Spritzen und Nadeln.
- Ein Einführkatheter, ein Führungsdraht, ein Dilatationstrokar und eine Abreißschleuse.
- Die PleurX-Röhre und eine Tunnelvorrichtung.
- Eine Kappe für den Schlauch oder alternativ ein Verbindungsstück, um ihn an das Thoraxdrainagesystem anzuschließen.
- Nahtmaterial und Verbände.
- Nicht im Lieferumfang enthalten sind sterile Kittel und Handschuhe sowie die Vakuumflaschen für die Drainage.
Die teilweise seitliche Position ist bequem für Patienten, die in der Lage sind, flach zu liegen, und ermöglicht den Einsatz einer bewussten Sedierung. Alternativ können die Patienten an der Bettkante sitzen und sich über einen Tisch beugen, wie sie es bei der Platzierung eines Epiduralkatheters tun würden. Die Freilegung des Rippenbogens und der lateralen Brustwand ist wichtig. Die Haut wird steril vorbereitet und drapiert. Es werden optimale Ein- und Austrittspunkte für die Röhre ausgewählt. Zu den wichtigsten Überlegungen gehören der einfache Zugang und die Handhabung des Schlauchs für den Patienten sowie die Platzierung des Schlauchs in einer abhängigen Position, um die Drainage zu maximieren. Die Haut ist an den Hautaustritts- und Pleuraeintrittsstellen markiert. Die Hautaustrittsstelle befindet sich typischerweise entlang des Rippenrandes, während die Pleuraeintrittsstelle eher posterior liegt. Ein Abstand von 10 oder mehr Zentimetern zwischen den beiden Stellen gewährleistet einen subkutanen Tunnel, der das Risiko einer Infektion des Pleuraraums verringert. Zu große Entfernungen machen den Tunnelvortrieb zu einer Herausforderung.
Das Lokalanästhetikum wird an beiden Stellen in einer subkutanen Quaddel verabreicht. Eine Blockade des Nervus interkostalis wird an der hinteren, pleuralen Eintrittsstelle durchgeführt. Dies geschieht durch Verabreichung eines Lokalanästhetikums um das Periost der Rippe, über der der Katheter platziert wird, durch Eindringen in den Pleuraraum über dieser Rippe, Zurückziehen der Pleuraflüssigkeit und anschließendes Zurückziehen der Nadel unter Injektion einer großzügigen Menge Lokalanästhetikum. Wenn an dieser Stelle keine Pleuraflüssigkeit aspiriert wird, sollte eine neue Stelle ausgewählt werden. Ultraschall kann bei diesem Schritt hilfreich sein.
An beiden Stellen werden ein Zentimeter große Hautschnitte gesetzt. Der Tunneler wird verwendet, um den Katheter zwischen der vorderen Hautaustrittsstelle und der Eintrittsstelle des hinteren Pleuraraums zu führen. Am distalen Ende des Schlauchs befindet sich eine Manschette, die den Schlauch am subkutanen Tunnel fixiert, indem eine fibroinflammatorische Reaktion hervorgerufen wird. Die Manschette wird idealerweise nur knapp bis zum vorderen Hautaustrittsschnitt belassen, was eine spätere Entfernung unter örtlicher Betäubung erleichtert.
Der Zugang zum Pleuraraum erfolgt über die hintere Stelle mit Hilfe der Ansatzschleuse. Sobald die Pleuraflüssigkeit abgesaugt ist, wird die Nadel entfernt und ein Führungsdraht durch die Schleuse geführt. Die Hülle wird entfernt. Ein Dilatator wird über den Führungsdraht bis tief zu den Rippen eingeführt. Daran schließt sich in Serie eine Abreißhülle an. Wenn die Abreißhülle an Ort und Stelle ist, werden der Draht und der innere Teil der Schleuse entfernt und der PleurX-Katheter durch den Kanal geführt. Die Schleuse kann aufgebrochen werden, wenn der Katheter in den Pleuraraum vorgeschoben wird. Die Absaugung des Katheters mit der daraus resultierenden Drainage der Pleuraflüssigkeit bestätigt eine angemessene Platzierung.
Die Haut an der hinteren Pleuraeintrittsstelle wird subkutan verschlossen. Der Katheter kann zur zusätzlichen Sicherheit an die Haut genäht werden, aber wir bevorzugen es, zu diesem Zweck die mitgelieferten sterilen Verbände zu verwenden, um das Problem einer vergessenen äußeren Naht zu vermeiden.
Der Schlauch kann für den späteren Gebrauch verschlossen oder an ein in sich geschlossenes Drainagesystem angeschlossen werden, um den Pleuraraum über einen bestimmten Zeitraum vollständig zu evakuieren. In der Regel beschränken wir den Flüssigkeitsabfluss auf jeweils nicht mehr als 1,5 l, um die seltene, aber potenziell lebensbedrohliche Komplikation des Reexpansions-Lungenödems zu vermeiden.
Die Platzierung eines PleurX-Katheters wird von den Patienten gut vertragen und führt zu einer sofortigen Verbesserung bei denjenigen, bei denen die Pleuraerkrankung einen signifikanten Beitrag zur Dyspnoe leistet. Eine marginale oder fehlende Verbesserung der Symptome kann auf eine unvollständige Drainage hinweisen, spricht aber eher für den polyfaktoriellen Charakter der Dyspnoe als Symptom. Zu den Komplikationen bei der Platzierung gehören der fehlende Zugang zum Pleuraraum, die subdiaphragmatische Platzierung des Katheters (insbesondere bei einem Patienten mit Aszites), Blutungen und Schäden an den darunter liegenden Strukturen. Blutungen können durch eine Verletzung des Interkostalgefäßsystems, den Eintritt in das Lungenparenchym oder eine Störung der Pleuraadhäsionen verursacht werden. In seltenen Fällen ist eine Embolisation oder eine operative Exploration erforderlich.
Unsere Patientin hat den Eingriff gut vertragen und die Operation verlief ohne Komplikationen. Sie berichtete über eine symptomatische Verbesserung ihrer Dyspnoe innerhalb von 1 Woche nach dem Legen des PleurX-Katheters. Ihr Katheter wurde in den ersten Wochen nach der Platzierung durch einen Pflegebesuch bei ihr zu Hause für etwa 125-250 ml Pleuraflüssigkeit zweimal pro Woche entleert. In der Folge begann die Drainageleistung abzunehmen, bis die Ausscheidung etwa 2,5 Monate nach dem Legen des PleurX-Katheters 0 ml betrug. Etwa 4 Monate nach der Platzierung wurde der Patient wegen Elektrolytanomalien, Übelkeit, Erbrechen, Durchfall und schlechter PO-Aufnahme im Zusammenhang mit der systemischen Therapie mit Mobocertinib, die durch die Thoraxonkologie eingeleitet worden war, ins Krankenhaus eingeliefert. Da die Katheterleistung minimal war, wurde sie bei dieser Aufnahme am Krankenbett entfernt.
CT-Scans des Patienten vor und nach der Platzierung des PleurX-Katheters sind in Abbildung 1 und 2 zu sehen.
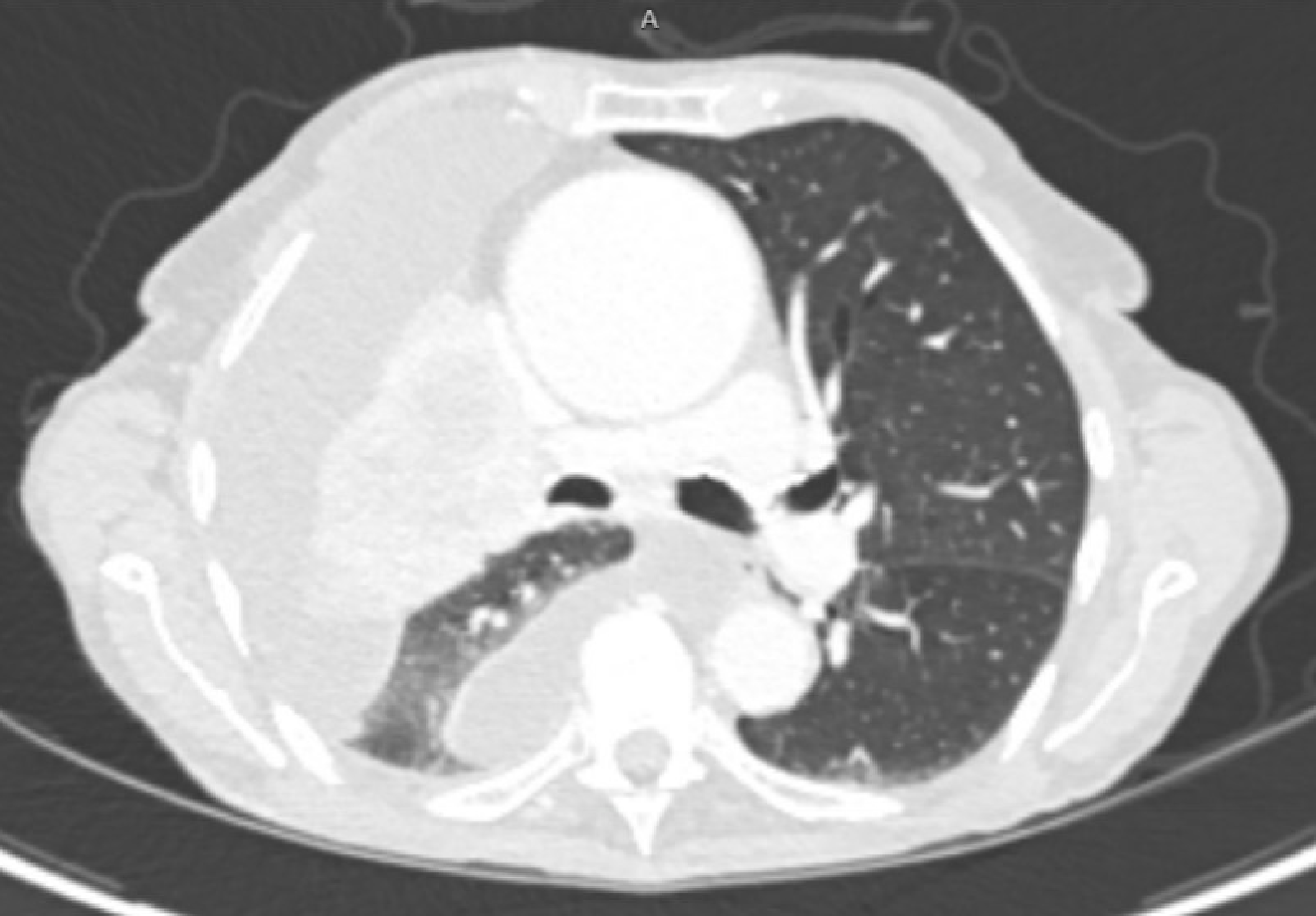
Abbildung 1. Der CT-Scan des Patienten vor der Platzierung des PleurX-Katheters.
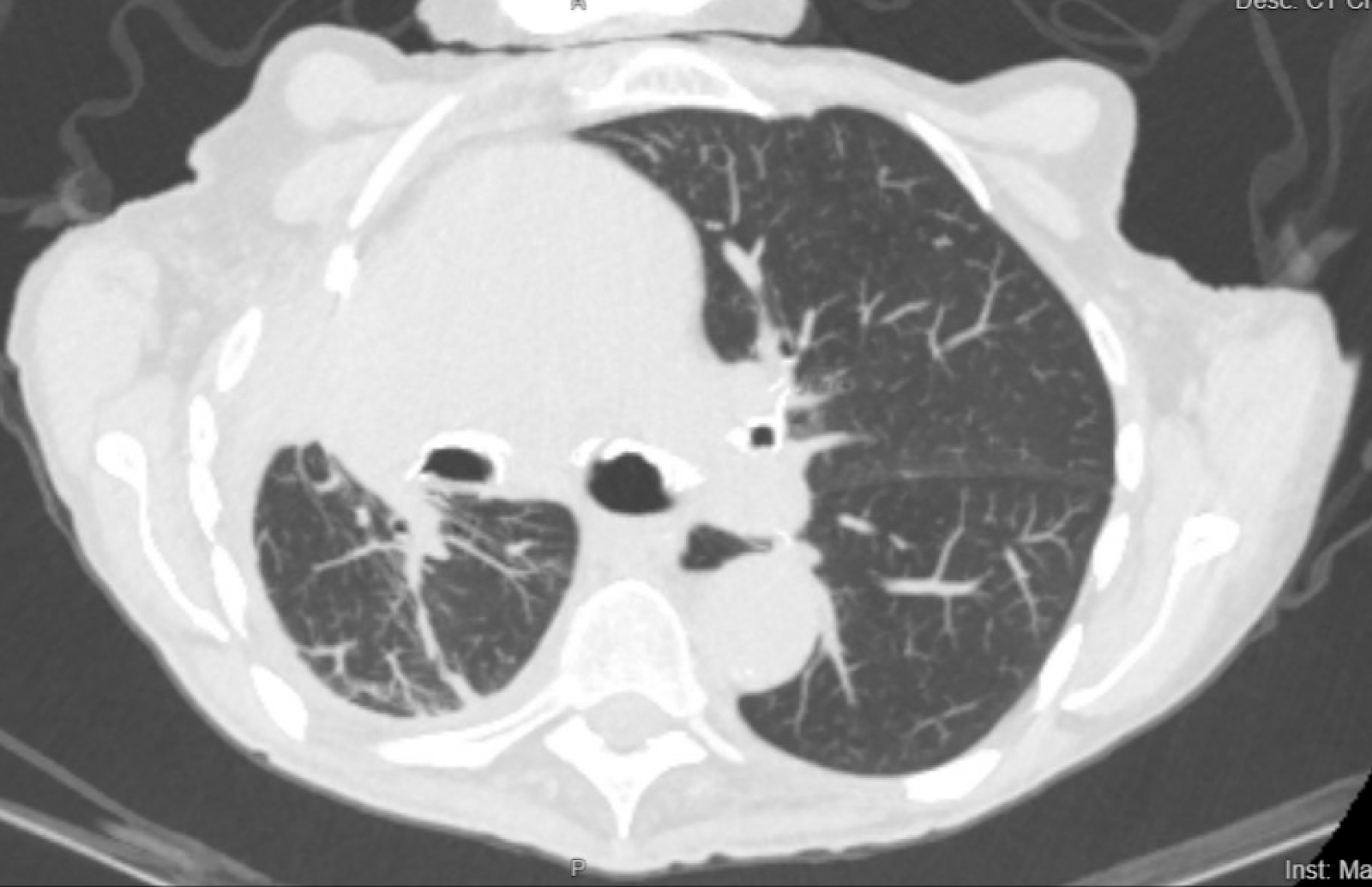
Abbildung 2. Der CT-Scan des Patienten 4 Monate nach der Platzierung des PleurX-Katheters.
Der Patient, auf den in diesem Videoartikel Bezug genommen wird, hat seine Einverständniserklärung gegeben, gefilmt zu werden, und ist sich bewusst, dass Informationen und Bilder online veröffentlicht werden.
References
-
Gonnelli F, Hassan W, Bonifazi M, et al. Bösartiger Pleuraerguss: aktueller Kenntnisstand und Therapieansatz. Respir Res. 2024 Januar 19; 25(1):47. doi:10.1186/s12931-024-02684-7.
-
Hofmann HS, Scheule AM, Markowiak T, Ried M. Die Behandlung von malignen Pleuraergüssen mit dauerhaften Pleuraverweilkathetern. Dtsch Arztebl Int. 5. September 2022; 119(35-36):595-600. doi:10.3238/arztebl.m2022.0229.
-
Skok K, Hladnik G, Grm A, Crnjac A. Bösartiger Pleuraerguss und seine derzeitige Behandlung: ein Überblick. Medicina (Kaunas). 15. August 2019; 55(8):490. doi:10.3390/medicina55080490.
-
Ferreiro L, Suárez-Antelo J, Álvarez-Dobaño JM, Toubes ME, Riveiro V, Valdés L. Maligner Pleuraerguss: Diagnose und Behandlung. Kann Respir J. 2020 Sep 23;2020:2950751. doi:10.1155/2020/2950751.
-
Egan AM, McPhillips D, Sarkar S, Breen DP. Bösartiger Pleuraerguss. QJM. 2014 Mär; 107(3):179-84. doi:10.1093/qjmed/hct245.
-
Wang S, Zhang R, Wan C, et al. Inzidenz von Komplikationen durch einen Verweilkatheter des Pleurakatheters bei Pleuraerguss: eine Metaanalyse. Clin Transl Sci. Januar 2023; 16(1):104-117. doi:10.1111/cts.13430.
-
Addala DN, Kanellakis NI, Bedawi EO, Dong T, Rahman NM. Bösartiger Pleuraerguss: Aktualisierungen in Diagnose, Management und aktuellen Herausforderungen. Vordere Oncol. 2022 Nov 17;12:1053574. doi:10.3389/fonc.2022.1053574.
-
Chalhoub M, Saqib A, Castellano M. Verweilkatheter im Pleurabereich: Komplikationen und Behandlungsstrategien. J Thorac Dis. Juli 2018; 10(7):4659-4666. doi:10.21037/jtd.2018.04.160.
Cite this article
Chung AS, Auchincloss HG. Anlegen eines rechtsseitigen PleurX-Katheters zur Palliation eines bösartigen Pleuraergusses. J Med Insight. 2024; 2024(419). doi:10.24296/jomi/419.


