Mastectomie avec perforateur mammaire interne préservant les mamelons (IMP-NSM) pour réduire les complications ischémiques
Main Text
Table of Contents
Les mastectomies avec reconstruction mammaire sont couramment pratiquées pour le traitement du cancer du sein ou les mastectomies prophylactiques réduisant les risques et ont des résultats esthétiques supérieurs à ceux de la mastectomie totale ou de la mastectomie épargnant la peau. La préservation du complexe aréolaire du mamelon (NAC) se traduit par une apparence esthétique plus naturelle du sein reconstruit, ainsi qu’une plus grande satisfaction de la patiente, comme l’indique l’amélioration du bien-être psychosocial et sexuel par rapport à la mastectomie totale. La préservation de l’approvisionnement vasculaire est de la plus haute importance pour la viabilité de la NAC et du lambeau cutané de la mastectomie après la chirurgie, car les complications ischémiques postopératoires peuvent nuire considérablement aux résultats esthétiques.
Ce rapport décrit une technique chirurgicale contemporaine de NMS développée par l’auteur principal (MK), pour préserver l’approvisionnement vasculaire dominant de la NAC et diminuer les complications ischémiques postopératoires. Au total, 114 NSM ont été réalisées de 2018 à 2020 par l’auteur principal. D’après l’IRM mammaire préopératoire avec visualisation de contraste de l’approvisionnement vasculaire de la NAC, les vaisseaux du perforateur mammaire interne (IMP) sortant du muscle grand pectoral au bord sternal ont fourni l’apport sanguin dominant à la NAC dans 92 % des cas et ont pu être préservés dans 89 % des cas.
La technique chirurgicale de mastectomie IMP-NSM (Internal Mammary Perforator Preserving Nipple-Sparing Mastectomi) a été mise au point pour préserver cet important apport sanguin IMP à la NAC, ce qui a entraîné une diminution des complications ischémiques postopératoires. Suite à la mise en œuvre de cette technique chirurgicale, une nécrose de la NAC nécessitant une ablation de la NAC est survenue dans 0,9 % des cas, et une nécrose cutanée de la mastectomie nécessitant une réintervention dans 1,8 % des cas, ce qui a permis de préserver la NAC chez la majorité des patientes. De plus, en raison de la localisation anatomique cohérente de l’approvisionnement vasculaire de l’IMP vers le NAC, cet approvisionnement vasculaire critique peut être régulièrement préservé même sans IRM préopératoire, améliorant ainsi les résultats cliniques. La technique chirurgicale IMP-NSM est décrite en détail dans ce rapport avec un exemple de cas.
Perforateur mammaire interne ; mastectomie avec conservation du mamelon, ischémie, nécrose de la mastectomie avec conservation du mamelon ; perfusion; Complexe aréolaire du mamelon.
La mastectomie avec conservation du mamelon (MNS) avec reconstruction mammaire immédiate permet d’améliorer l’apparence du sein reconstruit et d’accroître la satisfaction de la patiente par rapport à la mastectomie totale. 1 à 6 Bien que les techniques de NMS aient été décrites pour préserver toute la peau du sein et le complexe de l’aréole du mamelon (NAC), les complications ischémiques postopératoires (c’est-à-dire la nécrose) nécessitant une réopération et l’excision de la peau nécrotique ou NAC représentent une complication importante fréquemment rapportée avec la NSM conventionnelle, qui ne préserve pas spécifiquement l’apport sanguin à la NAC. 7 à 10 Par conséquent, des méthodes spécifiques pour préserver l’apport sanguin à la NAC et à la peau de mastectomie peuvent réduire les complications ischémiques et améliorer considérablement les résultats des patientes.
Le développement de la technique chirurgicale de mastectomie IMP-NSM (IMP-NSM) par Karin est basé sur un schéma vasculaire cohérent et préserve l’apport sanguin dominant à la NAC, qui provient des vaisseaux IMP sortant du muscle grand pectoral au bord sternal chez la majorité des patients (Figure 1). La préservation de cet axe vasculaire entraînera, de manière prévisible, une diminution des complications ischémiques. 1, 1113 De plus, avec la préservation de l’IMP, les branches sensorielles cutanées antérieures (ACB) associées des nerfs intercostaux (ICN), qui se déplacent avec les vaisseaux de l’IMP et fournissent une sensation au sein médial et à la NAC, sont souvent observées et préservées (Figure 2), ce qui promet de préserver la sensation à un degré plus élevé que de suivre les techniques de mastectomie conventionnelles. 14 Les étapes importantes de l’IMP-NSM, y compris la dissection rétro-aréolaire, la biopsie sous-mamelonnaire, les lambeaux de mastectomie et la dissection pour la préservation de l’IMP, sont décrites en détail dans ce rapport avec un exemple de cas. 15, 16
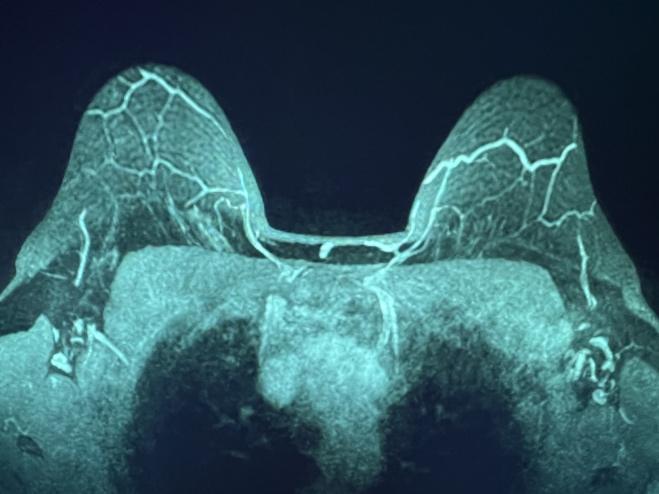
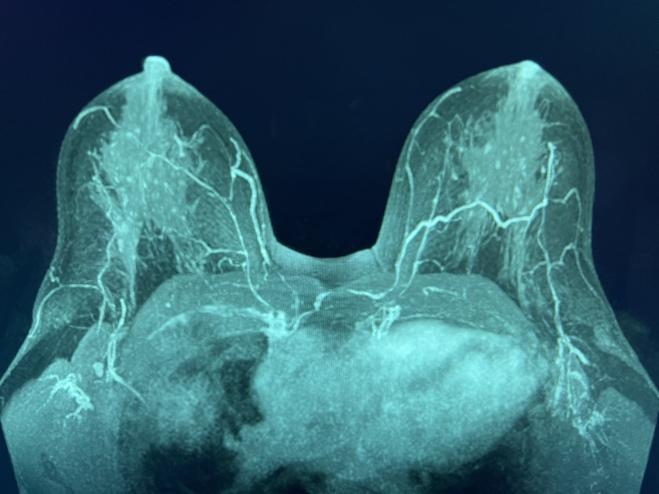
Graphique 1. IRM MIP montrant les PSI se déplaçant vers le NAC, au-dessus du mamelon (à gauche) et au niveau du mamelon (à droite).
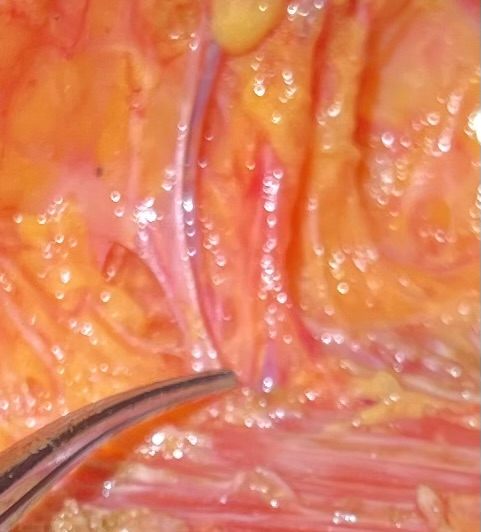
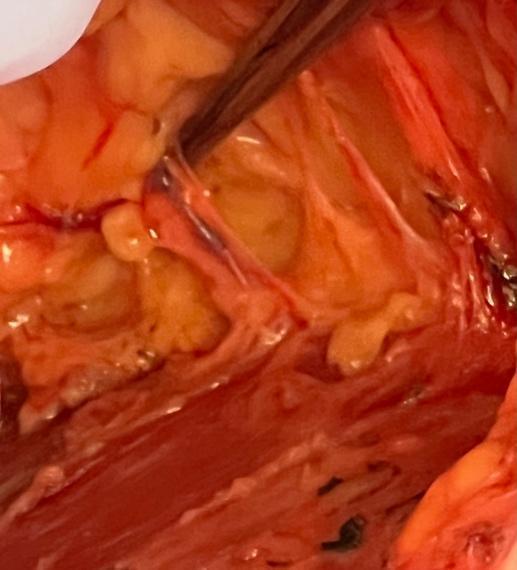
Graphique 2. Exemples de faisceau neurovasculaire IMP avec artère, veine et ACB du nerf sensoriel au 3e CSI préservés dans le lambeau de mastectomie pendant IMP-NSM.
Une femme ménopausée de 58 ans s’est présentée avec un carcinome canalaire invasif de grade 3 du sein droit détecté par mammographie, un récepteur d’œstrogène (ER) négatif, un récepteur de progestérone (PR) négatif et un HER2 positif, avec Ki67 de 70 à 80 %, indiquant un taux de prolifération très rapide. La mammographie de dépistage a révélé une asymétrie du sein droit avec des calcifications associées. La mammographie diagnostique avec échographie (US) a montré une masse suspecte de 0,9 cm à 6h00, à 8 cm du mamelon (cmfn). Une biopsie à l’aiguille guidée par forage guidée par l’échographie a confirmé les résultats ci-dessus. En raison d’antécédents familiaux de cancer du sein – la mère à 78 ans et la sœur à 50 ans – et le père atteint d’un cancer de la prostate, un panel de tests génétiques pour le cancer du sein héréditaire a été obtenu et s’est avéré négatif.
Une IRM mammaire a été réalisée pour la stadification, qui a démontré le cancer connu prouvé par biopsie, mesurant 1,8 cm à 6:00, et des résultats suspects de maladie multifocale, y compris d’autres anomalies suspectes à 6:00, et une anomalie très suspecte de 1,3 cm à 3:00. Pas de ganglions lymphatiques palpables ou anormaux à l’imagerie. Le stade clinique initial était cT1c (multifocal) N0.
Le patient était généralement en bonne santé avec un IMC de 30,2 kg/m2 et une classe AAS 3. Elle a arrêté de fumer 6 ans avant l’opération et avait des antécédents de tabagisme de 3,75 paquets-années.
Les résultats de l’examen physique comprenaient un soutien-gorge préopératoire de taille 38C avec une ptose de grade 2. Le cancer du sein droit connu était palpable sous la forme d’une masse ferme et irrégulière d’environ 2 cm, juste au-dessus du pli sous-mammaire (FMI), près de la peau sus-jacente, et d’une sensibilité du sein droit à 6:00, d’une sensibilité de 2,5 cmfn avec fermeté, d’un gonflement possible par biopsie à l’aiguille par rapport à la masse. La NAC droite semblait normale, le mamelon gauche était partiellement inversé, sans écoulement bilatéral. Pas de ganglions lymphatiques palpables.
L’IRM mammaire avec produit de contraste obtenue pour la stadification a montré un cancer du sein droit connu de 1,8 cm à 6:00, 9 cmfn près de la peau de l’IMF, 2 petites masses suspectes supplémentaires de 2,3 cm plus haut, une zone suspecte de 1,3 cm à 3:00, et aucun ganglion lymphatique suspect.
Les images IRM du sein MIP (projection d’intensité maximale), un reformat courant faisant la moyenne de plusieurs tranches, ont clairement visualisé l’apport sanguin dominant à la NAC (Figure 1). IMP bilatérales dominantes, émanant du muscle grand pectoral le long du bord sternal au niveau des 2e et/ou 3e espaces intercostaux (ICS). Par la suite, les vaisseaux se sont écoulés vers l’avant dans le tissu sous-cutané du sein et se sont terminés près de la NAC.
La TEP-TDM, réalisée après le diagnostic postopératoire de métastases ganglionnaires, n’a montré aucune métastase à distance.
Le patient a été évalué par l’oncologie médicale concernant les options de chimiothérapie néoadjuvante par rapport à la chimiothérapie adjuvante avec un traitement ciblé HER2 et, sur la base du stade clinique initial, la chirurgie a été recommandée en premier. Le traitement systémique standard était une combinaison de chimiothérapie et de thérapie dirigée contre HER2. En raison de l’hétérogénéité de la maladie HER2, la chimiothérapie traiterait les parties de la maladie qui n’étaient pas HER2 positives.
La patiente s’est vu proposer un traitement de conservation du sein ainsi qu’une mastectomie (conservation du mamelon) avec reconstruction immédiate.
Sur la base des résultats de l’imagerie et d’antécédents familiaux importants de cancer du sein, elle a décidé de procéder à des mastectomies bilatérales et souhaitait une approche épargnant le mamelon avec reconstruction mammaire immédiate.
Les options reconstructives proposées étaient la reconstruction par implant ainsi que la reconstruction autologues. Après une discussion approfondie, le patient a opté pour une reconstruction autologue bilatérale avec lambeaux abdominaux libres.
Les objectifs du traitement chirurgical comprenaient l’ablation du cancer avec des marges claires. Cela a été réalisé par IMP-NSM bilatéral, biopsie du ganglion sentinelle axillaire (BGS) et dissection ganglionnaire axillaire complète (ALND) réalisée pour une macrométastase SLNB et plusieurs ganglions lymphatiques palpables suspects en peropératoire. Le stade pathologique final était pT2N3a (cancer chez 15/26 LN). Elle a reçu un traitement adjuvant ddAC-Taxol et Herceptin, ainsi qu’une radiothérapie adjuvante (50 Gy sur 5 semaines), traitant le sein droit reconstruit et tous les ganglions régionaux à l’aide d’une technique de radiothérapie conformationnelle 3D.
La biopsie du sous-mamelon droit a été interprétée comme bénigne en peropératoire ; Cependant, la dernière pathologie a montré un carcinome dans les espaces lymphovasculaires et à la base du mamelon. Par conséquent, le mamelon droit a ensuite été excisé, transformant la procédure en mastectomie épargnant l’aréole droite (ASM) (Figure 3). Elle a développé une nécrose aréolaire partielle inférieure et une mastectomie inférieure, une nécrose cutanée supérieure à l’IMF bilatérale (probablement liée à une rétraction), qui a guéri avec des soins locaux de la plaie. Pour l’hypopigmentation aréolaire inférieure, une correspondance avec la couleur environnante avec un tatouage aréolaire a été proposée, mais elle a refusé étant satisfaite de l’apparence. Cela démontre l’aspect esthétique après ASM et NSM, avec une reconstruction mammaire immédiate, ce qui se traduit par un contour naturel du sein, supérieur à ce qui peut être obtenu avec des mastectomies totales.
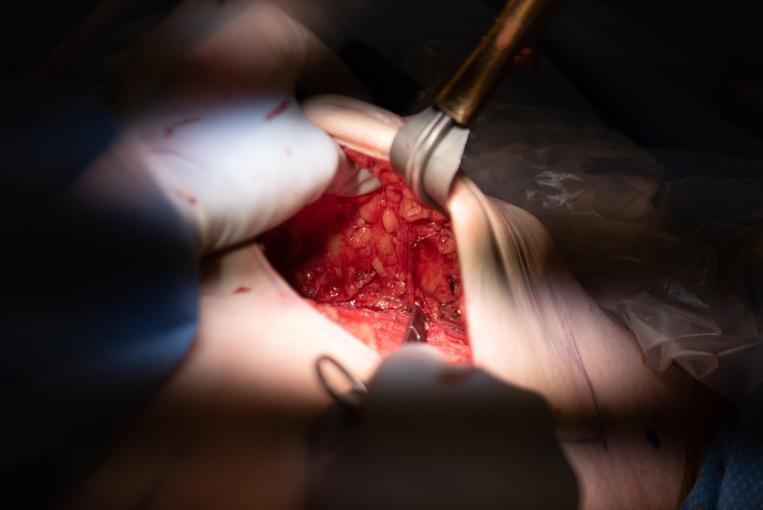
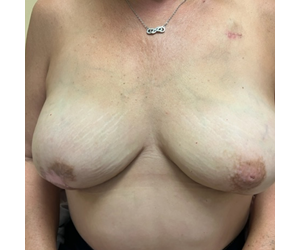
Graphique 3. A gauche : Dissection IMP-NSM montrant que l’IMP a été préservé, correspondant à l’IRM ci-dessus sur la figure 1. À droite : Photo postopératoire à 3 mois après l’IMP-NSM bilatéral et la reconstruction mammaire immédiate par lambeau abdominal libre avec lambeau myocutané transverse droit épargnant les muscles droits (MS-TRAM) et lambeau perforant épigastrique inférieur profond gauche (DIEP). Excision ultérieure du mamelon droit pour le cancer lors d’une biopsie sous-mamelonnaire, et guérison après conversion en ASM droite, et nécrose aréolaire/cutanée partielle inférieure.
La technique chirurgicale IMP-NSM visant à préserver un important approvisionnement en sang NAC a déjà été publiée, y compris les principales étapes importantes. 1, 11, 12 L’IRM mammaire avec contraste, si elle est obtenue pour la stadification préopératoire, peut clairement démontrer l’apport sanguin NAC, mieux visualisé sur les images MIP. Cela montre l’apport sanguin NAC dominant provenant généralement de l’IMP bilatéralement, généralement au 2e ou 3e CSI le long du bord sternal (Figure 1).
Les 2e et 4e CSI sont marqués sur la peau, à 1 cm du bord sternal, indiquant les zones communes où les principaux vaisseaux IMP sont identifiés et conservés en avant du muscle grand pectoral. La technique IMP-NSM peut être réalisée sans IRM du sein, en marquant ces emplacements habituels avec une dissection minutieuse ultérieure dans ces zones ; cependant, si elles sont disponibles, les images IRM du sein peuvent fournir des informations utiles sur l’apport sanguin IMP et anticiper l’emplacement lors de la chirurgie. L’IMP-NSM est définie comme la préservation de l’apport sanguin dominant de l’IMP à la NAC ; cependant, la technique a évolué pour inclure la préservation de petits vaisseaux IMP non dominants supplémentaires visualisés le long du bord sternal, qui peuvent contribuer à l’approvisionnement vasculaire, en plus des branches sensorielles associées à l’ACN. (Figures 1 et 2).
Les incisions cutanées sont le plus souvent le long de l’IMF, et dans ce cas, elles comprenaient l’ablation de la peau recouvrant le plus grand cancer du sein droit près de la peau à 6h00 à l’IMF. Par l’incision cutanée, une solution de tumescence diluée de faible volume est injectée dans le tissu sous-cutané recouvrant le tissu mammaire (1 % de lidocaïne avec épinéphrine 1:100 000, 20 cc dilués dans 200 cc NS). 17, 18 Les lambeaux sous-cutanés IMP-NSM sont surélevés sur le tissu mammaire à l’aide d’une combinaison de dissection cautérisée, contondante et tranchante. Ceci est facilité par l’hydrodissection de tumescence précédente. De plus, la tumescence élargit la largeur du tissu sous-cutané, ce qui facilite la dissection des lambeaux de mastectomie avec une épaisseur optimale constante et évite les lésions de l’approvisionnement vasculaire du tissu sous-cutané et de la peau, réduisant ainsi les complications ischémiques.
Le curage sous-aréolaire recouvrant le tissu mammaire est généralement très proche de la peau car le tissu sous-cutané est beaucoup plus mince. Ainsi, les ciseaux Metzenbaum sont utilisés pour la dissection émoussée et tranchante, et la cautérisation est généralement évitée pour prévenir les dommages thermiques au plexus vasculaire sous-cutané. Le faisceau canalaire allant au mamelon est identifié circonférentiellement par dissection émoussée (Figure 4), divisé directement sous le derme du mamelon avec la maladie de Metzenbaum, et une longueur d’environ 0,5 à 1 cm est retirée, marquant la marge antérieure finale sous le derme du mamelon avec une suture. La biopsie sous-mamelonnaire est envoyée à la pathologie pour une évaluation peropératoire, afin de s’assurer que le mamelon est exempt de toute pathologie maligne.
Graphique 4. Faisceau de biopsie sous-canalaire du mamelon alimentant le mamelon sur la circonférence du mamelon. Division du tissu canalaire avec Metzenbaums, directement sous le derme.
L’étape critique de l’IMP-NSM est une dissection très soigneuse et douce avec préservation de l’IMP près du bord sternal, généralement au niveau des 2e et 3e CSI où l’IMP dominant perfore généralement le muscle pectoral majeur, puis se déplace dans les tissus sous-cutanés (Figure 3). Des vaisseaux sanguins IMP plus petits sont souvent observés dans d’autres CSI et préservés s’ils sont identifiés. La tumescence facilite cette dissection, et avec un étalement doux à l’aide d’une pince, le tissu mammaire est facilement séparé du tissu sous-cutané contenant l’IMP, avec préservation de l’IMP (Figures 2 et 3). La dissection pour préserver le IMP dominant est facilitée par la visualisation du 2e-3e CSI près du bord sternal, généralement après que le reste de la dissection de mastectomie soit presque terminé.
Les blocs régionaux de pectoral placé par le chirurgien (PECS) sont généralement injectés sous visualisation directe. La bupivacaïne avec épinéphrine est injectée comme suit : PECS1 (10 cc sous le fascia entre le grand et le petit pectoral), PECS2 (10 cc sous le fascia entre le petit pectoral et le dentelé) et 10 cc, ou le reste, sous forme de bloc plan dentelé sous le fascia dentelé exposé et le bloc de champ.
Ce rapport décrit la technique chirurgicale IMP-NSM, développée spécifiquement pour réduire les complications ischémiques en préservant l’important IMP, qui fournit l’apport sanguin dominant à la NAC dans 92 % des cas selon l’IRM du sein. 1 Les descriptions antérieures ont noté un apport sanguin NAC dominant IMP chez la majorité des patients, en plus des contributions de l’artère thoracique latérale. 19 Amanti a indiqué que la préservation des branches cutanées de l’IMP est de la plus haute importance pour la viabilité de la NAC avec la NMS. 20 Il est important de noter que, d’après les modèles d’approvisionnement en sang par IRM du sein, l’IMP contribue à l’approvisionnement vasculaire de la NAC, même s’il n’est pas l’apport sanguin dominant, et par conséquent, la préservation est tentée dans tous les IMP-NSM pour aider à prévenir la nécrose. Malgré les rapports soulignant l’importance de la préservation de la IMP, jusqu’à la publication récente de notre technique et de nos résultats IMP-NSM, la littérature se caractérise par une rareté d’études rapportant le taux de réussite spécifique de la préservation de la IMP et son impact sur les complications ischémiques. 1, 12, 13
L’IMP-NSM nécessite une marge claire au niveau du mamelon similaire à n’importe quelle NMS, et la principale contre-indication est le cancer impliquant le mamelon ou la nécessité d’enlever le mamelon pour obtenir des marges claires. 21 Par conséquent, la technique IMP-NSM comprend une biopsie sous-mamelonnaire pour une évaluation peropératoire avec une section congelée ou une préparation par grattage. Si la pathologie met en évidence un cancer à la marge de la biopsie sous-mamelonnaire, l’exérèse du mamelon est effectuée et la procédure est convertie en ASM (Figure 2). Même après l’exérèse du mamelon, l’aspect esthétique de l’ASM, qui préserve la forme et la pigmentation de la peau aréolaire, est supérieur à l’élimination de la NAC. Les contre-indications extrêmement rares à la préservation de l’IMP comprennent l’angiosarcome ou les phyllodes malins si une excision large est nécessaire près de l’IMP pour les marges, survenant chez < 1 % des patients.
Les options de localisation de l’incision IMP-NSM sont similaires à celles de la NSM conventionnelle, l’IMF étant la plus courante, suivie d’incisions radiales ou verticales avec extensions périaréolaires si nécessaire. 1, 13 Cependant, les incisions périaréolaires sont évitées si possible en raison de l’incidence plus élevée de nécrose NAC. 22, 23 Les incisions péritumorales peuvent être incorporées dans l’incision de la mastectomie, ou planifiées pour réséquer la peau recouvrant le cancer pour des marges claires. Les incisions verticales peuvent être une bonne option esthétique et pratique pour les patientes atteintes de ptose, qui n’ont pas subi de plastie mammaire de réduction ou qui n’ont pas utilisé la cicatrice verticale ou IMF antérieure après des réductions mammaires antérieures. 1, 12, 13 Les incisions de mastopexie verticale sont moins fréquentes, dans 5 % des cas d’IMP-NSM, comme option pour corriger le ptosis, qui comprend la désépithélialisation périaréolaire pour augmenter la NAC de manière plus supérieure. 1, 13 La décision finale concernant l’emplacement de l’incision est basée sur l’emplacement du cancer pour la meilleure approche oncologique. D’autres considérations sont des cicatrices antérieures et une discussion avec le chirurgien plasticien pour assurer le meilleur résultat esthétique.
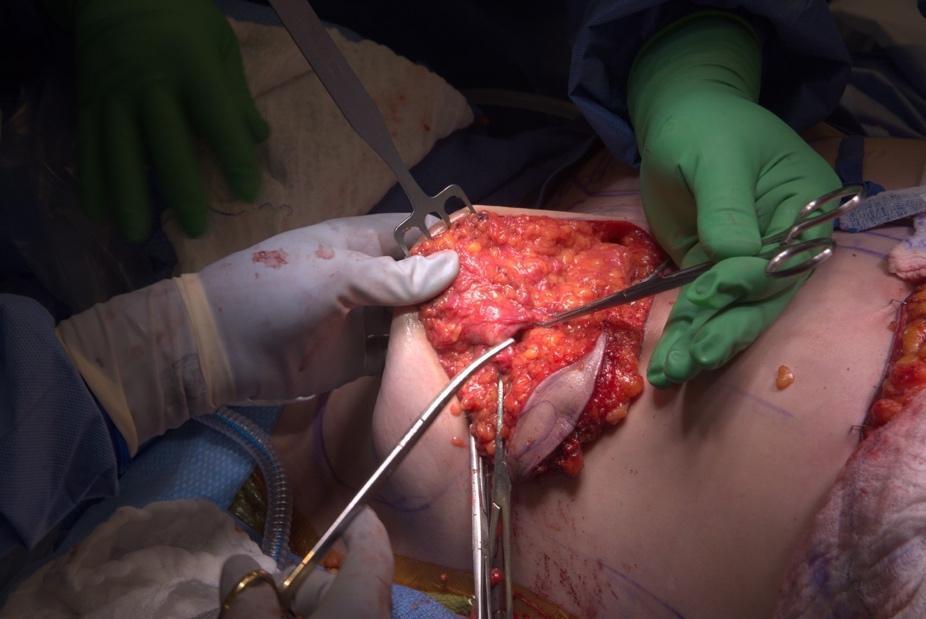
En cas de ptose ou de macromastie importante ne permettant pas une NMS initiale en raison de l’emplacement du mamelon, une mastopexie ou une réduction mammaire initiale, associée à une tumorectomie si indiquée, peut être proposée initialement, afin de préparer la forme du sein et la position du mamelon pour la future NMS (Figure 5). 1 2326 Nous avons démontré que cette approche permet avec succès la préservation du mamelon chez les patients atteints de ptose, de macromastie ou d’obésité avec un IMC moyen = 35, qui n’avaient pas auparavant reçu de routine une NMS. 23, 25 Pour la mastopexie ou la réduction mammaire avant la NMS, le principe clé pour prévenir le lambeau cutané ou la nécrose de la NAC, selon Spear, est de garder le « derme périaréolaire intact pour préserver l’apport sanguin cutané maximal de NAC ». 24 IMP-NSM préserve l’apport sanguin maximal de NAC en fonction des schémas de flux sanguin IRM, ce qui peut être particulièrement important après une réduction mammaire antérieure ou une autre chirurgie mammaire. Par conséquent, la mastopexie initiale ou la réduction mammaire oncoplastique, avec ou sans tumorectomie, suivie d’une IMP-NSM avec reconstruction mammaire, facilite la préservation réussie du mamelon pour les seins très gros ou ptotiques qui ne seraient pas autrement candidats à la NMS.
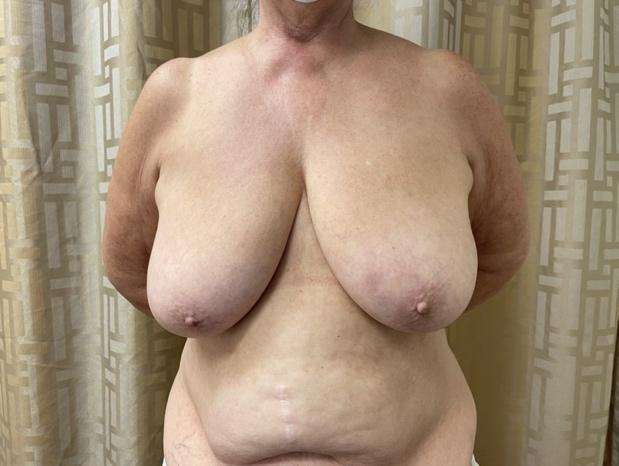
Graphique 5. De gauche à droite : A) Photo préopératoire montrant une ptose marquée. Désire une NMS bilatérale pour la mutation du gène BRCA2. B) Après une plastie mammaire de réduction, première étape, pour une NMS planifiée 3 mois plus tard. C) Postopératoire, 6 mois après une IMP-NSM bilatérale avec reconstruction autologue immédiate avec lambeaux abdominaux libres. La patiente a une légère sensation de toucher du bord sternal médialement sur 5 cm sur le sein droit et 8 cm sur le sein gauche, indiquant une préservation du nerf sensoriel des ACB des ICN.
L’emplacement du cancer près de la peau nécessitant une excision cutanée ou des cicatrices mammaires antérieures ne sont pas des contre-indications à l’IMP-NSM. Cependant, l’utilisation de cicatrices de tumorectomie précédemment irradiées pour la NMS a été associée à une augmentation de la nécrose cutanée de la mastectomie et n’était auparavant pas recommandée ; cependant, avec l’IMP-NSM, il a été réalisé avec succès sans complications ischémiques. 27 Pour les patientes présentant des cicatrices mammaires antérieures qui sont petites ou plus éloignées de la NAC, et qui ne devraient pas provoquer d’ischémie NAC, l’IMP-NSM est systématiquement effectué sans procédure de retard préalable. La figure 6 montre une patiente avec une cicatrice de tumorectomie antérieure du quadrant interne supérieur, et les résultats après une IMP-NSM bilatérale en une seule étape avec reconstruction mammaire par lambeau abdominal libre, sans complications ischémiques. Ainsi, la plupart des cicatrices mammaires antérieures loin de la NAC ne nécessitent pas de procédure de retard du mamelon avant l’IMP-NSM.
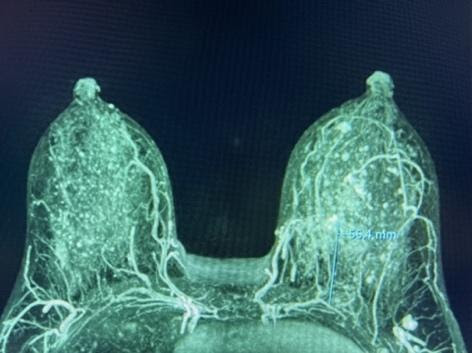
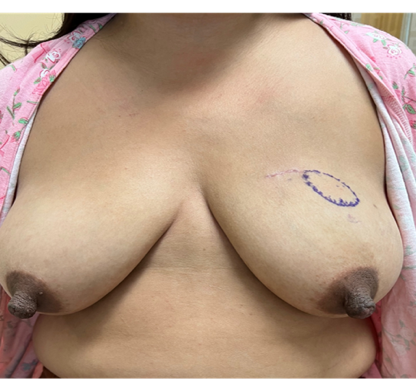
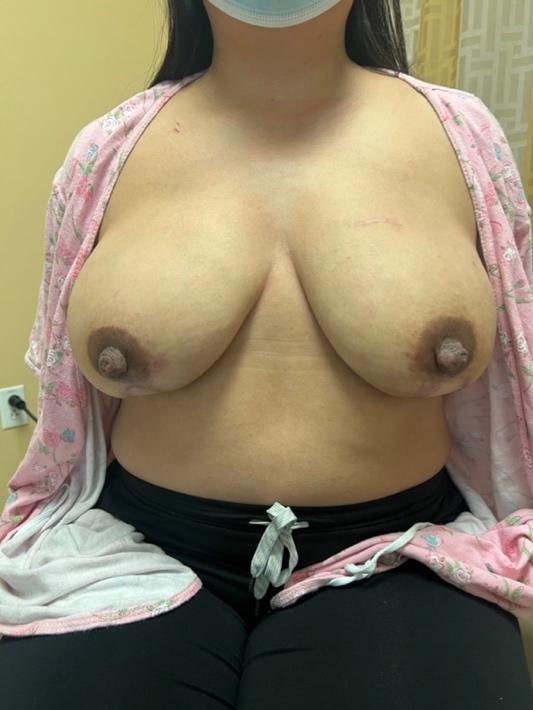
Graphique 6. De gauche à droite : A) IRM mammaire préopératoire MIP démontrant l’apport sanguin IMP à la NAC. B) Photo préopératoire montrant la cicatrice antérieure de tumorectomie dans le quadrant interne supérieur et le site cancéreux marqué. Des mastectomies totales bilatérales ont été recommandées dans un hôpital extérieur en raison d’une ptose ; cependant, le patient souhaitait une préservation de la NAC. C) Photo postopératoire à 3 mois après IMP-NSM (incision verticale) bilatérale avec lambeaux abdominaux libres bilatéraux.
Une procédure de retard du mamelon, qui consiste en une élévation de la NAC entière avec biopsie sous-mamelonnaire, éventuellement avec tumorectomie, est effectuée avant l’IMP-NSM pour des indications spécifiques avec un risque accru anticipé de nécrose (tableau 1). Il s’agit notamment de raisons oncologiques, comme dans les cas d’anomalies d’imagerie très proches du mamelon. D’autres indications sont la nécessité anticipée d’une excision sous-cutanée pour obtenir des marges claires, la nécessité d’incisions périaréolaires interrompant l’apport sanguin à la NAC, des incisions de mastopexie mastectomie planifiée ou une RT antérieure. Il a été démontré qu’une procédure en deux étapes avec retard du mamelon avant la NMS améliore la NAC et la viabilité du mamelon après la NMS en diminuant les complications de la nécrose. 28, 29 Une procédure en deux étapes, avec tumorectomie initiale et procédure différée, est oncologiquement sûre, la majorité des patients subissant la NSM complète, sans maladie invasive résiduelle sur la pathologie finale. 30 Cependant, en dehors des indications ci-dessus, l’IMP-NSM standard, généralement avec IMF, incisions radiales ou verticales, ne nécessite pas une procédure de retard du mamelon de routine ; pourtant, elle n’est associée qu’à un très faible taux de nécrose postopératoire nécessitant une ablation de la NAC dans seulement 0,9 % des cas. 13 Outre les raisons oncologiques ci-dessus, nos principales indications pour la procédure de retard du mamelon pour l’IMP-NSM sont des cicatrices ou des incisions mammaires antérieures susceptibles de provoquer une ischémie importante, ou une RT antérieure, similaire aux indications décrites par Guliano et al.28 Cependant, en préservant le système vasculaire dominant, l’IMP-NSM est réalisée sans qu’il soit nécessaire de recourir à une chirurgie supplémentaire du retard du mamelon chez la plupart des patients.
Tableau 1 : Indications de la procédure initiale de retard du mamelon avec biopsie sous-mamelonnaire avant IMP-NSM.
| Indications de la procédure de retard du mamelon avec biopsie sous-mamelonnaire (Nipple Delay-bx) |
Commentaires |
| Anomalies d’imagerie < 1 cm au mamelon |
Envisager une biopsie sous-mamelonnaire pendant l’IMP-NSM par rapport au retard du mamelon-bx |
|
Problèmes oncologiques (c’est-à-dire cancer près de la peau sur une grande surface) |
Envisager une tumorectomie avec excision cutanée possible pour évaluer les marges, suivie d’une IMP-NSM retardée |
| Anticipez un risque accru significatif d’ischémie due à une mastectomie, à une incision cutanée ou à des cicatrices antérieures | Envisagez un retard du mamelon avant l’IMP-NSM pour une incision de mastectomie de type mastopexie ou certaines grandes incisions périaréolaires nécessaires. |
| RT antérieure du sein entier |
Recommander d’effectuer le retard du mamelon-bx |
Retard du mamelon-Bx : Procédure de retard du mamelon avec dissection rétro-aréolaire et biopsie sous-mamelonnaire réalisée de manière similaire à la dissection NSM, généralement avec élévation du lambeau de mastectomie juste à l’extérieur de la NAC avant la NSM.
L’apport sanguin dominant de l’IMP NAC émane le plus souvent au 2e ou 3e CSI le long du bord sternal et est préservé pendant l’IMP-NSM. De plus, les petits vaisseaux IMP sont souvent identifiés et préservés lors de la chirurgie au 4e et au 5e CSI, ce qui contribue à l’apport sanguin à la peau de la mastectomie et/ou à la NAC. 31 La dissection au niveau de la 4e CSI près du bord sternal est particulièrement importante, sur la base d’une méta-analyse récente de la NAC et de l’innervation mammaire par Tuinder et al, démontrant que le nerf sensoriel cutané antérieur sortant du bord sternal et la branche cutanée latérale de la 4e ICN sont les plus importants à préserver pendant la chirurgie mammaire, car ceux-ci fournissent la plus grande surface de peau du sein et de NAC. 14 Il est important de noter que ces ACB des 3e et 4e ICN sont souvent observés sortant par le bord sternal sous la forme d’un faisceau neurovasculaire avec l’IMP, et peuvent donc être préservés pendant l’IMP-NSM (Figures 3 et 5). La technique IMP-NSM comprend actuellement une dissection le long du bord sternal à tous les CSI exposés pendant la mastectomie pour la préservation des vaisseaux IMP et des nerfs sensoriels associés pour la préservation sensorielle.
Les résultats après la procédure IMP-NSM ont été très favorables pour les patients subissant une reconstruction autologue (Figure 5) ou une reconstruction par implant (Figure 7). Comme publié précédemment, après l’IMP-NSM, les taux de nécrose du mamelon ou de la peau étaient faibles, la majorité guérissant sans autre intervention chirurgicale. 1 Par conséquent, l’angiographie par fluorescence vert d’indocyanine pour évaluer la perfusion du lambeau de mastectomie pour l’excision peropératoire n’est pas couramment utilisée pour l’IMP-NSM, car l’excision de la nécrose postopératoire est rare avec la préservation de l’approvisionnement en sang. 32 L’utilisation d’une solution de tumescence aide non seulement à développer les bons plans tissulaires, mais minimise également la perte de sang. Les blocs PEC placés par le chirurgien permettent un contrôle efficace de la douleur et une réduction marquée du besoin de prise de narcotiques.
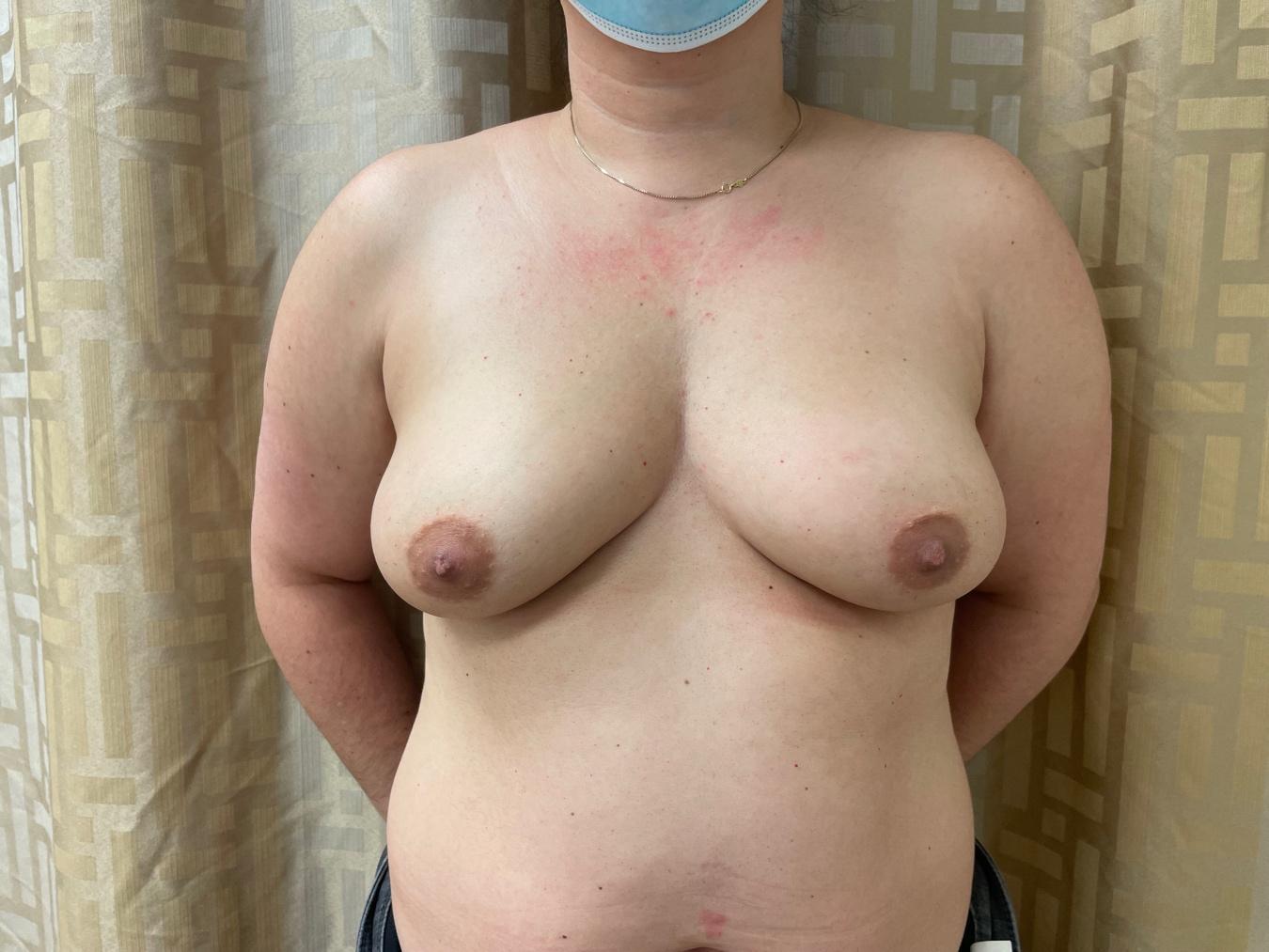

Graphique 7. À gauche) Photo préopératoire. À droite) Postopératoire après une IMP-NSM bilatérale et une reconstruction prépectorale par implant étagée. La patiente signale une légère sensation de toucher du sein médial, y compris une sensation bilatérale du mamelon, indiquant une préservation sensorielle des ACB des ICN.
Des études futures pourraient évaluer si les modèles de flux sanguin par IRM du sein pourraient être utiles dans la planification chirurgicale du type d’incision ou aider à déterminer les indications des procédures de retard du mamelon pour les patientes présentant un risque plus élevé de nécrose. La sélection des patients appropriés qui bénéficieraient d’une procédure de retard du mamelon avant l’IMP-NSM, et l’effet des différents types de flux sanguins IRM sur la décision de placer l’incision, restent des domaines dans lesquels les études futures pourraient être très instructives. De plus, l’IMP-NSM semble préserver la sensation dans le sein médial sur la base des nerfs sensoriels cutanés antérieurs observés lors de la chirurgie qui sont préservés avec le faisceau neurovasculaire IMP, et des résultats préliminaires indiquant une sensation préservée correspondante, qui est étudiée plus avant pour évaluer l’effet sur la préservation sensorielle.
L’IMP-NSM représente une technique chirurgicale importante et mise à jour pour préserver intentionnellement l’IMP et peut être facilement réalisée pour réduire les complications ischémiques. Les patientes présentant une ptose ou une macromastie importante qui ne seraient pas autrement candidates à la NMS, se voient proposer une mastopexie initiale ou une réduction mammaire, suivie d’une IMP-NSM avec reconstruction pour une meilleure esthétique associée à la préservation du mamelon. La préservation des vaisseaux IMP près du bord sternal améliore la NAC et l’approvisionnement vasculaire cutané, ce qui entraîne de très faibles complications ischémiques et d’excellents résultats cliniques, avec l’avantage supplémentaire de la préservation des nerfs sensoriels associée. Ainsi, l’IMP-NSM peut être effectué régulièrement pour améliorer les résultats cliniques.
Toutes les patientes ont fait l’objet d’un suivi postopératoire initial par l’oncologue chirurgical du sein tous les 3 à 6 mois, et d’un suivi supplémentaire avec le chirurgien plasticien.
Aucun équipement spécial autre que les instruments chirurgicaux de routine n’est nécessaire pour la NMS.
Aucune divulgation pertinente.
Le patient visé dans cet article vidéo a donné son consentement éclairé pour être filmé et est conscient que des informations et des images seront publiées en ligne.
La vidéo a été mise à jour le 20/10/23 pour ajouter l’image en écran partagé pendant le chapitre 9 de l’IMP, et pour une étiquette supplémentaire à la fin pour le bloc PECs 2.
References
- Karin MR, Pal S, Ikeda D, Silverstein M, Momeni A. Technique de mastectomie épargnant le mamelon pour réduire les complications ischémiques : préservation d’un flux sanguin important basé sur l’IRM du sein. Monde J Surg. 2023; 47(1):192-200. doi :10.1007/s00268-022-06764-x.
- Wong SM, Chun YS, Sagara Y, Golshan M, Erdmann-Sager J. Modèles nationaux de reconstruction mammaire et de mastectomie épargnant le mamelon pour le cancer du sein, 2005-2015. Ann Surg Oncol. 2019; 26(10):3194-3203. doi :10.1245/s10434-019-07554-x.
- Krajewski AC, Boughey JC, Degnim AC, et al. Des indications élargies et des résultats améliorés pour la mastectomie avec conservation du mamelon au fil du temps. Ann Surg Oncol. 2015; 22(10):3317-3323. doi :10.1245/s10434-015-4737-3.
- Didier F, Radice D, Gandini S, et al. La préservation du mamelon dans la mastectomie améliore-t-elle la satisfaction à l’égard des résultats esthétiques, de l’ajustement psychologique, de l’image corporelle et de la sexualité ? Traiter le cancer du sein. 2009; 118(3):623-633. doi :10.1007/s10549-008-0238-4.
- Satteson ES, Brown BJ, Nahabedian MY. Reconstruction du complexe mamelon-aréolaire et satisfaction des patients : une revue systématique et une méta-analyse. Chirurgie de la glande. 2017; 6(1):4-13. doi :10.21037/gs.2016.08.01.
- Wei CH, Scott AM, Price AN, et al. Bien-être psychosocial et sexuel après une mastectomie avec conservation du mamelon et une reconstruction. Sein J. 2016; 22(1):10-17. doi :10.1111/tbj.12542.
- Ahn SJ, Woo TY, Lee DW, Lew DH, Song SY. Ischémie et nécrose du complexe mamelon-aréolaire dans la mastectomie épargnant le mamelon. Eur J Surg Oncol. 2018; 44(8):1170-1176. doi :10.1016/j.ejso.2018.05.006.
- Bahl M, Pien IJ, Buretta KJ, et al. Les modèles vasculaires de l’imagerie par résonance magnétique préopératoire peuvent-ils aider à prédire la nécrose de la peau après une mastectomie avec conservation du mamelon ? J Am Coll Surg. 2016; 223(2):279-285. doi :10.1016/j.jamcollsurg.2016.04.045.
- Agha RA, Al Omran Y, Wellstead G, et al. Revue systématique de la mastectomie thérapeutique avec conservation du mamelon par rapport à la mastectomie avec conservation de la peau. BJS Ouvert. 2019; 3(2):135-145. doi :10.1002/bjs5.50119.
- Galimberti V, Vicini E, Corso G, et al. Mastectomie avec conservation des mamelons et de la peau : revue des objectifs, innocuité oncologique et contre-indications. Le sein. 2017; 34 :S82 à S84. doi :10.1016/j.breast.2017.06.034.
- Karin M, Pal S, Silverstein M. La mastectomie épargnant le mamelon avec préservation du perforateur de l’artère mammaire interne basée sur l’IRM du sein réduit les complications ischémiques. Dans : Actes officiels de la Société américaine des chirurgiens du sein. Vol XXIII. 29; 1-330. Ann Surg Oncol ; 2022.
- Karin MR, Momeni A. Technique contemporaine de mastectomie épargnant le mamelon pour préserver le flux sanguin du perforateur mammaire interne vers le mamelon et l’analyse des résultats. J Am Coll Surg. 2022; 235(5). doi :10.1097/01.XCS.0000895632.71287.67.
- Karin MR, Wu R, Black CK, Momeni A. Utilisation des données de débit sanguin IRM du sein pour améliorer les résultats cliniques après une mastectomie avec conservation de la peau et une mastectomie avec conservation du mamelon. J Am Coll Surg. 2021; 233(5) :E13. doi :10.1016/j.jamcollsurg.2021.08.037.
- Smeele HP, Bijkerk E, van Kuijk SMJ, Lataster A, van der Hulst RRWJ, Tuinder SMH. Innervation du sein et du mamelon féminins : une revue systématique et une méta-analyse des études de dissection anatomique. Plast Reconstr Surg. 2022; 150(2):243-255. doi :10.1097/PRS.000000000009306.
- Edquilang J, Wu R, Momeni A, Karin MR. Résultats après préservation du perforateur de l’artère mammaire interne dans la mastectomie avec conservation du mamelon. Springer. 2020 :S441 et 442.
- Karin M, Edquilang J, Momeni A. Utilisation de l’IRM mammaire pour faciliter l’identification et la préservation du flux sanguin du perforateur mammaire interne dominant vers le mamelon dans la mastectomie avec conservation du mamelon. ANZ J Surg. 2020; 90(S1) :12 et 13.
- Khavanin N, Fine NA, Bethke KP, et al. La technique tumescente n’augmente pas le risque de complication après une mastectomie avec reconstruction immédiate. Ann Surg Oncol. 2014; 21(2):384-388. doi :10.1245/s10434-013-3311-0.
- Tasoulis MK, Agusti A, Karakatsanis A, Montgomery C, Marshall C, Gui G. L’utilisation de l’hydrodissection dans la mastectomie avec conservation du mamelon et de la peau : une étude de cohorte rétrospective. Plast Reconstr Surg Glob Ouvert. 2019; 7(11) :E2495. doi :10.1097/GOX.000000000002495.
- Urban C, Rietjens M, El-Tamer M, Sacchini VS, éds. Chirurgie mammaire oncoplastique et reconstructrice. Springer International Publishing ; 2019. doi :10.1007/978-3-319-62927-8.
- Maggi S, Amanti C, Lombardi A, et al. Importance de la perforation des vaisseaux dans la mastectomie avec conservation du mamelon : une description anatomique. BCTT. Publié en ligne en juillet 2015:179. doi :10.2147/BCTT.S78705.
- Coopey SB, Smith BL. Le mamelon n’est qu’une autre marge. Ann Surg Oncol. 2015; 22(12):3764-3766. doi :10.1245/s10434-015-4648-3.
- Tevlin R, Griffin M, Karin M, Wapnir I, Momeni A. Impact de la mise en place d’une incision sur les complications ischémiques dans la reconstruction mammaire microchirurgicale. Plast Reconstr Surg. 2022; 149(2):316-322. doi :10.1097/PRS.000000000008770.
- Momeni A, Kanchwala S, Sbitany H. Procédures oncoplastiques en préparation à la mastectomie avec conservation du mamelon et à la reconstruction mammaire autologue : contrôle de l’enveloppe mammaire. Plast Reconstr Surg. 2020; 145(4):914-920. doi :10.1097/PRS.000000000006657.
- Spear SL, Rottman SJ, Seiboth LA, Hannan CM. Reconstruction mammaire à l’aide d’une mastectomie par étapes avec conservation du mamelon après une mastopexie ou une réduction. Plast Reconstr Surg. 2012; 129(3):572-581. doi :10.1097/PRS.0b013e318241285c.
- Daly L, Tsai J, Stone K, et al. Préservation du complexe aréole du mamelon et obésité – succès par étapes. Microchirurgie. Publié en ligne le 3 avril 2023 : micr.31043. doi :10.1002/micr.31043.
- Salibian AA, Frey JD, Karp NS, Choi M. La réduction mammaire par étapes avant la mastectomie avec conservation du mamelon diminue-t-elle les complications ? Une étude de cohorte appariée entre les techniques stadifiées et non stadifiées : Plast Reconstr Surg. 2019; 144(5):1023-1032. doi :10.1097/PRS.000000000006121.
- Frederick M, Lin A, Neuman R, Smith BL, Austen W, Colwell AS. Mastectomie avec conservation du mamelon chez les patientes ayant déjà subi une chirurgie mammaire : analyse comparative de 775 reconstructions mammaires immédiates. Maladies du sein : un annuaire trimestriel. 2016; 27(1):55-57. doi :10.1016/j.breastdis.2016.01.014.
- Jensen JA, Lin JH, Kapoor N, Giuliano AE. Retard chirurgical du complexe mamelon-aréolaire : une technique puissante pour maximiser la viabilité du mamelon après une mastectomie avec conservation du mamelon. Ann Surg Oncol. 2012; 19(10):3171-3176. doi :10.1245/s10434-012-2528-7.
- Ju T, Chandler J, Momeni A, et al. Mastectomie en deux étapes ou mastectomie en une étape avec conservation du mamelon : le moment de l’intervention chirurgicale permet d’éviter la perte du mamelon. Ann Surg Oncol. 2021; 28(10):5707-5715. doi :10.1245/s10434-021-10456-6.
- Thompson C, Chandler J, Ju T, Wapnir I, Tsai J. La mastectomie en deux étapes avec conservation du mamelon ne compromet pas la sécurité oncologique. Springer. 2022; 29(1):204-205.
- Nahabedian MY, Angrigiani C, Rancati A, Irigo M, Acquaviva J, Rancati A. L’importance des cinquièmes vaisseaux intercostaux antérieurs après une mastectomie épargnant le mamelon. Plast Reconstr Surg. 2022; 149(3):559-566. doi :10.1097/PRS.000000000008828.
- Liu EH, Zhu SL, Hu J, Wong N, Farrokhyar F, Thoma A. L’SPY peropératoire réduit les complications du lambeau cutané post-mastectomie : une revue systématique et une méta-analyse. Plast Reconstr Surg Glob Ouvert. 25 avril 2019 ; 7(4) :E2060. doi :10.1097/GOX.0000000000002060.
Cite this article
Karin MR, Momeni A, Thompson CN. Perforateur mammaire interne préservant la mastectomie épargnant le mamelon (IMP-NSM) pour réduire les complications ischémiques. J Med Insight. 2023; 2023(365). doi :10.24296/jomi/365.



