Pontage thoracofémoral : une approche rétropéritonéale
Main Text
Table of Contents
L’intervention chirurgicale pour la maladie occlusive aortoiliaque (AIOD) reste un outil essentiel dans la prise en charge de l’AIOD. L’AIOD est causée par une occlusion des artères infra-rénale et/ou iliaque, souvent secondaire à l’athérosclérose. Nous présentons ici le cas d’un jeune patient masculin ayant des antécédents d’hyperlipidémie familiale et de consommation chronique de tabac, ayant subi une procédure de pontage thoracofémoral (TFB) via une approche rétropéritonéale. Il présentait des symptômes classiques de douleurs bilatérales aux jambes en marchant, des douleurs nocturnes aux membres inférieurs, ainsi que des pouls diminués corrélés aux membres inférieurs. La TFB était l’approche privilégiée en raison de la charge agressive et molle de la plaque s’étendant dans l’aorte suprarénale, ce qui empêchait la réparation endovasculaire et aurait augmenté le risque de pontage aortofémoral infra-rénal standard (AFB). Cette vidéo et ce rapport de cas présentent une explication détaillée d’une approche rétropéritonéale d’une procédure TFB ainsi que les indications nuancées des interventions chirurgicales pour l’AIOD. 1,2
La maladie occlusive aortoiliaque (AIOD) est une manifestation complexe de la maladie artérielle périphérique (MAP), dans laquelle la lumière de l’aorte infra-rénale et/ou les artères iliaques sont anéanties secondairement à cause de l’athérosclérose (souvent un mélange de plaque calcifiée et riche en lipides). La MAP symptomatique peut être causée par des plaques athérosclérotiques primaires rétrécissement de la lumière et limitant le flux, ou par une obstruction secondaire due aux complications emboliques de ces plaques. 1,2 AIOD présente fréquemment des symptômes évoluant de la claudication fessier/cuisse, à des douleurs au repos dans les membres inférieurs, et, dans la forme la plus grave, à une ulcération ischémique. La description classique de la présentation de l’AIOD a été faite par Leriche, son syndrome éponyme étant composé de claudication fessier/cuisse, absence de pouls fémoraux et de dysfonction érectile. 1,2 En cas d’embolisation distale concomitante ou d’occlusion infrainguinale, l’IAOD peut entraîner une ischémie chronique menaçant un membre (CLTI), qui présente un pronostic mauvais. 3
Les facteurs de risque les plus importants pour l’athérosclérose, et par conséquent pour l’AIOD, sont la consommation de tabac et le diabète sucré. 1 L’hyperlipidémie, qui peut être induite par le mode de vie ou due à une hyperlipidémie familiale précoce, contribue également au développement de l’AIOD. D’autres facteurs de risque incluent l’augmentation de l’âge, les antécédents familiaux, le sexe masculin et la race. 4,5
La prévalence de l’AIOD dans la population générale varie de 3,56 % à plus de 14 %. 4,6 Des études ont montré une prévalence plus élevée dans la tranche d’âge 70-80 ans, soit de 14 % à 23 %. 8,9 À mesure que la population vieillit et que les taux de diabète et de maladies cardiovasculaires augmentent, il y aura un potentiel de charge accrue de l’AIOD. Il est donc important d’identifier les patients à risque unique pour obtenir une intervention précoce.
Le bilan doit être initié avec un indice cheville-brachial (BAI). 10-12 Suspicion clinique pour l’AIOD devrait être élevée avec un ABI anormal et un examen du pouls fémoral absent/anormal. Chez le patient symptomatique, l’évaluation doit procéder à une artériographie par tomodensitométrie (ATC) afin de déterminer la nature de la maladie et d’établir une stratification du risque appropriée pour l’intervention. Cependant, certains patients présentent encore des symptômes et peuvent être pris en charge initialement par des mesures conservatrices comme des programmes de marche et du cilostazol. Ces patients n’ont pas besoin de subir un CTA car il s’agirait d’une exposition indésirable à la radiation et au milieu de contraste. 13,14
Quelle que soit la stratégie d’intervention, tous les patients ont besoin d’une prise en charge médicale optimale des maladies chroniques, incluant une évaluation pour l’administration de statines et d’antiplaquettes, l’utilisation d’un programme d’exercice et l’arrêt du tabac. 11,15,16 Pour ceux chez qui une intervention est justifiée, la thérapie endovasculaire est souvent la première ligne de traitement, le pontage chirurgical étant réservé à ceux qui présentent soit un anévrisme concomitant, soit une charge de maladie plus importante.
Le patient est un homme de 52 ans avec des antécédents médicaux d’hyperlipidémie familiale précoce et une consommation antérieure de tabac (50 paquets-an), qui s’est initialement présenté pour un pontage coronarien (CABG) secondaire à un infarctus aigu du myocarde. Lors de l’évaluation clinique du CABG, il a été constaté qu’il présentait une occlusion aortique infra-rénale. Après avoir subi un CABG et une rééducation cardiaque réussis, il a été évalué en clinique vasculaire. Le patient a rapporté un succès lors de l’arrêt du tabac après le CABG, mais présente toujours une claudication à courte distance avec des douleurs de crampes dans les cuisses/fessiers/mollets bilatéralement à 50 yards. De plus, il avait un historique personnel important d’hyperlipidémie et des antécédents familiaux de plusieurs proches au premier degré présentant des événements cardiovasculaires index avant l’âge de 50 ans. Il semblait en bonne santé, sans blessures ischémiques, mais il n’avait pas de pouls fémor/poplité ni de pédales.
L’ACT a démontré une occlusion aortique complète au niveau des artères rénales bilatérales à partir d’une combinaison de plaque athérosclérieuse calcifiée et molle. De manière significative, dans ce cas, l’athérome s’étendait proximalement jusqu’au niveau de l’artère mésentérique supérieure (SMA), comme on le voit à la Figure 1, ce qui aurait compliqué le clampage suprarénal et compromis l’afflux approprié pour le pontage aortofémoral standard (AFB). L’aorte supracéliaque était exempte de maladie artérielle (Figure 2). L’occlusion s’étendait aux artères fémorales communes bilatérales, où le flux était reconstitué à partir des artériels collatéraux iliaciens épigastrique et circonflexe. Les artères fémorales communes bilatérales (AFC) présentaient une plaque athéromatouse d’environ 60 % de sténose, puis le ruissellement était intact sous la bifurcation de la CFA.
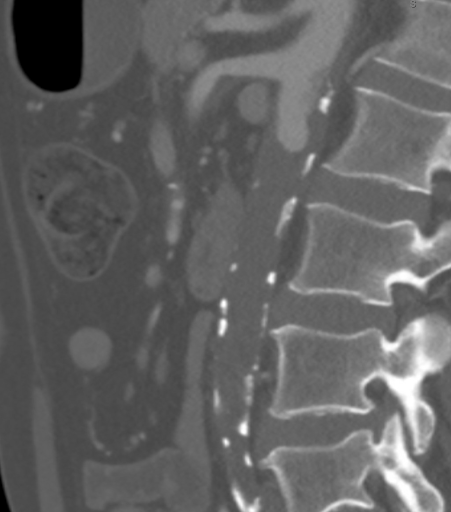
Figure 1. CTA a montré que l’athérome s’étendait proximalement jusqu’au niveau de l’artère mésentérique supérieure (SMA), ce qui aurait compliqué le clampage suprarénalien et compromis l’afflux approprié pour la base AFB standard.
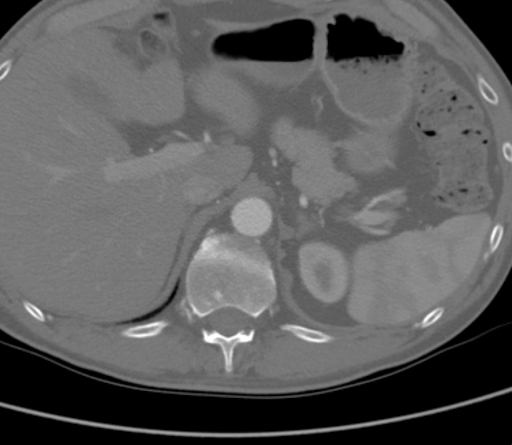
Figure 2. L’ATC montrant que l’aorte supracéliaque était exempte de maladie artérielle.
Comme pour tout patient avec claudication, la première option de traitement est conservatrice, avec une thérapie médicale optimale et un arrêt du tabac. Cependant, la durabilité des procédures d’entrée, combinée à une faible morbidité et mortalité chez les patients correctement sélectionnés, rend l’intervention appropriée pour les patients qui restent symptomatiques malgré les mesures conservatrices. Le Consensus inter-sociétés pour la prise en charge des maladies artérielles périphériques (TASC II)17 est un excellent guide pour décrire les différentes options de traitement et la justification du choix approprié en fonction de l’anatomie du patient et des comorbidités. En général, pour les patients comme celui-ci, avec une occlusion aortique flush et une occlusion iliaque externe nécessitant une endartériectomie CFA, une approche chirurgicale ouverte est la prise en charge privilégiée. Le pontage chirurgical ouvert de l’aorte infra-rénale vers la finartérique bilatérale CFA +/- CFA est la reconstruction la plus courante pour l’AOID sévère, avec une perpédade à 10 ans rapportée pouvant atteindre 90 %. 17 Cependant, certaines contraintes anatomiques telles que la charge de la maladie dans le site de pincement proximal ou une AFB antérieure défaillante peuvent limiter l’approche standard, auquel cas un pontage vers la CFA bilatérale utilisant l’aorte thoracique descendante comme entrée est une approche viable. La perpétuité à 5 ans est supérieure à 80 % lorsqu’elle est réalisée soit par une toracotomie, soit par une approche rétropéritonéale de l’aorte thoracique descendante distale. 18 Chez un patient présentant des comorbidités médicales sévères empêchant une opération au niveau aortique, un pontage axillo-bifémoral avec endartériectomie CFA concomitante serait une autre option viable, bien qu’avec une perpédade attendue de seulement ~50 % à 5 ans.
Ce patient est jeune et en forme après avoir arrêté de fumer et réussi une revascularisation coronarienne. Il restait symptomatique et, compte tenu de son âge, souhaitait toujours améliorer la distance à pied pour faciliter l’emploi, le mode de vie quotidien et une meilleure capacité d’exercice pour une meilleure santé à long terme.
La décision d’utiliser un site d’entrée alternatif de l’aorte au niveau de l’aorte thoracique descendante a été principalement prise en second plan par rapport à l’athérome mou dans un juxtarénale typique du site de pincement, ce qui aurait compromis l’anastomose aortique proximale standard. De plus, il a été décidé d’utiliser une approche rétropéritonéale plutôt qu’une thoracotomie gauche, car cela permettrait une évaluation duplex intraopératoire des vaisseaux viscéraux et rénaux afin d’assurer un apport suffisant et d’effectuer un pontage viscéral concomitant si nécessaire. De plus, compte tenu de sa jeunesse, nous pourrions laisser le site d’entrée de la cavité thoracique pour une future revascularisation si nécessaire.
Les étapes d’un pontage thoracofémoral (TFB) devraient être familières à la plupart des chirurgiens vasculaires, car elles imitent de nombreux séquençages similaires à ceux d’une AFB standard, mais avec un site d’entrée alternatif. Le patient est positionné dans un décubitus latéral droit modifié, avec les hanches aussi proches que possible de plats afin de permettre un accès fémoral adéquat pour effectuer une endartériectomie lorsque cela est nécessaire, comme ce patient. L’opération doit commencer par les expositions de l’aine par incisions obliques afin de limiter le temps total d’ouverture du rétropéritoine (RP) afin de diminuer les pertes insensibles. Lorsque l’on anticipe une endartériectomie fémorale concomitante, il est crucial de contrôler l’artère fémorale superficielle (SFA) et la profondeur fémorale (PA) jusqu’aux zones exemptes de plaque pour garantir une endartériectomie adéquate. Le principal site de défaillance à la base aérienne est constituée par les anastomoses fémorales, c’est pourquoi une attention méticuleuse est accordée à cette étape.
Après une dissection artérielle adéquate, le ligament inguinal doit être légèrement divisé pour éviter la compression des membres greffés lorsqu’ils passent dans la région fémorale. Cela permet également une visualisation directe de la veine iliaque circonflexie superficielle lorsqu’elle parcourt l’artère iliaque externe distale (EIA) et la ligature avant le tunnel. Les aines doivent être garnies de gaze humide et porter l’attention à l’exposition aortique.
Une incision curviligne est ensuite réalisée en commençant par la 8e ou 9e zone intercostale chez la plupart des patients, car cela facilite la division du diaphragme si nécessaire pour assurer un contrôle proximal adéquat, comme on le voit dans ce cas. Cela doit se faire en sachant que cela peut entraîner une hernie diaphragmatique ultérieure ou un effondrement pleural, et éviter si ce n’est pas nécessaire. Chez certains patients, la cavité thoracique n’a pas besoin d’être formellement pénétrée, mais n’hésitez pas à le faire si nécessaire. L’incision est ensuite portée obliquement à travers l’abdomen jusqu’au bord latéral du muscle droit de l’abdomen, puis étendue vers le bas de quelques centimètres sous le niveau de l’ombilicus. Cela permet de diviser la musculature abdominale sans sacrifier le muscle droit. Après avoir divisé le transverse de l’abdomen, le plan RP est créé en rétractant brusquement le péritoine médialement hors de la paroi abdominale. Il est plus simple de développer d’abord le plan dans le quadrant inférieur gauche et d’identifier l’uretère pour s’assurer qu’il n’est pas blessé. Cela permet un accès rapide aux vaisseaux iliaciens, puis le plan peut se développer vers le haut, soulevant le rein et la rate par voie médiale. À ce stade, une ligature de la veine lombaire-rénale doit être réalisée pour prévenir les saignements et identifier l’artère rénale gauche.
Une fois la rotation viscérale médiane terminée, un rétracteur Omni est placé pour faciliter la visualisation et le crus gauche du diaphragme est divisé par catérage, exposant l’aorte supracéliaque. Le contrôle circonférentiel de l’aorte à ce niveau est obtenu à l’aide d’un ruban ombilical pour faciliter un clampage croisé complet en cas de complication aortique. Les tunnels peuvent alors être réalisés de manière brute dans l’entrejambe. Le tunnel gauche devrait être assez facile car l’uretère et le côlon ont été médialisés. Le tunnel de l’aine droit nécessite une dissection douce pour identifier la bifurcation aortique, puis un balayage supérieur de l’uretère à l’aide d’une dissection au doigt, facilitée par la palpation des vaisseaux iliaciens avec l’ongle. Des cathéters en caoutchouc rouge sont placés pour maintenir les tunnels des deux côtés et de l’héparine est administrée.
Avant la pose de la pince proximale, nous préférons utiliser un duplex stérile intraopératoire afin de garantir que l’aorte est exempte d’athérome. Dans les cas de plaque postérieure, une pince totale proximale et distale standard peut être préférable et une dissection plus supérieure de l’aorte, facilitée par la division du diaphragme. Dans ce cas, l’aorte supracéliaque était normale sur le duplex et une pince Satinsky à mordon latérale a donc été utilisée pour le contrôle.
Une fois la pince fixée et vérifiée pour être occlusive, l’aortotomie est prolongée avec un poinçon aortique pour retirer une ellipse de tissu, et le greffon est biseauté et cousu d’un bout à l’autre. Le corps principal de la greffe doit être laissé assez long pour que les membres atteignent les deux artères fémorales.
Après une anastomose proximale, le greffon doit être rincé avec du sérum physiologique hépariné, des pinces souples utilisées, et les membres creusés en tunnel avec très peu de redondance. L’opération doit ensuite se déplacer vers l’aine droite avec le clampage de la SFA, de la PA et de l’EIA dans cet ordre, suivie d’une artériotomie longitudinale et d’une endartériectomie si nécessaire, comme dans ce cas. Le membre greffé est ensuite biseauté et anastomosé de bout en côté. L’anastomose du fémur gauche est réalisée de manière similaire, puis un duplex complet de chaque réparation est réalisé, suivi d’un examen visuel et du pouls des pieds afin de garantir l’absence d’embolisation et un bon résultat hémodynamique.
À ce stade, l’héparine est inversée avec de la protamine et un nouveau bilan de coagulation est envoyé pour aider à la réanimation et à l’hémostasie. Les aines doivent être laissées ouvertes pour fermer en dernier et remplies de gaze sèche et d’agents hémostatiques selon les besoins. Le RP est ensuite minutieusement inspecté pour détecter l’hémostasie et la sérum sésim chaud utilisé pour le lavage. Si le diaphragme était ouvert, comme dans ce cas, un drain thoracique est placé puis le diaphragme se referme avec une suture monofilament 0-0 verrouillant et exécutée. Les côtes sont réapprochées avec une suture tressée #2 et le contenu abdominal est retrouvé en position normale. L’incision RP est fermée avec une suture monofilament absorbable #1 et les aines sont fermées en couches.
Bien que la division du diaphragme ne soit pas nécessaire pour toutes les TFB via exposition RP, elle peut faciliter la visualisation de la rate lors de sa mobilisation et permet un contrôle aortique plus proximal. Cela est particulièrement utile chez les patients masculins présentant un habitus corporel « torse en baril » dû au tabagisme chronique, comme on le voit dans ce cas. Le diaphragme peut être divisé avec des agrafes de charge violettes dans une agrafeuse endo-GIA pour réduire le débordement des bords coupés et faciliter la fermeture à l’extrémité de l’étui. Nous préférons utiliser une technique de suture verrouillée à la fermeture car elle empêche la ligne de suture de devenir lâche pendant la réapproche des côtes.
La visualisation du site de la pince supra-cœliaque devrait être excellente car la pince à mordre latérale peut être encombrante à coudre. Cependant, les effets physiologiques d’une pince partielle avec une ischémie viscérale réduite l’emportent sur les inconvénients du chirurgien. En utilisant un poinçon aortique pour retirer une ellipse appropriée du tissu, l’anastomose proximale peut être facilitée. Même ainsi, comme on le voit dans ce cas, la ligne de suture proximale peut nécessiter des sutures de réparation. Il est idéal de faire cela avant de retirer la pince afin d’éviter la nécessité de serrer plusieurs fois. Nous préférons tester l’anastomose en injectant du sérum physiologique héparinisé avec une seringue bulbe avant le retrait de la pince afin d’identifier les défauts évidents dans la ligne de suture. Une fois la pince retirée, les points de réparation restants sont mieux réalisés avec des sutures de soutien pledget et un nœud précis.
L’avantage de l’évaluation duplex intraopératoire ne peut être sous-estimé. Nous choisissons de réaliser cela après l’achèvement de l’anastomose proximale dans tous les cas afin de garantir toute complication liée à la pose d’une perfusion viscérale adéquate. L’examen du pouls et/ou le Doppler à onde continue seuls peuvent être trompeurs. En assurant une réparation adéquate, on peut détourner l’attention de l’incision RP et toute l’attention portée à la réalisation des anastomoses fémorales.
La stratégie d’utilisation d’une exposition aortique thoracorétropéritonéale gauche pour la TFB, telle que vue chez notre patiente, présente certains avantages par rapport à la technique traditionnelle de la thoraco-péritonérie. Le principal avantage de cette exposition est l’avantage d’éviter les complications pulmonaires. 18 Un bénéfice secondaire est l’accès direct aux artères cœliaque, mésentérique supérieure et rénale gauche, qui peuvent être revascularisées si nécessaire. 18 De plus, cela facilite le creusement de tunnels dans des domaines plus complexes car les tunnels sont accessibles directement. Les inconvénients potentiels par rapport à l’approche traditionnelle à deux cavités sont la probabilité accrue de lésion splénique et une incidence plus élevée de hernie incisive.
Notre patiente a eu une récupération hospitalière sans incident et cela fait maintenant plus d’un an depuis la procédure avec un ABI normal et un état fonctionnel illimité.
En conclusion, la TFB est une alternative thérapeutique sûre et efficace au pontage axillo-bifémoral lorsque l’anatomie du patient et l’étendue de la charge de la maladie aortique la rendent moins favorable. Le meilleur jugement clinique doit être confié au chirurgien opérateur en fonction de son expérience et de la présentation clinique individuelle du patient. Comme on l’a vu pour nos patients et dans les séries précédemment rapportées, le rôle de la TFB reste toujours présent dans certaines populations de patients.
- Omni-rétracteur.
Rien à divulguer.
Le patient mentionné dans cet article vidéo a donné son consentement éclairé pour être filmé et est conscient que les informations et images seront publiées en ligne.
Animation ajoutée après la publication le 30/05/2025. Aucun changement n’a été apporté au contenu de l’article.
References
-
Frederick M, Newman J, Kohlwes J. Syndrome de Leriche. J Gen Intern Med. octobre 2010 ; 25(10):1102-4. doi :10.1007/s11606-010-1412-z.
-
Rodríguez SP, Sandoval F. Maladie occlusive aorto-iliaque, un syndrome silencieux. Représentant de cas BMJ 15 juillet 2019 ; 12(7) :e230770. doi :10.1136/bcr-2019-230770.
-
Narula N, Dannenberg AJ, Olin JW, et al. Pathologie de la maladie artérielle périphérique chez les patients atteints d’ischémie critique des membres. J Am Coll Cardiol. 30 octobre 2018 ; 72(18):2152-2163. doi :10.1016/j.jacc.2018.08.002.
-
Allison MA, Cushman M, Solomon C, et al. Ethnicité et facteurs de risque de changement dans l’indice de pression systolique : l’étude multiethnique de l’athérosclérose. J Vasc Surg. novembre 2009 ; 50(5):1049-56. doi :10.1016/j.jvs.2009.05.061.
-
Criqui MH, Vargas V, Denenberg JO, et al. Ethnicité et maladie artérielle périphérique : l’étude de la population de San Diego. Circulation. 25 octobre 2005 ; 112(17):2703-7. doi :10.1161/CIRCULATIONAHA.105.546507.
-
Berger JS, Hochman J, Lobach I, Adelman MA, Riles TS, Rockman CB. Charge des facteurs de risque modifiables et prévalence de la maladie artérielle périphérique dans différents territoires vasculaires. J Vasc Surg. Septembre 2013 ; 58(3) :673-81.e1. doi :10.1016/j.jvs.2013.01.053.
-
Diehm C, Schuster A, Allenberg JR, et al. Prévalence élevée de l’artériopathie périphérique et de la comorbidité chez 6880 patients en soins primaires : étude transversale. Athérosclérose. janvier 2004 ; 172(1):95-105. doi :10.1016/s0021-9150(03)00204-1.
-
Olin JW, Sealove BA. Maladie artérielle périphérique : connaissances actuelles sur la maladie, son diagnostic et sa prise en charge. Mayo Clin Proc. Juillet 2010 ; 85(7):678-92. doi :10.4065/mcp.2010.0133.
-
Prévalence et facteurs de risque de la maladie artérielle périphérique aux États-Unis : résultats de l’enquête nationale sur la santé et la nutrition, 1999-2000. Circulation. 10 août 2004 ; 110(6):738-43. doi :10.1161/01.CIR.0000137913.26087.F0.
-
Guirguis-Blake JM, Evans CV, Redmond N, Lin JS. Dépistage de la maladie artérielle périphérique à l’aide de l’indice de pression systolique : rapport de données probantes mis à jour et revue systématique pour le US Preventive Services Task Force. JAMA. 10 juillet 2018 ; 320(2):184-196. doi :10.1001/jama.2018.4250.
-
Groupe de rédaction des lignes directrices des membres inférieurs de la Society for Vascular Surgery ; Conte MS, Pomposelli FB, Clair DG, et al ; Société de chirurgie vasculaire. Lignes directrices de pratique de la Society for Vascular Surgery pour la maladie occlusive athéroscléreuse des membres inférieurs : prise en charge de la maladie asymptomatique et de la claudication. J Vasc Surg. mars 2015 ; 61(3 Suppl) :2S-41S. doi :10.1016/j.jvs.2014.12.009. Erratum dans : J Vasc Surg. mai 2015 ; 61(5):1382.
-
Gerhard-Herman MD, Gornik HL, Barrett C, et al. 2016 Lignes directrices AHA/ACC sur la prise en charge des patients atteints de maladie artérielle périphérique des membres inférieurs : Résumé exécutif : Un rapport du groupe de travail de l’American College of Cardiology/American Heart Association sur les directives de pratique clinique. Circulation. 21 mars 2017 ; 135(12) :e686 à e725. doi :10.1161/CIR.000000000000470. Erratum dans : Circulation. 21 mars 2017 ; 135(12) :E790. doi :10.1161/CIR.000000000000501.
-
Ahmed S, Raman SP, Fishman EK. Angiographie par tomodensitométrie et imagerie 3D dans la maladie occlusive aorto-iliaque : voies collatérales dans le syndrome de Leriche. Abdom Radiol (NY). Septembre 2017 ; 42(9):2346-2357. doi :10.1007/s00261-017-1137-0.
-
Koelemay MJ, den Hartog D, Prins MH, Kromhout JG, Legemate DA, Jacobs MJ. Diagnostic de la maladie artérielle des membres inférieurs par échographie duplex. Br J Surg. mars 1996 ; 83(3):404-9. doi :10.1002/bjs.1800830336.
-
Gardner AW, Poehlman ET. Programmes de réadaptation par l’exercice pour le traitement de la douleur de claudication. Une méta-analyse. JAMA. 27 septembre 1995 ; 274(12):975-80.
-
Weitz JI, Byrne J, Clagett GP, et al. Diagnostic et traitement de l’insuffisance artérielle chronique des membres inférieurs : une revue critique. Circulation. 1er décembre 1996 ; 94(11):3026-49. doi :10.1161/01.cir.94.11.3026. Erratum dans : Circulation. 29 août 2000 ; 102(9):1074.
-
Norgren L, Hiatt WR, Dormandy JA, Nehler MR, Harris KA, Fowkes FG ; Groupe de travail TASC II. Consensus intersociétés pour la prise en charge de la maladie artérielle périphérique (TASC II). J Vasc Surg. 2007 Jan ; 45 Suppl S :S5-67. doi :10.1016/j.jvs.2006.12.037.
-
Crawford JD, Scali ST, Giles KA, et al. Résultats contemporains du pontage thoracofémoral. J Vasc Surg. avril 2019 ; 69(4) :1150-1159.e1. doi :10.1016/j.jvs.2018.07.053.
Cite this article
Allan JM, Aucoin V, Pearce BJ. Pontage thoracofémoral : une approche rétropéritonéale. J Med Insight. 2024; 2024(353). doi :10.24296/jomi/353.



