Bypass toracofemoral: un abordaje retroperitoneal
Main Text
Table of Contents
La intervención quirúrgica para la enfermedad oclusiva aortoilíaca (AIOD) sigue siendo una herramienta vital en el manejo de la AIOD. La DIOA es causada por la oclusión de las arterias infrarrenal y/o ilíaca, a menudo secundaria a la aterosclerosis. Aquí presentamos el caso de un paciente joven con antecedentes de hiperlipidemia familiar y consumo crónico de tabaco que se sometió a un bypass toracemoral (TFB) mediante un enfoque retroperitoneal. Se presentó con síntomas clásicos de dolor bilateral en las piernas al caminar, dolor nocturno en las extremidades inferiores y pulsos correlacionados disminuidos en las extremidades inferiores. La TFB fue el enfoque preferido debido a la agresiva carga blanda de placa que se extiende hacia la aorta suprarrenal, lo que impedía la reparación endovascular y aumentaba el riesgo de bypass estándar infrarrenal aortofemoral (AFB). Este vídeo y el informe del caso presentan una explicación detallada de un enfoque retroperitoneal para un procedimiento TFB y las indicaciones matizadas de las intervenciones quirúrgicas para la AIOD. 1,2
La enfermedad oclusiva aortoilíaca (DIAA) es una manifestación compleja de la enfermedad arterial periférica (EAP), en la que el lumen de la aorta infrarrenal y/o las arterias ilíacas se destruyen secundariamente debido a la aterosclerosis (a menudo una mezcla de placa calcificada y rica en lípidos). La EAP sintomática puede ser causada por placas ateroscleróticas primarias que estrechan la luz y limitan el flujo, o por obstrucción secundaria causada por las complicaciones embólicas de estas placas. 1,2 AIOD frecuentemente presenta síntomas que progresan desde la claudicación en glúteos/muslos, a dolor en reposo en las extremidades inferiores y, en su forma más grave, a ulceración isquémica. La descripción clásica de la presentación de la AIOD fue hecha por Leriche, con su síndrome homónimo compuesto por claudicación en glúteos/muslos, ausencia de pulsos femorales y disfunción eréctil. 1,2 Cuando se presenta embolización distal o oclusión infrainguinal concomitante, la TOA puede provocar isquemia crónica que amenaza la extremidad (CLTI), con un pronóstico negativo. 3
Los factores de riesgo más significativos para la aterosclerosis, y en consecuencia para la AIOD, son el consumo de tabaco y la diabetes mellitus. 1 La hiperlipidemia, que puede ser inducida por el estilo de vida o debida a una hiperlipidemia familiar de inicio temprano, también contribuye al desarrollo de la AIOD. Otros factores de riesgo incluyen el aumento de la edad, antecedentes familiares, sexo masculino y raza. 4,5
La prevalencia de la AIOD en la población general varía desde el 3,56% hasta más del 14%. 4,6 Los estudios han mostrado una mayor prevalencia en el rango de edad de 70 a 80 años, del 14% al 23%. 8,9 A medida que la población sigue envejeciendo y las tasas de diabetes y enfermedades cardiovasculares aumentan, existe la posibilidad de una mayor carga de AIOD. Por ello, es importante identificar a los pacientes con riesgo único para obtener una intervención temprana.
La evaluación debe iniciarse con un Índice Tobillo-Braquial (BIA). 10-12 La sospecha clínica de AIOD debería ser alta con un ABI anormal y un examen de pulso femoral ausente/anormal. En el paciente sintomático, la evaluación debe proceder con una arteriografía por tomografía computarizada (CTA) para delimitar la naturaleza de la enfermedad y establecer la estratificación adecuada del riesgo para la intervención. Sin embargo, todavía hay algunos pacientes que presentan síntomas y pueden ser gestionados inicialmente con medidas conservadoras como programas de caminata y cilostazol. Estos pacientes no necesitan someterse a la CTA, ya que sería una radiación no deseada y una exposición a medios de contraste. 13,14
Independientemente de la estrategia de intervención, todos los pacientes necesitan un manejo médico óptimo de las enfermedades crónicas, incluyendo la evaluación para la administración de estatinas y antiplaquetarías, el uso de un régimen de ejercicio y la cesación del tabaquismo. 11,15,16 Para quienes se requiere intervención, la terapia endovascular suele ser la primera línea de tratamiento, reservando el bypass quirúrgico para quienes presentan aneurisma concomitante o una carga de enfermedad más extensa.
El paciente es un caballero de 52 años con antecedentes médicos de hiperlipidemia familiar de inicio temprano y consumo previo de tabaco (50 paquetes por año) que inicialmente se presentó para un injerto de bypass coronario (CABG) secundario a un infarto agudo de miocardio. Durante la evaluación clínica para el CABG, se detectó una oclusión aórtica infrarrenal. Tras someterse con éxito a una CABG y rehabilitación cardíaca, fue evaluado en una clínica vascular. El paciente reportó éxito con la cesación del tabaquismo tras el CABG, pero aún indica una claudicación a corta distancia con dolor de calambres en los muslos/glúteos/pantorrillas bilaterales a 50 yardas. Además, tenía un historial personal significativo de hiperlipidemia y antecedentes familiares de varios parientes de primer grado con eventos cardiovasculares índice menores de los 50 años. Parecía sano, sin heridas isquémicas, pero no presentaba pulsos femorales/poplíteos ni pedales.
La CTA demostró una oclusión aórtica completa a nivel de las arterias renales bilaterales a partir de una combinación de placa aterosclerótica calcificada y blanda. De manera significativa, en este caso, el ateroma se extendió proximalmente hasta el nivel de la arteria mesentérica superior (AME), como se ve en la Figura 1, lo que habría complicado el pinzamiento suprarrenal y comprometido el flujo adecuado para el bypass aortofemoral estándar (AF). La aorta supracelíaca estaba libre de enfermedad arterial (Figura 2). La oclusión se extendió a las arterias femorales comunes bilaterales, donde el flujo se reconstituyó a partir de las arterias colaterales ilíacas epigástricas y circunflexas. Las arterias femorales comunes bilaterales (AFC) presentaban una placa ateromatosa de aproximadamente un 60% de estenosis, y luego la escorrentía permanecía intacta por debajo de la bifurcación de la ACC.
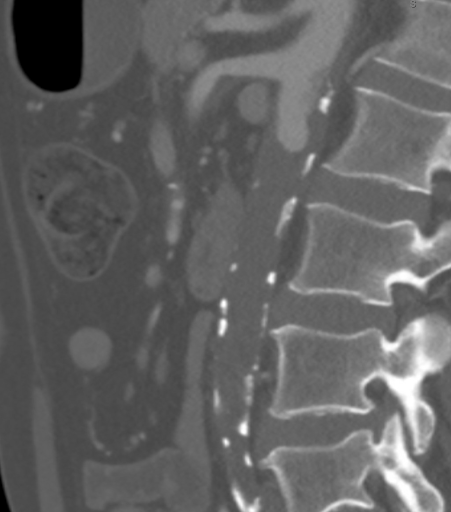
Figura 1. La CTA mostró que el ateroma se extendía proximalmente hasta el nivel de la arteria mesentérica superior (AME), lo que habría complicado el pinzado suprarrenal y comprometido el flujo adecuado para la AFB estándar.
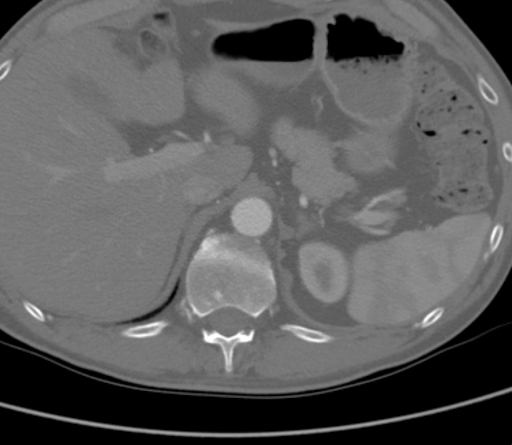
Figura 2. La CTA mostró que la aorta supracelíaca estaba libre de enfermedad arterial.
Como con cualquier paciente con claudicación, la primera opción de tratamiento es conservadora, con una terapia médica óptima y cesación del tabaquismo. Sin embargo, la durabilidad de los procedimientos de entrada, combinada con la baja morbilidad y mortalidad en pacientes seleccionados adecuadamente, hace que la intervención sea adecuada para aquellos que permanecen sintomáticos a pesar de las medidas conservadoras. El Consenso Inter-Sociedad para el Manejo de la Enfermedad Arterial Periférica (TASC II)17 es una excelente guía para describir las distintas opciones de tratamiento y la justificación de la elección adecuada basada en la anatomía y comorbilidades del paciente. En general, para pacientes como este, con oclusión aórtica flush y oclusión ilíaca externa que requerirá una endarterectomía CFA, el tratamiento quirúrgico abierto es el tratamiento preferido. El bypass quirúrgico abierto desde la aorta infrarrenal hasta la endoarterectomía bilateral CFA +/- CFA es la reconstrucción más común para AOID grave, con una patencia a 10 años reportada de hasta el 90%. 17 Sin embargo, ciertas restricciones anatómicas, como la carga de la enfermedad en el sitio de pinza proximal o la falla previa de la AFB, pueden limitar el enfoque estándar, en cuyo caso un bypass hacia la CFA bilateral utilizando la aorta torácica descendente como entrada es un enfoque viable. La permeabilidad a los 5 años es mayor al 80% cuando se realiza mediante toracotomía o retroperitoneal en la aorta torácica descendente distal. 18 En un paciente con comorbilidades médicas graves que impiden la operación a nivel aórtico, el bypass axilo-bifemoral con endarterectomía CFA concomitante sería otra opción viable, aunque con una permeabilidad esperada de solo ~50% a los 5 años.
Este paciente es joven y está en forma tras dejar de fumar y una revascularización coronaria exitosa. Permaneció con síntomas y, dada su edad, seguía deseando una mayor distancia a pie para facilitar el empleo, el estilo de vida diario y una mayor capacidad de ejercicio para una mejor salud a largo plazo.
La decisión de utilizar un sitio alternativo de entrada aórtica en la aorta torácica descendente se tomó principalmente como secundaria al ateroma blando dentro de un sitio típico de pinza, lo que habría comprometido la anastomosis aórtica proximal estándar. Además, se decidió utilizar un enfoque retroperitoneal en lugar de una toracotomía izquierda, ya que esto permitiría una evaluación dúplex intraoperatoria de los vasos viscerales y renales para asegurar un flujo adecuado y realizar un bypass visceral concomitante si fuera necesario. Además, dada su juventud, podríamos dejar el lugar de entrada de la cavidad torácica para futuras revascularizaciones si fuera necesario.
Los pasos de un bypass tohoracofemoral (TFB) deberían ser familiares para la mayoría de los cirujanos vasculares, ya que imitan muchas de las mismas secuencias que una AFB estándar, solo que con un sitio alternativo de entrada. El paciente se coloca en un decúbito lateral derecho modificado con las caderas lo más cerca posible de estar planas para permitir un acceso femoral adecuado para realizar la endarterectomía cuando sea necesario, como en este paciente. La operación debe comenzar con las exposiciones de la ingle a través de incisiones oblicuas para limitar el tiempo total de apertura del retroperitoneo (RP) y así disminuir las pérdidas insensibles. Cuando se anticipa una endarterectomía femoral concomitante, es crucial controlar la arteria femoral superficial (SFA) y la profunda femoral (PA) hasta zonas libres de placa para garantizar una endarterectomía adecuada. El principal lugar de fallo en la AFB son las anastomosis femorales, por lo que se merece una atención meticulosa a este paso.
Tras una disección arterial adecuada, el ligamento inguinal debe dividirse ligeramente para evitar la compresión de las extremidades del injerto al pasar a la región femoral. Esto también permite la visualización directa de la vena ilíaca circunfleja superficial mientras recorre la arteria ilíaca externa distal (EIA) y la ligadura antes de la excavación. Las ingles deben estar llenas de gasa húmeda y centrar la atención en la exposición aórtica.
En la mayoría de los pacientes se realiza una incisión curvilínea comenzando en el octavo o noveno espacio intercostal, ya que esto facilitará la división del diafragma si es necesario para asegurar un control proximal adecuado, como se observa en este caso. Esto debe hacerse con la comprensión de que puede provocar hernia diafragmática posterior o derrame pleural y evitarse si no es necesario. En algunos pacientes, no es necesario acceder formalmente a la cavidad torácica, pero no dudes en hacerlo si es necesario. La incisión se lleva entonces oblicuamente a través del abdomen hasta el borde lateral del músculo recto abdominal y se extiende hacia abajo unos centímetros por debajo del nivel del umbilicus. Esto permite la división de la musculatura abdominal sin sacrificar el músculo recto. Tras dividir el transverso del abdomen, el plano RP se crea retrayendo de forma directa el peritoneo medialmente desde la pared abdominal. Nos resulta más sencillo desarrollar primero el plano en el cuadrante inferior izquierdo e identificar el uréter para asegurarnos de que no sufra daño. Esto permite un acceso rápido a los vasos ilíacos y luego el plano puede desarrollarse superiormente, levantando el riñón y el bazo y medialmente. En este punto, debe realizarse la ligadura de la vena lumbar-renal para prevenir el sangrado e identificar la arteria renal izquierda.
Una vez completada la rotación visceral medial, se coloca un separador Omni para facilitar la visualización y el cruz izquierdo del diafragma se divide con cauterización, exponiendo la aorta supracelíaca. El control circunferencial de la aorta a este nivel se obtiene con una cinta umbilical para facilitar el clampado cruzado completo si se presenta una complicación aórtica. Los túneles pueden luego hacerse de forma directa hacia la ingle. El túnel izquierdo debería ser bastante sencillo, ya que el uréter y el colon han sido medializados. El túnel de la ingle derecha requiere una disección suave para identificar la bifurcación aórtica y luego un barrido superior del uréter mediante la disección del dedo, facilitada por el toque de los vasos ilíacos con la uña. Se colocan catéteres de goma roja para sujetar los túneles a ambos lados y se administra heparina.
Antes de colocar la pinza proximal, preferimos usar dúplex estéril intraoperatorio para asegurar que la aorta esté libre de ateroma. En casos de placa posterior, puede ser preferible el clamp total proximal y distal estándar y una disección más superior en la aorta, facilitada por la división del diafragma. En este caso, la aorta supracelíaca era normal en dúplex y, por tanto, se utilizó una pinza Satinsky de mordisco lateral para el control.
Una vez asegurada y comprobada que la pinza es oclusiva, la aortotomía se extiende con un punzón aórtico para eliminar una elipse de tejido, y el injerto se bisela y cose de extremo a lado. El cuerpo principal del injerto debe dejarse lo suficientemente largo para que las extremidades lleguen a ambas arterias femorales.
Tras la anastomosis proximal, el injerto debe enjuagarse con solución fisiológica heparinizada, usar pinzas blandas y las extremidades excavadas con muy poca redundancia. La operación debe trasladarse entonces a la ingle derecha con el pinzamiento de la SFA, PA y EIA en ese orden, seguido de arteriotomía longitudinal y endarterectomía si es necesario, como en este caso. El miembro del injerto se bisela y se anastoma de extremo a lado. La anastomosis del fémur izquierdo se realiza de manera similar, y luego se realiza el dúplex completo de cada reparación, seguido de un examen visual y del pulso de los pies para asegurar que no haya embolización y un buen resultado hemodinámico.
En este punto, la heparina se revierte con protamina y se envía un nuevo panel de coagulación para ayudar en la reanimación y la hemostasis. Las ingles deben dejarse abiertas hasta cerrarse al final y rellenarse con gasas secas y agentes hemostáticos según sea necesario. Después, el RP se inspecciona meticulosamente para detectar hemostasia y se utiliza solución salina tibia para lavado. Si el diafragma se abría, como en este caso, se colocaba un tubo torácico y luego el diafragma se cerraba con una sutura monofilamento 0-0 que se bloqueaba y funcionaba. Las costillas se reaproximan con sutura trenzada #2 y el contenido abdominal vuelve a la posición normal. La incisión RP se cierra con sutura monofilamentosa absorbible #1 y las ingles se cierran en capas.
Aunque la división del diafragma no es necesaria para todas las TFB mediante exposición a RP, puede facilitar la visualización del bazo mientras se moviliza y permite un control aórtico más próximo. Esto es especialmente útil en pacientes masculinos con un hábito corporal de 'pecho barril' debido al tabaquismo crónico, como se observa en este caso. El diafragma puede dividirse con grapas de carga moradas en una engrapadora GIA para reducir el sangrado desde los bordes cortados y facilitar el cierre al final de la caja. Preferimos usar la técnica de sutura con bloqueo al cerrar, ya que evita que la línea de sutura se afloje mientras se reaproximan las costillas.
La visualización del sitio de la pinza supracelíaca debería ser excelente, ya que la pinza lateral puede ser engorrosa de coser. Aun así, los efectos fisiológicos de una pinza parcial con una isquemia visceral reducida superan las molestias del cirujano. Al utilizar un punzón aórtico para eliminar una elipse adecuada del tejido, se puede facilitar la anastomosis proximal. Aun así, como se ve en este caso, la línea de sutura proximal puede requerir suturas de reparación. Lo ideal es realizarlo antes de retirar la pinza para evitar la necesidad de volver a sujetar varias veces. Preferimos analizar la anastomosis inyectando solución fisiológica heparinizada con una jeringuilla bulbosa antes de retirar la pinza para identificar defectos evidentes en la línea de sutura. Una vez retirada la pinza, cualquier sutura de reparación restante se realiza mejor con suturas de soporte de pledget y nudos precisos.
La ventaja de la evaluación dúplex intraoperatoria no puede ser subestimada. Optamos por realizar esto tras la finalización de la anastomosis proximal en todos los casos para evitar complicaciones al pinzar una perfusión visceral adecuada. El examen de pulso y/o el Doppler de onda continua por sí solos pueden ser engañosos. Asegurando una reparación adecuada, se puede apartar la atención de la incisión RP y dedicar toda la atención a la realización de las anastomosis femorales.
La estrategia de utilizar una exposición aórtica thoracoretroperitoneal izquierda para la TFB, como se observó en nuestro paciente, ofrece algunas ventajas sobre la técnica tradicional de toracotomía. La principal ventaja de esta exposición es la ventaja de evitar complicaciones pulmonares. 18 Un beneficio secundario es el acceso directo a las arterias celíaca, mesentérica superior y renal izquierda, que pueden revascularse si es necesario. Además , esto facilita la excavación en campos más complejos, ya que se puede acceder directamente a los túneles. Las posibles desventajas respecto al enfoque tradicional de dos cavidades son la mayor probabilidad de lesión esplénica y una mayor incidencia de hernia incisional.
Nuestro paciente tuvo una recuperación hospitalaria sin incidentes y ahora lleva más de un año tras el procedimiento, con un ABI normal y un estado funcional ilimitado.
En conclusión, la TFB es una alternativa terapéutica segura y eficaz al bypass axilo-bifemoral cuando la anatomía del paciente y el grado de la carga de la enfermedad aórtica la hacen menos favorable. El mejor juicio clínico debe remitirse al cirujano quirúrgico en función de su experiencia y de la presentación clínica individual del paciente. Como se ha visto en nuestros pacientes y en series previamente reportadas, sigue existiendo un papel continuo de la TFB en poblaciones seleccionadas de pacientes.
- Omni-retractor.
Nada que revelar.
El paciente al que se refiere en este vídeo ha dado su consentimiento informado para ser grabado y es consciente de que la información y las imágenes se publicarán en línea.
Animación añadida tras la publicación el 30/05/2025. No se hicieron cambios en el contenido del artículo.
References
-
Frederick M, Newman J, Kohlwes J. Síndrome de Leriche. J Gen Pasante Med. Octubre de 2010; 25(10):1102-4. doi:10.1007/s11606-010-1412-z.
-
Rodríguez SP, Sandoval F. Enfermedad oclusiva aortoilíaca, un síndrome silencioso. BMJ Caso Rep. 15 de julio de 2019; 12(7):E230770. doi:10.1136/bcr-2019-230770.
-
Narula N, Dannenberg AJ, Olin JW, et al. Patología de la enfermedad arterial periférica en pacientes con isquemia crítica de las extremidades. J Am Coll Cardiol. 30 de octubre de 2018; 72(18):2152-2163. doi:10.1016/j.jacc.2018.08.002.
-
Allison MA, Cushman M, Solomon C, et al. Etnicidad y factores de riesgo para el cambio en el índice tobillo-brazo: el estudio multiétnico de la aterosclerosis. J Vasc Surg. Noviembre de 2009; 50(5):1049-56. doi:10.1016/j.jvs.2009.05.061.
-
Criqui MH, Vargas V, Denenberg JO, et al. Etnicidad y enfermedad arterial periférica: el estudio poblacional de San Diego. Circulación. 25 de octubre de 2005; 112(17):2703-7. doi:10.1161/CIRCULATIONAHA.105.546507.
-
Berger JS, Hochman J, Lobach I, Adelman MA, Riles TS, Rockman CB. Carga de factores de riesgo modificables y prevalencia de enfermedad arterial periférica en diferentes territorios vasculares. J Vasc Surg. septiembre de 2013; 58(3):673-81.E1. doi:10.1016/j.jvs.2013.01.053.
-
Diehm C, Schuster A, Allenberg JR, et al. Alta prevalencia de enfermedad arterial periférica y comorbilidad en 6880 pacientes de atención primaria: estudio transversal. Aterosclerosis. Enero de 2004; 172(1):95-105. doi:10.1016/s0021-9150(03)00204-1.
-
Olin JW, Sealove BA. Enfermedad arterial periférica: información actual sobre la enfermedad y su diagnóstico y tratamiento. Mayo Clin Proc. julio de 2010; 85(7):678-92. doi:10.4065/mcp.2010.0133.
-
Selvin E, Erlinger TP. Prevalencia y factores de riesgo para la enfermedad arterial periférica en los Estados Unidos: resultados de la Encuesta Nacional de Examen de Salud y Nutrición, 1999-2000. Circulación. 10 de agosto de 2004; 110(6):738-43. doi:10.1161/01.CIR.0000137913.26087.F0.
-
Guirguis-Blake JM, Evans CV, Redmond N, Lin JS. Cribado de la enfermedad arterial periférica mediante el índice tobillo-brazo: informe de evidencia actualizado y revisión sistemática para el Grupo de Trabajo de Servicios Preventivos de EE. UU. JAMA. 10 de julio de 2018; 320(2):184-196. doi:10.1001/jama.2018.4250.
-
Grupo de Redacción de Guías de Extremidades Inferiores de la Sociedad de Cirugía Vascular; Conte MS, Pomposelli FB, Clair DG, et al; Sociedad de Cirugía Vascular. Guías de práctica de la Sociedad de Cirugía Vascular para la enfermedad oclusiva aterosclerótica de las extremidades inferiores: manejo de la enfermedad asintomática y claudicación. J Vasc Surg. marzo de 2015; 61(3 Supl):2S-41S. doi:10.1016/j.jvs.2014.12.009. Fe de erratas en: J Vasc Surg. mayo de 2015; 61(5):1382.
-
Gerhard-Herman MD, Gornik HL, Barrett C, et al. 2016 Guía de AHA/ACC sobre el tratamiento de pacientes con enfermedad arterial periférica de las extremidades inferiores: resumen ejecutivo: un informe del grupo de trabajo del Colegio Americano de Cardiología/Asociación Americana del Corazón sobre las directrices de práctica clínica. Circulación. 21 de marzo de 2017; 135(12):E686-E725. doi:10.1161/CIR.00000000000000470. Fe de erratas en: Circulación. 21 de marzo de 2017; 135(12):E790. doi:10.1161/CIR.00000000000000501.
-
Ahmed S, Raman SP, Fishman EK. Angiografía por TC e imagen 3D en la enfermedad oclusiva aortoilíaca: vías colaterales en el síndrome de Leriche. Abdom Radiol (Nueva York). septiembre de 2017; 42(9):2346-2357. doi:10.1007/s00261-017-1137-0.
-
Koelemay MJ, den Hartog D, Prins MH, Kromhout JG, Legemate DA, Jacobs MJ. Diagnóstico de la enfermedad arterial de las extremidades inferiores con ecografía dúplex. Hno. J Surg. marzo de 1996; 83(3):404-9. doi:10.1002/bjs.1800830336.
-
Gardner AW, Poehlman ET. Programas de rehabilitación de ejercicios para el tratamiento del dolor de la claudicación. Un meta-análisis. JAMA. 27 de septiembre de 1995; 274(12):975-80.
-
Weitz JI, Byrne J, Clagett GP, et al. Diagnóstico y tratamiento de la insuficiencia arterial crónica de las extremidades inferiores: una revisión crítica. Circulación. 1 de diciembre de 1996; 94(11):3026-49. doi:10.1161/01.cir.94.11.3026. Fe de erratas en: Circulación. 29 de agosto de 2000; 102(9):1074.
-
Norgren L, Hiatt WR, Dormandy JA, Nehler MR, Harris KA, Fowkes FG; Grupo de Trabajo TASC II. Consenso Intersociedad para el Manejo de la Enfermedad Arterial Periférica (TASC II). J Vasc Surg. Enero de 2007; 45 Supl S:S5-67. doi:10.1016/j.jvs.2006.12.037.
-
Crawford JD, Scali ST, Giles KA, et al. Resultados contemporáneos del bypass toracofemoral. J Vasc Surg. Abril de 2019; 69(4):1150-1159.e1. doi:10.1016/j.jvs.2018.07.053.
Cite this article
Allan JM, Aucoin V, Pearce BJ. Bypass toracofemoral: abordaje retroperitoneal. J Med Insight. 2024; 2024(353). doi:10.24296/jomi/353.



