Thorakofemoraler Bypass: Ein retroperitonealer Ansatz
Main Text
Table of Contents
Die chirurgische Intervention bei aortoliaker Okklusiverkrankung (AIOD) bleibt ein wichtiges Instrument im Management von AIOD. AIOD wird durch eine Verstopfung der Arterie Infrarenal- und/oder Iliacarterie verursacht, oft sekundär zur Arteriosklerose. Hier stellen wir einen Fall eines jungen, männlichen Patienten mit familiärer Hyperlipidämie und chronischem Tabakkonsum vor, der sich einem thoracofemoralen Bypass (TFB)-Verfahren mittels retroperitonealem Ansatz unterzogen hat. Er zeigte klassische Symptome von beidseitigen Beinschmerzen beim Gehen, nächtlichen Schmerzen in den unteren Extremitäten und korrelierten verminderten Pulsen der unteren Extremitäten. TFB war der bevorzugte Ansatz aufgrund der aggressiven, weichen Plaquebelastung, die sich bis in die suprarenale Aorta erstreckte, was eine endovaskuläre Reparatur verhinderte und ein erhöhtes Risiko für einen Standard-infrarenalen Aortofemoralbypass (AFB) mit sich brachte. Dieses Video und der Fallbericht bieten eine detaillierte Erklärung eines retroperitonealen Ansatzes für ein TFB-Verfahren sowie die nuancierten Hinweise der chirurgischen Eingriffe bei AIOD. 1,2
Die aortoiliakale Okklusiverkrankung (AIOD) ist eine komplexe Manifestation der peripheren arteriellen Erkrankung (PAD), bei der das Lumen der infrarenalen Aorta und/oder der iliakalen Arterien sekundär zur Atherosklerose (oft eine Mischung aus verkalkter und lipidreicher Plaque) ausgelöscht werden. Symptomatische PAD kann durch primäre atherosklerotische Plaques verursacht werden, die das Lumen verengen und den Fluss einschränken, oder durch sekundäre Verstopfungen durch die embolischen Komplikationen dieser Plaques. 1,2 AIOD zeigt häufig Symptome, die sich von einer Gesäß-/Oberschenkel-Klaudikation über Ruheschmerzen in den unteren Extremitäten bis hin zu ischämischen Ulzerationen entwickeln. Die klassische Beschreibung für die Präsentation von AIOD wurde von Leriche gegeben, wobei sein namensgebendes Syndrom aus Gesäß-/Oberschenkelklaudikation, fehlenden Femurpulsen und erektiler Dysfunktion bestand. 1,2 Bei gleichzeitiger distaler Embolisation oder Infrainguinal-Okklusion kann AIOD zu chronischer, extremitätsbedrohender Ischämie (CLTI) führen, die eine schlechte Prognose hat. 3
Die bedeutendsten Risikofaktoren für Arteriosklerose und folglich AIOD sind Tabakkonsum und Diabetes mellitus. 1 Hyperlipidämie, die durch den Lebensstil ausgelöst oder durch früh einsetzende familiäre Hyperlipidämie verursacht werden kann, trägt ebenfalls zur Entwicklung von AIOD bei. Weitere Risikofaktoren sind höheres Alter, familiäre Vorgeschichte, männliches Geschlecht und Rasse. 4,5
Die Prävalenz von AIOD in der Allgemeinbevölkerung liegt zwischen 3,56 % und mehr als 14 %. 4,6 Studien haben eine höhere Prävalenz im Alter von 70 bis 80 Jahren von 14 % bis 23 % gezeigt. 8,9 Da die Bevölkerung weiter altert und die Raten von Diabetes und Herz-Kreislauf-Erkrankungen steigen, besteht die Möglichkeit einer größeren Belastung durch AIOD. Daher ist es wichtig, eindeutig gefährdete Patienten zu identifizieren, um eine frühzeitige Intervention zu erhalten.
Die Untersuchung sollte mit einem Ankle-Brachial-Index (ABI) begonnen werden. 10-12 Der klinische Verdacht auf AIOD sollte hoch sein, bei einem abnormalen ABI und fehlender/abnormaler Femoralpulsuntersuchung. Beim symptomatischen Patienten sollte die Untersuchung mit einem Computertomographie-Arteriogramm (CTA) durchgeführt werden, um die Art der Erkrankung zu bestimmen und eine angemessene Risikostratifizierung für die Intervention zu gewährleisten. Es gibt jedoch immer noch einige Patienten, die symptomatisch sind und zunächst mit konservativen Maßnahmen wie Spaziergängen und Cilostazol behandelt werden können. Diese Patienten müssen sich nicht einer CTA unterziehen, da es sich um unerwünschte Strahlen- und Kontrastmittelexposition handelt. 13,14
Unabhängig von der Interventionsstrategie benötigen alle Patienten eine optimale medizinische Behandlung chronischer Erkrankungen, einschließlich der Untersuchung der Statin- und Thrombozytenverabreichung, der Anwendung eines Trainingsprogramms und dem Rauchentwöhnen. 11,15,16 Für diejenigen, bei denen ein Eingreifen notwendig ist, ist die endovaskuläre Therapie oft die erste Behandlungslinie, wobei der chirurgische Bypass für Personen mit gleichzeitiger Aneurysma oder größerer Krankheitslast reserviert ist.
Der Patient ist ein 52-jähriger Herr mit einer frühen Vorgeschichte von früh einsetzender familiärer Hyperlipidämie und Tabakkonsum (50-Pack-Jahre), der zunächst eine koronare Bypass-Transplantation (CABG) infolge eines akuten Myokardinfarkts vorlag. Während der klinischen Untersuchung für das CABG wurde bei ihm eine infrarenale Aortenokklusion festgestellt. Nach einer erfolgreichen CABG und kardiologischer Rehabilitation wurde er in einer Gefäßklinik untersucht. Der Patient berichtete von Erfolg mit dem Rauchentwöhnen nach der CABG, befürwortet aber weiterhin eine kurzstreckige Klaudikation mit Krämpfschmerzen in den beiden Oberschenkeln/Gesäßen/Waden in 50 Metern Entfernung. Darüber hinaus hatte er eine bedeutende persönliche Vorgeschichte von Hyperlipidämie und eine familiäre Vorgeschichte mehrerer Verwandter ersten Grades mit kardiovaskulären Ereignissen unter 50 Jahren. Er wirkte gesund ohne ischämische Wunden, hatte aber keine femoralen, poplitealen und Pedalpulse.
Die CTA zeigte eine vollständige Aortenokklusion auf Höhe der beidseitigen Nierenarterien durch eine Kombination aus verkalktem und weichem atherosklerotischer Plaque. Bedeutsam ist, dass sich das Atherom in diesem Fall proximal zur Ebene der oberen Mesenterienarterie (SMA) ausdehnte, wie in Abbildung 1 zu sehen, was die suprarenale Klemmung erschwert und den geeigneten Zufluss für die Standard-aortofemorale Bypass (AFB) beeinträchtigt hätte. Die supracelische Aorta war frei von arteriellen Erkrankungen (Abbildung 2). Die Okklusion erstreckte sich auf die beidseitigen gemeinsamen Oberschenkelarterien, wo der Fluss aus den epigastrischen und zirkumflexen iliakalen Kollateralen rekonstruiert wurde. Die beidseitigen gemeinsamen Oberschenkelarterien (CFA) wiesen eine atheromatöse Plaque von etwa 60 % Stenose auf, und der Abfluss war unterhalb der CFA-Bifurkation intakt.
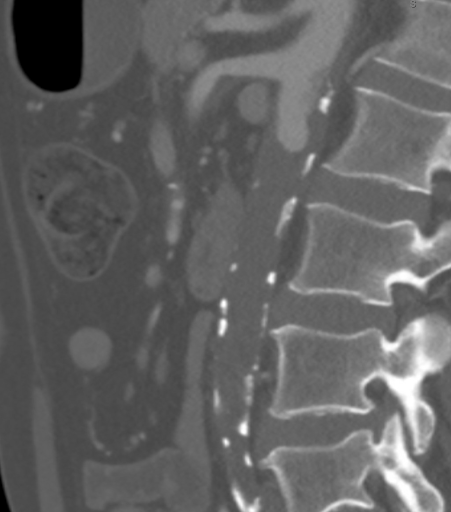
Abbildung 1. CTA, die zeigt, dass das Atherom proximal zur Ebene der oberen Mesenterisarterie (SMA) reichte, was die suprrenale Klemmung erschwert und den entsprechenden Zufluss für die Standard-AFB beeinträchtigt hätte.
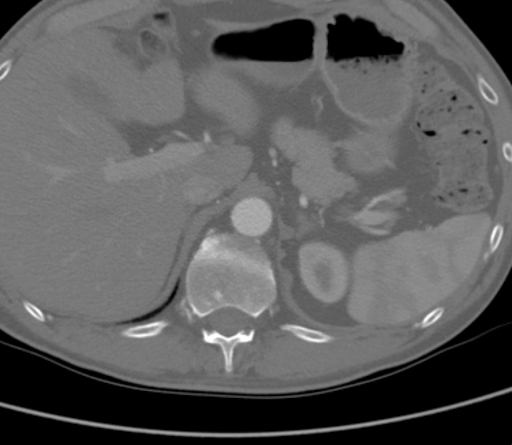
Abbildung 2. CTA, die zeigte, dass die supracelische Aorta frei von arteriellen Erkrankungen war.
Wie bei jedem Patienten mit Klaudikation ist die erste Behandlungsoption konservativ, mit optimaler medizinischer Behandlung und Rauchentwöhnung. Die Beständigkeit der Zuflussverfahren zusammen mit niedriger Morbidität und Mortalität bei entsprechend ausgewählten Patienten macht die Intervention jedoch für Patienten geeignet, die trotz konservativer Maßnahmen weiterhin symptomatisch bleiben. Der Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II)17 ist ein ausgezeichneter Leitfaden, der die verschiedenen Behandlungsoptionen und die Begründung für die passende Wahl basierend auf der Anatomie und Komorbiditäten des Patienten beschreibt. Im Allgemeinen ist bei Patienten wie diesem mit einer Flush-Aorten-Okklusion und einer externen Iliak-Okklusion, die eine CFA-Endarteriektomie erfordern, ein offener chirurgischer Ansatz die bevorzugte Behandlung. Eine offene chirurgische Bypass-Operation von der infrarenalen Aorta zur beidseitigen CFA +/- CFA-Endarterektomie ist die häufigste Rekonstruktion bei schwerer AOID, mit einer 10-jährigen Patency von bis zu 90 %. 17 Bestimmte anatomische Einschränkungen, wie die Krankheitslast an der proximalen Klemmstelle oder ein ausgefallenes vorheriges AFB, können jedoch den Standardansatz einschränken, sodass ein Bypass zur bilateralen CFA über die absteigende thorakale Aorta als Zufluss ein praktikabler Ansatz ist. Die Durchsichtigkeit nach 5 Jahren beträgt bei einer Thorakotomie oder einem retroperitonealen Ansatz der distalen absteigenden thorakalen Aorta über 80 %. 18 Bei einem Patienten mit schweren medizinischen Komorbiditäten, die eine Aortenhöhen-Operation ausschließen, wäre eine Axillo-Bifemoral-Bypass-Operation mit begleitender CFA-Endarterektomie eine weitere gangbare Option, allerdings mit einer erwarteten Patency von nur ~50 % nach 5 Jahren.
Dieser Patient ist nach dem Rauchentwöhnen und erfolgreicher koronarer Revaskularisation jung und fit. Er blieb symptomatisch und wünschte sich trotz seines Alters weiterhin eine bessere Gehdistanz, um Beschäftigung, den Alltag zu erleichtern und die Bewegungskapazität für eine langfristige Gesundheit zu verbessern.
Die Entscheidung, eine alternative Aortenzuflussstelle an der absteigenden thorakalen Aorta zu verwenden, wurde größtenteils sekundär zum weichen Atherom innerhalb einer typischen Klemmstelle juxtarenaler getroffen, was die standardmäßige proximale Aortenanastomose beeinträchtigt hätte. Darüber hinaus wurde entschieden, einen retroperitonealen Ansatz statt einer linken Thorakotomie zu verwenden, da dies eine intraoperative Duplexuntersuchung der viszeralen und nierenen Gefäße ermöglichen würde, um einen ausreichenden Zufluss sicherzustellen und bei Bedarf einen gleichzeitigen viszeralen Bypass durchzuführen. Außerdem könnten wir aufgrund seines jungen Alters die Zuflussstelle der Brusthöhle für eine spätere Revaskularisation belassen, falls nötig.
Die Schritte eines thorakofemoralen Bypass (TFB) sollten den meisten Gefäßchirurgen vertraut sein, da sie viele der gleichen Sequenzen wie eine Standard-AFB nachahmen, nur mit einer alternativen Zuflussstelle. Der Patient befindet sich in einem modifizierten rechten lateralen Dekubitus mit den Hüften so flach wie möglich, um einen ausreichenden femoralen Zugang für eine Endarterektomie durchzuführen, wenn dies erforderlich ist, wie bei diesem Patienten. Die Operation sollte mit den Leistenexpositionen durch schräge Schnitte beginnen, um die Gesamtzeit des Retroperitoneums (RP) zu begrenzen und unsichtbare Verluste zu verringern. Wenn eine gleichzeitige femorale Endarteriektomie erwartet wird, ist es entscheidend, die oberflächliche Femurarterie (SFA) und die profunda femoris (PA) bis in plaquefreie Zonen zu kontrollieren, um eine angemessene Endarteriektomie sicherzustellen. Die Hauptstelle des Versagens bei AFB sind die femoralen Anastomosen, daher ist bei diesem Schritt sorgfältige Aufmerksamkeit geboten.
Nach einer ausreichenden arteriellen Dissektion sollte das Leistenband leicht geteilt werden, um eine Kompression der Graftgliedmaßen beim Eintreten in den Oberschenkelbereich zu vermeiden. Dies ermöglicht auch die direkte Sichtbarkeit der oberflächlichen zirkumflexen Iliakalvene, während sie über die distale externe Iliakalarterie (EIA) und die Ligation vor dem Tunneln verläuft. Die Leisten sollten mit feuchtem Gaze gefüllt werden und die Aufmerksamkeit auf die Aortenexposition gerichtet sein.
Bei den meisten Patienten wird dann ein kurvilinearer Schnitt beginnend im 8. oder 9. Interrippenraum gemacht, da dies die Teilung des Zwerchfells erleichtert, falls nötig, um eine angemessene proximale Kontrolle sicherzustellen, wie in diesem Fall zu sehen. Dies sollte mit dem Verständnis geschehen, dass es später zu einem Zwerchfellbruch oder Pleuraerguss führen kann, und sollte vermieden werden, wenn es nicht notwendig ist. Bei einigen Patienten muss die Thoraxhöhle nicht formell betreten werden, zögern Sie jedoch nicht, dies bei Bedarf zu tun. Der Schnitt wird dann schräg über den Bauchraum bis zum lateralen Rand des Musculus rectus abdominis geführt und dann einige Zentimeter unterhalb des Nabelniveaus verlängert. Dies ermöglicht eine Teilung der Bauchmuskulatur, ohne dass der Musculus rectus geopfert wird. Nach der Teilung des Transversus Abdominis wird die RP-Ebene geschaffen, indem das Peritoneum stumpf von der Bauchwand abgezogen wird. Wir finden es am einfachsten, die Ebene zuerst im linken unteren Quadranten zu entwickeln und den Harnleiter zu identifizieren, um sicherzustellen, dass er nicht verletzt ist. Dies ermöglicht einen schnellen Zugang zu den Darmbeingefäßen und dann kann die Ebene oberlich entwickelt werden, wobei Niere und Milz nach oben und medial angehoben werden. An diesem Punkt sollte die Ligation der lumbal-nierenvenen durchgeführt werden, um Blutungen zu verhindern und die linke Nierenarterie zu identifizieren.
Sobald die mediale viszerale Rotation abgeschlossen ist, wird ein Omni-Retraktor zur Unterstützung der Visualisierung eingesetzt und der linke Krus des Zwerchfells durch Kauterie geteilt, wodurch die supraceliaca Aorta freigelegt wird. Die umlaufende Kontrolle der Aorta auf diesem Niveau erfolgt mit einem Nabelschlenkband, um bei einer Aortenkomplikation eine vollständige Kreuzklemmung zu ermöglichen. Die Tunnel können dann stumpf in die Leistengegend gegraben werden. Der linke Tunnel sollte recht einfach sein, da Harnleiter und Dickdarm medialisiert wurden. Der rechte Leistentunnel erfordert eine sanfte Dissektion, um die Aortenbifurkation zu identifizieren, und anschließend das obere Entfernen des Harnleiters mittels Fingerdissektion, die durch das Tasten der Iliaca-Gefäße mit dem Fingernagel erleichtert wird. Rote Gummikatheter werden angebracht, um die Tunnel auf beiden Seiten zu halten, und Heparin wird verabreicht.
Vor dem Einsetzen der proximalen Klemme bevorzugen wir, sterile Duplexe intraoperativ zu verwenden, um sicherzustellen, dass die Aorta frei von Atheromen ist. Bei posteriorer Plaque kann eine standardmäßige proximale und distale Totalklemme vorzuziehen sein, und eine überlegenere Dissektion an der Aorta wird durch Teilung des Zwerchfells erleichtert. In diesem Fall war die supracelische Aorta auf dem Duplex normal, weshalb eine seitlich beißende Satinsky-Klemme zur Kontrolle verwendet wurde.
Sobald die Klemme befestigt und auf Okklusiv überprüft ist, wird die Aortotomie mit einem Aortenschlag verlängert, um eine Ellipse des Gewebes zu entfernen, und das Transplantat wird abgeschrägt und seitlich genäht. Der Hauptkörper des Transplantats sollte lang genug bleiben, damit die Gliedmaßen beide Oberschenkelarterien erreichen.
Nach einer proximalen Anastomose sollte das Transplantat mit heparinisiertem Kochsalzlösung durchspült, weiche Klemmen verwendet und die Gliedmaßen mit sehr wenig Redundanz tunneln lassen. Die Operation sollte dann zur rechten Leiste mit Abklemmen von SFA, PA und EIA in dieser Reihenfolge verlagert werden, gefolgt von einer longitudinalen Arteriotomie und, falls erforderlich, Endarteriektomie, wie in diesem Fall. Das transplantierte Glied wird dann abgeschrägt und seitlich anastomosiert. Die linke Femoralanastomose erfolgt auf ähnliche Weise, und anschließend erfolgt ein duplex Duplex jeder Reparatur, gefolgt von einer visuellen und pulsierenden Untersuchung der Füße, um keine Embolisation und ein gutes hämodynamisches Ergebnis sicherzustellen.
An diesem Punkt wird das Heparin mit Protamin umgekehrt und ein neues Gerinnungspanel zur Unterstützung der Wiederbelebung und Hämostase geschickt. Die Leisten sollten zum Schließen offen gelassen und bei Bedarf mit trockenem Gaze und hämostatischen Mitteln gefüllt werden. Der RP wird dann sorgfältig auf Hämostase und warme Kochsalzlösung für die Spülung untersucht. Wenn das Zwerchfell geöffnet wurde, wie in diesem Fall, wird eine Thoraxdrainage eingesetzt und das Zwerchfell mit einer verschließenden, verlaufenden 0-0-0 Monofilamentnaht geschlossen. Die Rippen werden mit der #2 geflochtenen Naht neu approximiert und der Bauchinhalt in die normale Position zurückversetzt. Der RP-Schnitt wird mit einer verlaufenden #1 absorbierbaren Monofilamentnaht geschlossen und die Leisten in Schichten geschlossen.
Obwohl die Teilung des Zwerchfells nicht für alle TFB durch RP-Exposition notwendig ist, kann sie die Sichtbarkeit der Milz während der Mobilisierung erleichtern und eine nähere Aortenkontrolle ermöglichen. Dies ist besonders nützlich bei männlichen Patienten mit einem 'Barrel-Chest'-Körpergewohnheit durch chronisches Rauchen, wie in diesem Fall zu beobachten. Das Membran kann mit violetten Ladeklammern in einem endometrischen GIA-Tacker getrennt werden, um die Blutung an den Schnittkanten zu verringern und den Verschluss am Ende des Gehäuses zu erleichtern. Wir bevorzugen eine Verriegelungstechnik beim Verschluss, da dies verhindert, dass die Nahtlinie beim Wiederannähern der Rippen schlaff wird.
Die Visualisierung der supra-zöliakie-Klemmstelle sollte ausgezeichnet sein, da die Seitenbeißklemme umständlich zu nähen sein kann. Dennoch überwiegen die physiologischen Effekte einer partiellen Klemme mit verminderter viszeraler Ischämie die Unannehmlichkeiten für den Chirurgen. Durch die Verwendung eines Aortenpunches, um eine geeignete Ellipse des Gewebes zu entfernen, kann die proximale Anastomose erleichtert werden. Dennoch kann die proximale Nahtlinie wie in diesem Fall Reparaturnähte benötigen. Es ist ideal, dies vor dem Entfernen der Klemme durchzuführen, um das mehrfache Nachspannen zu vermeiden. Wir bevorzugen es, die Anastomose zu testen, indem wir vor der Entfernung der Klemme heparinisierter Kochsalzlösung mit einer Bulb-Spritze injizieren, um offensichtliche Defekte in der Nahtlinie zu erkennen. Sobald die Klemme entfernt ist, werden alle verbleibenden Reparaturnähte am besten mit Pledget-Stütznähten und präzisem Knotenbinden durchgeführt.
Der Vorteil der intraoperativen Duplex-Bewertung kann nicht hoch genug eingeschätzt werden. Wir entscheiden uns in jedem Fall dafür, dies nach Abschluss der proximalen Anastomose durchzuführen, um keine Komplikationen durch das Abklemmen einer ausreichenden viszeralen Perfusion zu vermeiden. Eine Pulsuntersuchung und/oder ein kontinuierlicher Doppler allein kann irreführend sein. Durch die Sicherstellung einer angemessenen Reparatur kann die Aufmerksamkeit vom RP-Schnitt abgelenkt und die volle Aufmerksamkeit auf die Durchführung der Femoralanastomosen gerichtet werden.
Die Strategie, eine linke thorakoperitoneale Aortenexposition für TFB zu verwenden, wie bei unserem Patienten beobachtet, bietet einige Vorteile gegenüber der traditionellen Thorakotomie-Technik. Der Hauptvorteil dieser Exposition ist die Vermeidung lungenbedingter Komplikationen. 18 Ein sekundärer Vorteil ist der direkte Zugang zur Zöliakie-, oberer Mesenteriarterie und linker Nierenarterie, die bei Bedarf revaskularisiert werden können. 18 Darüber hinaus erleichtert dies den Tunnelbau in anspruchsvolleren Bereichen, da die Tunnel direkt zugänglich sind. Mögliche Nachteile gegenüber dem traditionellen Zwei-Karies-Ansatz sind die erhöhte Wahrscheinlichkeit einer Milzverletzung und die höhere Häufigkeit von Schnittvornie.
Unser Patient hatte eine ereignislose Genesung im Krankenhaus und ist nun mehr als ein Jahr nach dem Eingriff mit normaler ABI und unbegrenztem funktionsfähigen Status.
Zusammenfassend lässt sich sagen, dass TFB eine sichere und wirksame Behandlungsalternative zum Axillo-bifemoralen Bypass ist, wenn die Anatomie des Patienten und das Ausmaß der Aortenbelastung sie weniger vorteilhaft machen. Das beste klinische Urteil sollte dem operierenden Chirurgen auf Grundlage seiner Erfahrung und der individuellen klinischen Präsentation des Patienten überlassen werden. Wie bei unserem Patienten und in zuvor berichteten Serien zu sehen ist, bleibt TFB weiterhin eine Rolle in ausgewählten Patientengruppen.
- Omni-Retraktor.
Nichts zu verraten.
Der in diesem Videoartikel erwähnte Patient hat seine informierte Zustimmung zur Aufnahme gegeben und weiß, dass Informationen und Bilder online veröffentlicht werden.
Animation wurde nach der Veröffentlichung am 30.05.2025 hinzugefügt. Am Artikelinhalt wurden keine Änderungen vorgenommen.
References
-
Frederick M, Newman J, Kohlwes J. Leriche-Syndrom. J Gen Praktikant Med. 2010 Okt; 25(10):1102-4. doi:10.1007/s11606-010-1412-z.
-
Rodríguez SP, Sandoval F. Aortoiliac Okklusionskrankheit, ein stilles Syndrom. BMJ Case Rep. 2019 Juli 15; 12(7):e230770. doi:10.1136/bcr-2019-230770.
-
Narula N, Dannenberg AJ, Olin JW, et al. Pathologie der peripheren arteriellen Verschlusskrankheit bei Patienten mit kritischer Ischämie der Gliedmaßen. J Am Coll Cardiol. 30. Oktober 2018; 72(18):2152-2163. doi:10.1016/j.jacc.2018.08.002.
-
Allison MA, Cushman M, Solomon C, et al. Ethnische Zugehörigkeit und Risikofaktoren für Veränderungen des Knöchel-Arm-Index: die multiethnische Studie zur Atherosklerose. J Vasc Surg. November 2009; 50(5):1049-56. doi:10.1016/j.jvs.2009.05.061.
-
Criqui MH, Vargas V, Denenberg JO et al. Ethnizität und periphere arterielle Verschlusskrankheit: die San Diego Population Study. Zirkulation. 25. Oktober 2005; 112(17):2703-7. doi:10.1161/CIRCULATIONAHA.105.546507.
-
Berger JS, Hochman J, Lobach I, Adelman MA, Riles TS, Rockman CB. Modifizierbare Belastung durch Risikofaktoren und die Prävalenz der peripheren arteriellen Verschlusskrankheit in verschiedenen vaskulären Territorien. J Vasc Surg. 2013 September; 58(3):673-81.e1. doi:10.1016/j.jvs.2013.01.053.
-
Diehm C, Schuster A, Allenberg JR, et al. Hohe Prävalenz der peripheren arteriellen Verschlusskrankheit und Komorbidität bei 6880 Patienten in der Primärversorgung: Querschnittsstudie. Atherosklerose. Januar 2004; 172(1):95-105. doi:10.1016/s0021-9150(03)00204-1.
-
Olin JW, Sealove BA. Periphere arterielle Verschlusskrankheit: aktuelle Erkenntnisse über die Krankheit und ihre Diagnose und Behandlung. Mayo Clin Proc. Juli 2010; 85(7):678-92. doi:10.4065/mcp.2010.0133.
-
Prävalenz und Risikofaktoren für periphere arterielle Verschlusskrankheit in den Vereinigten Staaten: Ergebnisse der National Health and Nutrition Examination Survey, 1999-2000. Zirkulation. 10. August 2004; 110(6):738-43. doi:10.1161/01.CIR.0000137913.26087.F0.
-
Guirguis-Blake JM, Evans CV, Redmond N, Lin JS. Screening auf periphere arterielle Verschlusskrankheit mit dem Knöchel-Arm-Index: aktualisierter Evidenzbericht und systematische Überprüfung für die US Preventive Services Task Force. JAMA. 2018 Juli 10; 320(2):184-196. doi:10.1001/jama.2018.4250.
-
Schreibgruppe der Gesellschaft für Gefäßchirurgie für Leitlinien für die unteren Extremitäten; Conte MS, Pomposelli FB, Clair DG et al.; Gesellschaft für Gefäßchirurgie. Praxisleitlinien der Gesellschaft für Gefäßchirurgie für atherosklerotische Okklusiverkrankungen der unteren Extremitäten: Behandlung von asymptomatischen Erkrankungen und Claudicatio. J Vasc Surg. 2015 Mär; 61(3 Ergänzung):2S-41S. doi:10.1016/j.jvs.2014.12.009. Erratum in: J Vasc Surg. Mai 2015; 61(5):1382.
-
Gerhard-Herman MD, Gornik HL, Barrett C, et al. 2016 AHA/ACC-Leitlinie zur Behandlung von Patienten mit peripherer arterieller Verschlusskrankheit der unteren Extremitäten: Zusammenfassung: Ein Bericht der Task Force des American College of Cardiology/American Heart Association zu Leitlinien für die klinische Praxis. Zirkulation. 21. März 2017; 135(12):e686-e725. doi:10.1161/CIR.000000000000470. Erratum in: Zirkulation. 21. März 2017; 135(12):e790. doi:10.1161/CIR.000000000000501.
-
Ahmed S, Raman SP, Fishman EK. CT-Angiographie und 3D-Bildgebung bei aortoiliakaler Verschlusskrankheit: Kollateralwege beim Leriche-Syndrom. Abdom Radiol (NY). 2017 September; 42(9):2346-2357. doi:10.1007/s00261-017-1137-0.
-
Koelemay MJ, den Hartog D, Prins MH, Kromhout JG, Legemate DA, Jacobs MJ. Diagnose einer arteriellen Verschlusskrankheit der unteren Extremitäten mit Duplex-Sonographie. Br J Surg. 1996 Mär; 83(3):404-9. doi:10.1002/bjs.1800830336.
-
Gardner AW, Poehlman ET. Übungsrehabilitationsprogramme zur Behandlung von Claudicatio-Schmerzen. Eine Meta-Analyse. JAMA. 27. September 1995; 274(12):975-80.
-
Weitz JI, Byrne J, Clagett GP, et al. Diagnose und Behandlung der chronischen arteriellen Insuffizienz der unteren Extremitäten: eine kritische Übersichtsarbeit. Zirkulation. 1. Dezember 1996; 94(11):3026-49. doi:10.1161/01.cir.94.11.3026. Erratum in: Zirkulation. 29. August 2000; 102(9):1074.
-
Norgren L, Hiatt WR, Dormandy JA, Nehler MR, Harris KA, Fowkes FG; Arbeitsgruppe TASC II. Intergesellschaftlicher Konsens für das Management der peripheren arteriellen Verschlusskrankheit (TASC II). J Vasc Surg. Januar 2007; 45 Suppl S:S5-67. doi:10.1016/j.jvs.2006.12.037.
-
Crawford JD, Scali ST, Giles KA, et al. Zeitgenössische Ergebnisse des thorakofemoralen Bypasses. J Vasc Surg. 2019 April; 69(4):1150-1159.e1. doi:10.1016/j.jvs.2018.07.053.
Cite this article
Allan JM, Aucoin V, Pearce BJ. Thorakofemoraler Bypass: ein retroperitonealer Zugang. J Med Insight. 2024; 2024(353). doi:10.24296/jomi/353.



