Résection antérieure basse robotisée avec iléostomie à anse de dérivation pour le cancer du rectum localement avancé
Main Text
Table of Contents
Cette vidéo fait la démonstration d’une résection antérieure basse robotisée pour un cancer du rectum localement avancé après un traitement néoadjuvant par chimioradiothérapie à base de FOLFOX. Une résection antérieure basse est recommandée pour les tumeurs rectales dans lesquelles une marge distale de 1 cm est réalisable sans empiètement du sphincter. Un élément clé de cette opération est une dissection mésorectale complète, qui est mise en évidence par la technique robotique. Dans ce cas, notre patient avait une tumeur de 2,6 cm située à 6 cm au-dessus du bord anal, qui a été traitée avec huit cycles de FOLFOX suivis d’une radiothérapie de consolidation. Une résection antérieure basse robotisée a été réalisée et la dernière pathologie a révélé une réponse pathologique complète.
Le cancer colorectal est la troisième cause de décès liés au cancer aux États-Unis ; cependant, l’amélioration de la survie globale dans le cancer du rectum a été démontrée avec l’ajout d’un traitement néoadjuvant total à base de FOLFOX. Bien que certains patients aient une réponse clinique complète après le traitement, une surveillance continue est recommandée. La chirurgie, y compris la résection antérieure basse (LAR) ou la résection abdominopérinéale (APR), est recommandée pour tous les patients présentant une maladie résiduelle ou une récidive. Une approche robotique de la LAR pour les tumeurs basses situées au-dessus du complexe sphincter offre une visualisation inégalée du mésorectum pendant la résection oncologique. Dans cette vidéo, nous faisons la démonstration d’une résection antérieure basse robotisée chez un patient atteint d’un cancer du rectum localement avancé, qui avait été traité par chimioradiothérapie néoadjuvante à base de FOLFOX.
Notre patiente est une femme de 50 ans par ailleurs en bonne santé qui s’est présentée au début de novembre 2020 pour une coloscopie de dépistage. Un adénocarcinome rectal modérément différencié avec des gènes de réparation de mésappariement intacts à environ 6 à 12 cm du bord anal et occupant 30 % de la circonférence luminale a été identifié. La masse a été ressentie à environ 6 à 7 cm du rebord anal lors du toucher rectal. Le patient était notablement asymptomatique de cette lésion.
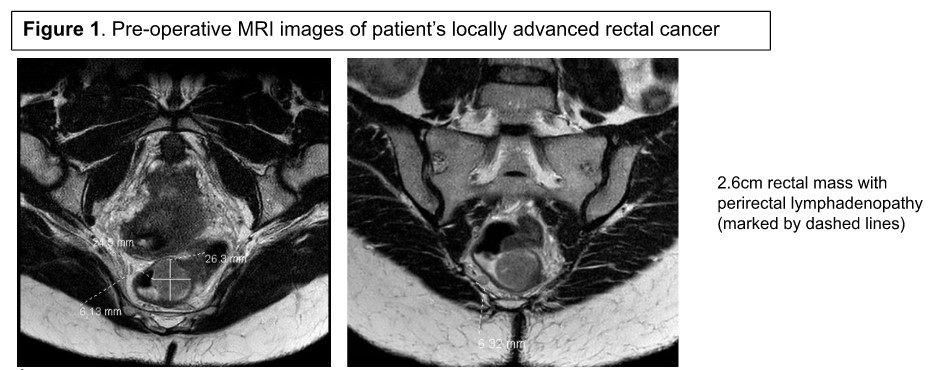
Le bilan de stadification, y compris l’imagerie axiale du thorax, de l’abdomen et du bassin, était négatif pour les métastases à distance ou péritonéales. De plus, une IRM a été réalisée, qui a montré une masse rectale semi-circonférentielle de 2,6 cm avec des ganglions lymphatiques mésorectaux à la limite de l’hypertrophie compatible avec la maladie cT3, cN1, cM0 (stade IIIB) (Figure 1). Son taux d’antigène carcinoembryonnaire (ACE) était de 7,9 ng/mL.
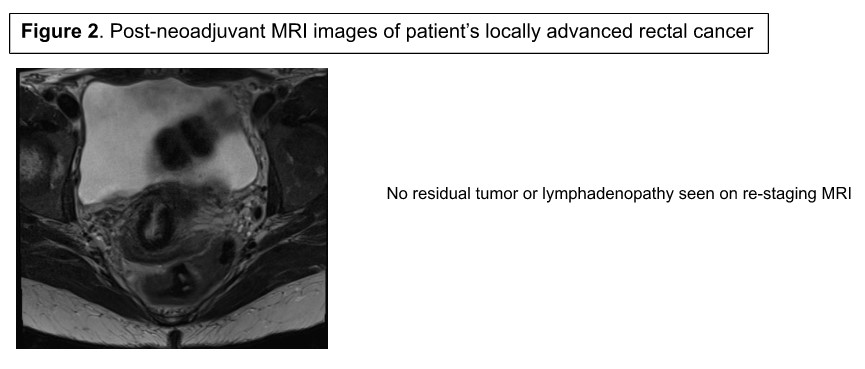
Le patient a été référé pour un traitement néoadjuvant, et huit cycles de chimioradiothérapie à base de FOLFOX ont été terminés en juillet 2020. L’IRM de restadification n’a pas mis en évidence de tumeur résiduelle ou d’adénopathie périrectale (Figure 2) ; Cependant, une sigmoïdoscopie flexible a montré un tissu adénomateux au niveau de la tumeur, suggérant une maladie résiduelle. Les risques et les avantages de l’observation par rapport à la chirurgie ont été discutés de manière multidisciplinaire, et le patient a accepté de procéder à une RAL robotisée. Comme pour toute approche LAR, une marge de 1 cm et un prélèvement d’excision mésorectal complet d’au moins 12 ganglions lymphatiques sont nécessaires pour une résection adéquate.
Le patient a été amené au bloc opératoire et positionné en décubitus dorsal, les bras enlevés. Les bras et le torse ont été fixés à l’aide d’une combinaison de poufs et de sangles de sécurité pour éviter tout déplacement lors du repositionnement de la table. L’emplacement des hublots est planifié avant la préparation et détaillé à la figure 3.
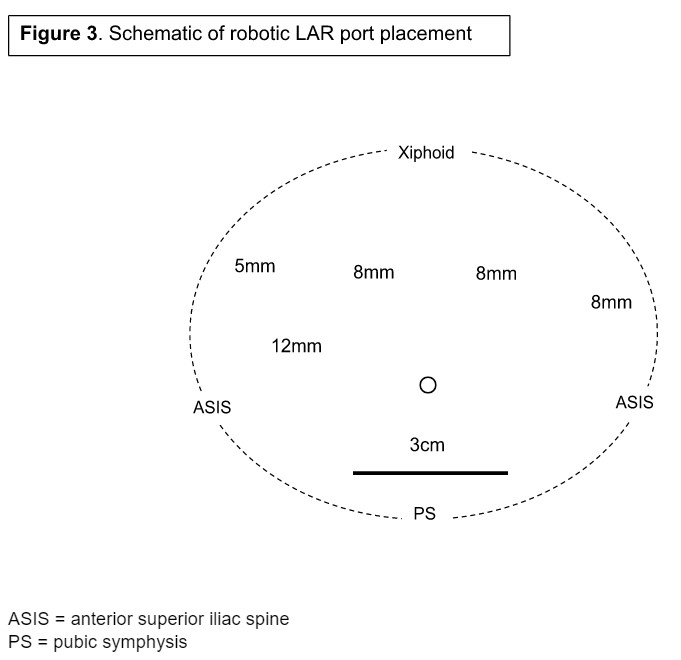
Nous avons commencé par une incision de Pfannenstiel de 3 cm à environ 2 doigts au-dessus de la symphyse pubienne. Cette incision a servi à la fois de port de caméra initial et de site d’extraction de l’échantillon. Un protecteur de plaie Alexis a été inséré et un trocart de 12 mm a été placé à travers le port. Le pneumopéritoine a été établi et l’abdomen a été exploré à la recherche d’une maladie métastatique occulte. Des ports supplémentaires de 8 mm ont été placés sous visualisation directe dans le port du quadrant inférieur droit, une largeur de main médiale à l’épine iliaque antérieure ainsi qu’à des points équidistants à travers l’abdomen dans la région épigastrique gauche et le quadrant supérieur gauche. Un dernier orifice de travail AirSeal de 5 mm a été inséré dans la région lombaire pour trianguler entre le quadrant inférieur droit et les orifices épigastriques gauche. Notez que si une stomie dérivante est prévue, le site du port du quadrant inférieur droit est souvent utilisé. Le robot DaVinci a ensuite été amarré et des instruments de travail ont été insérés dans les trocarts. Notez que le site du port inférieur droit a été augmenté à 12 mm et utilisé comme port de caméra.
Le patient a ensuite été positionné en léger Trendelenburg avec le côté droit vers le bas pour faciliter la mobilisation du contenu intra-abdominal. L’épiploon a été balayé par les céphales jusqu’au côlon transverse, et l’intestin grêle a été rentré dans le quadrant supérieur droit. Notre dissection a commencé de manière latérale à médiale en libérant le côlon sigmoïde du bord pelvien et de la paroi latérale. La ligne blanche de Toldt a été incisée pour élever le côlon descendant et son mésentère proximal au niveau de la flexion splénique.
Une fois mobilisés, nous avons ensuite identifié le pédicule de l’artère mésentérique inférieure et développé un plan entre le vaisseau et le rétropéritoine. Cela a été prolongé latéralement à notre dissection latérale à médiale antérieure. Pour éviter une blessure par inadvertance, l’uretère a été clairement visualisé pendant cette partie de la dissection.
Ensuite, nous avons déplacé la céphalade pour compléter la dissection médiale à latérale en incisant d’abord le péritoine juste latéralement au ligament de Treitz. La veine mésentérique inférieure a été identifiée, encerclée et prélevée avec un dispositif énergétique. Cette partie de la dissection médiale a été prolongée sous le mésocôlon transverse et latéralement vers la flexion splénique. Les attaches omentales sus-jacentes et le ligament gastrocolique ont été incisés pour libérer complètement la flexion splénique et assurer une longueur colique adéquate pour l’anastomose colorectale. L’attention a ensuite été ramenée sur la dissection médiale, qui a été prolongée caudalement vers la racine IMA.
Une fois la partie proximale de la dissection terminée, nous avons procédé à la dissection du rectum proximal en l’éloignant du bord pelvien et de la paroi latérale avec une préservation soigneuse du plexus du nerf hypogastrique. Cela nous a permis d’entrer dans le plan correct pour élever l’ensemble du mésorectum du rétropéritoine. Nous avons terminé notre dissection rectale en incisant la réflexion péritonéale circonférentiellement autour de la poche de Douglas et en mobilisant davantage le rectum extrapéritonéal caudalement. Une sigmoïdoscopie flexible a été réalisée pour s’assurer que la dissection était inférieure à la tumeur résiduelle.
Ensuite, deux tirs de l’agrafeuse Endo-GIA à charge verte ont ensuite été utilisés pour transecter le rectum distal disséqué. La dissection colique a été complétée par la ligature de l’IMA juste distale au décollage des coliques gauches. Le mésentère colique a été divisé jusqu’au niveau de la section proximale après que l’angiographie ICG ait confirmé une perfusion adéquate. L’échantillon a ensuite été extériorisé par l’incision de Pfannenstiel.
Le site de section proximale proposé a été débarrassé de toute graisse péricolique et nettement divisé. Un dispositif automatique de cordon de bourse a été utilisé pour enfiler une suture Prolene autour de la colotomie. Une enclume Covidien 28-EEE française a été insérée dans la lumière, liée au prolène, et le côlon est retourné dans la cavité péritonéale.
Le pneumopéritoine a ensuite été rétabli et l’agrafeuse Covidien a été insérée dans l’anus. La pointe a été déployée à l’arrière du milieu de la ligne d’agrafe rectale, et un cordon de bourse Prolene a été placé autour de la pointe. L’enclume était jointe à l’extrémité de l’agrafeuse et tirée. Une suture en V de pleine épaisseur a été utilisée pour surcoudre l’anastomose. Le sigmoïdoscope flexible a été inséré pour examiner l’anastomose et effectuer un test d’étanchéité.
Comme la tumeur se trouvait à moins de 7 cm de la bordure anale et avait été traitée par un traitement néoadjuvant, une iléostomie temporaire de l’anse de dérivation a été préparée. Un segment d’iléon situé à environ 20 cm à proximité de la valve iléo-caecale a été identifié et saisi. La peau autour du site de l’orifice du quadrant inférieur droit a été excisée et les tissus mous ont été disséqués jusqu’au fascia. Le fascia a été incisé de manière cruciée et les fibres musculaires se sont fendues. Le segment sélectionné de l’iléon a ensuite été amené à travers l’ouverture sans difficulté. La stomie a été mûrie à la manière de Turnbull-Brooke avec des sutures tripartites Vicryl interrompues.
Le patient a toléré l’intervention et s’est rétabli sans incident après l’opération. Elle est rentrée chez elle le 3e jour postopératoire. La pathologie finale a révélé une réponse pathologique complète sans tumeur résiduelle et 0/24 ganglions lymphatiques positifs. Elle a été vue lors du suivi et continue de bien se porter. Sa stomie sera inversée environ 12 semaines après l’opération.
Plusieurs revues prospectives et rétrospectives ont pris en compte les facteurs associés à la fuite anastomotique dans les résections antérieures basses. 1 Dans les cas de tumeurs rectales basses (à <7 cm du bord anal) et de chimioradiothérapie néoadjuvante, les taux de fuite anastomotique sont plus élevés. 1, 2 Une dérivation temporaire avec une iléostomie en boucle est donc recommandée dans ces cas.
En ce qui concerne les avantages de l’approche robotique, une étude récente a démontré un taux plus élevé de dissection mésorectale complète, et moins de dissections presque complètes ou incomplètes par rapport à la laparoscopie. 3 Il est important de se rappeler, cependant, que l’expérience du chirurgien dans les différentes approches devrait dicter l’approche de la résection antérieure basse.
Pas d’équipement spécial ni d’implants.
Rien à divulguer.
Le patient visé dans cet article vidéo a donné son consentement éclairé pour être filmé et est conscient que des informations et des images seront publiées en ligne.
Aucun.
References
- Sciuto A, Merola G, De Palma GD, Sodo M, Pirozzi F, Bracale UM, Bracale U. Facteurs prédictifs des fuites anastomotiques après une chirurgie colorectale laparoscopique. Monde J Gastroenterol. 2018; 24(21):2247-60. doi :10.3748/wjg.v24.i21.2247.
- Park JS, Choi GS, Kim SH, et al. Analyse multicentrique des facteurs de risque de fuite anastomotique après excision du cancer du rectum par laparoscopie : le groupe d’étude coréen sur la chirurgie colorectale laparoscopique. Ann Surg. 2013; 257(4):665-71. doi :10.1097/SLA.0b013e31827b8ed9.
- Baik SH, Kwon HY, Kim JS, Hur H, Sohn SK, Cho CH, Kim H. Résection antérieure basse robotique versus laparoscopique du cancer du rectum : résultat à court terme d’une étude comparative prospective. Ann Surg Oncol. 2009; 16(6):1480-7. doi :10.1245/s10434-009-0435-3.
Cite this article
Harrison J, Francone T. Résection antérieure basse robotisée avec iléostomie à boucle de dérivation pour le cancer du rectum localement avancé. J Med Insight. 2022; 2022(343). doi :10.24296/jomi/343.


