Robotergestützte Low Anterior Resektion mit Diverting Loop Ileostomy bei lokal fortgeschrittenem Rektumkarzinom
Main Text
Table of Contents
Dieses Video zeigt eine robotergestützte niedrige vordere Resektion für lokal fortgeschrittenen Rektumkarzinom nach neoadjuvanter FOLFOX-basierter Chemostrahlenbehandlung. Eine niedrige vordere Resektion wird für rektale Tumoren empfohlen, bei denen ein distaler Rand von 1 cm ohne Eingriff in den Schließmuskel erreichbar ist. Eine Schlüsselkomponente dieser Operation ist eine vollständige mesorektale Dissektion, die mit der Robotertechnik hervorgehoben wird. In diesem Fall hatte unser Patient einen 2,6 cm großen Tumor, der sich 6 cm über dem Analrand befand, der mit acht Zyklen FOLFOX gefolgt von einer konsolidativen Strahlentherapie behandelt wurde. Eine robotergestützte niedrige vordere Resektion wurde durchgeführt, und die endgültige Pathologie zeigte eine vollständige pathologische Reaktion.
Darmkrebs ist die dritthäufigste Ursache für krebsbedingte Todesfälle in den Vereinigten Staaten; Ein verbessertes Gesamtüberleben bei Rektumkarzinom wurde jedoch durch die zusätzliche FOLFOX-basierte neoadjuvante Gesamttherapie nachgewiesen. Obwohl einige Patienten nach der Therapie ein vollständiges klinisches Ansprechen haben, wird eine laufende Überwachung empfohlen. Eine Operation, einschließlich niedriger anteriorer Resektion (LAR) oder abdominoperinealer Resektion (APR), wird für alle Patienten mit Resterkrankung oder Rezidiv empfohlen. Ein robotischer Ansatz für LAR für tief liegende Tumoren oberhalb des Schließmuskelkomplexes bietet eine beispiellose Visualisierung des Mesorektums während der onkologischen Resektion. In diesem Video demonstrieren wir eine robotergestützte niedrige vordere Resektion für einen Patienten mit lokal fortgeschrittenem Rektumkarzinom, der mit neoadjuvanter FOLFOX-basierter Chemostrahlung behandelt wurde.
Unsere Patientin ist eine ansonsten gesunde 50-jährige Frau, die sich Anfang November 2020 zur Screening-Koloskopie vorgestellt hat. Es wurde ein mäßig differenziertes rektales Adenokarzinom mit intakten Mismatch-Reparaturgenen etwa 6–12 cm vom Analrand entfernt identifiziert und nimmt 30% des luminalen Umfangs ein. Die Masse wurde etwa 6–7 cm vom Analrand entfernt während der digitalen rektalen Untersuchung ertastet. Der Patient war von dieser Läsion auffallend asymptomatisch.
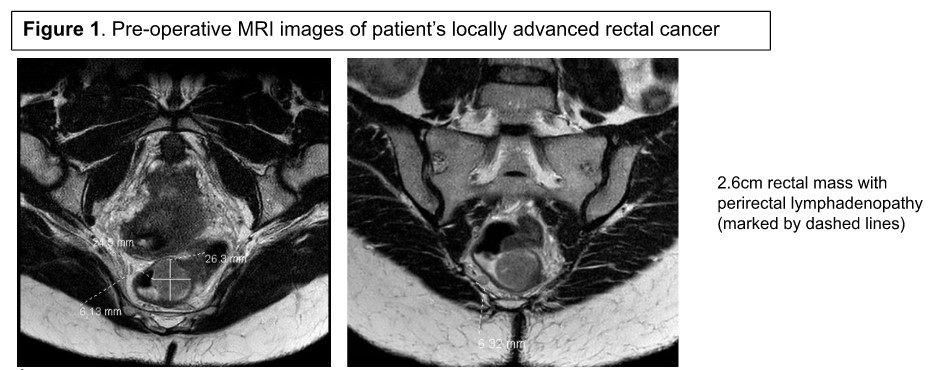
Die Staging-Aufarbeitung einschließlich axialer Bildgebung von Brust, Bauch und Becken war negativ für entfernte oder peritoneale Metastasen. Zusätzlich wurde eine MRT durchgeführt, die eine halbumfangige 2,6 cm rektale Masse mit grenzwertig vergrößerten mesorektalen Lymphknoten zeigte, die mit cT3, cN1, cM0 (Stadium IIIB) übereinstimmen (Abbildung 1). Ihr karzinembryonales Antigen (CEA) betrug 7,9 ng/ml.
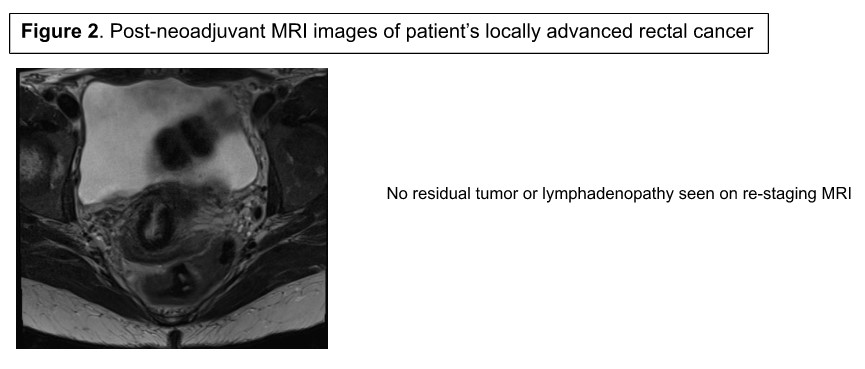
Der Patient wurde zur neoadjuvanten Therapie überwiesen, und acht Zyklen der FOLFOX-basierten Chemobestrahlung wurden im Juli 2020 abgeschlossen. Die Restaging-MRT zeigte keinen Resttumor oder perirektale Adenopathie (Abbildung 2); Eine flexible Sigmoidoskopie zeigte jedoch adenomatöses Gewebe auf der Ebene des Tumors, was auf eine Resterkrankung hindeutet. Die Risiken und Vorteile der Beobachtung gegenüber einer Operation wurden multidisziplinär diskutiert, und der Patient stimmte zu, mit der Roboter-LAR fortzufahren. Wie bei jedem LAR-Ansatz ist ein 1-cm-Rand und eine vollständige mesorektale Exzisionsprobenahme von mindestens 12 Lymphknoten für eine adäquate Resektion erforderlich.
Der Patient wurde in den Operationssaal gebracht und in Rückenlage mit entführten Armen positioniert. Die Arme und der Oberkörper wurden mit einer Kombination aus Sitzsack und Sicherheitsgurten gesichert, um ein Verschieben bei einer Neupositionierung des Tisches zu verhindern. Die Portplatzierung wird vor der Vorbereitung geplant und in Abbildung 3 beschrieben.
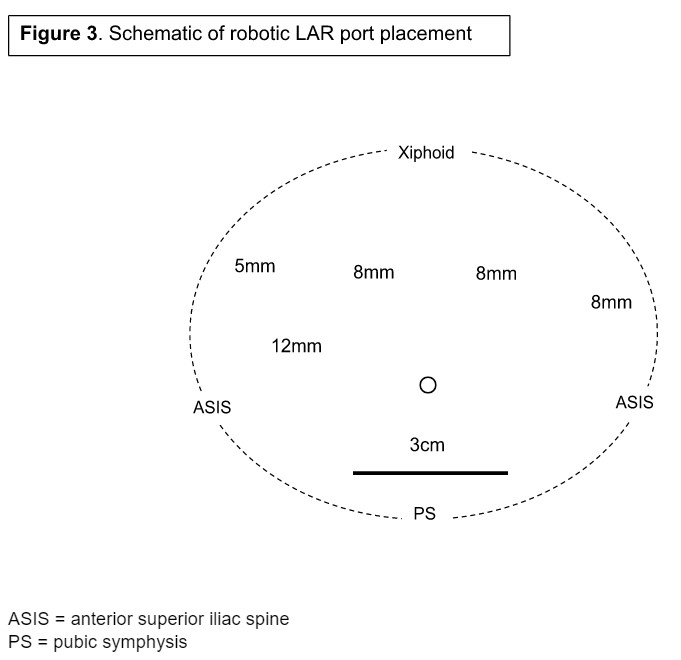
Wir begannen mit einem 3 cm großen Pfannenstiel-Schnitt etwa 2 Fingerbreit über der Schambeinsymphyse. Dieser Schnitt diente sowohl als unser erster Kameraport als auch als Probenextraktionsstelle. Ein Alexis-Wundschutz wurde eingesetzt und ein 12-mm-Trokar durch den Port platziert. Pneumoperitoneum wurde etabliert und der Bauch wurde auf okkulte metastasierende Erkrankungen untersucht. Zusätzliche 8-mm-Ports wurden unter direkter Visualisierung im rechten unteren Quadrantenport, eine Handbreit medial zur vorderen Beckenwirbelsäule sowie an Äquidistanzpunkten über den Abdomen im linken Oberbauchbereich und im linken oberen Quadranten platziert. Ein abschließender 5-mm-AirSeal-Arbeitsanschluss wurde in die Lendengegend eingeführt, um zwischen dem rechten unteren Quadranten und den linken Oberbauchanschlüssen zu triangulieren. Beachten Sie, dass, wenn ein umleitendes Stoma geplant ist, häufig der rechte untere Quadrantenhafen verwendet wird. Anschließend wurde der DaVinci-Roboter angedockt und Arbeitsinstrumente in die Trokare eingesetzt. Beachten Sie, dass der rechte untere Anschluss auf 12 mm vergrößert und als Kameraanschluss verwendet wurde.
Der Patient wurde als nächstes in leichter Trendelenburg mit der rechten Seite nach unten positioniert, um die Mobilisierung des intraabdominalen Inhalts zu erleichtern. Das Omentum wurde vom Kephalopen zum Colon transversum gefegt, und der Dünndarm wurde im rechten oberen Quadranten versteckt. Unsere Dissektion begann lateral zu medial, indem wir den Sigma von der Beckenkrempe und der Seitenwand befreiten. Die weiße Linie von Toldt wurde eingeschnitten, um den absteigenden Dickdarm und sein Mesenterium proximal auf die Höhe der Milzflexur zu heben.
Nach der Mobilisierung identifizierten wir als nächstes den unteren Stiel der Arteria mesenterica und entwickelten eine Ebene zwischen dem Gefäß und dem Retroperitoneum. Diese wurde seitlich auf unsere vorherige laterale bis mediale Dissektion ausgedehnt. Um unbeabsichtigte Verletzungen zu vermeiden, wurde der Harnleiter während dieses Teils der Dissektion deutlich visualisiert.
Als nächstes bewegten wir den Kopfschmerz, um die mediale bis laterale Dissektion abzuschließen, indem wir zuerst das Peritoneum seitlich zum Band von Treitz einschnitten. Die Vena mesenterica inferior wurde identifiziert, eingekreist und mit einem Energiegerät aufgenommen. Dieser Teil der medialen Dissektion wurde unterhalb des transversalen Mesokolons und seitlich in Richtung Milzflexur verlängert. Überlagernde omentale Anhänge und das gastrokolische Band wurden eingeschnitten, um die Milzflexur vollständig zu befreien und eine ausreichende Kolonlänge für die kolorektale Anastomose zu gewährleisten. Die Aufmerksamkeit wurde dann wieder auf die mediale Dissektion gelenkt, die kaudal in Richtung der IMA-Wurzel verlängert wurde.
Nachdem der proximale Teil der Dissektion abgeschlossen war, sezierten wir das proximale Rektum weg vom Beckenrand und der Seitenwand unter sorgfältiger Erhaltung des hypogastrischen Nervenplexus. Dies ermöglichte uns den Eintritt in die richtige Ebene, um das gesamte Mesorektum aus dem Retroperitoneum zu heben. Wir schlossen unsere rektale Dissektion ab, indem wir die peritoneale Reflexion umlaufend um den Beutel von Douglas einschnitten und das extraperitoneale Rektum kaudal weiter mobilisierten. Eine flexible Sigmoidoskopie wurde durchgeführt, um sicherzustellen, dass die Dissektion unterhalb des Resttumors lag.
Als nächstes wurden dann zwei Schüsse des grünen Endo-GIA-Hefters verwendet, um das sezierte distale Rektum zu transektieren. Die Kolondissektion wurde abgeschlossen, indem die IMA nur distal zum linken Kolikstart ligiert wurde. Das Dickdarmmesenterium wurde bis zur Höhe der proximalen Durchtrennung aufgeteilt, nachdem die ICG-Angiographie eine ausreichende Perfusion bestätigt hatte. Die Probe wurde dann durch den Pfannenstiel-Schnitt nach außen exmatriziert.
Die vorgeschlagene proximale Transektionsstelle wurde von jeglichem perikolischen Fett befreit und scharf geteilt. Eine automatische Geldbeutelschnurvorrichtung wurde verwendet, um eine Prolene-Naht um die Kolotomie zu fädeln. Ein 28-französischer EEA-Covidien-Amboss wurde in das Lumen eingeführt, prolene gebunden und der Dickdarm kehrte in die Peritonealhöhle zurück.
Das Pneumoperitoneum wurde dann wiederhergestellt und der Covidien-Hefter wurde durch den Anus eingeführt. Der Dorn wurde hinter der Mitte der rektalen Klammerlinie eingesetzt, und eine Prolene-Geldbörse wurde um den Dorn gelegt. Der Amboss wurde mit dem Ende des Hefters verbunden und abgefeuert. Eine volldicke, laufende V-Lock-Naht wurde verwendet, um die Anastomose zu übernähen. Das flexible Sigmoidoskop wurde eingesetzt, um die Anastomose zu untersuchen und einen Dichtheitstest durchzuführen.
Da sich der Tumor innerhalb von 7 cm vom Analrand befand und mit einer neoadjuvanten Therapie behandelt worden war, wurde eine temporäre Umleitungsschleifenileostomie vorbereitet. Ein Ileumsegment etwa 20 cm in der Nähe der Ileozökalklappe wurde identifiziert und gegriffen. Die Haut um die rechte Hafenstelle des unteren Quadranten wurde herausgeschnitten und die Weichteile bis zur Faszie seziert. Die Faszie wurde kreuzig eingeschnitten und die Muskelfasern spalteten sich. Das ausgewählte Segment des Ileums wurde dann problemlos durch die Öffnung gebracht. Das Stoma wurde in Turnbull-Brooke-Manier mit unterbrochenen dreiteiligen Vicryl-Nähten gereift.
Der Patient tolerierte den Eingriff und erholte sich ereignislos. Sie wurde am postoperativen Tag 3 nach Hause entlassen. Die endgültige Pathologie zeigte eine vollständige pathologische Reaktion ohne Resttumor und 0/24 positive Lymphknoten. Sie wurde im Follow-up gesehen und es geht ihr weiterhin gut. Ihr Stoma wird etwa 12 Wochen nach der Operation rückgängig gemacht.
Mehrere prospektive und retrospektive Reviews haben Faktoren berücksichtigt, die mit anastomotischen Leckagen bei niedrigen vorderen Resektionen verbunden sind. 1 Bei niedrigen rektalen Tumoren (<7 cm vom Analrand) und neoadjuvanter Chemostrahlung sind die anastomotischen Leckraten höher. 1, 2 In diesen Fällen wird daher eine vorübergehende Diversion mit einer Schleifenileostomie empfohlen.
In Bezug auf den Nutzen des Roboteransatzes zeigte eine kürzlich durchgeführte Studie eine höhere Rate der vollständigen mesorektalen Dissektion und weniger fast vollständige oder unvollständige Dissektionen im Vergleich zur Laparoskopie. 3 Es ist jedoch wichtig, sich daran zu erinnern, dass die Erfahrung des Chirurgen in verschiedenen Ansätzen den Ansatz der niedrigen anterioren Resektion diktieren sollte.
Keine spezielle Ausrüstung oder Implantate.
Nichts zu enthüllen.
Der in diesem Videoartikel erwähnte Patient hat seine informierte Zustimmung zum Filmen gegeben und ist sich bewusst, dass Informationen und Bilder online veröffentlicht werden.
Nichts.
References
- Sciuto A, Merola G, De Palma GD, Sodo M, Pirozzi F, Bracale UM, Bracale U. Prädiktive Faktoren für anastomotische Leckage nach laparoskopischen kolorektalen Operationen. Welt J Gastroenterol. 2018;24(21):2247-60. doi:10.3748/wjg.v24.i21.2247.
- Park JS, Choi GS, Kim SH, et al. Multizentrische Analyse von Risikofaktoren für anastomotische Leckage nach laparoskopischer Rektumkarzinomexzision: die koreanische laparoskopische kolorektale Chirurgie-Studiengruppe. Ann Surg. 2013;257(4):665-71. doi:10.1097/SLA.0b013e31827b8ed9.
- Baik SH, Kwon HY, Kim JS, Hur H, Sohn SK, Cho CH, Kim H. Robotic versus laparoskopische niedrige vordere Resektion von Rektumkarzinom: kurzfristiges Ergebnis einer prospektiven Vergleichsstudie. Ann Surg Oncol. 2009;16(6):1480-7. doi:10.1245/s10434-009-0435-3.
Cite this article
Harrison J, Francone T. Robotergestützte niedrige vordere Resektion mit Diverting-Loop-Ileostomie für lokal fortgeschrittenen Rektumkarzinom. J Med Einblick. 2022;2022(343). doi:10.24296/jomi/343.


