胰腺癌的开腹远端胰腺切除术
Main Text
远端胰腺切除术是最常用于胰腺肿瘤(良性和恶性)的手术,但也可用于胰腺炎的治疗。该手术可以通过脾脏整块切除或保留脾脏进行——脾切除术适用于肿瘤切除术。手术方法(腹腔镜、机器人或开放)取决于患者和手头的临床情况。在这种情况下,我们会对一名接受胰腺癌新辅助治疗的患者进行开阔性远端胰腺切除术联合脾切除术。这是患者在初步诊断为转移性疾病后接受手术切除的独特案例。患者为一名 69 岁女性,最初表现为腹痛和腹胀,发现胰体内有 2 cm 可疑肿瘤,活检证实为单发肝转移。她接受了延长疗程的新辅助化疗,重新分期扫描显示显着反应。放化疗完成,影像学上不再可见肝转移。诊断后 27 个月,她被送往手术室进行远端胰腺切除术和脾切除术;未见肝脏或腹膜转移。她的术后过程总体上没有变化,恢复得很好。最终手术病理学显示完全病理反应,未见疾病证据,0/11 淋巴结恶性肿瘤阳性。她的肿瘤内科团队目前正在每三个月对她进行一次 CT 扫描和肿瘤标志物随访,截至目前,即 2022 年 2 月,没有复发的证据。
尽管胰腺癌的发病率相对较低,但它是美国癌症死亡的第四大原因。1 胰腺导管腺癌 (PDAC) 是最常见的胰腺癌类型,一小部分患者患有生长缓慢的恶性内分泌肿瘤。风险因素包括高龄、男性、糖尿病、吸烟史、胰腺炎和某些遗传易感性基因位点等。这些肿瘤的 R0 手术切除提供了治愈性治疗的唯一机会。在诊断时,胰腺癌分为不可切除/播散性、局部晚期、临界可切除或前期可切除(见表 1),这在很大程度上取决于局部脉管系统的肿瘤受累和远处转移的存在。2 大多数胰腺癌 (60-70%) 发生在腺体头部,其余发生在身体和腺尾。1 与远端胰腺切除术相关,脾脉管系统的受累不是手术切除的禁忌症。不幸的是,大多数胰腺癌患者在诊断时会有疾病的远处扩散;这在胰体和胰尾肿瘤患者中的发生率甚至更高,因为胰腺这一部分的小肿块通常没有症状。最终,只有 5-7% 的胰体/胰尾 PDAC 个体会接受手术。3
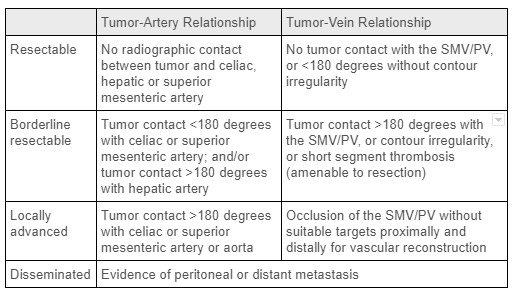
表 1:胰腺癌肿瘤分期标准。来源:当前手术治疗、胰腺癌的新辅助和辅助治疗2
根据 2019 年 NCCN 指南,对于没有高风险特征的一线可切除疾病患者,手术是推荐的一线治疗选择,并得到了最新临床试验的支持。4 英寸 >4 胰腺癌的手术治疗选择包括胰十二指肠切除术(Whipple 手术)治疗头部病变,远端胰腺切除术联合脾切除术治疗身体和尾部病变。 交界性可切除和局部晚期疾病的一线治疗是新辅助治疗 (NAT),包括 FOLFIRINOX 或吉西他滨白蛋白结合型紫杉醇。3 越来越多的文献支持 PAT 在 PDAC 中的应用,因此许多临床试验正在检查前期可切除疾病手术切除前 NAT。5、6 这种方法的优缺点将在下面更详细地讨论。
治疗结果根据患者就诊时肿瘤的分期和手术切除的范围而有所不同。所有胰腺癌患者的总体 5 年生存率约为 10%。这从成功切除 R0 的患者(预示淋巴结阴性疾病的 5 年生存率约为 30%,淋巴结阳性疾病的 5 年生存率约为 10%)到诊断时为播散性疾病的患者(预示着淋巴结阴性疾病的 5 年生存率约为 10%),以及诊断时病灶播散性、几乎没有长期生存可能性的患者。1
患者是一名 69 岁女性,有明显的吸烟史、HLD、HTN 和 GERD,最初表现为腹痛、体重减轻和腹胀。检查包括 CT 扫描,显示胰腺体重为 2.1 厘米,肝脏病变。肿瘤标志物 CA 19-9 升高至 69 U/mL。胸部 CT 完全分期对转移性疾病呈阴性。美国引导下的肝活检显示腺癌。然后,患者接受了 4 个周期的 FOLFIRINOX。重新分期扫描显示肝脏病灶大小增加,胰腺肿块减少,她被换用吉西他滨/阿布拉克桑四个周期。 然后重复 CT 显示肝脏和胰腺肿块均减少。 共进行了 17 个周期的 gem/abraxane 治疗,CT 显示病情稳定,CA 19-9 为 5 U/mL。然后她被转移到吉西他滨单药治疗。她对化疗的耐受性非常好,副作用很小——经历失眠和神经病变。
鉴于病情持续稳定,然后提供长期 (5 周) 的放化疗。卡培他滨与放疗 (RT) 同时给药。MRI 肝脏成像显示治疗完成时没有疾病证据。原发肿瘤的大小也显著缩小。多学科讨论的共识是,对于最初诊断为 IV 期胰腺癌的患者,远端胰腺切除术和脾切除术的手术治疗是合适的下一步,尽管非常规,因为她的反应持久且重复影像学上缺乏转移性疾病的证据,并且肿瘤标志物水平低。
就诊时,患者没有黄疸、可触及的腹部肿块或腹部手术疤痕的证据。
诊断时的 CT 扫描显示胰腺体内异质、不规则的低衰减胰腺肿块,尺寸为 2.1 cm x 2.1 cm,伴有胰腺导管扩张和胰腺实质萎缩,怀疑胰腺恶性肿瘤。 肝脏 MRI 进一步表征右肝叶 9 mm 异质性低衰减肝病灶,最终超声引导活检证实转移性腺癌。
SMA 和 SMV 不与肿块有关,但脾静脉消失。
初步诊断后两年内手术切除前完成新辅助治疗后的 CT 扫描显示胰腺体内有 1.2 cm x 0.5 cm 的低密度病灶,这与之前的影像学研究没有变化,没有导管扩张,但胰尾持续萎缩。肝脏 MRI 不再能看到右叶的亚厘米级肝脏病变。
远端胰腺切除术的手术技术通常遵循两种模式。可以以内侧到外侧的方式接近夹层,首先在胰腺下形成一条隧道并横切腺体,将夹层延伸到胰尾和脾门。或者,夹层可以从腺体的外侧开始并在内侧进行。我们最喜欢的方法是内侧到外侧解剖,尽管当困难的解剖可能排除其中一种方法时,涉及两者的理解和技能为外科医生提供了替代途径。
远端胰腺切除术可以联合或不联合脾切除术。保留脾脏的手术技术包括从胰腺后部细致解剖脾血管,或保留短胃血管,在脾管结扎的情况下为脾脏提供血液供应,最早由 Warshaw 等人描述。1988 年。7 在这种情况下,考虑到患者肿瘤表现的性质,我们选择进行脾切除术,尽管保留脾脏确实预示着一些临床益处,例如避免压倒性脾切除术后感染 (OPSI) 的风险。在接受脾切除术联合远端胰腺切除术的患者中,必须接种针对荚膜微生物的疫苗以降低 OPSI 的风险。这包括接种 脑膜炎奈瑟菌、 肺炎链球菌 和 流感嗜血杆菌疫苗。患者还定期获得紧急抗生素供应,以防感染。
胰腺远端切除术和脾切除术对胰体和尾部病变的手术治疗目标是 R0 切除并切除所有疾病。这为患者提供了治愈性治疗的唯一选择。尽管高容量中心的围手术期死亡率较低 (1-2%),但发病率仍然很高 (20-30%)。8 这包括与手术相关的并发症,包括最常见的胰瘘,但也包括后果,例如糖尿病的发展,这种情况发生在大约 15-30% 的患者中。9 因此,还必须权衡相对病态手术的风险与实现 R0 切除术的潜在益处和可能性,这是在多学科会议中以及患者和外科医生之间进行的个体化讨论。
该病例以一名独特的患者为特色,最初表现为转移性疾病,在接受手术切除前表现出对 NAT 的持久反应超过两年,病理学完全反应。这一非凡的病程是一个异类,但为 PDAC 治疗的未来提供了重大希望,并强调了 NAT 在潜在降期疾病中的作用(在其他消化道癌症中观察到的范式,包括直肠癌,其中通常在 NAT10 后出现完全病理反应)。文献中的一些病例报告描述了类似的患者反应。11
该病例的技术亮点包括困难的腹膜后夹层伴广泛的纤维化,这在 NAT 后患者中很常见。冰冻切片是覆盖肝动脉的纤维化组织,恶性肿瘤阴性。注意到肿瘤柔软而柔韧,这是对新辅助治疗反应良好的患者经常看到的特征。胰腺体和胰尾周围的主要血管结构(包括 PV 和 SMV)、肝动脉、肾静脉和肾上腺静脉的解剖均顺利进行。胰腺用吻合器横切,利用接缝保护钉负载。按照我们的方案,在胰腺横断缘留下了一根引流管。估计失血量为 < 100 cc,患者康复无明显术后并发症。值得注意的是,最终的手术病理学显示没有疾病证据,具有完全的病理反应。
胰腺癌的现代治疗取决于患者所处的阶段,患者接受包括化疗和放疗在内的多学科治疗。 前期可切除的胰腺癌可以先通过手术治疗,目的是实现 R0 切除;然而,即使在前期可切除的疾病中,人们也越来越有兴趣在手术前提供 NAT。如上所述,在局部晚期和临界可切除的疾病中,一线治疗是 NAT;如果患者在 NAT 中未显示疾病进展,则通常提供手术探查,因为影像学检查结果通常不能预测 NAT 后可切除性。
NAT 在可切除疾病中的好处包括允许更早和更快地治疗微观疾病、改进患者选择以及更高完成完整治疗方案的可能性。鉴于手术时发现转移性疾病的患者比例很高(高达 25%),新辅助治疗的实施使肿瘤生物学得以发展,并可能为最有可能从使患者面临严重并发症风险的外科手术中受益的患者进行自我选择。另一个好处是 NAT 后胰瘘的风险显着降低12
但是,这种方法也有一些缺点。放弃 NAT 提供了在任何进展发生之前切除肿瘤的机会,因为手术切除是 PDAC 长期治愈的唯一机会。对于接受 NAT 的胆道梗阻患者,需要进行胆道支架置入术,这有其自身的相应风险,已在多项研究中记录。13
远端胰腺切除术的进步包括使用微创技术;腹腔镜和机器人手术都在全国各地进行。最近,发表了第一个关于微创与开腹远端胰腺切除术的随机对照临床试验。14 LEOPARD 试验是一项针对无血管受累的左侧胰腺肿瘤患者的多中心患者盲法 RCT。在该试验中,微创远端胰腺切除术与功能恢复时间缩短有关;然而,总体并发症发生率不受影响。15 LAPOP 试验是一项非盲的前瞻性 RCT,评估术后住院时间的主要终点。该试验表明住院时间显著缩短 (5 天 vs 6 天),总体并发症发生率没有变化。16 这些数据表明,微创远端胰腺切除术可能为患者提供更便利的恢复。然而,在比较开放手术和微创手术时,缺乏关于肿瘤结局的数据,需要在这一领域做更多的工作。在 NAT 患者中,特别是如果放疗是组成部分,主要血管周围可能存在明显的纤维化,这使得夹层(尽管微创)更加困难。
在随访中,该患者能够恢复正常的日常生活活动。她报告体重显着减轻 > 25 磅,并且持续稀便。 她因推测胰腺外分泌功能不全而开始使用 Creon。在 2022 年 2 月撰写本文时的最新影像学检查显示没有疾病复发的证据。她的肿瘤内科团队将继续对患者进行每 3 个月一次的 CT 扫描和肿瘤标志物测量。
没什么可透露的。
本视频文章中提到的患者已同意拍摄,并且知道信息和图像将在网上发布。
References
- 麦圭根 A、凯利 P、特金顿 RC、琼斯 C、科尔曼 HG、麦凯恩 RS。胰腺癌:临床诊断、流行病学、治疗和结果综述。 世界 J 胃肠醇。2018;24(43):4846-4861. doi:10.3748/wjg.v24.i43.4846.
- 卡梅隆 JK,卡梅隆 AM。 目前的手术治疗。 第 10 版费城:Elsevier Mosby;2011.
- Oba A, Ho F, Bao QR, Al-Musawi MH, Schulick RD, Del Chiaro M. 胰腺癌的新辅助治疗。 肿瘤学前沿。2020;10(245). doi:10.3389/fonc.2020.00245.
- Ghaneh P、Palmer DH、Cicconi S et.al。ESPAC-5F: 与新辅助吉西他滨加卡培他滨 (GEMCAP) 或 FOLFIRINOX 或放化疗 (CRT) 相比,立即手术治疗交界性可切除胰腺癌患者的四臂、前瞻性、多中心、国际随机 II 期试验。 J Clin Oncol。2020;38(15)4505. doi:10.1200/JCO.2020.38.15_suppl.4505.
- Muller PC、Frey MC、Ruzza CM 等人。胰腺癌的新辅助化疗:对当前高水平证据的评估。 药理学。2021;106:143-153. doi:10.1159/000510343.
- Versteijne E, Suker M, Groothuis K, et al.可切除和临界可切除胰腺癌的术前放化疗与立即手术:荷兰随机 III 期 PREOPANC 试验的结果。 J Clin Oncol。2020;38(16):1763-1773. doi:10.1200/JCO.19.02274.
- 保留脾脏的远端胰腺切除术。 J 肝胆胰科学。2010;17:818-812. doi:10.1007/s00534-009-0226-z.
- Lillemoe KD、Kaushal S、Cameron JL、Sohn TA、Pitt HA、Yeo CJ。远端胰腺切除术:235 例患者的适应症和结果。 安外科。1999;229(5):693. doi:10.1097/00000658-199905000-00012.
- De Brujin KMJ, van Eijck CHJ.远端胰腺切除术后新发糖尿病:系统评价。 安外科。2015;216(5):854-61. doi:10.1097/SLA.00000000000000819.
- Kong M, Hong SE, Choi WS, Kim SY, Choi J. 局部晚期直肠癌的术前同步放化疗:治疗结果和预后因素分析。 癌症研究治疗。2012;44(2):104-112. doi:10.4143/crt.2012.44.2.104.
- 里奥斯佩雷斯 MV、戴 B、科伊 EJ、沃尔夫 RA、弗莱明 JB。IV 期胰腺癌回归根治性手术和 I 引入一种新的离体化疗敏感性测定。 Cureus.2015;7(12):e423。 doi:10.7759/cureus.423.
- Hank T、Sandini M、Ferrone CR 等人。新辅助化疗时代胰瘘与长期生存的关联。 美国医学会外科杂志。2019;154(10):943-951. doi:10.1001/jamasurg.2019.2272.
- Kuwatani M, Nakamura T, Hayashi T, et al.胰腺癌新辅助治疗期间胆道引流的临床结果:金属支架与塑料支架。 肠肝。2020;14(2):269-273. doi:10.5009/gnl18573.
- Riviere D、Gurusamy KS、Kooby DA、Vollmer CM、Besselink MGH、Davidson BR、van Laarhoven CJHM。腹腔镜与开腹远端胰腺切除术治疗胰腺癌。 Cochrane 系统评价数据库。2016;4(CD011391)。 doi:10.1002/14651858.CD011391.pub2.
- De Rooij T, van Hilst J, van Santvoort H, et.al.微创与开放远端胰腺切除术 (LEOPARD):一项多中心患者盲法随机对照试验。 安外科。2019;269(1):2-9. doi:10.1097/SLA.00000000000002979.
- Bjornsson B、Sandstrom P、Larsson AL、Hjalmarsson C、Gasslander T. 腹腔镜与开腹远端胰腺切除术 (LAPOP):单中心、非盲、随机对照试验的研究方案。 试验。2019;20(356). doi:10.1186/s13063-019-3460-y.
Cite this article
Hennessy ML, Fernandez-del Castillo C. 胰腺癌的开阔远端胰腺切除术。 J Med Insight. 2022;2022(339). doi:10.24296/jomi/339.

