Pancreatectomia Distal Aberta para Câncer de Pâncreas
Main Text
Table of Contents
A pancreatectomia distal é um procedimento realizado com mais frequência para tumores pancreáticos - benignos e malignos - mas também pode ser indicada no tratamento da pancreatite. A operação pode ser realizada com uma ressecção em bloco do baço ou com preservação esplênica - a esplenectomia é indicada para ressecção oncológica. A abordagem operatória - laparoscópica, robótica ou aberta - é ditada pelo paciente e pelo cenário clínico em questão. Neste caso, realizamos uma pancreatectomia distal aberta com esplenectomia em um paciente submetido a tratamento neoadjuvante para adenocarcinoma pancreático. Este é um caso único de um paciente submetido à ressecção cirúrgica após o diagnóstico inicial de doença metastática. A paciente é uma mulher de 69 anos que inicialmente apresentou dor abdominal e distensão abdominal, e foi encontrada com um tumor suspeito de 2 cm no corpo do pâncreas e metástase hepática única comprovada por biópsia. Ela foi tratada com um curso prolongado de quimioterapia neoadjuvante, e os exames de reestadiamento mostraram resposta significativa. A quimiorradiação foi concluída e a metástase hepática não era mais visível na imagem. Vinte e sete meses após o diagnóstico, ela foi levada à sala de cirurgia para pancreatectomia distal e esplenectomia; Não foram observadas metástases hepáticas ou peritoneais. Seu curso pós-operatório foi geral sem intercorrências e ela se recuperou bem. A patologia cirúrgica final demonstrou resposta patológica completa sem evidência de doença observada e 0/11 linfonodos positivos para malignidade. Atualmente, ela está sendo acompanhada com tomografias computadorizadas e marcadores tumorais a cada três meses por sua equipe médica de oncologia e, a partir de agora, fevereiro de 2022, não há evidências de recorrência.
Apesar de sua incidência relativamente baixa, o câncer de pâncreas é a quarta principal causa de morte por câncer nos EUA. 1 O adenocarcinoma ductal pancreático (PDAC) é o tipo mais frequente de câncer de pâncreas, com uma pequena proporção de pacientes abrigando tumores endócrinos malignos de crescimento mais lento. Os fatores de risco incluem idade avançada, sexo masculino, diabetes, história de tabagismo, pancreatite e certos loci de suscetibilidade genética, entre outros. A ressecção cirúrgica R0 desses tumores oferece a única chance de tratamento curativo. No diagnóstico, os cânceres de pâncreas são categorizados como irressecáveis/disseminados, localmente avançados, ressecáveis limítrofes ou ressecáveis antecipadamente (ver Tabela 1), o que depende em grande parte do envolvimento tumoral da vasculatura local e da presença de metástases à distância. 2 A maioria dos cânceres de pâncreas (60-70%) surge na cabeça da glândula, com o restante no corpo e na cauda. 1 Relevante na pancreatectomia distal, o envolvimento da vasculatura esplênica não é uma contraindicação à ressecção cirúrgica. Infelizmente, a maioria dos pacientes com câncer de pâncreas terá disseminação distante da doença no momento do diagnóstico; Isso é visto em uma taxa ainda maior naqueles com tumores do corpo e cauda pancreáticos, pois pequenas massas nesta parte do pâncreas são tipicamente assintomáticas. Em última análise, apenas 5 a 7% dos indivíduos com PDAC no corpo / cauda do pâncreas serão submetidos à cirurgia. 3
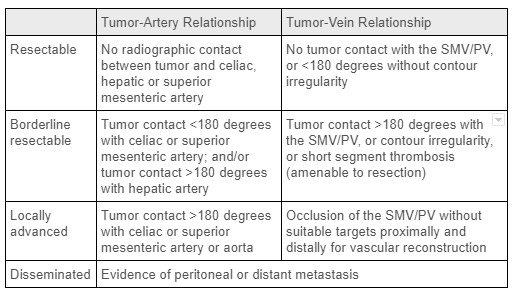
Tabela 1: Critérios para estadiamento tumoral no câncer de pâncreas. Fonte: Terapia Cirúrgica Atual, Terapia Neoadjuvante e Adjuvante para Câncer de Pâncreas2
Para pacientes com doença ressecável inicial sem características de alto risco, a cirurgia é a opção de tratamento de primeira linha recomendada, de acordo com as diretrizes da NCCN de 2019, e é apoiada por ensaios clínicos recentes. 4 ">4 As opções para o tratamento cirúrgico do adenocarcinoma pancreático incluem duodenopancreatectomia (procedimento de Whipple) para lesões na cabeça e pancreatectomia distal com esplenectomia para lesões do corpo e da cauda. A terapia de primeira linha para doença limítrofe ressecável e localmente avançada é com tratamento neoadjuvante (NAT), que consiste em FOLFIRINOX ou gencitabina-nab-paclitaxel.3 Um crescente corpo de literatura apóia o NAT no PDAC, de modo que vários ensaios clínicos estão examinando o NAT antes da ressecção cirúrgica na doença ressecável inicial. 5, 6 Os prós e contras de tal abordagem são discutidos com mais detalhes abaixo.
Os resultados do tratamento variam de acordo com o estágio do tumor na apresentação do paciente e a extensão da ressecção cirúrgica. A taxa de sobrevida global de 5 anos para todos os pacientes com câncer de pâncreas é de cerca de 10%. Isso varia de pacientes com ressecção R0 bem-sucedida, que pressagia uma taxa de sobrevida de aproximadamente 30% em 5 anos na doença negativa para linfonodos e 10% de sobrevida em 5 anos na doença positiva para linfonodos, a pacientes com doença disseminada no momento do diagnóstico, praticamente sem possibilidade de sobrevida em longo prazo. 1
A paciente é uma mulher de 69 anos com história significativa de tabagismo, DAN, hipertensão e DRGE que apresentou inicialmente dor abdominal, perda de peso e distensão abdominal. A investigação incluiu uma tomografia computadorizada que revelou uma massa corporal pancreática medindo 2,1 cm e uma lesão hepática. O marcador tumoral CA 19-9 estava elevado em 69 U/mL. A TC de tórax para estadiamento completo foi negativa para doença metastática. A biópsia hepática guiada por US revelou adenocarcinoma. O paciente foi então submetido a 4 ciclos de FOLFIRINOX. Os exames de reestadiamento demonstraram um aumento no tamanho das lesões hepáticas e uma diminuição na massa pancreática, e ela foi alterada para gencitabina / abraxane por quatro ciclos. A repetição da TC mostrou diminuição das massas hepática e pancreática. Um total de 17 ciclos de gem/abraxane foram administrados, com TC mostrando doença estável e CA 19-9 de 5 U/mL. Ela foi então transferida para monoterapia com gencitabina. Ela tolerou a quimioterapia notavelmente bem com efeitos colaterais mínimos - experimentando insônia e neuropatia.
Um longo curso (5 semanas) de quimiorradiação foi então oferecido devido à doença estável em andamento. Foi administrada capecitabina concomitante com radioterapia (RT). A imagem do fígado com ressonância magnética não revelou evidências de doença ao final do tratamento. O tumor primário também diminuiu notavelmente de tamanho. O consenso da discussão multidisciplinar foi que o tratamento cirúrgico com pancreatectomia distal e esplenectomia foi um próximo passo apropriado, embora não convencional, em uma paciente inicialmente diagnosticada com câncer de pâncreas em estágio IV, dada sua resposta durável e falta de evidência de doença metastática em imagens repetidas e baixo nível de marcador tumoral.
Na apresentação, o paciente não apresentava evidência de icterícia, massas abdominais palpáveis ou cicatrizes cirúrgicas abdominais.
A tomografia computadorizada no momento do diagnóstico demonstrou uma massa pancreática heterogênea, irregular e de baixa atenuação no corpo do pâncreas, medindo 2,1 cm x 2,1 cm, com dilatação ductal pancreática e atrofia do parênquima do pâncreas, suspeita de malignidade pancreática. Uma lesão hepática heterogênea de baixa atenuação de 9 mm no lobo hepático direito foi caracterizada com ressonância magnética hepática e, finalmente, a biópsia guiada por US confirmou adenocarcinoma metastático.
A AMS e a VMS não foram envolvidas pela massa, mas houve apagamento da veia esplênica.
A tomografia computadorizada após a conclusão do tratamento neoadjuvante antes da ressecção cirúrgica ao longo de dois anos após o diagnóstico inicial demonstrou um foco hipodenso de 1,2 cm x 0,5 cm no corpo do pâncreas, que permaneceu inalterado em relação aos estudos de imagem anteriores, sem dilatação ductal, mas atrofia persistente da cauda pancreática. A ressonância magnética do fígado não visualizava mais o que havia se tornado uma lesão hepática subcentimétrica no lobo direito.
A técnica operatória na pancreatectomia distal geralmente segue dois modelos. Pode-se abordar a dissecção de forma medial a lateral, primeiro formando um túnel sob o pâncreas e seccionando a glândula, estendendo a dissecção em direção à cauda pancreática e ao hilo esplênico. Alternativamente, a dissecção pode ser iniciada na face lateral da glândula e realizada medialmente. Nossa abordagem preferida é a dissecção medial para lateral, embora uma compreensão e um conjunto de habilidades envolvendo ambos ofereçam ao cirurgião caminhos alternativos quando uma dissecção difícil pode impedir uma ou outra abordagem.
A pancreatectomia distal pode ser realizada com ou sem esplenectomia. As técnicas cirúrgicas para preservação esplênica incluem dissecção meticulosa dos vasos esplênicos da parte posterior do pâncreas, ou preservação dos vasos gástricos curtos, que fornecem suprimento sanguíneo ao baço no cenário de ligadura dos vasos esplênicos, descrita pela primeira vez por Warshaw et al. em 1988. 7 Nesse caso, optamos por realizar uma esplenectomia dada a natureza da apresentação oncológica do paciente, embora a preservação do baço pressagie alguns benefícios clínicos, como evitar o risco de infecção pós-esplenectomia avassaladora (OPSI). Em pacientes submetidos a esplenectomia em conjunto com pancreatectomia distal, vacinas contra organismos encapsulados devem ser administradas para reduzir o risco de OPSI. Isso inclui a vacinação contra Neisseria meningitides, Streptococcus pneumoniae e Haemophilus influenzae. Os pacientes também recebem rotineiramente um suprimento emergencial de antibióticos em caso de infecção.
O objetivo do tratamento cirúrgico das lesões do corpo e cauda pancreática com pancreatectomia distal e esplenectomia é a ressecção R0 com remoção de todas as doenças. Isso fornece ao paciente a única opção de tratamento curativo. Embora as taxas de mortalidade perioperatória sejam baixas em centros de alto volume (1–2%), a morbidade permanece alta (20–30%). 8 Isso inclui complicações relacionadas à operação, incluindo fístula pancreática, que é a mais comum, mas também consequências, como o desenvolvimento de diabetes, que ocorre em aproximadamente 15 a 30% dos pacientes. 9 Assim, o risco de uma operação relativamente mórbida também deve ser ponderado em relação aos benefícios potenciais e à probabilidade de se obter uma ressecção R0, que é uma discussão individualizada a ser realizada em conferências multidisciplinares e entre o paciente e o cirurgião.
Este caso apresenta um paciente único, inicialmente apresentando doença metastática, que demonstrou resposta durável ao NAT por mais de dois anos antes de ser submetido à ressecção cirúrgica, com uma resposta patológica completa. Este curso notável é um outlier, mas fornece esperança significativa para o futuro do tratamento no PDAC e destaca o poder do NAT na doença potencialmente de estadiamento inferior (um paradigma observado em outros cânceres do trato digestivo, incluindo câncer retal, no qual a resposta patológica completa é frequentemente observada após o NAT10). Alguns relatos de casos na literatura descrevem respostas semelhantes dos pacientes. 11
Os destaques técnicos deste caso incluem uma dissecção retroperitoneal difícil com fibrose extensa, como é frequentemente visto em pacientes após NAT. A secção congelada foi enviada de tecido fibrótico recoberto à artéria hepática e foi negativa para malignidade. O tumor foi observado como mole e flexível, característica frequentemente observada em pacientes com boa resposta ao tratamento neoadjuvante. A dissecção das principais estruturas vasculares ao redor do corpo e da cauda do pâncreas, incluindo PV e SMV, artéria hepática, veia renal e veia adrenal, ocorreu sem incidentes. O pâncreas foi seccionado com um grampeador, utilizando uma carga de grampos de proteção de costura. Um dreno foi deixado no local na margem da transecção pancreática, como é nosso protocolo. A perda sanguínea estimada foi < 100 cc e o paciente se recuperou sem complicações pós-operatórias significativas. Notavelmente, a patologia cirúrgica final não revelou evidências de doença com uma resposta patológica completa.
O tratamento moderno do câncer de pâncreas depende do estágio em que o paciente se apresenta, e os pacientes são tratados com terapia multimodal, incluindo quimioterapia e radioterapia. O câncer de pâncreas ressecável inicial pode ser tratado primeiro com cirurgia, com o objetivo de obter uma ressecção R0; no entanto, há um interesse crescente em oferecer NAT antes da cirurgia, mesmo na doença ressecável inicial. Como mencionado acima, na doença localmente avançada e limítrofe ressecável, o tratamento de primeira linha é a nat; se os pacientes não apresentarem progressão da doença na TNA, a exploração cirúrgica geralmente é oferecida, pois os achados radiográficos geralmente não são preditivos de ressecabilidade após a TNA.
Os benefícios do NAT na doença ressecável incluem permitir o tratamento precoce e mais rápido da doença microscópica, melhor seleção de pacientes, bem como uma maior probabilidade de conclusão do esquema completo de tratamento. Dadas as altas taxas de pacientes (até 25%) com doença metastática no momento da cirurgia, a administração do tratamento neoadjuvante permite que a biologia do tumor evolua e potencialmente se auto-selecione para pacientes com maior probabilidade de se beneficiar de um procedimento cirúrgico que coloca o paciente em risco de morbidade significativa. Um benefício adicional é que o risco de fístula pancreática diminui acentuadamente após a NAT.12
No entanto, existem algumas desvantagens dessa abordagem. A renúncia ao NAT oferece a oportunidade de remover o tumor antes que ocorra qualquer progressão, pois a remoção cirúrgica é a única chance de cura a longo prazo no PDAC. Para pacientes com obstrução biliar submetidos a NAT, o implante de stent biliar precisa ser realizado, o que acarreta seus próprios riscos correspondentes que foram relatados em vários estudos. 13
Os avanços na pancreatectomia distal incluem o uso de técnicas minimamente invasivas; Procedimentos laparoscópicos e robóticos estão sendo realizados em todo o país. Recentemente, foram publicados os primeiros ensaios clínicos randomizados controlados de pancreatectomia distal minimamente invasiva versus aberta. 14 O estudo LEOPARD é um ECR multicêntrico cego para pacientes com tumores pancreáticos do lado esquerdo sem envolvimento vascular. Neste estudo, a pancreatectomia distal minimamente invasiva foi associada a um tempo reduzido para recuperação funcional; no entanto, a taxa geral de complicações não foi afetada. 15 O estudo LAPOP é um ECR prospectivo não cego, avaliando o desfecho primário do tempo de internação hospitalar pós-operatória. Este estudo demonstrou uma diminuição significativa no tempo de internação hospitalar (5 dias versus 6 dias) e, em geral, nenhuma alteração na taxa de complicações. 16 Esses dados sugerem que a pancreatectomia distal minimamente invasiva pode oferecer aos pacientes uma recuperação mais rápida. No entanto, faltam dados em relação aos resultados oncológicos ao comparar procedimentos abertos e minimamente invasivos, e mais trabalho é necessário nessa área. Em pacientes com nata, particularmente se a radiação for um componente, pode haver fibrose acentuada ao redor dos vasos principais, tornando a dissecção, embora minimamente invasiva, mais difícil.
No acompanhamento, essa paciente conseguiu retornar às suas atividades normais de vida diária. Ela relatou perda de peso significativa de > 25 libras e fezes moles contínuas. Ela foi iniciada no Creonte por suposta insuficiência pancreática exócrina. As imagens mais recentes na redação deste artigo em fevereiro de 2022 não demonstraram evidências de doença recorrente. A paciente continuará a ser acompanhada por sua equipe médica de oncologia com tomografias computadorizadas do 3º mês e medição de marcadores tumorais.
Nada a divulgar.
O paciente referido neste artigo em vídeo deu seu consentimento informado para ser filmado e está ciente de que informações e imagens serão publicadas online.
References
- McGuigan A, Kelly P, Turkington RC, Jones C, Coleman HG, McCain RS. Câncer de pâncreas: uma revisão do diagnóstico clínico, epidemiologia, tratamento e resultados. Mundo J Gastroenterol. 2018; 24(43):4846-4861. DOI:10.3748/wjg.v24.i43.4846.
- Cameron JK, Cameron AM. Terapia Cirúrgica Atual. 10ª ed. Filadélfia: Elsevier Mosby; 2011.
- Oba A, Ho F, Bao QR, Al-Musawi MH, Schulick RD, Del Chiaro M. Tratamento neoadjuvante no câncer de pâncreas. Fronteiras em Oncologia. 2020; 10(245). DOI:10.3389/fonc.2020.00245.
- Ghaneh P, Palmer DH, Cicconi S, et.al. ESPAC-5F: Ensaio clínico internacional randomizado de fase II de quatro braços, prospectivo, multicêntrico, de cirurgia imediata em comparação com gencitabina neoadjuvante mais capecitabina (GEMCAP) ou FOLFIRINOX ou quimiorradioterapia (CRT) em pacientes com câncer de pâncreas ressecável limítrofe. J Clin Oncol. 2020; 38(15)4505. DOI:10.1200/JCO.2020.38.15_suppl.4505.
- Muller PC, Frey MC, Ruzza CM, et al. Quimioterapia neoadjuvante no câncer de pâncreas: uma avaliação das evidências atuais de alto nível. Farmacologia. 2021;106:143-153. DOI:10.1159/000510343.
- Versteijne E, Suker M, Groothuis K, et. al. Quimiorradioterapia pré-operatória versus cirurgia imediata para câncer de pâncreas ressecável e limítrofe ressecável: resultados do estudo holandês randomizado de fase III PREOPANC. J Clin Oncol. 2020; 38(16):1763-1773. DOI:10.1200/JCO.19.02274.
- Pancreatectomia distal com preservação do baço. J Sci do pâncreas hepatobiliar. 2010;17:818-812. DOI:10.1007/S00534-009-0226-Z.
- Lillemoe KD, Kaushal S, Cameron JL, Sohn TA, Pitt HA, Yeo CJ. Pancreatectomia distal: indicações e resultados em 235 pacientes. Ann Surg. 1999; 229(5):693. DOI:10.1097/00000658-199905000-00012.
- De Brujin KMJ, van Eijck CHJ. Diabetes de início recente após pancreatectomia distal: uma revisão sistemática. Ann Surg. 2015; 216(5):854-61. DOI:10.1097/SLA.00000000000000819.
- Kong M, Hong SE, Choi WS, Kim SY, Choi J. Quimiorradioterapia concomitante pré-operatória para câncer retal localmente avançado: resultados do tratamento e análise de fatores prognósticos. Tratamento de Res de Câncer. 2012; 44(2):104-112. DOI:10.4143/crt.2012.44.2.104.
- Rios Perez MV, Dai B, Koay EJ, Wolff RA, Fleming JB. Regressão do câncer de pâncreas em estágio IV para cirurgia curativa e introdução de um novo ensaio de quimiossensibilidade ex-vivo. Cureus. 2015; 7(12):e423. DOI:10.7759/cureus.423.
- Hank T, Sandini M, Ferrone CR, et al. Associação entre fístula pancreática e sobrevida a longo prazo na era da quimioterapia neoadjuvante. JAMA Surg. 2019; 154(10):943-951. DOI:10.1001/jamasurg.2019.2272.
- Kuwatani M, Nakamura T, Hayashi T, et. al. Resultados clínicos da drenagem biliar durante uma terapia neoadjuvante para câncer de pâncreas: stents de metal versus plástico. Intestino Fígado. 2020; 14(2):269-273. DOI:10.5009/GNL18573.
- Riviere D, Gurusamy KS, Kooby DA, Vollmer CM, Besselink MGH, Davidson BR, van Laarhoven CJHM. Pancreatectomia distal laparoscópica versus aberta para câncer de pâncreas. Banco de Dados Cochrane de Revisões Sistemáticas. 2016; 4(CD011391). DOI:10.1002/14651858.CD011391.pub2.
- De Rooij T, van Hilst J, van Santvoort H, et.al. Pancreatectomia distal minimamente invasiva versus aberta (LEOPARD): um estudo controlado randomizado multicêntrico cego para pacientes. Ann Surg. 2019; 269(1):2-9. DOI:10.1097/SLA.00000000000002979.
- Bjornsson B, Sandstrom P, Larsson AL, Hjalmarsson C, Gasslander T. Pancreatectomia distal laparoscópica versus aberta (LAPOP): protocolo de estudo para um ensaio clínico randomizado e controlado de centro único, não cego. Ensaios. 2019; 20(356). DOI:10.1186/S13063-019-3460-y.
Cite this article
Hennessy ML, Fernandez-del Castillo C. Pancreatectomia distal aberta para câncer de pâncreas. J Med Insight. 2022; 2022(339). DOI:10.24296/jomi/339.

