췌장암에 대한 개방 원위 췌장 절제술
Main Text
Table of Contents
원위 췌장 절제술은 양성 및 악성 췌장 종양에 대해 가장 자주 수행되는 절차이지만 췌장염 치료에도 적용될 수 있습니다. 수술은 비장의 en-bloc 절제술 또는 비장 보존으로 수행 할 수 있습니다 - 비장 절제술은 종양 절제술을 위해 지시됩니다. 수술 적 접근 방식 (복강경, 로봇 또는 개방)은 환자와 임상 시나리오에 따라 결정됩니다. 이 경우 췌장 선암에 대한 신 보조 치료를받은 환자에서 비장 절제술로 개방 원위 췌장 절제술을 시행합니다. 이것은 전이성 질환의 초기 진단 후 외과 적 절제술을받는 환자의 독특한 경우입니다. 환자는 69 세의 여성으로 처음에는 복통과 팽만감을 보였으며 췌장 몸에 2cm의 의심스러운 종양이 있고 생검으로 입증 된 단일 간 전이가있는 것으로 밝혀졌습니다. 그녀는 신 보조 화학 요법의 연장 된 과정으로 치료를 받았으며 재 병기 스캔은 유의 한 반응을 보였다. 화학 방사선이 완료되었고 간 전이가 더 이상 영상에서 보이지 않았습니다. 진단 후 27개월 후 그녀는 원위 췌장 절제술과 비장 절제술을 위해 수술실로 이송되었습니다. 간 또는 복막 전이는 보이지 않았습니다. 그녀의 수술 후 과정은 전반적으로 사건이 없었고 그녀는 잘 회복되었습니다. 최종 수술 병리학은 질병의 증거가 보이지 않고 0/11 림프절이 악성 종양에 양성인 완전한 병리학 적 반응을 보여주었습니다. 그녀는 현재 종양학 팀에서 3개월마다 CT 스캔과 종양 마커를 추적하고 있으며 2022년 2월 현재 재발의 증거는 없습니다.
상대적으로 낮은 발병률에도 불구하고 췌장암은 미국에서 암으로 인한 사망의 네 번째 주요 원인입니다. 1 췌장관 선암종(PDAC)은 가장 흔한 유형의 췌장암으로, 환자의 비율은 느리게 성장하는 악성 내분비 종양을 가지고 있습니다. 위험 요인에는 고령, 남성 성별, 당뇨병, 흡연 병력, 췌장염 및 특정 유전 적 감수성 유전자좌가 포함됩니다. 이 종양의 R0 외과 적 절제술은 치료 치료의 유일한 기회를 제공합니다. 진단 시 췌장암은 절제 불가능/전파, 국소 진행성, 경계선 절제 가능 또는 선행 절제 가능(표 1 참조)으로 분류되며, 이는 주로 국소 혈관계의 종양 침범 및 원격 전이의 존재에 따라 달라집니다. 2 대부분의 췌장암(60-70%)은 샘의 머리에서 발생하고 나머지는 몸과 꼬리에서 발생합니다. 1 원위 췌장 절제술과 관련하여, 비장 혈관계의 침범은 외과 적 절제술에 금기 사항이 아닙니다. 불행히도, 대부분의 췌장암 환자는 진단 당시 질병이 멀리 퍼질 것입니다. 이것은 췌장의 이 부분에 있는 작은 덩어리가 일반적으로 무증상이기 때문에 췌장체와 꼬리의 종양이 있는 사람들에게서 훨씬 더 높은 비율로 나타납니다. 궁극적으로 췌장의 몸 / 꼬리에 PDAC가있는 개인의 5-7 %만이 수술을받을 것입니다. 3
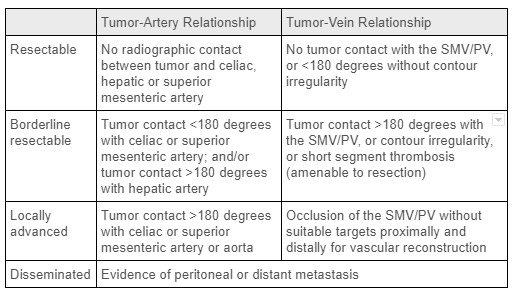
표 1 : 췌장암의 종양 병기 결정 기준. 출처: 현재 수술 요법, 췌장암에 대한 신보조 및 보조 요법2
고위험 특징이 없는 선행 절제 가능한 질환 환자의 경우 2019년 NCCN 지침에 따라 수술이 권장되는 1차 치료 옵션이며 최근 임상 시험에서 뒷받침됩니다. 4인치>4 췌장 선암의 외과 적 관리를위한 옵션에는 머리의 병변에 대한 췌장 십이지장 절제술 (Whipple 절차)과 몸과 꼬리의 병변에 대한 비장 절제술을 통한 원위 췌장 절제술이 포함됩니다. 경계선 절제 가능 및 국소 진행성 질환에 대한 1차 요법은 FOLFIRINOX 또는 젬시타빈-나브-파클리탁셀로 구성된 신보조 치료(NAT)를 사용하는 것입니다.3 점점 더 많은 문헌이 PDAC에서 NAT를 지원하므로 많은 임상 시험에서 선행 절제 가능한 질병에서 외과적 절제 전에 NAT를 검사하고 있습니다. 5, 6 이러한 접근법의 장단점은 아래에서 자세히 설명합니다.
치료 결과는 환자 발표시 종양의 단계와 외과 적 절제의 정도에 따라 다릅니다. 모든 췌장암 환자의 전체 5 년 생존율은 약 10 %입니다. 이는 노드 음성 질환에서 약 30 %의 5 년 생존율과 노드 양성 질환에서 10 %의 5 년 생존율을 나타내는 성공적인 R0 절제술 환자부터 진단 시 파종 된 질병 환자에 이르기까지 다양하며 장기 생존 가능성이 거의 없습니다. 1
환자는 상당한 흡연 이력, HLD, HTN 및 GERD를 가진 69 세 여성으로 처음에는 복통, 체중 감소 및 팽만감을 나타 냈습니다. 정밀 검사에는 2.1cm의 췌장 체질량과 간 병변이 밝혀진 CT 스캔이 포함되었습니다. 종양 표지자 CA 19-9는 69 U/mL에서 상승하였다. CT 흉부 병기 결정이 완료되어 전이성 질환에 대해 음성이었다. 미국 유도 간 생검 결과 선암이 밝혀졌습니다. 그런 다음 환자는 4주기의 FOLFIRINOX를 받았습니다. 재병기 스캔은 간 병변의 크기가 증가하고 췌장 덩어리가 감소하는 것으로 나타났으며 4주기 동안 젬시타빈/아브락산으로 변경되었습니다. 그런 다음 CT를 반복하면 간과 췌장 종괴 모두에서 감소가 나타났습니다. 총 17 사이클의 보석 / 아브 락산이 투여되었으며, CT는 안정적인 질병과 5 U / mL의 CA 19-9를 보였다. 그런 다음 그녀는 젬시 타빈 단독 요법으로 옮겨졌습니다. 그녀는 불면증과 신경 병증을 경험하는 최소한의 부작용으로 화학 요법을 현저하게 잘 견뎌냈습니다.
그런 다음 지속적인 안정적인 질병을 감안할 때 화학 방사선의 긴 과정(5주)이 제공되었습니다. 카페시타빈과 방사선 요법(RT)을 동시에 투여하였다. MRI를 이용한 간 영상은 치료 완료시 질병의 증거를 밝히지 않았다. 원발성 종양의 크기도 현저하게 감소했습니다. 다학문 논의의 합의는 원위 췌장 절제술과 비장 절제술을 통한 외과적 관리가 IV기 췌장암으로 처음 진단된 환자에서 영구적인 반응과 반복 영상에서 전이성 질환의 증거가 부족하고 종양 마커 수치가 낮다는 점을 감안할 때 적절한 다음 단계라는 것이었습니다.
발표 시 환자는 황달, 만져지는 복부 종괴 또는 복부 수술 흉터의 증거를 보이지 않았습니다.
진단시 CT 스캔은 췌장 악성 종양이 의심되는 췌장 실질의 위축과 함께 2.1cm x 2.1cm 크기의 췌장 체내에서 이질적이고 불규칙한 저 감쇠 췌장 덩어리를 보여주었습니다. 우측 간엽의 9mm 이질적인 저 감쇠 간 병변은 간 MRI로 더 특성화되었으며 궁극적으로 미국 유도 생검에서 전이성 선암이 확인되었습니다.
SMA와 SMV는 질량에 관여하지 않았지만 비장 정맥이 사라졌습니다.
초기 진단 후 2 년 동안 외과 적 절제 전에 신 보조 치료를 완료 한 후 CT 스캔은 췌장 체내에서 1.2cm x 0.5cm 저밀도 초점을 보여 주었으며, 이는 덕트 확장이 없지만 췌장 꼬리의 지속적인 위축이있는 이전 영상 연구와 변하지 않았습니다. 간 MRI는 더 이상 우엽에서 센티미터 이하의 간 병변이 된 것을 시각화하지 않았습니다.
원위 췌장 절제술의 수술 기술은 일반적으로 두 가지 모델을 따릅니다. 하나는 내측에서 측면 방식으로 해부에 접근 할 수 있으며, 먼저 췌장 아래에 터널을 형성하고 샘을 가로 질러 해부를 췌장 꼬리와 비장 hilum쪽으로 확장합니다. 대안적으로, 해부는 샘의 측면 측면에서 시작되어 내측으로 운반 될 수 있습니다. 우리가 선호하는 접근 방식은 내측에서 측면 해부이지만, 두 가지를 모두 포함하는 이해와 기술은 어려운 해부가 하나 또는 다른 접근 방식을 배제할 수 있는 경우 외과의에게 대안적인 방법을 제공합니다.
원위 췌장 절제술은 비장 절제술의 유무에 관계없이 시행 될 수 있습니다. 비장 보존을위한 수술 기술에는 췌장 후방에서 비장 혈관의 세심한 해부 또는 Warshaw et al.에 의해 처음 기술 된 비장 혈관의 결찰 설정에서 비장에 혈액 공급을 제공하는 짧은 위 혈관의 보존이 포함됩니다. 1988년. 7 이 경우 우리는 환자의 종양학적 표현의 특성을 고려하여 비장 절제술을 수행하기로 선택했지만 비장의 보존은 압도적인 비장 절제술 후 감염(OPSI)의 위험을 피하는 것과 같은 일부 임상적 이점을 예고합니다. 원위 췌장 절제술과 함께 비장 절제술을받는 환자의 경우 OPSI의 위험을 줄이기 위해 캡슐화 된 유기체에 대한 백신을 투여해야합니다. 여기에는 Neisseria 수막염, 폐렴 연쇄상 구균 및 헤모필루스 인플루엔자에 대한 예방 접종이 포함됩니다. 환자는 또한 감염의 경우 항생제의 비상 공급을 일상적으로 제공받습니다.
원위 췌장 절제술 및 비장 절제술로 췌장 신체 및 꼬리 병변의 외과 적 치료의 목표는 모든 질병을 제거한 R0 절제술입니다. 이것은 환자에게 치료 치료를위한 유일한 옵션을 제공합니다. 수술 전후 사망률은 대량 센터 (1-2 %)에서 낮지 만 이환율은 여전히 높습니다 (20-30 %). 8 여기에는 가장 흔한 췌장 누공을 포함하여 수술과 관련된 합병증뿐만 아니라 환자의 약 15-30 %에서 발생하는 당뇨병 발병과 같은 결과도 포함됩니다. 9 따라서 상대적으로 병적인 수술의 위험은 R0 절제술을 달성할 수 있는 잠재적인 이점과 가능성과도 비교되어야 하며, 이는 다학문 회의에서 그리고 환자와 외과의사 간에 개별적으로 논의되는 것입니다.
이 사례는 초기에 전이성 질환을 앓고 있는 독특한 환자가 병리학적 완전 반응으로 외과적 절제술을 받기 전에 2년 이상 NAT에 대한 지속적인 반응을 보였습니다. 이 놀라운 과정은 이상치이지만 PDAC 치료의 미래에 대한 중요한 희망을 제공하며 잠재적으로 다운 스테이징 질환(직장암을 포함한 다른 소화관암에서 볼 수 있는 패러다임, NAT10 이후에 완전한 병리학적 반응이 종종 나타남)에서 NAT의 힘을 강조합니다. 문헌의 몇 가지 사례 보고서는 유사한 환자 반응을 설명합니다. 11
이 사례의 기술적 하이라이트는 NAT 후 환자에서 흔히 볼 수 있듯이 광범위한 섬유증을 동반 한 어려운 후 복막 박리를 포함합니다. 동결 절편은 간동맥 위에 있는 섬유성 조직으로 보내졌으며 악성종양에 대해 음성이었습니다. 종양은 부드럽고 유연한 것으로 나타 났으며, 이는 신 보조 치료에 대한 반응이 좋은 환자에서 종종 볼 수있는 특징입니다. PV 및 SMV를 포함한 췌장의 몸과 꼬리 주변의 주요 혈관 구조, 간동맥, 신장 정맥 및 부신 정맥의 해부는 모두 사고없이 진행되었습니다. 췌장은 솔기 가드 스테이플 하중을 사용하여 스테이플러로 옮겨졌습니다. 하나의 배수구는 우리의 프로토콜과 마찬가지로 췌장 절개 가장자리에 그대로 남아 있었습니다. 추정 출혈량은 100cc <이었고 환자는 수술 후 심각한 합병증 없이 회복되었습니다. 특히, 최종 수술 병리학은 완전한 병리학 적 반응을 가진 질병의 증거를 나타내지 않았다.
췌장암의 현대 치료는 환자가 제시하는 단계에 달려 있으며 환자는 화학 요법 및 방사선 요법을 포함한 다중 모드 요법으로 치료됩니다. 선행 절제 가능한 췌장암은 R0 절제술을 목표로 먼저 수술로 치료할 수 있습니다. 그러나 절제 가능한 질병에서도 수술 전에 NAT를 제공하는 것에 대한 관심이 증가하고 있습니다. 위에서 언급했듯이 국소 진행성 및 경계선 절제 가능한 질병에서 1 차 치료는 NAT입니다. 환자가 NAT에서 질병 진행을 보이지 않는 경우, 방사선 학적 소견이 종종 NAT 후 절제 가능성을 예측하지 못하기 때문에 일반적으로 외과 적 탐색이 제공됩니다.
절제 가능한 질병에서 NAT의 이점은 현미경 질환의 조기 및 빠른 치료, 환자 선택 개선 및 전체 치료 요법의 완료 가능성 증가를 포함합니다. 수술 당시 전이성 질환이 있는 것으로 밝혀진 환자의 높은 비율(최대 25%)을 감안할 때, 신보조 치료의 전달은 종양 생물학이 진화하고 잠재적으로 환자를 심각한 이환율의 위험에 빠뜨리는 수술 절차의 혜택을 받을 가능성이 가장 높은 환자를 스스로 선택할 수 있도록 합니다. 추가적인 이점은 NAT 이후 췌장 누공의 위험이 현저하게 감소한다는 것입니다.12
그러나 이 접근 방식에는 몇 가지 단점이 있습니다. NAT를 포기하면 PDAC에서 외과적 제거가 장기간 치료할 수 있는 유일한 기회이기 때문에 진행이 발생하기 전에 종양을 제거할 수 있는 기회를 제공합니다. NAT를 받는 담도 폐쇄 환자의 경우 담즙 스텐트 삽입을 수행해야 하며, 이는 여러 연구에서 기록된 고유한 위험을 수반합니다. 13
원위 췌장 절제술의 발전에는 최소 침습 기술의 사용이 포함됩니다. 복강경과 로봇 시술이 모두 전국에서 시행되고 있습니다. 최근에, 최소 침습성 대 개방 원위 췌장 절제술에 대한 최초의 무작위 대조 임상 시험이 발표되었습니다. 14 LEOPARD 시험은 혈관 침범이 없는 좌측 췌장 종양 환자를 위한 다기관 환자 맹검 RCT입니다. 이 시험에서 최소 침습적 원위 췌장 절제술은 기능 회복 시간 단축과 관련이 있었습니다. 그러나 전반적인 합병증 비율은 영향을 받지 않았습니다. 15 LAPOP 시험은 수술 후 입원 기간의 1차 평가변수를 평가하는 비맹검 전향적 RCT입니다. 이 시험은 입원 기간(5일 대 6일)이 크게 감소했으며 전반적으로 합병증 비율에 변화가 없음을 보여주었습니다. 16 이러한 데이터는 최소 침습적 원위 췌장 절제술이 환자에게 보다 편리한 회복을 제공할 수 있음을 시사합니다. 그러나 개방 절차와 최소 침습 절차를 비교할 때 종양 학적 결과와 관련하여 데이터가 부족하며이 분야에서 더 많은 연구가 필요합니다. NAT 환자의 경우, 특히 방사선이 구성 요소 인 경우 주요 혈관을 둘러싼 현저한 섬유증이있어 최소 침습적이지만 해부가 더 어려워 질 수 있습니다.
후속 조치에서이 환자는 일상 생활의 정상적인 활동으로 돌아갈 수있었습니다. 그녀는 > 25파운드의 상당한 체중 감소와 지속적인 느슨한 대변을 보고했습니다. 그녀는 췌장 외분비 기능 부전으로 추정되는 크레온에서 시작되었습니다. 2022년 2월 이 기사를 작성할 때 가장 최근의 영상에서는 재발성 질병의 증거가 없음을 보여주었습니다. 환자는 q3 개월 CT 스캔 및 종양 마커 측정을 통해 종양학 팀이 계속 추적 할 것입니다.
공개 할 것이 없습니다.
이 비디오 기사에 언급된 환자는 정보에 입각한 동의로 촬영에 동의했으며 정보와 이미지가 온라인에 게시될 것임을 알고 있습니다.
References
- 맥기건 A, 켈리 P, 터킹턴 RC, 존스 C, 콜먼 HG, 매케인 RS. 췌장암 : 임상 진단, 역학, 치료 및 결과에 대한 검토. 월드 J 가스트로엔테롤. 2018;24(43):4846-4861. 도이 : 10.3748 / WJG.v24.i43.4846.
- 카메론 JK, 카메론 AM. 현재 수술 요법. 10판. 필라델피아: 엘스비어 모스비; 2011.
- Oba A, Ho F, Bao QR, Al-Musawi MH, Schulick RD, Del Chiaro M. 췌장암의 신 보조 치료. 종양학의 최전선. 2020;10(245). 도이 : 10.3389 / fonc.2020.00245.
- 가네 P, 팔머 DH, 시코니 S, et.al. ESPAC-5F: 경계성 절제 가능한 췌장암 환자를 대상으로 신보조 젬시타빈과 카페시타빈(GEMCAP) 또는 FOLFIRINOX 또는 화학방사선요법(CRT)과 비교한 즉각적인 수술의 4군, 전향적, 다기관, 국제 무작위 2상 시험. J 클린 온콜. 2020;38(15)4505. 도이 : 10.1200 / JCO.2020.38.15_suppl.4505.
- 뮬러 PC, 프레이 MC, 루자 CM, 외. 췌장암의 신 보조 화학 요법 : 현재의 높은 수준의 증거에 대한 평가. 약리학. 2021;106:143-153. 도이 : 10.1159 / 000510343.
- Versteijne E, Suker M, Groothuis K, et. al. 절제 가능 및 경계선 절제 가능한 췌장암에 대한 수술 전 화학 방사선 요법 대 즉각적인 수술 : 네덜란드 무작위 3 상 PREOPANC 시험 결과. J 클린 온콜. 2020;38(16):1763-1773. 도이 : 10.1200 / JCO.19.02274.
- Warshaw AL. 비장 보존과 함께 원위 췌장 절제술. J 간 담도 췌장 과학. 2010;17:818-812. 도이 : 10.1007 / S00534-009-0226-Z.
- 릴레모에 KD, 카우샬 S, 카메론 JL, 손 TA, 피트 하, 여씨제이. 원위 췌장 절제술 : 235 명의 환자에서 적응증 및 결과. 앤 서지. 1999;229(5):693. doi:10.1097/00000658-199905000-00012.
- De Brujin KMJ, van Eijck CHJ. 원위 췌장 절제술 후 새로 발병 한 당뇨병 : 체계적인 검토. 앤 서지. 2015;216(5):854-61. doi:10.1097/SLA.00000000000000819.
- Kong M, Hong SE, Choi WS, Kim SY, Choi J. 국소 진행성 직장암에 대한 수술 전 동시 화학 방사선 요법 : 치료 결과 및 예후 인자 분석. 암 치료. 2012;44(2):104-112. 도이 : 10.4143 / CRT.2012.44.2.104.
- 리오스 페레즈 MV, 다이 B, 코아이 EJ, 울프 RA, 플레밍 JB. IV 기 췌장암의 치료 수술로의 회귀 및 새로운 생체 외 화학 감수성 분석의 도입. 쿠레우스. 2015;7(12):e423. 도이 : 10.7759 / 큐어 우스 .423.
- 행크 T, 산디니 M, 페론 CR, 외. 췌장 누공과 신 보조 화학 요법 시대의 장기 생존 사이의 연관성. 자마 서지. 2019;154(10):943-951. 도이 : 10.1001 / 자마 서지.2019.2272.
- 쿠와타니 M, 나카무라 T, 하야시 T, 외. 췌장암에 대한 신 보조 요법 중 담즙 배액의 임상 결과 : 금속 대 플라스틱 스텐트. 장 간. 2020;14(2):269-273. 도이 : 10.5009 / GNL18573.
- Riviere D, Gurusamy KS, Kooby DA, Vollmer CM, Besselink MGH, Davidson BR, van Laarhoven CJHM. 췌장암에 대한 복강경 대 개방 원위 췌장 절제술. 체계적인 문헌고찰의 코크란 데이터베이스. 2016;4(CD011391). doi:10.1002/14651858.CD011391.pub2.
- De Rooij T, van Hilst J, van Santvoort H, et.al. 최소 침습적 대 개방 원위 췌장 절제술(LEOPARD): 다기관 환자 맹검 무작위 대조 시험. 앤 서지. 2019;269(1):2-9. doi:10.1097/SLA.00000000000002979.
- Bjornsson B, Sandstrom P, Larsson AL, Hjalmarsson C, Gasslander T. 복강경 대 개방 원위 췌장 절제술 (LAPOP) : 단일 센터, 비 맹검, 무작위 대조 시험에 대한 연구 프로토콜. 시험. 2019;20(356). 도이 : 10.1186 / S13063-019-3460-Y.
Cite this article
헤네시 ML, 페르난데스-델 카스티요 C. 췌장암에 대한 개방 원위 췌장 절제술. J 메드 인사이트. 2022;2022(339). 도이 : 10.24296 / 조미 / 339.

