膵臓がんのための開口末端膵切除術
Main Text
Table of Contents
遠位膵切除術は、良性・悪性の両方の膵腫瘍に対して最もよく行われる手術ですが、膵炎の治療にも適応症が適用されます。この手術は脾臓の一括切除または脾臓保存を伴うものがあり、腫瘍的切除には脾摘出が推奨されます。手術のアプローチは腹腔鏡、ロボット手術、または開腹手術のいずれかで、患者と臨床状況によって決まります。今回の場合、膵腺癌の新補助療法を受けた患者に対して、開腹末端膵切除術と脾摘出術を行います。これは、転移性疾患と診断された後に外科的切除を受けた患者の珍しいケースです。患者は69歳の女性で、当初は腹痛と膨満感を訴え、膵臓体内に2cmの疑わしい腫瘍と生検で証明された単一肝転移が認められました。彼女は長期にわたるネオアジュバント化学療法を受け、再検査で有意な反応が認められました。化学放射線治療が完了し、肝転移は画像で確認できなくなりました。診断から27か月後、彼女は遠位膵切除術と脾臓摘出術のため手術室に運ばれました。肝臓や腹膜の転移は認められませんでした。術後の経過は全体的に特に問題なく、回復も順調でした。最終的な外科的病理検査では、病変の証拠はなく、悪性腫瘍が検出されたリンパ節は0/11で、完全な病理学的反応を示しました。現在、腫瘍内科チームによって3か月ごとにCTスキャンと腫瘍マーカーの経過観察を受けており、2022年2月時点で再発の証拠はありません。
比較的低い発生率にもかかわらず、膵臓がんはアメリカにおけるがんによる死因の第4位です。膵 管腺癌(PDAC)は最も一般的な膵臓がんのタイプであり、少数の患者は進行の遅い悪性内分泌腫瘍を抱えています。リスク要因には高齢、男性、糖尿病、喫煙歴、膵炎、特定の遺伝的感受性遺伝子座などが含まれます。これらの腫瘍のR0外科的切除が治癒治療の唯一のチャンスを提供します。診断時には、膵臓がんは切除不能/転播性、局所進行性、境界切除可能、または初期切除可能(表1参照)に分類され、これらは主に局所血管の腫瘍関与および遠隔転移の有無に依存します。膵 臓がんの大多数(60〜70%)は腺頭に発生し、残りは体や尾部に発生します。1 遠位膵切除術に関連して、脾血管の関与は外科的切除の禁忌ではありません。残念ながら、膵臓がん患者の大多数は診断時に遠隔転移があります。膵臓の体や尾部の腫瘍を持つ人では、この部分の小さな腫瘤は通常無症状であるため、この発症率はさらに高くなります。最終的に、膵臓の体や末部にPDACを持つ患者のうち、手術を受けるのは5〜7%にとどまります。3
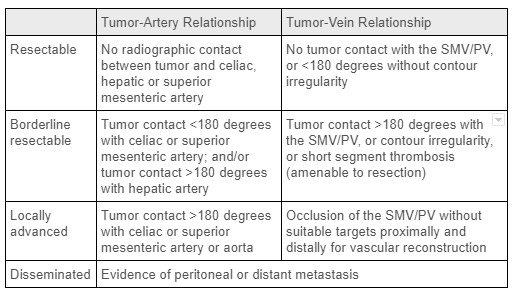
表1:膵臓がんにおける腫瘍病期の基準。出典:現在の外科的治療、膵臓がんに対するネオアジュバントおよびアジュバント療法2
リスクの高い特徴を伴わない初期切除可能な疾患の患者には、2019年のNCCNガイドラインに基づき手術が第一選択の治療として推奨されており、最近の臨床試験によって支持されています。4インチ>4 膵腺癌の外科的治療の選択肢には、頭部の病変に対する膵十二指腸切除術(ウィップル手術)や、体および尾部の病変に対する膵臓切除術と脾摘出術があります。 境界切除可能かつ局所進行疾患の第一選択療法は、FOLFIRINOXまたはジェムシタビン-ナブ-パクリタキセルからなる新補助療法(NAT)です。3 将来的には、前期切除可能な疾患におけるNATを支持する文献が増えており、多くの臨床試験が手術切除前のNATを検討しています。5、6 このようなアプローチの利点と欠点については、以下で詳しく説明します。
治療の転帰は、患者が就診した時の腫瘍の病期や手術的切除の範囲によって異なります。膵臓がん患者の全ての5年生存率は約10%です。これは、リンパ節陰性疾患で約30%の5年生存率、リンパ節陽性疾患で約10%の5年生存率を示すR0切除術の成功例から、診断時に事実上長期生存の可能性がほぼゼロの転播性疾患患者まで様々です。1
患者は69歳の女性で、喫煙歴、HLD、HTN、GERDがあり、当初は腹痛、体重減少、膨満感を訴えました。検査ではCTスキャンがあり、膵臓の体重2.1cmと肝臓病変が確認されました。腫瘍マーカーCA 19-9は69 U/mLで上昇しました。胸部から完全病期までのCT検査では転移性疾患は陰性でした。超音波ガイド付き肝生検により腺癌が判明しました。その後、患者はFOLFIRINOXを4サイクル受けました。再検査では肝病変の大きさが増え、膵臓の腫瘤が減少し、4サイクルにわたりジェムシタビン/アブラキサンに切り替えました。 再CTでは肝臓と膵臓の腫瘤が減少することが確認されました。 ジェム/アブラキサンは合計17サイクル投与され、CTでは安定した病変、CA 19-9(5 U/mL)が示されました。その後、ジェムシタビン単独療法に切り替えられました。彼女は化学療法に驚くほどよく耐え、副作用も最小限で、不眠症や神経障害を経験しました。
その後、安定した病状が進行している場合、5週間の長期化学放射線治療が提供されました。カペシタビンを放射線治療(RT)と併用して投与しました。MRIを用いた肝画像検査では、治療終了時点で疾患の証拠は認められませんでした。原発腫瘍も著しく縮小していました。多職種的議論の合意では、膵臓末梢切除術および脾摘出術による外科的治療は、初期IV期膵臓がんと診断された患者に対しては異例ながら適切な次のステップであるとされました。患者は持続的な反応があり、繰り返し画像検査で転移性疾患の証拠がなく、腫瘍マーカーレベルも低いためです。
受診時、患者には黄疸、腹部の触知できる腫瘤、腹部手術の傷跡の兆候は見られませんでした。
診断時のCTスキャンでは、膵臓体内に2.1 cm x 2.1cmの不均一で不規則な低減衰膵腫瘤、膵管拡張および膵実質の萎縮が認められ、膵臓悪性腫瘍の疑いが見られました。 右肝葉の9mm異様低減衰肝病変が肝MRIでさらに特徴付けられ、最終的に超音波ガイド生検により転移性腺癌が確認されました。
SMAとSMVは腫瘍には関与していませんが、脾静脈の消失がありました。
初期診断から2年以上経過した新補助療法終了後のCTスキャンでは、膵臓体内に1.2cm×0.5cmの低密度焦点が認められ、これは以前の画像検査と変わらず、膵管拡張はなく膵尾部の持続萎縮が見られました。肝MRIでは、右葉のサブセンチメートル型肝病変をもはや可視化できなかった。
遠位膵臓切除術の手術技術は一般的に2つのモデルに従います。内側から外側への解離を行い、まず膵臓の下にトンネルを作り、腺を横断して膵尾部と脾門に向かって解離を拡張します。あるいは、切除は腺の外側から開始し、内側から行うこともあります。私たちが好むアプローチは内側から外側への解離ですが、両者を兼ね備えた理解とスキルセットがあれば、難しい解離でどちらか一方のアプローチが難しい場合でも、外科医に代替の道を提供します。
遠位膵切除術は脾摘出術の有無にかかわらず行うことができます。脾臓保存のための外科的技術には、膵臓の後部から脾臓血管を綿密に剥離することや、脾臓血管結紮の際に脾臓に血流を供給する短胃血管の保存が含まれ、これはウォーショー らによって初めて記述されました。1988年に。7 この場合、患者の腫瘍症状の性質を考慮して脾摘出術を選択しましたが、脾臓の保存は、脾摘出後の圧倒的な感染(OPSI)のリスク回避など、いくつかの臨床的利益を予兆しています。膵臓遠位切除術と併用して脾摘出術を受ける患者では、OPSIのリスクを減らすために被膜菌に対するワクチンを接種する必要があります。これには 髄膜炎菌、 肺炎連鎖球菌 、イン フルエンザ菌の予防接種が含まれます。感染した場合に備え、患者には緊急の抗生物質が定期的に投与されます。
膵臓および尾部の膵病変の外科的治療は、遠位膵切除術および脾臓摘出術によるR0切除と全病変の除去を目的としています。これにより患者は治癒治療の唯一の選択肢を得ることができます。大量治療施設では周術期死亡率は低く(1〜2%)、罹患率は依然として高い(20〜30%)。これには 、最も一般的な膵瘻を含む手術に関連する合併症だけでなく、約15〜30%の患者に発症する糖尿病の発症などの影響も含まれます。9 したがって、比較的重い手術のリスクは、R0切除の実現可能性と、多職種会議や患者と外科医の間で個別に議論されるべきR0切除の可能性とも考慮されなければなりません。
この症例は、転移性疾患を初期に発症し、手術的切除を受ける前から2年以上持続的なNAT反応を示し、病理学的完全反応を示した独特な患者を特徴としています。この驚くべき経過は例外ですが、PDAC治療の将来に大きな希望を与え、潜在的に病期ダウン(他の消化管がん、特に直腸がんで見られるモデルで、NAT10後に完全な病理反応が見られる)におけるNATの力を強調しています。文献のいくつかの症例報告では、同様の患者反応が報告されています。11
この症例の技術的ハイライトは、NAT後によく見られる広範な線維化を伴う困難な後腹膜解離です。肝動脈の上に覆う線維化組織の凍結切片を行い、悪性は認められませんでした。腫瘍は柔らかく柔軟性があり、これは新補助療法に良好な反応を示す患者によく見られる特徴です。膵臓の体および尾部の主要な血管構造(PVおよびSMV)、肝動脈、腎静脈、副腎静脈の解離はすべて問題なく進められました。膵臓は縫い目防止ステープルを用いてホチキスで切断されました。1つのドレーンは膵臓切断マージンに残し、私たちのプロトコル通りにしています。推定出血量は<100ccで、患者は術後重大な合併症なく回復しました。特筆すべきは、最終的な外科的病理検査で完全な病理反応を伴う疾患の証拠は認められなかったことです。
現代の膵臓がん治療は患者の症状の段階によって異なり、患者は化学療法や放射線療法を含む多様法療法で治療されます。 切除可能な膵臓がんは、まず手術で治療し、R0切除を目指します。しかし、早期に切除可能な疾患であっても、手術前にNATを提供することへの関心が高まっています。前述の通り、局所進行で切除可能な境界疾患では、第一選択の治療はNATです。NATで進行が見られない患者は、放射線検査ではNAT後の切除可能性を予測できないことが多いため、一般的に外科的探究が提案されます。
切除可能な疾患におけるNATの利点には、顕微鏡的疾患の早期かつ迅速な治療、患者選択の改善、そして治療の全治療計画を完了する可能性の向上が含まれます。手術時に転移性疾患が認められる患者の割合が最大25%であることから、ネオアジュバント治療の提供は腫瘍生物学を進化させ、患者が重大な罹患リスクにさらされる手術を受ける可能性が高い患者に対して自己選択を可能にします。さらに、NAT後は膵瘻のリスクが著しく低下するという利点もあります。12
しかし、この方法にはいくつかの欠点もあります。NATを放棄することで、PDACにおける長期的な治癒の唯一の方法は外科的切除であるため、進行前に腫瘍を摘出する機会が得られます。胆道閉塞の患者でNATを受けている場合、胆道ステント挿入が必要であり、これには複数の研究で記録されている独自のリスクがあります。13
遠位膵切除術の進歩には、低侵襲技術の使用が含まれます。腹腔鏡手術とロボット手術の両方が全国で行われています。最近、低侵襲と開口末端膵臓切除術の初のランダム化比較臨床試験が発表されました。14 LEOPARD試験は、血管障害のない左側膵腫瘍患者を対象とした多施設患者盲検RCTです。本試験では、低侵襲の遠位膵切除術が機能回復までの時間短縮と関連し、しかし、全体的な合併症率には影響がなかった。15 LAPOP試験は前向きRCTであり、術後入院期間の主要評価項目を評価した非盲検RCTです。この試験では入院期間が有意に短縮され(5日対6日)、合併症率の全体的な変化は見られませんでした。これらの データは、低侵襲の遠位膵切除術が患者により迅速な回復をもたらす可能性を示唆しています。しかし、開放手術と低侵襲手術の比較における腫瘍学的転帰に関するデータは不足しており、この分野でさらなる研究が必要です。NAT患者、特に放射線が成分であった場合、主要血管の周囲に明らかな線維化が生じ、低侵襲ながらも解離がより困難になることがあります。
追跡調査の結果、この患者は通常の日常生活に戻ることができました。彼女は25ポンド>大幅な体重減少と継続的な軟便を報告しました。 膵臓外分泌不全の疑いでクレオンを始めました。この記事執筆時点での最新の画像診断では再発性疾患の証拠は示されませんでした。患者は引き続き、3か月ごとのCTスキャンと腫瘍マーカーの測定で腫瘍内科チームによるフォローアップが行われます。
特に開示することはない。
この動画で言及されている患者は撮影に同意しており、情報や画像がオンラインで公開されることを認識しています。
References
- マクギガンA、ケリーP、ターキントンRC、ジョーンズC、コールマンHG、マケインRS。膵臓がん:臨床診断、疫学、治療および転帰のレビュー。 ワールド・ジャーナル・ガストロエンテロール。2018;24(43):4846-4861. DOI:10.3748/WJG.V24.i43.4846.
- キャメロンJK、キャメロンAM。 現在の外科的治療。 第10版。フィラデルフィア:エルゼビア・モズビー;2011.
- オバ・A、ホー・F、バオ・QR、アル・ムサウィ・MH、シュリック・RD、デル・キアロ・M。膵臓がんにおけるネオアジュバント治療。腫瘍 学のフロンティア。2020;10(245). DOI:10.3389/FONC.2020.00245.
- ガーネー P、パーマー DH、チッコーニ S、 et.al。ESPAC-5F:境界切除可能な膵臓がん患者を対象に、即時手術を用いる4群前向き多施設国際ランダム化第II相試験。 J クリン・オンコール。2020;38(15)4505. DOI:10.1200/JCO.2020.38.15_suppl.4505。
- ミュラーPC、フライMC、ルッツァCMら。膵臓がんにおける新補助化学療法:現在のハイレベルエビデンスの評価。 薬理学。2021;106:143-153. DOI:10.1159/000510343。
- フェルスタイネE、スカーM、グルートハイス Kら。切除可能かつ境界切除可能な膵臓がんに対する術前化学放射線療法と即時手術の比較:オランダのランダム化第III相PREOPANC試験の結果。 J クリン・オンコール。2020;38(16):1763-1773. doi:10.1200/JCO.19.02274。
- ウォーショウAL。脾臓保存を伴う遠位膵切除術。 肝胆膵科学誌。2010;17:818-812. DOI:10.1007/S00534-009-0226-Z。
- リレモエKD、カウシャルS、キャメロンJL、ソーンTA、ピッツバーグHA、ヨーCJ。遠位膵切除術:235人の患者の適応症と転帰。 アン・サージ。1999;229(5):693. doi:10.1097/00000658-199905000-00012。
- デ・ブルジン KMJ、ファン・エイク CHJ.遠位膵切除術後の新発糖尿病:系統的レビュー。 アン・サージ。2015;216(5):854-61. doi:10.1097/SLA.00000000000000819.
- Kong M, Hong SE, Choi WS, Kim SY, Choi J. 局所進行直腸がんに対する術前併発化学放射線療法:治療結果および予後因子の解析。 がん治療。2012;44(2):104-112. doi:10.4143/crt.2012.44.2.104.
- リオス・ペレスMV、ダイB、コアイEJ、ウォルフRA、フレミングJB。ステージIV膵臓がんの退行から治癒手術への移行と、新規の体外化学感受性アッセイの導入。 キュレウス。2015;7巻(12):e423。 DOI:10.7759/Cureus.423。
- ハンク・T、サンディーニ・M、フェローネ ・CRら。新補助化学療法時代における膵瘻と長期生存率の関連。 JAMAサージ。2019;154(10):943-951. DOI:10.1001/JamaSurg.2019.2272。
- 桑谷M、中村T、林 T他。膵臓がんに対するネオアジュバント療法における胆道排膿の臨床的結果:金属ステントとプラスチックステントの違い。 腸肝臓。2020;14(2):269-273. DOI:10.5009/GNL18573。
- リヴィエールD、グルサミーKS、クービーDA、ヴォルマーCM、ベッセリンクMGH、デビッドソンBR、ヴァンラーホーフェンCJHM。膵臓がんに対する腹腔鏡下と開口末端膵臓切除術の比較。 コクラン・システマティックレビューデータベース。2016;4(CD011391)。 doi:10.1002/14651858.CD011391.pub2。
- デ・ルーイ T、ファン・ヒルスト J、ファン・サントフォールト H、 et.al。低侵襲と開閉末位膵切除術(LEOPARD):多施設患者盲検ランダム化比較試験。 アン・サージ。2019;269(1):2-9. doi:10.1097/SLA.00000000000002979.
- ビョルンソンB、サンドストロムP、ラーションAL、ヒャルマルソンC、ガスランダーT. 腹腔鏡手術と開口末端膵切除術(LAPOP):単一センター、非盲検、ランダム化比較試験の研究プロトコル。 試練。2019;20(356). DOI:10.1186/S13063-019-3460-Y。
Cite this article
ヘネシーML、フェルナンデス・デル・カスティーヨC. 膵臓がんのための開腹末端膵切除術。 J Med Insight。 2022;2022(339). doi:10.24296/jomi/339。

